2017年中考化学总复习第一轮基础知识复习第二部分身边的化学物质第4讲金属(精讲)课件
高考化学一轮复习考点过关金属元素及其化合物专题4金属材料及应用20170616214

金属元素及其化合物专题4 金属材料及应用【考点过关】1.金属铜及其化合物(1)金属铜2(2)铜的化合物2CuONaOH【巩固演练】下列说法正确的是。
①铜绿的主要成分是碱式碳酸铜,可用稀盐酸除铜器表面的铜绿②除去Cu粉中混有CuO的方法是加入稀硝酸溶解、过滤、洗涤、干燥③将铜粉加入1.0 mol·L-1 Fe2(SO4)3溶液中,现象是溶液变蓝,有黑色固体出现④铁比铜活泼,铆在铜板上的铁钉在潮湿空气中不易生锈⑤氧化铜可作为制造玻璃、搪瓷的红色颜料⑥硫酸铜溶液可用作游泳池的消毒剂⑦为了避免青铜器生成铜绿,在青铜器的表面覆盖一层防渗的高分子膜 ⑧1 mol Cu 和足量热浓硫酸反应可生成N A 个SO 3分子 ⑨冶炼铜的反应为8CuFeS 2+21O 2高温8Cu +4FeO +2Fe 2O 3+16SO 2,若CuFeS 2中Fe 的化合价为+2,反应中被还原的元素是Cu 和O⑩CuSO 4溶液与过量浓氨水反应的离子方程式:Cu 2++2NH 3·H 2O=Cu(OH)2↓+2NH 4+⑪将CuCl 2溶液在蒸发皿中加热蒸干,得到无水CuCl 2固体 ⑫H 2通过灼热的CuO 粉末,反应后固体物质增重解析:铜绿主要成分是Cu 2(OH)2CO 3,可视为Cu(OH)2·CuCO 3,所以铜绿能和盐酸反应,①正确;铜与稀硝酸会反应,应该用稀盐酸,②错误;Cu 与硫酸铁发生氧化还原反应,生成硫酸铜和硫酸亚铁,无黑色固体出现,③错误;铁铜在潮湿的空气中能组成原电池,发生电化学腐蚀,铁做负极被腐蚀,④错误;氧化铜是黑色物质,不能作为红色颜料,⑤错误;因为Cu 2+是重金属离子,可使蛋白质变性,有杀菌能力,故能作游泳池的消毒剂,⑥正确;铜绿是生活中常见现象,反应原理为2Cu+O 2+CO 2+H 2O==Cu 2CO 3(OH)2,故青铜器应保存在干燥的环境中或表面覆盖一层防渗的高分子膜防止被腐蚀,⑦正确;Cu 和足量热浓硫酸反应生成的是SO 2,不是SO 3,⑧错误;若CuFeS 2中Fe 的化合价为+2,则Cu 化合价为+2,S 化合价为-2,分析化学方程式两边元素化合价的变化可知,化合价降低的元素被还原,有Cu 和O 元素,⑨正确;过量浓氨水反应产生[Cu(NH 3)4]2+,⑩错误;Cu 2+水解,加热CuCl 2溶液不能得到CuCl 2固体,⑪错误;氢气通过灼热的CuO 粉末发生的反应为CuO+H 2=====△Cu+H 2O ,固体由CuO 变为Cu ,1molCuO 的质量为80g ,1molCu 的质量为64g ,反应后固体质量减小,⑫错误。
【化学课件】2017届中考化学基础知识总汇

首页
末页
首页
末页ቤተ መጻሕፍቲ ባይዱ
首页
末页
首页
末页
首页
末页
首页
末页
首页
末页
首页
末页
首页
末页
首页
末页
首页
末页
首页
末页
首页
末页
首页
末页
1、做老师的只要有一次向学生撒谎撒漏了底,就可能使他的全部教育成果从此为之毁灭。——卢梭 2、教育人就是要形成人的性格。——欧文 3、自我教育需要有非常重要而强有力的促进因素——自尊心、自我尊重感、上进心。——苏霍姆林斯基 4、追求理想是一个人进行自我教育的最初的动力,而没有自我教育就不能想象会有完美的精神生活。我认为,教会学生自己教育自己,这是一种 最高级的技巧和艺术。——苏霍姆林斯基 5、没有时间教育儿子——就意味着没有时间做人。——(前苏联)苏霍姆林斯基 6、教育不是注满一桶水,而且点燃一把火。——叶芝 7、教育技巧的全部奥秘也就在于如何爱护儿童。——苏霍姆林斯基 8、教育的根是苦的,但其果实是甜的。——亚里士多德 9、教育的目的,是替年轻人的终生自修作准备。——R.M.H. 10、教育的目的在于能让青年人毕生进行自我教育。——哈钦斯 11、教育的实质正是在于克服自己身上的动物本能和发展人所特有的全部本性。——(前苏联)苏霍姆林斯基 12、教育的唯一工作与全部工作可以总结在这一概念之中——道德。——赫尔巴特 13、教育儿童通过周围世界的美,人的关系的美而看到的精神的高尚、善良和诚实,并在此基础上在自己身上确立美的品质。——苏霍姆林斯基 14、教育不在于使人知其所未知,而在于按其所未行而行。——园斯金 15、教育工作中的百分之一的废品,就会使国家遭受严重的损失。——马卡连柯 16、教育技巧的全部诀窍就在于抓住儿童的这种上进心,这种道德上的自勉。要是儿童自己不求上进,不知自勉,任何教育者就都不能在他的身 上培养出好的品质。可是只有在集体和教师首先看到儿童优点的那些地方,儿童才会产生上进心。——苏霍姆林斯基 17、教育能开拓人的智力。——贺拉斯 18、作为一个父亲,最大的乐趣就在于:在其有生之年,能够根据自己走过的路来启发教育子女。——蒙田 19、教育上的水是什么就是情,就是爱。教育没有了情爱,就成了无水的池,任你四方形也罢、圆形也罢,总逃不出一个空虚。班主任广博的爱 心就是流淌在班级之池中的水,时刻滋润着学生的心田。——夏丐尊 20、教育不能创造什么,但它能启发儿童创造力以从事于创造工作。——陶行知
2025年中考化学总复习第一部分考点梳理课题4金属与金属材料

返回目录
考点二 金属的化学性质 1. 可充分发挥化学实验的重要作用,设计各种探究实验,总结金属 的化学性质。可通过创设“化山论剑”“易拉罐的前世、今生和来世” 等情境的项目式学习活动,将金属化学性质的复习贯穿其中,增加课堂 的趣味性。 2. 要加强学生对应知应会基础知识的落实,例如正确书写有关的化 学方程式,判断基本反应类型,描述实验现象、反应发生的原因等。 考点三 金属活动性顺序 设置实验,判断金属活动性顺序;通过金属活动性顺序判断置换反 应能否进行,利用金属活动性顺序解释日常生活中有关的化学问题。
分析纯金属与合金的性质,加深学生对物质的性质与物质用途关系的了 解。认识金属既有共性,又有各自的特性。
2. 有关金属材料知识的考查较为基础,要注意区分合金和合成材 料,知道生铁和钢的区别;同时,还要介绍古代有关金属的重大成就、 新的科技成果和近期的重点工程,引导学生以发展的眼光看待与金属材 料相关的知识。
返回目录
续表
2022版课程标准
情境素 材建议
我国传统化学工艺,如“湿法炼铜”,瓷器、铜器、 铁器制造等;《梦溪笔谈》中关于“湿法炼铜”的描述, 我国重要的金属矿产资源及其分布,《天工开物》中对我 国古代金属冶炼成就的描述,我国古代合金材料的制造 (如铸造钱币、青铜器等),我国在金属及金属材料领域 的研究和应用成就,现代交通、航空航天、国防科技等领 域使用的合金材料及其发展,废弃金属的分类回收和再利 用。
考情分析
返回目录
年份 题号/题型/分值
考查内容
情境素材
23/化学与工程 金属材料的性能、防锈措施 /2 分
西气东输跨 黄工程管道
根据题干信息书写碳酸锌与碳
2024
25/化学与技术/3 分
反应的化学方程式、分析古代 冶锌晚于铁和铜的原因
广东省中考化学复习第一部分考点复习第一单元我们身边的化学物质第4讲金属名师精编课件

听到__爆__鸣__声__
(续表)
实验环节
过程和步骤
实验现象
结论或解释
(3)取 2 支试管,各放入一 小块铜片,然后分别加入 少量的硫酸亚铁溶液和硝
酸银溶液,观察现象
放 的 放 铜 色 色入 入 片 物 变铜硫 硝 表 质 为片_酸 酸 面 ,__蓝产亚 银 溶___无_生铁 溶 液色_现_溶 液 由__银_象_液的无__白_,铁金动的__铁、属性顺__、铜的由序__铜、金强是__、银属到____银三活弱__种_
3.合金
(1)概念:在金属中加热熔合某些金属或__非__金__属__制得的具
有__金__属____特征的物质。
(2)性能:合金的硬度一般比组成它的纯金属的硬度__大__,
抗腐蚀性__强__,合金的熔点一般比组成它的纯金属的熔点__低__。
(3)铁的合金(生铁与钢)。
铁的合金 含碳量 性能
机械加工
生铁 __2_%_~__4_._3_%_ 质硬而脆,无韧性 可铸,不可锻轧
3. 与 盐反
应
Cu 与 AgNO3
C__u_+__2_A_g_N__O_3_=_=_=_C_u_(_N_O__3_)2_+_ 2_A__g_____________________
表面有___银__白___色
__置__换_
物质析出,溶液由 ____无____ 色 变
____蓝____色
Al 与 CuSO4
合成材料。
5.生铁不能完全溶解在盐酸里,因为生铁中的碳不与盐酸 反应。
【易错诊断】 判断正误,正确的打“√”,错误的打“×”。 1.合金中一定不含有非金属元素。( × ) 2.生铁和钢都是混合物。( √ ) 3.赤铁矿石不属于金属材料。( √ ) 4.四氧化三铁属于合金。( × )
人教版化学河北中考考点:第一单元 身边的化学物质
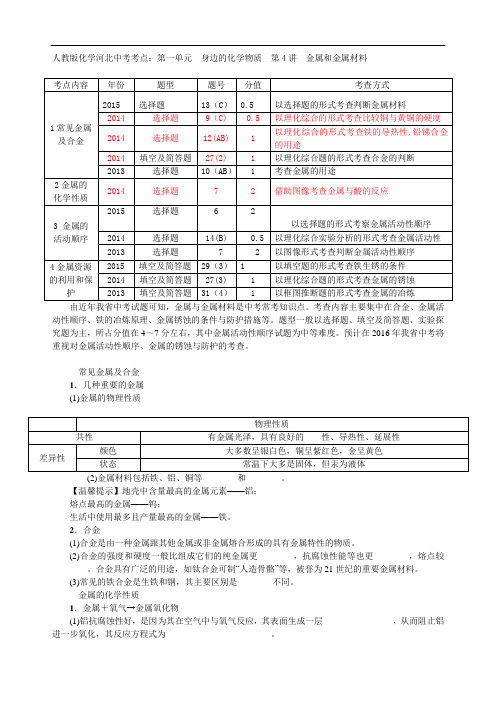
人教版化学河北中考考点:第一单元身边的化学物质第4讲金属和金属材料动性顺序、铁的冶炼原理、金属锈蚀的条件与防护措施等。
题型一般以选择题、填空及简答题、实验探究题为主,所占分值在4~7分左右,其中金属活动性顺序试题为中等难度。
预计在2016年我省中考将重视对金属活动性顺序、金属的锈蚀与防护的考查。
常见金属及合金1.几种重要的金属(1)金属的物理性质【温馨提示】地壳中含量最高的金属元素——铝;熔点最高的金属——钨;生活中使用最多且产量最高的金属——铁。
2.合金(1)合金是由一种金属跟其他金属或非金属熔合形成的具有金属特性的物质。
(2)合金的强度和硬度一般比组成它们的纯金属更________,抗腐蚀性能等也更________,熔点较________。
合金具有广泛的用途,如钛合金可制“人造骨骼”等,被誉为21世纪的重要金属材料。
(3)常见的铁合金是生铁和钢,其主要区别是________不同。
金属的化学性质1.金属+氧气→金属氧化物(1)铝抗腐蚀性好,是因为其在空气中与氧气反应,其表面生成一层________________,从而阻止铝进一步氧化,其反应方程式为________________________。
(2)铁丝在氧气中燃烧的化学方程式:________________________。
(3)铜与氧气反应的化学方程式:________________________________________________________________________。
【温馨提示】“真金不怕火炼”说明金即使在高温时也不与氧气反应。
2.金属+酸(稀盐酸、稀硫酸)→盐+氢气色大多不发生变化,但铁反应后得到的盐溶液呈浅绿色,盐中的铁元素呈+2价。
(2)金属与酸发生反应后,溶液的质量均增加。
3.金属+盐→新盐+新金属金属的活动性顺序1.常见金属在溶液中的活动性顺序2.金属活动性顺序的应用(1)在金属活动性顺序里,金属的位置越靠前,它的活动性越强;(2)在金属活动性顺序里,排在氢前面的金属能置换出盐酸、稀硫酸中的氢;(3)在金属活动性顺序里,位于前面的金属能把后面的金属从它们的化合物溶液里置换出来。
