中国药典中吐温80介绍复习课程
《药剂学》期末复习资料

《药剂学》期末复习资料第一章(一)1.剂型:是指根据不同给药方式和不同给药部位等要求将药物制成的不同“形态”。
2.药剂学:是将原料制备成用于治疗、诊断、预防疾病所需药物制剂的一门科学。
即以药物制剂为中心研究其基本理论、处方设计、制备工艺、质量控制和合理应用的综合性应用技术科学(二)1.药剂学的宗旨是制备安全、有效、稳定、使用方便的药物制剂2.药用高分子材料学:主要研究对象是没有药理活性、无毒的合成和天然的高分子材料3.生物药剂学:研究药物在体内的吸收、分布、代谢与排泄的机制及过程,阐明药物因素、剂型因素和生理因素与药效之间的关系,为合理设计剂型和制剂处方以及制备工艺等提供依据,使制剂产品的生物利用度最大限度地发挥(三)药物剂型的分类1.按给药途径分类:口服给药剂型、口腔内给药剂型、注射给药剂型、呼吸道给药剂型、皮肤给药剂型、眼部给药剂型、鼻粘膜给药剂型、直肠给药剂型、阴道给药剂型、耳部给药剂型、透析给药剂型2.按分散系统分类:溶液型、胶体型、乳剂型、混悬型、气体分散型、微粒分散型、固体分散型3.按形态分类:液体剂型、气体剂型、固体剂型、半固体剂型(四)1.药用辅料系:是指生产药物制剂时使用的赋形剂或附加剂,是除活性成分以外,含在药物制剂中的所有物质。
2.药剂学中使用辅料的目的:使剂型具有形态特征、使制备过程顺利进行、提高药物的稳定性、调节有效成分的作用部位作用时间或满足生理要求(五)药典:是一个国家记载药品标准、规格的法典,一般由国家药典委员会组织编纂、出版,并由政府颁布、执行,具有法律约束力。
第二章(一)1.药用溶剂的种类:水、非水溶剂2.非水溶剂:醇与多元醇类、醚类、酰胺类、酯类、植物油类、烃类、亚砜类(二)1.溶解度:指在一定温度(气体在一定压力)下,在一定量溶剂中达到饱和时溶解的最大药量,是反映药物溶解性的重要指标2.影响药物溶解度的因素及增加药物溶解度的方法(选择):(1)药物的分子结构;(2)溶剂化作用与水合作用;(3)晶型;(4)溶剂化物;(5)粒子大小;(6)温度;(7)pH与同离子效应;(8)混合溶剂;(9)添加物3. 影响药物溶出速度的因素和增加溶出速度的方法(1)固体的粒径和表面积(2)温度(3)溶出介质的性质(4)溶出介质的体积(5)扩散系数6、扩散层的厚度(三)1. 渗透压:如果半透膜的一侧为药物溶液,另一侧为溶剂,则溶剂侧的溶剂透过半透膜进入溶液侧,最后达到渗透平衡,此时两侧所产生的压力差即为溶液的渗透压2.等张溶液:是指溶液的张力与红细胞张力相等,也就是药物溶液与细胞接触时细胞功能和结构保持正常,红细胞在该溶液中不发生溶血。
中药注射液中吐温80的含量测定

中药注射液中吐温80的含量测定发表时间:2016-05-11T11:13:36.370Z 来源:《心理医生》2015年14期供稿作者:董磊张鹏楚中亚[导读] 河南省漯河市中医院河南漯河 462000)结果显示,本方法专属性强,操作简单,结果准确,出峰时间比较合适,且分离度好能够满足注射液中吐温80的检查。
董磊张鹏楚中亚(河南省漯河市中医院河南漯河 462000)【摘要】目的:建立中药注射液中辅料吐温80的含量测定方法,为中药注射液的安全性检测提供方法和理论依据。
方法:采用分子排阻-蒸发光散射(SEC-ELSD)法测定中药注射液中吐温80的含量。
结果:中药注射液中吐温80含量差异较大。
结论:文献表明吐温80可引起不良反应,因此为保证产品质量的安全性,应在现行标准中增加吐温80的含量检查项,对其用量进行有效控制。
【关键词】丹参注射液;香丹注射液;吐温80;含量测定【中图分类号】R927.2 【文献标识码】A 【文章编号】1007-8231(2015)14-0235-02吐温80(聚山梨酯80),其化学名为聚氧乙烯20山梨醇酐单油酸酯,为淡黄色至橙黄色的粘稠液体,在水、乙醇、甲醇或乙酸乙酯中易溶,在矿物油中极微溶解。
是由山梨醇及其失水化合物的单油酸酯与环氧乙烷在碱性条件下缩合而成。
我国常采用其作为注射液中的助溶剂。
但随着近年来药理学研究的深入,人们认识到吐温80是具有一定生物和药理活性的物质,并与药物临床上出现的不良反应相关[1]。
本文建立了中药注射液中辅料吐温80的SEC-ELSD含量测定方法,以此对中药注射液质量的稳定性和安全性进行综合评价和分析。
1.材料与试药1.1 仪器岛津SHIMADZU LC-2010A型高效液相色谱仪(配有四元梯度泵、自动进样器、柱温箱、SEDEX ELSD 75型蒸发光散射检测器、CLASS VP色谱工作站)日本岛津公司;FA2104N分析天平(上海四瑞仪器有限公司)。
卵磷脂、吐温 80-营养琼脂(TTC 卵磷脂、吐温 80-营养琼脂基础) 产品说明书
广东环凯微生物科技有限公司网址: 地址:广州市黄埔区科学城神舟路788号邮编:510663传真:860288778876产品说明书Product Manual【产品名称】通用名称:卵磷脂、吐温80-营养琼脂(TTC 卵磷脂、吐温80-营养琼脂基础)英文名称:Lecithin Tween-80Nutrient Agar/TTC Lecithin Tween-80Nutrient Agar 【产品编号与包装规格】产品编号产品类型包装规格027020干粉250g/瓶【产品用途】用于化妆品细菌总数测定。
【检验原理】蛋白胨和牛肉膏粉提供碳氮源、维生素和生长因子;氯化钠维持均衡的渗透压;卵磷脂和吐温80能中和防腐剂,并能起到在乳浊液中分散物质的功能,卵磷脂能中和季铵盐,吐温80可中和酚、六氯酚、福尔马林,两者结合可中和乙醇;琼脂是培养基的凝固剂;大多数细菌能还原TTC,使之形成易于辨别的红色菌落,TTC 还能减缓某些细菌的蔓延生长。
卵磷脂、吐温80-营养琼脂:称取干粉51g,加入蒸馏水或去离子水1L,搅拌加热煮沸至完全溶解,分装三角瓶,121高压灭菌20min,冷至50℃左右,备用。
TTC 卵磷脂、吐温80-营养琼脂:灭菌的卵磷脂、吐温80-营养琼脂冷至50℃左右,每200mL 培养基加入1支2mL0.5%的无菌TTC 溶液(029226)可制成TTC 卵磷脂、吐温80-营养琼脂,混匀。
【质量控制】贮存于避光、干燥处,用后立即旋紧瓶盖;保质期三年。
【注意事项】1、称量时注意粉尘,佩戴口罩操作以避免引起呼吸道系统不适。
2、干粉培养基使用后立即旋紧瓶盖,避免吸潮结块。
贮存于避光、干燥处。
3、质检报告可以登录环凯网站 ,打开“质检报告”页面,输入产品批号下载。
【废物处理】检测之后带菌物品置于121℃下高压灭菌30分钟后处理。
【执行标准】Q/HKSJ03-2011广东环凯微生物科技有限公司企业标准普通微生物培养基【说明版本】2019年11月23日【参考文献】化妆品卫生规范2015版广东环凯微生物科技有限公司网址:地址:广州市黄埔区科学城神舟路788号邮编:510663传真:************-8619 ************8602************88778876。
《药物制剂技术》复习题

《药物制剂技术》复习题第一章绪论一、名词解释1、药物制剂技术2、药剂学3、制剂4、剂型5、药典6、GMP二、填空题1、我国现行药品质量标准有:和2、药物制剂按发展程度不同可分为、、、。
3、目前我国的制剂名称种类有____、_____和____三种,其中_____须采用国家批准的法定名称。
4、药品批准文号的格式一般由____、____和_____组成。
其中,化学药品使用字母____,中药使用字母____-。
5、药物剂型分类方法有:_____、____、____和_____。
6、GMP是的简称;GSP是的简称。
7、〈〈中国药典〉〉的基本结构包括:、、和;其中包括了药典中各种术语的含义及其在使用时的有关规定。
三、选择题1、研究药物制剂的基本理论、处方设计、制备工艺、质量控制等内容的综合性应用技术科学,称为()A、制剂学B、调剂学C、药剂学D、方剂学E、工业药剂学2、<<中华人民共和国药典>>最早颁布于( )A、1949年B、1953年C、1963年D、1977年E、1930年3、根据〈〈国家药品标准〉〉的处方,将原料药物加工制成具有一定规格的制品,称为()A、方剂B、调剂C、制剂D、中药E、剂型4、药品生产、供应、检验和使用的主要依据是()A、GMPB、GLPC、GSPD、药典E、药品管理法5、现行版的药典,施行的时间()A、2000.7.1B、2005.1.1C、2005.7.1D、2005.8.1E、2001.1.16、〈〈中国药典〉〉是由()A、国家颁布的药品集B、国家药典委员会制定的药物手册C、国家药品监督管理局制定的药品标准D、国家药品监督管理局制定的药品法典E、国家编撰的药品规格标准的法典四、简答题1、简述药物剂型的重要性第二章制药卫生一、名词解释1、F0值2、F值3、物理灭菌法4、化学灭菌法5、湿热灭菌法6、热压灭菌法7、无菌操作法8、灭菌9、防腐10.无菌11、空气洁净技术二、填空题1、在GMP中,卫生的含义包括_________、_________、_________和_________等各方面。
TEC-ZLF-008聚山梨酯80(吐温80)质量标准及检验操作规程
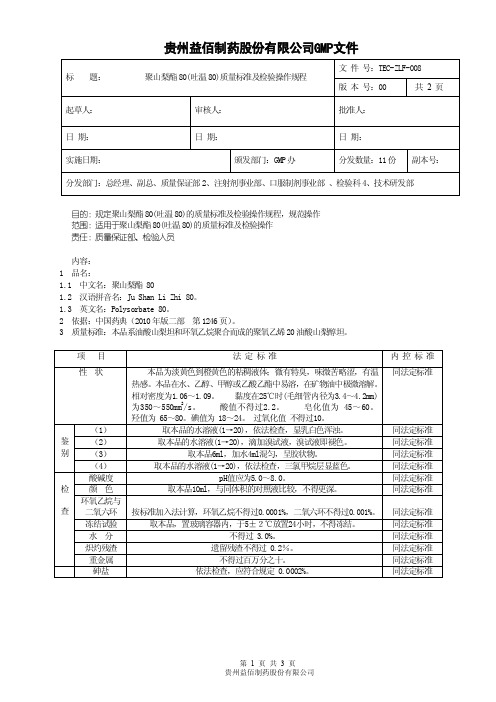
贵州益佰制药股份有限公司GMP文件目的:规定聚山梨酯80(吐温80)的质量标准及检验操作规程,规范操作范围:适用于聚山梨酯80(吐温80)的质量标准及检验操作责任:质量保证部、检验人员内容:1 品名:1.1 中文名:聚山梨酯 801.2 汉语拼音名:Ju Shan Li Zhi 80。
1.3 英文名:Polysorbate 80。
2 依据:中国药典(2010年版二部第1246页)。
3 质量标准:本品系油酸山梨坦和环氧乙烷聚合而成的聚氧乙烯20油酸山梨醇坦。
4 检验操作规程:4.1 试药与试剂:乙醇、甲醇、乙酸乙酯、矿物油、、氢氧化钠试液、稀盐酸、溴试液、硫氰酸铵、硝酸钴、三氯甲烷、比色用重铬酸钾溶液、比色用氯化钴液 0.5mol /L氢氧化钾乙醇溶液溴化碘溶液酰化剂乙醚硫酸过氧化氢三氧化二砷碘化钾试液酸性氯化亚锡试液锌粒醋酸铅盐酸聚乙二醇400 氯化镁硫代乙酰胺氨试液甘油指示液:甲酚红-麝香草酚蓝混合指示液、淀粉指示液酚酞指示液缓冲液:磷酸盐标准缓冲液(pH6.86)、苯二甲酸盐标准缓冲液(pH4.00)滴定液:盐酸滴定液(0. 5mol /L)、氢氧化钠滴定液(0. 1mol /L)、硫代硫酸钠滴定液(0.1mol/L)、乙醇制盐酸滴定液(0.1mol/L)、乙醇制氢氧化钾滴定液(0.1mol/L)对照品:环氧乙烷二氧六环4.2 仪器与用具:电子天平、韦氏比重秤、比色管、干燥器、称量瓶、PH计、烧杯、冷凝管、滴定管、水浴锅、碘量瓶、量筒、锥形瓶、高温电炉、凯氏烧瓶、砷盐装置、脱脂棉、量瓶、气相色谱仪、顶空进样装置等。
4.3 操作方法:4.3.1 性状:4.3.1.1 取本品适量,自然光下目测色泽、口尝味道、嗅闻气味、手触温热感,并记录结果。
4.3.1.2 取本品适量,观察其在水、乙醇、甲醇、乙酸乙酯或矿物油中的溶解情况。
4.3.1.3 相对密度:照检验操作规程附录相对密度测定法——韦氏比重秤法测定,并记录结果。
吐温80的组分

[3] ZENG X H,SHI L,ZHAO S J,et al. Determination of sufentanil in human plasma by LC-MS / MS[J]. Chin J Clin Pharm( 中国临 床药学杂志) ,2010,19( 2) : 93-96.
[4] XIAO B,ZHANG X A,SHI C. Studies on clinical pharmacokinetics of sufentanil and its application[J]. Chin J Mod Appl Pharm( 中国现代应用药学杂志) ,2008,25( 4) : 298-301.
美国药典 32 版、《中国药典》2005 年版都用此 定义了吐温 80。也基于此开发了很多质量控制方 法,如比色 法[1]、HPLC[2-4] 等。 基 于 这 种 认 识,有 些 研究把吐温 80 出现的问题归咎于其原料纯度不够 和杂质残留。因此研究者试图通过提高原料 ( 油 酸) 纯度[5]、控制杂质 ( 环 氧 乙 烷、二 氧 六 环、氯 乙 醇、乙二醇、二甘醇) 残留量的方法来解决其安全性 问题[6],但溶血的实验表明,高纯度的吐温 80 仍然 具有溶血性,高质量评分的样品( 油酸含量 97. 7% , 无杂质残留) 致敏性虽低于普通样品,但也仍然会 发生致敏的问题[7],说明仅通过提高原料纯度要求 及杂质残留限量要求的质量控制方法并不能完全解 决吐温 80 使用中的安全问题。这提示必须从新的 角度来解决吐温 80 在使用中所出现的安全性问题。
中药注射剂所含吐温_80与过敏反应关系的研究

药物不良反应杂志 2010 年 6 月第 12 卷第 3 期
ADRJ,June 2010 ,Vol 12. No. 3
· 实验研究 ·
80 与过敏反应关系的研究 中药注射剂所含吐温罗霞
摘要
*
王青 **
周联
董燕
江益平
( 广州中医药大学免疫研究室, 广州 510405 )
80 溶液、 80 含量不同的中药注射剂对 RBL2H3 细胞脱颗粒的影响, 目的: 观察不同浓度吐温吐温探讨中药注射剂所
Traditional Chinese Medicine,Guangzhou 510405 ,China) ABSTRACT Objective: To observe the effects of different concentrations of Tween80 solutions and injections of Chinese herbal ( Laboratory of Immunity, Guangzhou University of
80 与过敏反应的关系。方法: 体外培养 RBL2H3 细胞, 20 、 10 、 2、 1、 0. 2 、 0. 1 、 0. 05 mg / mL ) 的吐温含吐温加入不同浓度( 40 、 80 溶液各组及对照组的脱颗粒细胞, 80 溶液, 之后加中性红染液, 计数不同浓度吐温并计算其百分率, 同时检测细胞上清液 80 的含量, 2 种中药注射剂对 RBL2H3 细胞的 中 β氨基己糖苷酶及组胺的释放量; 测定穿琥宁注射液和香丹注射液中吐温 80 可导致 RBL2H3 细胞 半数抑制浓度( IC50 ) 以及加入 2 种注射液各组细胞释放组胺的量 。结果: 中性红染色实验显示吐温 20 、 10 、 2、 1、 0. 2 、 0. 1mg / mL 的吐温80 溶液各组和 RPMI 1640 对 脱颗粒, 表现为肥大细胞体积变大, 内有空泡产生; 浓度为 40 、 ( 32. 54 ± 2. 33) 、 ( 21. 74 ± 0. 72 ) 、 ( 16. 96 ± 0. 26 ) 、 ( 11. 40 ± 1. 70 ) 、 ( 9. 71 ± 照组导致细胞的脱颗粒百分率分别为( 57. 38 ± 0. 47) 、 ( 7. 22 ± 0. 15) 和( 1. 51 ± 1. 39) % , 2 组相比差异有统计学意义( P < 0. 05 , P < 0. 01 ) ; 浓度为 40 、 20 、 2、 1、 0. 2mg / mL 的吐 0. 26) 、 80 溶液各组和 RPMI 1640 对照组致细胞 β( 7. 50 ± 温氨基己糖苷酶的释放率分别为 ( 52. 44 ± 1. 53 ) 、( 18. 91 ± 0. 77 ) 、 ( 6. 65 ± 0. 20 ) 、 ( 6. 15 ± 0. 27 ) 和( 0. 35 ± 0. 06 ) % , 2 组相比差异有统计学意义( P < 0. 05 , P < 0. 01 ) ; 不同浓度吐温80 1. 82 ) 、 2H3 细胞释放组胺的量也不同; 当吐温80 溶液浓度为 20 ~ 0. 1 mg / mL 时, RBL2H3 细胞脱颗粒百分率、 溶液引起 RBLβ氨基 80 溶液的浓度呈线性关系( r = 0. 986 2 ,r = 0. 984 9 ,r = 0. 974 0 ) 。 穿琥宁注 己糖苷酶的释放率及其释放组胺的量均与吐温 80 的含量分别为( 0. 086 ± 0. 004 ) 和( 0. 070 ± 0. 008 ) mg / mL, 2 种注射液对 RBL2H3 细胞的 IC50 分 射液和香丹注射液中吐温 ( 1. 0 ± 0. 2 ) μL / mL, 穿琥宁注射液和香丹注射液组组胺释放量分别为 ( 2. 39 ± 0. 01 ) 和( 1. 87 ± 0. 00 ) 别为( 57. 4 ± 1. 2 ) 、 ng / mL。结论: 吐温80 可引起 RBL2H3 细胞脱颗粒释放炎症介质; RBL2H3 细胞组胺的释放量与中药注射剂中吐温 80 的含 80 可能与过敏反应的发生有关 。 量有关; 中药注射剂中所含的吐温 关键词 80 ; 中药注射剂; RBL2H3 细胞; 过敏反应 吐温R 944. 11 文献标识码: A 文章编号: 10085734 ( 2010 ) 3016006 中图分类号:
吐温80介绍

Tween 80 polyoxyethylene sorbitan monostearate 聚氧乙烯(20EO)失水山梨醇单油酸酯非离子HLB 15.0吐温80产品名称:吐温80英文品名:Tween(R) 80Cas 号:9005-65-6别名:聚氧乙烯脱水山梨醇单油酸酯;乳化剂T80;吐温81;乳化剂T-81;聚山梨醇酯80分子结构:分子式:C24H44。
6分子量:428.60EINECS:500-019-9化学属性:吐温80(9005-65-6) 的性状:1. 其外观呈淡黄色黏稠液体,有特殊臭味,味微苦。
2. 相对密度1.10 d0.05,凝固点0C以下。
3. 极易溶于至,形成无色的溶液,溶于乙更、醋酸乙酯、非挥发性油、苴等有机溶剂,不溶于矿物油和石油醍。
4.1%水溶液pH值为5〜8,浊点温度在85 C以下。
常温下耐酸、通和盐。
HLB 值为14.6。
5.小白鼠经口LD50 25g/kg。
ADI 0 〜25mg/kg(FAO/WHO , 1994)。
吐温80(9005-65-6) 的用途:1. 作O/W型食品乳化剂,单独使用或与司盘60、司盘65、司盘80混合使用。
我国规定可用于乳化天然色素,最大使用量为10g/kg ;在牛乳中最大使用量为l.5g/kg ;在雪糕和冰淇淋中最大使用量为 1.0g/kg。
2. 本品广泛用于石油开采和运输、医药.化妆品,油漆颜料,纺织,食品,农药。
在洗涤剂生产和金属表面防锈清洗等方面用作乳化剂、分散剂、稳定剂、扩散剂、润滑剂、柔软剂、抗静电剂、防锈剂、整理剂、降粘剂等等。
3. 用作乳化剂、润湿剂,渗透剂、扩散剂等,也用作绵纶和粘胶帘子张油剂用途:的组分。
在聚氨酯泡沫塑料生产中用作乳化剂。
食品工业用作冰淇淋乳化剂,用量为0.1%黄油,一般油中加量1%左右。
4. 用作气相色谱固定液,用于匿、鲍、酯类的分离及脂肪匪和炷类的分离。
5. 本品具有优良的乳化、分散、润湿等性能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国药典中吐温80介绍聚山梨酯80Polysorbate 80【别名】聚氧乙烯失水山梨醇单油酸酯;聚氧乙烯(20)山梨醇酐单油酸酯;吐温80【质量标准】《中国药典》本品为聚氧乙烯20山梨醇酐单油酸酯。
【性状】本品为淡黄色至橙黄色的黏稠液体;微有特臭,味微苦略涩,有温热感。
本品在水、乙醇、甲醇或醋酸乙酯中易溶,在矿物油中极微溶解。
相对密度本品的相对密度(《中国药典》附录Ⅵ A韦氏比重秤法)为1.06~1.09。
黏度本品的运动黏度(《中国药典》附录Ⅵ G第一法),在25℃时(毛细管内径为3.4 ~4.2 mm)为350~550mm2/s。
酸值取本品10g ,精密称定,置250ml 锥形瓶中,加中性乙醇(对酚酞指示液显中性)50ml,溶解后,附回流冷凝器煮沸10分钟,放冷,加酚酞指示液5 滴,用氢氧化钠滴定液(0.1mol/L)滴定,酸值(《中国药典》附录Ⅶ H)不大于2.2。
皂化值本品的皂化值(《中国药典》附录Ⅶ H)为45~60。
羟值本品的羟值(《中国药典》附录Ⅶ H)为65~80。
碘值本品的碘值(《中国药典》附录Ⅶ H)为18~24。
【鉴别】 (1) 取本品的溶液(1→20)5ml,加氢氧化钠试液5ml ,煮沸数分钟,放冷,用稀盐酸酸化,显乳白色浑浊。
(2) 取本品的溶液(1→20) ,滴加溴试液,溴试液即褪色。
(3) 取本品6ml ,加水4ml 混匀,呈胶状物。
(4) 取本品的溶液(1→20)10ml ,加硫氰酸钴铵溶液(取硫氰酸铵17.4g 与硝酸钴2.8g,加水溶解成100ml )5ml ,混匀,再加三氯甲烷5ml ,振摇混合,静置后,三氯甲烷层显蓝色。
【检查】酸碱度取本品0.50g ,加水10ml溶解后,依法测定(《中国药典》附录Ⅵ H),pH值应为5.0 ~8.0。
颜色取本品10ml,与同体积的对照液(取比色用重铬酸钾液8.0ml 与比色用氯化钴液0.8ml ,加水至10ml)比较,不得更深。
冻结试验取本品,置玻璃容器内,于5℃±2℃放置24小时,不得冻结。
水分取本品,照水分测定法(《中国药典》附录Ⅷ M第一法 A)测定,含水分不得过3.0%。
炽灼残渣取本品1.0g,依法检查(《中国药典》附录Ⅷ N),遗留残渣不得过0.2%。
重金属取炽灼残渣项下遗留的残渣,依法检查(《中国药典》附录Ⅷ H第二法),含重金属不得过百万分之十。
【类别】药用辅料。
【贮藏】遮光,密封保存。
【国内外标准差异】比较美国药典(USP-29)、英国药典(BP2005)、欧洲药典(EP5.4)、日本药典(JP14)以及中国药典(CP2005)等各国药典中聚山梨酯80的质量标准可知,各国药典对聚山梨酯80的控制有所不同,而CP和USP 基本一致。
各国药典对羟值、皂化值、酸值、重金属、炽灼残渣、水分、粘度、密度等指标规定无大的差别。
总体而言,EP和BP的控制标准较CP、USP、JP更为严格,主要体现在对所含杂质和含量的控制水平。
EP和BP对过氧化值(≤10.0),脂肪酸含量:肉豆蔻酸(≤5.0%)、棕榈酸(≤16.0%)、棕榈油酸(≤8.0%)、硬脂酸(≤6.0%)、亚油酸(≤18.0%)、亚麻酸(≤4.0%),乙烯氧化物(1,4—二氧六环)含量(≤10ppm)、环氧乙烷含量(≤1ppm)的控制指标一致;BP的油酸含量(58.0%-85.0%)和EP的油酸含量(≥58.0%)控制指标略有不同;BP还对2-氯乙醇含量(≤10ppm)、乙二醇含量(≤0.25%)和二甘醇含量(≤0.25%)进行了控制,而EP没有此三项控制指标。
【应用】本品属多元醇型非离子表面活性剂,是聚山梨酯类中最常用的一种。
对电解质有显著的抵抗力,亲水性强,广泛应用于液体、半固体、固体制剂中,作O/W型乳化剂、增溶剂、湿润剂、分散剂和稳定剂[1]。
1.聚山梨酯是一类优良的O/W型乳化剂,高浓度电解质和pH值的改变对其乳化能力影响很小。
对植物油、矿物油、动物油脂等均有良好的乳化作用。
在外用、口服和注射剂的乳剂中均可使用。
用量一般为1~15%。
本品与亲水性乳化剂(如月桂醇硫酸钠)合用可以增强O/W型乳化剂或乳膏剂的稳定性,用量1~10%。
也常与脱水山梨醇脂肪酸酯类(司盘类)以不同比例合用,以制得稳定的O/W型或O/W型乳剂基质。
2.本品为常用的增溶剂之一。
对非极性化合物和含极性集团的化合物均有良好的增溶效果。
用量一般为1~10%。
当实际增溶时,应将脂溶性药物先与增溶剂混匀,再在搅拌下加水稀释,制得的溶液澄明稳定而且增溶剂用量较少。
本品作增溶剂常能改善药物的吸收,增强生理活性。
例如增溶维生素A,一般均能增大其吸收。
但有些情况下,增溶后反而导致药物吸收降低,药效减弱后失去活性。
大部分原因是药物进入增溶剂胶团中使溶出受阻。
典型例子为含酚羟基的消毒防腐剂,如尼泊金类、三氯叔丁醇、苯甲醇、季铵类等与吐温-80配伍后均可以使其抑菌力减低。
即使再将溶液稀释至吐温-80的CMC以下,尼泊金类的抑菌活性仍不能恢复。
原因是吐温-80的聚氧乙烯基与酚羟基之间形成混合物,将抑菌剂包入胶团中而使之不活化。
但本品对甲醛、山梨酸、苯甲酸及硝酸苯汞的抑菌力量影响较小。
在一些透皮给药制剂中非离子型表面活性剂往往促透皮吸收的作用不明显,甚至还可能因增溶作用使分配系数减少而导致透皮量下降。
总之,这些现象与被增溶物的性质及增溶剂的浓度等因素有关。
具体药物应通过实验来确定。
本品是中药注射剂最常用的增溶剂。
能改善其澄明度,提高稳定性,用量一般为1~2%。
但不能盲目地使用本品,如果不彻底地去除杂质,单靠增加其用量则难以达到目的。
不能减轻副作用(如刺激性),甚至影响药物的吸收。
吐温-80因加热及贮藏后会造成pH值下降,在酸性溶液中可使溶液变浊。
3.本品作润湿剂,可以改善药物粒子表面的润湿性。
用于疏水性水性片剂能使水分易于渗入,加快崩解速度。
另外其增溶好反絮凝作用可提高药物溶出度,适用于药物是疏水性的、辅料水溶性差、糊精比例较大者或由于原辅料本身性质引起制出的颗粒硬度较大,以及单独用羧甲基淀粉钠崩解度改善不明显的片剂。
一般用量为0.2~0.5%。
加入方法可以是混入润湿剂或粘合剂中制颗粒,或混入崩解剂中,也可以配成醇溶液喷洒在颗粒上。
在浸提某些中药材中有效成分时,加入适量本品能增加药材的浸润性,从而提高浸出溶媒的浸出效能。
但应注意表面活性剂虽有能提高浸出效能的作用,但浸出的杂质亦较多。
4.用于疏水性药物制成的混悬液体药剂中,如合剂、注射剂、气雾剂等能促进药物粒子分散,其反絮凝作用可以防止细小药物粒子聚集,增加其稳定性,用量一般为0.1~0.2%(g/ml)。
用于疏水性药物制成的膜剂中,适量与药物共研可以避免药物加入涂膜浆中带入大量气泡。
5.另外,据笔者了解,聚山梨酯还被用在蛋白质和抗体注射剂中,用来预防在空气-水界面的变性,同时可以用于防止玻璃药瓶或静脉输液管表面非特异性吸附。
【安全性】本品静脉毒性中等,胃肠道摄取毒性中等,对眼有刺激性[2]。
犬对本品十分敏感,可产生明显的组胺反应,因此犬可能不适合于含有本品制剂的安全性研究,特别是注射制剂[3]。
小鼠和大鼠试验表明,LD50(小鼠, IP):7.6g/kg; LD50(小鼠, IV):4.5g/kg;LD50(小鼠,口服):25g/kg;LD50(大鼠, IP):7.8g/kg;LD50(大鼠, IV):1.8g/kg[2]。
医药、食品、化妆品领域均有使用本品的情况,本品在医药行业的使用途径有口服、肌肉注射、静脉注射、皮肤外用等。
食品中本品的用量一般较药品低,国家已对食品(使用途径为经口入消化道)中本品的最大用量进行了规定,《食品添加剂使用卫生标准》(GB2760-1996)规定雪糕、冰淇淋≤1‰,牛乳≤15‰,卫生部公告2006年第12号规定复合调味酱≤5‰,干粉复合调味料≤4g‰。
笔者据各中药制剂药品标准统计计算得知本品用量范围,口服液为0.5%~5%,肌肉注射液为4~128mg/日,静脉注射液为50~500mg/日。
药品中不同给药途径间用量有较大差异,外用>口服>静脉注射>肌肉注射,其中静脉注射远大于肌肉注射用量,而给药途径的安全性顺序为外用>口服>肌肉注射>静脉注射,因此,其用量大小与给药途径的安全性相反。
这与静脉注射一般体积较大,在达到相同增溶效果的情况下,用量必然增加有关,这可能带来安全隐患。
另外,有美国药物调查[4]显示,本品用量如下:肌肉注射≤4%(如氯氮卓),静脉推注≤0.4%(如胺碘酮),静脉滴注≤2%(如多西他赛)。
【注意事项】聚山梨酯类产品与碱、重金属盐、酚类、单宁类化合物有配伍禁忌,可以降低酚性抑菌剂的活性,可与一些药物如氯化十六烷基吡啶、龙胆紫、地卡因等结合而影响其释放性能。
碱及盐类能降低其浊点,苯甲醇亦能显著降低其浊点,尤其含量高于本品时影响更大。
本品具有吸湿性,使用前应该检查水分,必要时进行干燥。
贮藏时间过长会产生过氧化物。
本品同苯酚、鞣酸、焦油类物质会发生变色或者沉淀反应。
没有充分的研究证实作为生产注射剂用的本品使用塑料桶包装是安全的,因此应该采用玻璃瓶或其他材料的容器包装,并尽量缩短贮藏时间。
本品应置于密封避光容器中,于阴凉干燥通风处贮存,并应避免与铁或聚乙烯类化合物长期接触,以免引起内在质量变化。
劳动保护方面,注意眼睛保护,并戴手套[2]。
本品有不良的臭味,在口服制剂中用量过大则味感不适,可加多羟基醇如甘油、山梨醇和水果香料改善之。
【国内市场基本情况】对生产商、供应商及其产品的主要情况进行概述,产品情况可以体现质量和功能的差异。
请各企业提供。
【参考文献】[1] 刘雅敏,张平山主编. 药物制剂常用辅料. 天津科技翻译出版公司, 1994.[2] [英]R.C.罗,[美]P.J.舍斯基,[英] P.J.韦勒编,郑俊民主译。
药用辅料手册(原著第四版).化学工业出版社,2005;554-557.[3] 王庆利,彭健.吐温80的安全性研究进展[J].毒理学杂志,2006,20(4):-262-264.[4] Robert G. Strickley .Solubilizing Excipients in Oral andInjectable Formulations. Pharmaceutical Research, 2004, 21(2):201-230.。
