重庆市2015高考化学二轮专题复习课件:专题七 化学反应速率和化学平衡(共141张PPT)
合集下载
高考化学二轮复习2.1.3化学反应速率与化学平衡课件

考向分析
-5专题知识脉络 能力目标解读 热点考题诠释
命题热点 考题统计 2016 卷乙,27(2) 2016 卷丙,27(3) 2015 卷Ⅰ,28(4) 2015 卷Ⅱ,27(2) 2014 卷Ⅰ,28(3) 2014 卷Ⅱ,26(2) 2013 卷Ⅰ,28(4) 2012 卷,27(4)考向源自析图(a)图(b)
-9专题知识脉络 能力目标解读 热点考题诠释
1 2 3
(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由 图可知,最佳n(氨)/n(丙烯)约为 ,理由是 。进料 气氨、空气、丙烯的理论体积比约为 。 答案 (1)两个反应均为放热量大的反应 降低温度、降低压强 催化剂 (2)不是 该反应为放热反应,平衡产率应随温度升高而降低 AC (3)1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1∶7.5∶1
化学反应 速率及化 学平衡图 像、图表 的分析
-6专题知识脉络 能力目标解读 热点考题诠释
1 2 3
1.(2014课标全国Ⅰ)已知分解1 mol H2O2放出热量98 kJ。在含少量 I-的溶液中,H2O2分解的机理为: H2O2+IH2O+IO- 慢 H2O2+IOH2O+O2+I- 快 下列有关该反应的说法正确的是( ) A.反应速率与I-浓度有关 关闭 B.IO-也是该反应的催化剂 C. 反应活化能等于98 kJ· mol-1 在一个化学反应的过程中 ,较慢的过程对整个反应起决定作用 ;化学反应 D. v(H2O2)=v(H2O)=v(O 2) 的活化能与反应热无关 ;一个化学反应 ,用不同的反应物或生成物表示反
化学平衡 状态的判 2015 卷Ⅱ,27(3) 断及平衡 2014 卷Ⅱ,26(3) 移动的影 响因素
化学反应速率与化学平衡——图像专题(共52张PPT)
v
v正 v逆 t
v
t1
②若对上述反应加负催化剂 或减小压强,画出平衡移动 过程中的 v-t图。
v正 v逆
t1
t
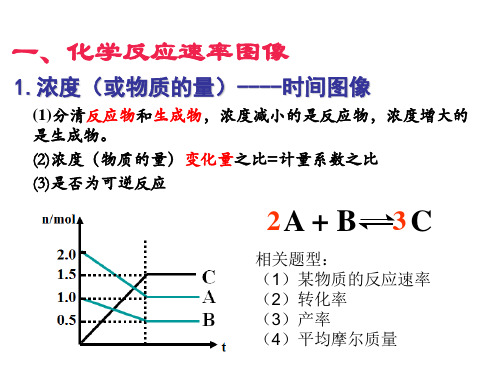
2.速率----时间图像
原因分类: (1)若a、b无断点,则平衡移动肯定是改变某一物质的浓 度导致。
(2)若a、b有断点,则平衡移动原因可能是:①改变反应 体系的压强;②改变反应体系的温度;③同时不同程度地改 变反应物(或生成物)的浓度;
②若对上述反应降温或减小 压强,画出平衡移动过程中 的 v-t图。
v正 v逆
t1 t2
t
v逆 v正
t1 t2
t
2.速率----时间图像
(3) 催化剂 压强变化b
①对于mA(g)+nB(g) pC(g)+qD(g),条件改变时有 右图变化,改变的条件可能 加正催化剂 ; 为:a.____________ 加压 ,m+n___p+q b.________ ;平 = 正 反应方向移动。 衡向____
mA(g)+nB(g)
A 的 转 化 率
pC(g)+qD(g) ΔH
T2C T1C
答 问 案 题
1、T1>T 与T 2 2的高低 2、是放热反应 ΔH<0 、放热反应还是吸热反应
看图技巧:
0
t1
t2
时间
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
二、化学平衡图像
1.含量——时间图像
看图技巧:
(1)看清横纵坐标含义 (2)先拐先平衡数值大 (3)平衡移动
课堂练习
mA(g)+nB(g)
A 的 转 化 率
pC(g)+qD(g) ΔH
高考化学二轮复习 第2部分 第1篇 高频考点6 化学反应速率与化学平衡课件

【解析】 8 min 时 X 的浓度不再变化,但反应并未停止,A 项错误。从反应开始至达到平衡,X 的浓度变化为 1.0 mol·L-1-0.15 mol·L-1=0.85 mol·L-1,转化率为01.8.05×100%=85%,B 项正确。ΔH <0,正反应放热,故升高温度,平衡将逆向移动,则 X 的转化率 减小,C 项错误。降低温度,正、逆反应速率同时减小,但是降低 温度平衡正向移动,故 v 正>v 逆,即逆反应速率减小得快,D 项错 误。
B.增加 CO 的量 D.降低温度
【解析】 CO 浓度减小,说明平衡右移,由于容器容积固定, 再结合反应放热判断,只能是降低温度。
【答案】 D
影响化学反应速率的因素判断步骤 (1) 审 清 题 干 : 看 清 题 目 要 求 是 “ 浓 度 ”“ 压 强 ” 还 是 “ 温 度”“催化剂”。 (2)审清条件:分清是“恒温、恒压”还是“恒温、恒容”或 其他限制条件。
已知:气体分压(p 分)=气体总压(p 总)×体积分数。下列说法正 确的是( )
A.550 ℃时,若充入惰性气体,v 正、v 逆均减小,平衡不移动 B.650 ℃时,反应达平衡后 CO2 的转化率为 25.0% C.T ℃时,若充入等体积的 CO2 和 CO,平衡向逆反应方向 移动 D.925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数 Kp=24.0 p 总
A.从反应开始到 t1 时的平均反应速率 v(X)=0t.12 mol·L-1·min-1 B.该温度下此反应的平衡常数 K=0.32 C.欲提高平衡体系中 Y 的含量,可升高体系温度或减少 Z 的 量 D.其他条件不变,再充入 0.1 mol 气体 X,平衡正向移动,X 的转化率增大
解析:选 B。在恒温恒容下,压强之比等于物质的量之比,从
高考化学冲刺总复习——化学反应速率与化学平衡(共30张PPT)

压强
①m+n≠p+q时,总压力一定(其他条件一定) ②m+n=p+q时,总压力一定(其他条件一定)
化学平衡 2. 化学平衡的特征及判断
(2)平衡标志的判断
混合气体平均相
①Mr一定时,只有当
对分子质量Mr
m+n≠p+q时
②Mr一定时,但m+n=p+q
时
体系的密度
密度一定
其他
如体系颜色不再变化等
化学平衡 2. 化学平衡的特征及判断
Байду номын сангаас
起始量(mol):
高催温化、2剂高N压 H3
2s末量(mol):
变化量(mol):
化学反应速率 1.化学反应速率及其计算
【例3】在不同条件下分别测得反应2SO2(g)+O2(g) ⇌ 2SO3(g)的化学
A 反应速率,其中表示该反应进行的最快的是( )
A.v(SO2)=4 mol·L-1·min-1 C.v(SO2)=0.1 mol·L-1·s-1
AB
【例4】在一定温度下,向aL密闭容器中加入1mol X气体和2mol Y气
体,发生如下反应:X(g)+2Y(g) ⇌ 2Z(g)。此反应达到化学平衡的标志 是( ) A.容器内压强不随时间变化 B.容器内各物质的浓度不随时间变化 C.容器内X、Y、Z的浓度之比为1:2:2 D.单位时间消耗0.1mol X同时生成0.2mol Z
化学反应速率 1.化学反应速率及其计算
(4)计算步骤——三段法 (5)化学反应速率与化学计量数的关系
高温、高压
【例2】在2L密闭容器中,加入1mol和3molH2和N2,发生 N2 + 3H催化2 剂
新课标高考化学二轮培优课件:化学反应速率和化学平衡131张

2020新课标高考化学二轮培优课件: 化学反 应速率 和化学 平衡13 1张 (共131张PPT)
2020新课标高考化学二轮培优课件: 化学反 应速率 和化学 平衡13 1张 (共131张PPT)
3.(2018·新课标全国卷Ⅲ节选)三氯氢硅(SiHCl3)是制备硅 烷、多晶硅的重要原料。回答下列问题:
化学反应速率和化学平衡
1.(2019·新课标全国卷Ⅰ节选)水煤气变换[CO(g)+H2O(g) =CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以 及合成气加工等工业领域中。回答下列问题:
(1)Shibata 曾做过下列实验:①使纯 H2 缓慢地通过处于 721 ℃下的过量氧化钴 CoO(s),氧化钴部分被还原为金属钴 (Co),平衡后气体中 H2 的物质的量分数为 0.025 0。
可知反应平衡常数 K(300 ℃) 大于 K(400 ℃)(填“大于”
或 “ 小 于 ”) 。 设 HCl 初 始 浓 度 为 c0 , 根 据 进 料 浓 度 比
c(HCl)∶c(O2)=1∶1 的数据计算 K(400 ℃)= 0.422×0.422
1-0.844×1-0.21c0 (列出计算式)。按化学计量比进料
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
解析:(1)H2 还原氧化钴的方程式为:H2(g)+CoO(s)===Co(s)
+H2O(g);CO 还原氧化钴的方程式为:CO(g)+CoO(s)===Co(s)
+ CO2(g) , 平 衡 时 H2 还 原 体 系 中 H2 的 物 质 的 量 分 数
2020新课标高考化学二轮培优课件: 化学反 应速率 和化学 平衡13 1张 (共131张PPT)
高考化学总复习第7章化学反应速率和化学平衡第1节化学反应速率及其影响因素课件新人教版

图中:E1 为__正__反__应__的__活__化__能______,使用催化剂时的活化能 为___E_3______,反应热为__E_1_-__E_2____。
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
1.增大反应物的浓度,能够增大活化分子的百分含量,所 以反应速率增大( × ) 2.N2(g)+3H2(g) 2NH3(g) ΔH<0,其他条件不变时升高 温度,反应速率 v(H2)和 H2 的平衡转化率均增大( × ) 3.往锌与稀硫酸反应混合液中加入 NH4HSO4 固体,反应速 率不变( × ) 4.对于反应 2H2O2===2H2O+O2↑,加入 MnO2 或降低温 度都能加快 O2 的生成速率( × )
考点一 化学反应速率
1.表示方法 通常用单位时间内_反__应__物__浓__度__的__减__少__或_生__成__物__浓__度__的__增__加_ 来表示。
2.表达式
v=ΔΔct,单位:_m_o_l_·_L_-_1_·__s-_1_或___m__o_l·_L_-_1_·__m__in_-。1 如密闭容 器中,合成氨的反应 N2+3H2 2NH3,开始时 c(N2)= 8 mol·L-1,2 min 后 c(N2)=4 mol·L-1,则用 N2 表示的反应 速率为__2_m__o_l·__L__-_1·__m__in__-_1 ___。
第七章·化学反应速率和化学平衡
第 1 节 化学反应速率及其影响因素
第七章·化学反应速率和化学平衡
【考纲要求】 了解化学反应速率的概念和定量表示方法。能正确计算
化学反应的转化率(α)。 了解反应活化能的概念,了解 催化剂的重要作用。 理解外界条件(浓度、温度、压强、 催化剂等)对反应速率的影响,能用相关理论解释其一般规 律。 了解化学反应速率的调控在生活、生产和科学研究 领域中的重要作用。
高三化学:化学反应速率和化学平衡 PPT
Ⅰ.H2S 的除去 方法 1:生物脱 H2S 的原理为: H2S+Fe2(SO4)3===S↓+2FeSO4+H2SO4 4FeSO4+O2+2H2SO4硫==杆==菌= 2Fe2(SO4)3+2H2O (1)硫杆菌存在时,FeSO4 被氧化的速率是无菌时的 5×105 倍, 该菌的作用是________________________________________ __________________________________________________。
(3)误认为纯固体与纯液体可不能改变化学反应速率。实际上不 能用纯固体与纯液体物质的变化表示化学反应速率,但若将固体 的颗粒变小(增大固体的接触面积)则化学反应速率会加快。 (4)误认为只要增大压强,化学反应速率一定增大。实际上反应在 密闭固定容积的容器中进行,若充入氦气(或不参与反应的气体), 压强增大,但参与反应的各物质的浓度不变,反应速率不变;若反 应在密闭容积可变的容器中进行,充入氦气(或不参与反应的气体) 而保持压强不变,容器体积增大,各组分浓度减小,反应速率减小。
(3)图(c)为反应产率与反应温度的关系曲线,副产物主要是高温裂 解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高 而增大的原因估计是 ____________________________________________________、 ___________________________________________________; 590 ℃ 之 后 , 丁 烯 产 率 快 速 降 低 的 主 要 原 因 估 计 是 _______________________________________________________ _____________________________________________________。
(3)误认为纯固体与纯液体可不能改变化学反应速率。实际上不 能用纯固体与纯液体物质的变化表示化学反应速率,但若将固体 的颗粒变小(增大固体的接触面积)则化学反应速率会加快。 (4)误认为只要增大压强,化学反应速率一定增大。实际上反应在 密闭固定容积的容器中进行,若充入氦气(或不参与反应的气体), 压强增大,但参与反应的各物质的浓度不变,反应速率不变;若反 应在密闭容积可变的容器中进行,充入氦气(或不参与反应的气体) 而保持压强不变,容器体积增大,各组分浓度减小,反应速率减小。
(3)图(c)为反应产率与反应温度的关系曲线,副产物主要是高温裂 解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高 而增大的原因估计是 ____________________________________________________、 ___________________________________________________; 590 ℃ 之 后 , 丁 烯 产 率 快 速 降 低 的 主 要 原 因 估 计 是 _______________________________________________________ _____________________________________________________。
