复杂金属簇合物的结构与功能
高等无机化学第四章 金属原子簇

金属原子簇化合物分三类:
1.多核金属羰基,亚硝酰配合物
2.低价卤化物和羧酸配合物 3.无配体原子簇 Hg2Cl2可看作最简单的金属原子簇化合物. 1907,法,美分别报道Ta6Cl14· 2O. 7H 上世纪20年代Linder(Ger.)合成了[Mo6Cl8]Cl4. 1935,Brosset(Swed.)报道了K3W3Cl4···. ···
可被其它配体取代,这类簇化合物及其衍生物是数量最大, 发展最快,又是最重要的一类金属簇化合物: Fe: [Fe3(CO)11]-1, Fe3(CO)12, [Fe6(CO)16C]2-··· ·· Co: Co3(CO)9CR (R=H.Cl.Me.Ph等), Co4(CO)12
[Co6(CO15C]12, [Co13(CO24C2H]4-·· ·,
第四章 金属原子簇
目前,金属原子簇化学已成为无机化学前沿领域
之一. 因其电子结构特殊,成键方式新颖,成为结构化
学新课题,也是对化学键理论的新挑战.
金属原子间形成以多面体骨架为特征的金属原子
簇(metal cluster),最基本的共同点是含金属-金属 键,超越了经典Werner型配和物的范畴(仅考虑金属 与配体间化学键).
210o C 12 h
研究结果表明:随温度升高,原子簇增大,极端情况 下可形成金属Os.由于很大的金属羰基簇合物可以看
作是金属表面吸附了CO,因此金属多核羰基化合物反
应性能可能与Os表面吸附了一氧化碳分子有关,这对
多相催化研究提供了一个模型.
此外还有光化学缩合等方法. 3.金属-羰基原子簇反应
此类反应具有其自身的特殊性和复杂性.
25 C,CO, KPa 100 THF
o
[Rh5(CO)15]+CO
第五章有机过渡金属化合物和过渡金属簇合物教材

Os(CO)5 Ir2(CO)8
Hf
Ta W(CO)6 Re2(CO)10
Pt
Au
Os3(CO)12 Ir4(CO)12
不稳定的羰基化合物如Ti(CO)6,Pb(CO)4,Pt(CO)4,Fe(CO)4,Ni(CO)3 等,可利用CO与金属原子在稀有气体基质中低温合成,这种技术称为基 质隔离法,在类似的条件下使稳定的羰基化合物发生光分解作用也能够制 备这类化合物。
17
§5.2 过渡金属羰基化合物
1. 概 述
过渡金属及其化合物与一氧化碳反应(直接或在还原剂存在
下),生成羰基化合物,一些典型的二元羰基化合物的合成:
Fe + 5CO
200℃ 高压
Fe(CO)5
250℃
OsO4 + 5CO 3.5 MPa Os(CO)5 + 2O2
115℃,7 MPa
2CrCl3 + 12CO + LiAlH4 乙醚 2Cr(CO)6 + LiCl + AlCl3 + Cl2 + H2
若只考虑价层电子,则金属价电子数加上配体σ电子数 的总和等于18的分子是稳定的,EAN规则亦称为18电子规则。
对于第二、第三系列过渡金属d8组态离子,它们的p轨 道能量较高,不能全部参加成键,以致生成平面正方形配合 物时16或14电子比18电子更稳定。
9
3. 配体分类和电子数计算
根据配体与金属键合的本质将配体分为:
挥发性
[LiMe]4 [BeMe2]x [AlMe3]2
21.96 39.08 72.09
四面体型聚合物
难熔
线型聚合物
在200℃升华
二聚物
在15.4 ℃熔化
金属原子簇化合物

•M-M键还存在如何确定键级问题,即如何 确定M-M键是单键、双键、叁键或四键?一
般通过将键长、键能的实验测定与理论分析 相结合的办法来确定。
3、 金属原子簇化合物的分类
• (异核1)簇按F成e2R簇u原(C子O)类12 ,型F分eR:u2同(C核O)簇12Fe3(CO)12 ; • (2)按结构类型分:开式结构多核簇;闭式
•(3)键能:M-M键能>80KJ/mol才是簇 状化合物(同族中原子簇的M-M键能从上到
下增大)
•Mn2(CO)10 Te2(CO)10 Re2(CO)10 Fe3(CO)12 Ru3(CO)12
Os3(CO)12 104KJ/mol 180
187
82
117
130
•(4)其它:振动光谱、Βιβλιοθήκη 电子能谱、电子 能谱2、特点:
• (1)存在M-M金属键
1935年, C. Brosset
K3W2Cl9 中, W—W 240pm (2.40Å)
W单质中, W—W 275pm (2)分子的立体结构一般 都是三角多面体或欠完整 的三角多面体,骨架成键 电子以离域多中心键形式 存在。(具有M-M键的两 个核配合物并不算原子簇)
-癸硼烷(14)
• D、硼烷离子命名时,在其母体后括弧中指明离子所带 的电荷。如:B12H122-闭式-十二硼烷阴离子(2-)
二、硼烷的结构和化学键
• 1、乙硼烷B2H6结构的成键要素
• 若与乙烷相似形成BH3BH3,有7 个共价单键,需14个 电子,但分子中只有12个电子。
• 在乙硼烷分子中B:2S22P1,采用SP3杂化,(1)每个 硼原子使用两个SP3杂化轨道和两个电子与氢原子形成 两个σ 键(2c-2e),两个硼原子形成了两个BH2基团, 且位于同一平面内;(2)每个硼原子还剩有一个价电 子和两个杂化轨道,且垂直于BH2平面,两个氢原子分 布在剩下的4个SP3杂化轨道组成的平面内,并将两个 硼原子桥联起来,(每个氢原子提供一个电子和一个 1s轨道,两个B原子提供两个SP3杂化轨道和一个电子) 形成两个B-H-B键( 3c-2e),且分别位于BH2平面 的上下方。
化学配位化学的络合物分子结构与配位键性质

化学配位化学的络合物分子结构与配位键性质化学配位化学是研究配位化合物的合成、结构和性质的领域。
配位化合物是通过配位键将中心金属离子与其他原子或分子团连接在一起的化合物。
在配位化学中,了解络合物分子结构和配位键性质对于理解其化学性质和应用具有重要意义。
一、络合物分子结构络合物是由中心金属离子与配体形成配位键而形成的化合物。
络合物的分子结构可以通过X射线结晶学、核磁共振等实验手段来表征。
根据分子结构的特征,络合物可以分为以下几种类型:1. 单核络合物:单核络合物由一个中心金属离子与一个或多个配体形成配位键,形成一个独立的分子。
例如,六配位的八面体形态的[Fe(H2O)6]2+是一种典型的单核络合物。
2. 簇合型络合物:簇合型络合物是由许多中心金属离子与相同或不同的配体通过配位键连接而形成的。
簇合型络合物具有较复杂的分子结构,例如,酸化钨酸铵((NH4)10[H2W12O42])就是一种簇合型络合物。
3. 桥联型络合物:桥联型络合物是由桥联配体连接两个或多个中心金属离子而形成的络合物。
桥联配体通常通过两个或多个配位原子与中心金属离子形成配位键。
桥联型络合物在催化、磁性等领域具有广泛应用。
二、配位键性质配位键是将中心金属离子与配体连接在一起的化学键。
配位键的性质直接影响着络合物的化学性质和应用。
以下是一些常见的配位键性质:1. 配位数:配位数是指一个中心金属离子周围配位原子或离子的个数。
不同的金属离子对于不同的配体具有不同的配位数。
例如,八面体形态的六配位络合物的配位数为6。
2. 配位键键长和键能:配位键的键长和键能决定了配位键的强度和稳定性。
通常情况下,配位键的键长较短,键能较大。
这是因为金属离子与配体之间的键是通过电子云的重叠来形成的。
3. 配位键的极性:配位键可以是极性的。
通常来说,金属离子的电子云密度较低,而配体具有较高的电子云密度。
因此,金属离子与配体之间形成的配位键通常是极性的。
4. 配位键的方向性:配位键可以是方向性的。
金属有机框架特点

金属有机框架特点金属有机框架(Metal-Organic Frameworks,MOFs)是一种由金属离子(或金属簇)和有机配体通过化学键结合而成的晶体结构材料。
MOFs具有以下几个特点:1. 多孔性:MOFs具有高度的孔隙度和表面积,其孔隙结构可以用于吸附、储存和释放气体分子。
MOFs的孔径和孔隙大小可以通过合成过程中控制配体的长度和功能基团来调节,使其适应不同分子的吸附需求。
2. 可调性:MOFs的结构可以通过选择不同的金属离子和有机配体来调节。
金属离子可以是过渡金属、稀土金属或主族金属,而有机配体可以是含氮、含氧、含硫等功能基团的有机化合物。
通过合理设计和选择配体,可以实现MOFs的结构和性能的调控。
3. 高度晶化:MOFs具有高度的结晶性,晶胞大小和形状可以通过调节合成条件来控制。
MOFs的高度晶化性质使其在结构表征和性能测试方面具有优势,有利于深入研究其结构和性质。
4. 多功能性:MOFs具有多种功能,可以用于气体分离、催化、吸附、传感等领域。
MOFs的多功能性来源于金属离子和有机配体的多样性,可以通过合成不同的MOFs来实现不同的功能需求。
5. 可再生性:MOFs具有良好的可再生性,可以通过溶解、再结晶等方法进行循环利用。
这使得MOFs在环境保护和可持续发展方面具有潜在应用价值。
6. 可控合成:MOFs的合成方法多样,可以通过溶剂热法、溶胶-凝胶法、水热法等不同的合成方法来制备。
这些方法可以实现对MOFs的形貌、晶型、孔隙结构等性质的控制。
7. 广泛应用:MOFs在气体储存、分离纯化、催化反应、药物传递、光电器件等领域都有广泛的应用前景。
由于其结构和性能的可调性,MOFs可以根据实际需求进行定制设计,以满足不同应用领域的需求。
金属有机框架是一类具有多孔性、可控性、可再生性和多功能性的晶体结构材料。
通过合理设计和选择金属离子和有机配体,可以调控MOFs的结构和性能,使其在气体储存、分离纯化、催化反应等领域具有广泛的应用前景。
化学竞赛 过渡金属元素为骨架的原子簇合物
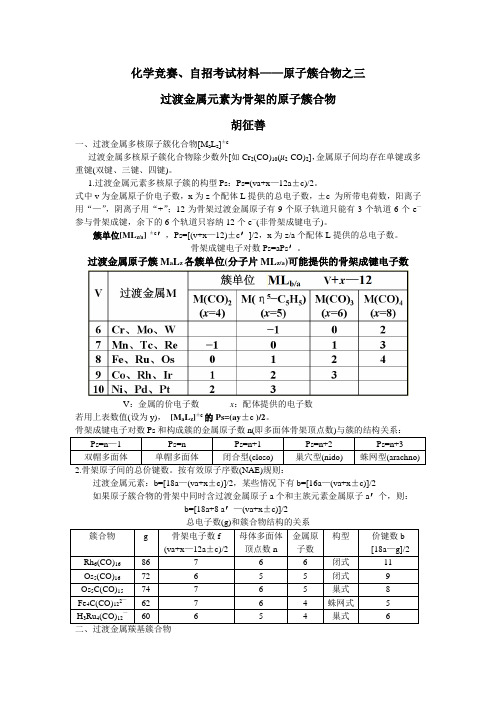
簇单位[MLz/a] ±c′,Ps=[(v+x—12)±c′]/2,x 为 z/a 个配体 L 提供的总电子数。 骨架成键电子对数 Ps=aPs′。
【例 3】Fe5(CO)15C Wade 规则:写作[Fe(CO)3]5C,f{[Fe(CO)3]5C}=[5×(8+6—12)+4]/2=7=5+2,属开(巢)式。 NAE 规则:5Fe 满足 18e—需 90e—,而 5Fe 提供 40e—,15CO 提供 30e—,C 提供 4e—,缺 90 —40—30—4=16e—,5 个 Fe 原子间需共用 8 对电子(Fe—Fe 金属键)。Fe5(CO)15C 结构如图
(2)Re3Cl123—:3 个 Re 过程三角骨架,含 9 个 μ1-Cl 键、3 个氯桥 μ2-Cl 键。 (3)(M6X8)4+(M=Mo、W)型的(Mo6Cl8)4+:[Mo6(μ3-Cl8)]4+
(Mo6Cl8)4+中 Mo 的价电子数:Mo612+=6×6—12=24,8Cl—=16,总数 40,每个 Mo 分摊 40/6。 很难用 18e—或 16 e—规则说明。6 个 Mo 原子构成一个八面体,在八面体的每个面正上方有 一个 Cl—以面桥基配位(μ3-Cl)。若把 8 个 Cl—取走,Mo612+=24e—,八面体的棱边正好是 12 个 Mo—Mo 键。 (4)(M6X12)2+型(M=Nb、Ta)的(Nb6Cl12)2+:[Nb6(μ2-Cl12)]2+
螯合物-配合物-络合物

配位键,又称配位共价键,或简称配键,是一种特殊的共价键。
当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。
配位键形成后,就与一般共价键无异。
形成条件配位键的形成需要两个条件:一是中心原子或离子,它必须有能接受电子对的空轨道;二是配位体,组成配位体的原子必须能提供配对的孤对电子。
当一路易斯碱供应电子对给路易斯酸而形成化合物时,配位键就形成了。
例如气态氨NH3和气体三氟化硼BF3形成固体NH3BF3化合价在配位化合物中,由电负性小的元素原子向电负性大的元素原子提供孤对电子形成配位键时,每个有一对孤对电子的前者(电负性小的原子)显示+2价,后者显示-2价。
反之,由电负性大的元素原子提供孤对电子与电负性小的元素原子之间形成配位键时,两种元素都无价态变化。
常见配位键化合物∙一氧化碳CO,其中碳氧间的三对共用电子对有一配位键,两个正常共价键。
∙铵根NH4+,其中N原子与左下右的H原子以极性键结合,与上边的H以配位键结合,由N原子提供孤对电子螯合物(英语:Chelation)是配合物的一种在螯合物的结构中,一定有一个或多个多齿配体提供多对电子与中心体形成配位键。
“螯”指螃蟹的大钳,此名称比喻多齿配体像螃蟹一样用两只大钳紧紧夹住中心体。
金属EDTA螯合物螯合物通常比一般配合物要稳定,其结构中经常具有的五或六元环结构更增强了稳定性。
正因为这样,螯合物的稳定常数都非常高,许多螯合反应都是定量进行的,可以用来滴定。
使用螯合物还可以掩蔽金属离子。
可形成螯合物的配体叫螯合剂。
常见的螯合剂如下:∙乙二胺(en),二齿∙2,2'-联吡啶(bipy),二齿∙1,10-邻二氮杂菲(phen),二齿∙草酸根(ox),二齿∙乙二胺四乙酸(EDTA),六齿值得一提的是EDTA。
它能提供2个氮原子和4个羧基氧原子与金属配合,可以用1个分子把需要6配位的钙离子紧紧包裹起来,生成极稳定的产物。
螯合物在工业中用来除去金属杂质,如水的软化、去除有毒的重金属离子等。
第七章 金属原子簇化学

金属原子簇
• 在铁硫蛋白中,铁硫原子簇的主要生理功能是传递电 子,因此,在研究铁硫原子族的性质时,往往对它们 的氧化还原性给予特殊的注意.
• 实验表明,中性的Fe4S4(NO)4可被还原到Fe4S4(NO)4-阴 离子
– [(η5-C5H5)Co][Fe4S4(NO)4]
– [AsPh4][Fe4S4(NO)4]
金属原子簇的类型
• 主要类型
– 金属—羰基原子簇化合物
– 金属—卤素原子簇化合物 – 其它类型
金属—羰基原子簇化合物及其衍生物
• 金属—羰基原子簇化合 物及其衍生物 • 金属—碳基能形成大量 的二元原子簇化合物,
– 一部分碳基还可被共 它配体如烯烃、炔烃 及芳香基等碳氢基团, 以及大量含氮、磷、 砷、氧、硫等非碳配 位原子的基团所取 代.
金属羰基原子簇化合物的合成和反应
• [Pt3(CO)6]n 2- (n=6、2或1)不易直接由PtCl62-的还原得 到,它们可由[Pt3(CO)6]n 2- (n=5、4、3)开始来制备
金属羰基原子簇化合物的合成和反应
• 锇的三核羰基族合物Os3(CO)12,是制备其它锇的二元 羰基簇合物及其衍生物的重要中间产物.
金属原子簇
• 例:Fe4S4(NO)4 • 制备: Hg[Fe(CO)3(NO)]2与 硫在甲苯溶液中迴流得到, Hg[Fe(CO)3(NO)]2则可由 Fe(CO)5、 KNO2和Hg(CN)2 反应而来. • 性能:黑色晶体, 稳定. • 结构:Fe4构成四面体, 硫 原子占据面桥基的位置.从 另一个角度来看,Fe4S4形 成一个畸变立方体的骨架, 其中Fe—Fe平均距离 265.1pm,12个Fe—S键长 的变化范围很小,仅从 220.85pm到222.4pm,平均 221.7pm(图).
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
复杂金属簇合物是由多个金属原子通过共价键或者离子键相互连接形成的大分子结构,具有独特的结构和性质。
其结构多样,可以是球形、链状、环状等,也可以是分子簇或者晶体等形态。
复杂金属簇合物具有以下的结构特点和功能:
1.多核结构:复杂金属簇合物可以由多个金属原子组成的多核结
构,这种多核结构可以使得簇合物具有更高的稳定性和更复杂的性能。
2.多功能性:由于复杂金属簇合物中含有多个金属原子和配体,
因此可以具有多种功能,如催化、光电性能、磁性等。
3.可调性:复杂金属簇合物中金属原子和配体之间的键可以被调
节,从而可以控制复杂金属簇合物的性质,如形状、尺寸、电子结构等。
4.低维结构:复杂金属簇合物可以形成低维结构,如二维或三维
晶体,这些低维结构具有高度的有序性和规则性,因此可以应用于电子器件、生物传感器、催化剂等领域。
总之,复杂金属簇合物的结构和功能是十分复杂和多样的,具有广泛的应用前景,已经成为当今材料科学领域的热点研究对象之一。
