镁铝及其化合物
镁铝及其化合物1.ppt
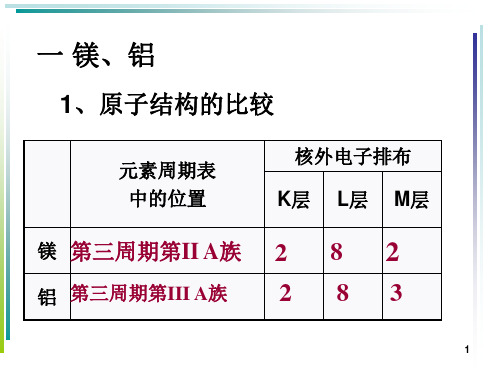
1、原子结构的比较
元素周期表 中的位置
核外电子排布 K层 L层 M层
镁 第三周期第II A族 2 8 2
铝 第三周期第III A族
2 83
1
2、物理性质的比较
相似点:均为 银白色 ;均为 轻金属 ; 熔点均 较低 ;硬度均 较小。都具有金属的 通性 不同点:镁在密度、熔点、沸点、硬度上 均 小于(或低于) 铝。
D.反应速率之比为2∶3
【解析】由关系式:Mg~H2,2Al~3H2,可知产生 等量H2时,消耗Mg、Al物质的量之比为3∶2,故A 项 正 确 。 二 者 质 量 之 比 为 4∶3 , 摩 尔 质 量 之 比 为
8∶9,反应速率之比为3∶2。
25
二、“铝三角”及其应用
1.“铝三角”是指Al3+、Al(OH)3和AlO2-相 互转化的三角关系(如下图)
分析依据:
2Al+6HCl === 2AlCl3+3H2↑ 2Al~6HCl~3H2↑
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2Al~2NaOH~3H2↑
【思考】
1.等质量的铝分别与足量的盐酸、氢氧化钠溶液反应,
所得H2的体积之比是多少? VHCl(H2):VNaOH(H2)=1:1
共存
②AlO2-不能与 H+、HCO3-(直接反应); Al3+、NH4+、 Fe3+(双水解)大量共存 28
即时巩固
4、某无色溶液中加入铝粉只产生氢气,则下列离子
组中可能大量共存的是 ( C D )
A.K+ 、NH4+、Cl- 、NO3- B.K+、Na+、Cl-、HCO3C.K+、NH4+、Cl-、SO42- D.K+、CO32-、Cl-、SO325、某无色透明溶液跟金属Al反应,放出H2。试判断 下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、 OH-、 CO32-、HCO3-、NO3-,下列两种情况能存在此溶液中。 当生成Al3+时,可能存在 __H_+_、__M__g_2_+_、__S_O_4_2- 当生成AlO2-时,可能存在_O__H_-_、__B__a_2_+、__N_ O3_-_ 29
镁铝及其化合物知识点

镁铝及其化合物知识点 SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-镁、铝及其化合物知识点整理Ⅰ.课标要求1.通过海水制镁的事例了解镁及化合物的性质.2.通过合金材料了解铝及化合物的性质.3.能列举合金材料的重要应用.Ⅱ.考纲要求1.掌握镁铝及化合物的性质.2.了解镁铝及化合物在生活.生活中的应用.Ⅲ.教材精讲一. Mg、Al的化学性质1.与非金属反应(1)与O2反应:常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁能在空气中燃烧:2Mg+O22MgO ,铝在纯氧中燃烧:4Al+ 3O22Al2O3(2)与卤素单质、硫等反应:Mg+ Cl 2MgCl 22Al+ 3Cl 22AlCl 32Al+ 3SAl 2S 3 (用于工业制备) Mg+ SMgS③集气瓶底部都要放一些细纱,以防止集气瓶炸裂。
2.与H 2O 反应Mg 、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气Mg+2H 2O (沸水) Mg(OH)2+H 2↑ 2A1+6H 2O2A1(OH)3+3H 2↑[特别提醒]:①镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生: 2Mg+O 22MgO 3Mg+N 2Mg 3N 2 2Mg+CO 22MgO+C②燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。
3.与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
4.与某些氧化物反应(1)镁与二氧化碳反应:2Mg+CO22MgO+C[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe2O32Fe+ Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
第2讲镁、铝及其化合物

NaOH量少:
NaOH量多:
2.与Ba(OH)2溶液反应 Ba(OH)2量少: Ba(OH)2量多:
〖典型例析〗
例1.【202X年高考上海卷】已知NaOH+Al(OH)3→Na[Al(OH)4]。 向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐 口,易拉罐慢慢凹瘪;再过一段时间,罐壁又重新突出。上述实
与Zn的盐溶液反应,其离子方程式为:
。
⑶用途
〖典型例析〗
例1.海水的综合利用可以制备金属镁,其流程如下图
所示:
(1)若在空气中加热MgCl2·6H2O,生成的是
Mg(OH)Cl或MgO,写出相应反应的化学方程
。
用电解法制取金属镁时,需要无水氯化镁。在干燥的
HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其
。
⑵与NaOH溶液反应的离子方程式为:
。
考点二 铝及其化合物
三、氢氧化铝
1.氢氧化铝是两性氢氧化物。这是因为氢氧化
铝在水溶液中存在两种方式的电离,其电离方程
式:
.
有关的离子方程式为:与盐酸的反应:
.
与NaOH的反应:
.
2.受热分解,化学反应方程式为:
.
考点二 铝及其化合物
3.用途 ⑴治疗胃酸过多,其原理可用离子方程式表示为:
。 。 。 。
考点一 镁及其化合物
二.镁的性质
⑴物理性质
⑵化学性质
①能与O2、Cl2、N2等非金属单质反应,产物分别 为、 、。
②与CO2反应 方程式为:
。
③与酸反应
镁与非氧化性酸如稀硫酸、盐酸等反应生成氢气,离子方程
式为:
。
镁与氧化性酸如浓H2SO4、稀HNO3、浓硝酸在常温下也能反 应,但不生成H2。 ④与盐溶液反应
第11讲 金属镁、铝及其化合物(讲义)(解析版)

第11讲金属镁、铝及及其化合物一镁、铝单质的性质1.镁、铝的结构和存在形态2.镁、铝的物理性质镁、铝都是银白色、有金属光泽的固体,密度较小,硬度较低,均具有良好的延展性、导电性和导热性等。
3.铝的化学性质特别强调:1.常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应。
2.能与铝反应产生氢气的溶液可能呈强酸性也可能呈强碱性。
4.对比掌握镁的化学性质特别强调:1.Mg在CO2中能够燃烧,所以活泼金属镁着火不能用干粉灭火器和泡沫灭火器灭火。
2.镁也可在氮气中燃烧,生成氮化镁(Mg3N2),氮化镁能与水剧烈反应生成Mg(OH)2沉淀并放出氨气。
5.从海水中提取镁(1)工艺流程(2)基本步骤及主要反应特别强调:1.由MgCl2·6H2O得到无水MgCl2,必须在HCl气流中加热,以防MgCl2水解。
2.因镁在高温下能与O2、N2、CO2等气体发生反应,故工业电解MgCl2得到的镁,应在H2氛围中冷却。
3.Mg在空气中燃烧得到的固体物质主要为MgO和少量Mg3N2及C的混合物。
4.Mg(OH)2为难溶于水的白色沉淀,故常用NaOH溶液检验Mg2+的存在。
5.由于Mg(OH)2的溶解度比MgCO3的小,故水垢的主要成分中含有的是Mg(OH)2,而非MgCO3。
6.镁的用途(1)镁合金用于制造火箭、导弹和飞机的部件;(2)镁制造信号弹和焰火;(3)MgO作耐火材料。
课堂检测011.科学家发明的透明坚硬镁铝氧化物新型材料,可以用作显示器和手机屏幕,下列关于镁、铝的说法正确的是()A.镁铝制品在空气中能稳定存在是因为铝不活泼B.浓HNO3、浓H2SO4能用铝制器皿盛装是因为铝与浓HNO3、浓H2SO4不反应C.镁、铝均能与NaOH溶液反应D.铝与Fe2O3发生铝热反应是利用了Al的还原性比Fe强答案:D2.小明家中收藏着一件清末的铝制品佛像,该佛像至今仍保存完好。
第三单元金属及其化合物:镁、铝及其化合物——高考化学

示:I2+2S2O2−
,
3 =2I +S4O6 )滴定终点的现象为滴加最后一滴Na2S2O3溶液,锥形瓶
中溶液蓝色褪去,且半分钟内不恢复原色 , 该粗硼样品的纯度为 99
%。
A.5.4 g
B.3.6 g
C.2.7 g
D.1.8 g
( A )
基础测评
4.在KOH和KAlO2混合溶液中滴加稀盐酸直到过量,下列生成沉淀物质
的量与所加盐酸体积关系的图像正确的是
(
D )
方法技能
铝与酸、碱反应生成H2的量的关系
3+
反应实质:Al
+
Al ,2H
H2↑;
定量关系:2Al~3H2。
(1)等量的铝分别与足量盐酸、氢氧化钠溶液反应,产生氢气的体积比
D.海水
Mg(OH)2
MgCl2溶液
MgCl2(熔融)
Mg
基础测评
3.从海水中提取镁的工艺流程如图所示:
下列说法错误的是
( B )
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2时阴极产生氯气
C.步骤⑤可将晶体置于HCl气体氛围中脱水
D.上述工艺流程中涉及化合反应、分解反应和复分解反应
+
+
Al3 +3NH3·H2O===Al(OH)3↓+3NH4 。
-
b.向 NaAlO2 溶液中通入足量 CO2,离子方程式为 AlO2 +CO2+2H2O===
-
Al(OH)3↓+HCO3 。
c.NaAlO2 溶液与 AlCl3 溶液混合:
-
+
3AlO2 +Al3 +6H2O===4Al(OH)3↓ 。
镁铝及其化合物

与 氧
H2O
△
Mg+2H2O Mg(OH)2+H2↑
除氧化膜后可与水微弱反应 铝热反应
化 CO2 物
2Mg+ CO2 点燃 2MgO+C
用途、引发
反
应
Fe2O3
高温
2Al+ Fe2O3 2Fe+ Al2O3
与 氧化 酸 性酸 反 应 H+
与碱反应
反应,无氢气生成 Mg+2H+=Mg2++H2↑
在冷浓硝酸、浓硫酸中“钝 化”,加热时反应,无氢气生 成
据此判断 (1)固体B所含物质的化学式为_____A_l_2_O_3____________。 (2)固体E所含物质的化学式为(__N__H_4_)__2_S_O__4、__K__2_S_O4__。 (3)反应①的离子方程式为________________________。
AlO2—+2H2O+CO2 (过量) = Al(OH)3↓ +HCO3— 或: 2AlO2—+3H2O+CO2 (不足) = 2Al(OH)3↓ +CO32—
A.5.4 g B.3.6 g C.2.7 g D.1.8 g
(2012·普宁华侨中学质检)镁和铝分别与等浓度、等体积
的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如
图。反应中镁和铝的( A )
A.物质的量之比为3∶2 C.摩尔质量之比为2∶3
B.质量之比为3∶2 D.反应速率之比为2∶3
练习:写出Al、Al2O3、A l(OH)3分别和
NaOH溶液反应的化学方程式。
2Al+2H2O+2NaOH= 2NaAlO2+3H2↑ Al2O3+2NaOH=2NaAlO2+ H2O Al(OH)3+NaOH=NaAlO2+2H2O
镁和铝及其重要化合物
镁、铝及其重要化合物一、镁及其化合物镁合金强度高,机械性能好,制造汽车,飞机,火箭的重要材料,冶金时,镁常用作还原剂和脱氧剂.常温下氧化生成氧化物保护层,具有抗腐蚀的性质.镁与O2,N2,CO2等气体燃烧.2Mg+O22MgO CO2+2Mg2MgO+C 3Mg+N2Mg3N2镁与SiO2:2Mg+SiO2=2MgO+Si镁与冷水反应很慢,在加热时反应加快.Mg+2H2O=Mg(OH)2+H2↑镁与非氧化性酸.Mg+2HCl=MgCl2+H2↑镁与水解显酸性的盐溶液的反应. Mg+2NH4Cl =MgCl2+2NH3+H2↑镁盐与氨水,产生Mg(OH)2沉淀.Mg(OH)2又能溶解在NH4Cl溶液中.前者由Mg(OH)2的特殊溶解性决定.在常见的难溶性氢氧化物中,Mg(OH)2的溶解度最大.故产生Mg(OH)2的条件:浓的Mg2+ 盐溶液与浓氨水反应.后者是由Mg(OH)2的电离性质和的水解性质决定.通常认为Mg(OH)2完全电离,能溶解在饱和NH4Cl溶液中,MgCl2+2NH3·H2OMgOH2+2NH4Cl海水提镁:㈠海水加碱,得氢氧化镁沉淀,沉淀分离出来再加盐酸,变成氯化镁;后过滤,干燥,电解得镁.Mg2++2OH-==Mg(OH)2↓,Mg(OH)2+2HCl=MgCl2+2H2O,MgCl2Mg+Cl2↑㈡从海水提取出食盐、KCl、Br2以后留下的母液浓缩,得到卤块,主要成分是MgCl2·6H2O,然后脱水, MgCl2·6H2OMgCl2+6H2O,最后电解熔融的氯化镁得到镁.氧化镁(白色粉末,高熔点,碱性氧化物,)与水缓慢作用,与酸反应.MgO+2HCl=MgCl2+H2O MgO+H2OMg(OH)2氢氧化镁(白色粉末,难溶于水)与H+作用,与NH4Cl溶液作用,对热不稳定.Mg(OH)2+2HCl=MgCl2+2H2O Mg(OH)2MgO+H2O↑二、铝及其化合物铝(银白色金属,导电性仅次于银、铜和金。
高中化学“镁、铝及其化合物”知识点总结
“镁、铝及其化合物”知识点总结一、Mg、Al的化学性质(一)与非金属反应1.与O2反应。
常温下与空气中的O2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在空气中燃烧:2.与卤素单质、硫等反应。
【特别提醒】(1)镁在空气中用酒精灯火焰点燃即可燃烧,而铝在空气中需要高温点燃才能燃烧。
镁在空气中燃烧时有三个反应发生:(2)燃烧时都放出大量的热,发出耀眼的白光。
利用镁的这种性质来制造照明弹。
(3)集气瓶底部都要放一些细纱,以防集气瓶炸裂。
(二)与H2O反应Mg、A1和冷水都不反应,但在加热条件下与水反应生成氢氧化物和氢气(三)与酸反应置换出H2Mg、A1与浓、稀盐酸、稀硫酸、磷酸等酸反应置换出H2,其中铝在冷浓 H2SO4,冷浓硝酸中发生钝化现象。
所以可用铝制容器贮存冷的浓硫酸或浓硝酸。
(四)与某些氧化物反应1.镁与二氧化碳反应:[特别提醒]:“CO2不能助燃”的说法是不全面的,CO2对绝大多数可燃物是良好的灭火剂,而对K、Ca、Na、Mg等可燃物却是助燃剂。
(2)铝热反应:2Al+ Fe2O32Fe+ Al2O3铝热反应可用于焊接钢轨和冶炼某些难熔金属,如:V、Cr、等。
[特别提醒]:(1)铝热剂是指铝粉和某些金属氧化物的混合物,金属氧化物可以是:Fe2O3、FeO、Fe3O4、Cr2O3、V2O5、Mn O2等。
(2)铝热反应的特点是反应放出大量的热,使生成的金属呈液态。
(3)要使用没有氧化的铝粉,氧化铁粉末要烘干。
(4)KClO3作为引燃剂,也可以用Na2O2代替。
实验时可以不用镁条点燃,而用在氯酸钾和白糖的混合物上滴加浓硫酸的方法来点燃。
(五)与碱反应镁不与碱反应,铝与碱液反应:二、氢氧化铝(一)物理性质:A l(O H)3是几乎不溶于水的白色胶状固体,具有吸附性。
(二)化学性质1.与酸反应:Al(OH)3 +3HCl=AlCl3+3H2O离子反应方程式:Al(OH)3+3H+=Al3++3H2O2.与碱反应:Al(OH)3+NaOH=NaAlO2+2H2O离子反应方程式:Al(OH)3+OH =NaAlO2+2H2O3.Al(OH)3的制取(1)铝盐与碱反应:实验室制取氢氧化铝时采用过量的氨水,而不用强碱与可溶性铝盐溶液反应是因为氢氧化铝是两性氢氧化物,能溶于强碱溶液,不溶于弱碱溶液。
镁铝及化合物的性质
一、镁、铝单质
1.存在 铝:铝土矿( Al2O3· XH2O ,含少量Fe2O3、SiO2) 明矾[KAl(SO4)2· 12H2O]、云母、正长石
镁:光卤石(KCl· MgCl2· 6H2O)
菱镁矿(MgCO3)、石棉
2.物理性质 共性:银白色轻金属、熔沸点低、硬度小,
思考2. 将足量的CO2不断通入KOH、Ca(OH)2、KAlO2 的混合溶液中,生成沉淀与通入CO2的体积的关系可表 示为
思考3. 将一定质量的Mg、Al合金全部溶解在500mL
盐酸中(体积变化不计),取10mL反应后的溶液,加 入1mol· L-1NaOH溶液,所加NaOH溶液的体积(mL) 与产生沉淀的质量(g)关系如图所示 (1)求Mg、Al质量各是多少?
物质的量为 ___________
NaNO3、Fe(NO3)3、Al(NO3)3、NH4NO3 0.028mol 0.024mol 0.008mol 0.012mol
二、镁铝的化合物 氧化镁 物理性质 所属类别
碱性氧化物 MgO+HCl→
氧化铝(刚玉)
两性氧化物 不与水反应 Al2O3+HCl → Al2O3+NaOH → 铝土矿的提纯 电解制铝、耐高温材料
白色粉末、熔点高硬度大、难溶于水
典型反应 MgO+H O→Mg(OH) 2 2 制备方法 MgCO3==MgO+CO2↑ 用途
B
思考5. 现有一定量Al、Fe混合物与稀HNO3充分反应, 反应过程中无任何气体放出。将反应结束后的溶液加 水稀释到1L,取出100mL,逐滴加入4mol · L -1NaOH
溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质
镁、铝及其化合物
铝
与O2反应
常温下生成氧化膜,点燃燃烧
2Mg+O2=2 MgO
常温下生成氧化膜
4Al+3O2=2Al2O3
与水反应
Mg+2H2O=2Mg(OH)2+H2↑
2Al+6H2O=2Al(OH)3+3H2
与酸反应
非氧化性酸Mg+2H+=Mg2++H2↑
氧化性酸:无H2生成。
非氧化性酸:2Al+6H+=2Al3++3H2
热稳定性
受热易分解
受热易分解
实验室制取
主要用途
阻燃剂
净水(明矾)
用途
制合金
制合金、电线、包装材料、涂料
二、镁、铝氧化物的性质
物质
氧化镁(MgO)
氧化铝(Al2O3)
色态
白色粉末
白色固体(天然产物称为刚玉)
类别
碱性氧化物
两性氧化物
溶解性
难溶于水,和水缓慢化合
MgO+H2O=Mg(OH)2
不溶于水
与盐酸反应
MgO+2HCl=MgCl2+H2O
Al2O3+6HCl=2AlCl3+3H2O
镁、铝及其化合物
一、镁、铝单质的性质
1、物理性质
①颜色:银白色有金属光泽
②熔沸点:较低且Mg<Al
③硬度:较柔软且Mg<Al
④密度:较小且Mgபைடு நூலகம்Al
⑤导电性:较好且Mg<Al
2、化学性质
都是活泼金属,均有较强的还原性,都能与非金属、酸及氧化物等反应,但镁的原子半径比铝大,更容易失电子,所以金属性Mg>Al。
Al与冷浓硫酸、浓硝酸发生钝化。
与碱反应
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过量强酸,不易控制酸的量;
Байду номын сангаас
• (3)步骤④中得到较纯的Al2O3,可能含有
杂质,在电解时它不
会影响铝的纯度的原因:___________________________________。 SiO2的熔点很高,电解时不会熔化,不影响电解产物的纯度
• 方案二:酸溶法
• 讨论回答下列问题: • (1)步骤①得到沉淀主要为 ,滤液甲中的溶质主要 为 ,生成该溶质的离子方程式为 。 • (2) ②中不用氨水沉淀Fe3+的原因: _________________________________________。
• • • • •
3.镁和铝都是较活泼的金属,下列叙述正确的是 ( CD) A.镁不与任何氧化物反应,而铝可用于冶炼金属 B.金属镁、铝作电极构成原电池时,负极反应一定为:Mg-2e-=Mg2+ C.将AlCl3溶液蒸干并灼烧固体,得到氧化铝 D.镁铝合金硬度高于镁、铝 ,氧化镁可用作耐火材料
• 4、取少量MgO、A12O3、SiO2、Fe2O3的混合粉末,加入过量盐酸,充分反应 后过滤,得到沉淀X和滤液Y。下列叙述正确的是 ( C ) A.上述四种氧化物对应的水化物中,Al(OH)3酸性最强 • B.向沉淀X中加入氢氟酸,沉淀X不溶解 C.溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ • D.溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2
• 三、铝土矿的提纯
• 主要成分是Al2O3,少量SiO2、Fe2O3等; • 方案一:碱溶法
• 讨论回答下列问题: • (1)写出①、③两步骤中可能发生反应的离子方程式。
AlO2 与酸反应生成的Al(OH) • (2)步骤③中不用盐酸(或H2SO4)酸化的理由是__________________ 。 3可溶于
• 写出上述转化的离子方程式。
• 二、问题讨论: • 1.Al→Al2O3可能的转化方式 • 2.Al→Al(OH)3 、 Al2O3 →Al(OH)3能否直接 转化 • 3.既能跟稀硫酸反应,又能跟氢氧化钠溶液 反应的物质类别 • 4.完全沉淀溶液中的Al3+ 、AlO2-的方法,写 • 出离子方程式 • 5.用铝屑、烧碱、稀H2SO4制取Al(OH)3的最佳 方法 • 6.铝化合物图像分析
• 练习: • 1将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的 下列溶液中,充分反应后,放出氢气最多的是( A ) • A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH D.18mol/LH2SO4
• • • • • 2、探究Mg及其化合物的性质,操作正确且能达到目的的是( B ) A、将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性 B、将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 C、将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 D、将Mg(OH)2沉淀转入表面皿中,加足量盐酸,加热蒸干得无水MgCl2固体
铝及其化合物
• • • • • • • • • •
一、方程式默写: 1.工业制取镁、冶炼铝 2.Mg和CO2 Al和 Fe3O4(铝热反应)
以下写离子方程式:
3.Al、Al2O3 、Al(OH)3分别和NaOH溶液 4.AlCl3溶液滴加过量氨水 AlCl3溶液加入过量NaOH 5.NaAlO2溶液通入过量CO2 NaAlO2溶液加入少量盐酸 NaAlO2溶液加入过量盐酸 6、 AlCl3溶液和NaAlO2溶液混合
