第二章生物大分子的结构及性质。
生物样品中生物大分子的分离纯化

19
(六) 生物大分子的抽提
✓ “抽提”是将经过预处理或破碎了的细胞或组织置于一 定条件下和溶剂中,使被提取的生物大分子以溶解状态 充分地释放到溶剂中,并尽可能保持原来的天然状态不 丢失生物活性的过程。
14
组织与细胞破碎
1、机械破碎法
✓ 研磨:这种方法比较柔和,适宜实验室使用; ✓ 组织捣碎器:这是一种较剧烈的破碎细胞的方法。利用高速
旋转的叶片产生的剪切力将组织细胞破碎。处理材料量较大 时,经常使用。 ✓ 匀浆器:匀浆器用来破碎那些比较柔软,易于分散的组织细 胞。科研上若材料处理量少,可使用匀浆器。
生物大分子的 分离纯化和鉴定
生物分子(Biomolecule)泛指生物体特有的各类分子, 是自然存在于生物体中的分子的总称,是组成生命 的基本单位。
包括
小分子(如脂类、激素、维生素等) 生物大分子(蛋白质、核酸、糖复合物等)
什么是生物大分子?
生物大分子指的是作为生物体内主要活性成分 的各种分子量达到上万或更多的有机分子,结构具 有一定的规律性,大多是由基本结构单位按一定顺 序和方式连接而形成的多聚体。
常见的生物大分子包括蛋白质(包括酶)、核酸、 多聚糖等。
3
生物大分子分离纯化的特殊性
1. 生物材料的组成复杂,种类极多;分离纯化方法千 差万别,没有一种标准方法可通用于各种生物大 分子的分离制备。
2. 许多生物大分子在生物材料中的含量极微,分离 纯化的步骤多,流程长。
生物大分子结构与功能

生物大分子结构与功能[掌握]:蛋白质的基本组成单位和平均含氮量。
氨基酸的理化性质。
蛋白质一级、二级、三级和四级结构基本概念及维系其稳定的化学键,肽单元的概念,蛋白质二级结构的主要类型,结构模体、超二级结构、结构域、亚基、蛋白质等电点的概念,蛋白质变性作用及影响因素。
[熟悉]:氨基酸的分类。
20种氨基酸的名称及三字母英文缩写符号。
肽的概念和基本结构,生物活性肽。
肽单元的结构特点。
蛋白质一级结构和空间结构与蛋白质功能之间的关系。
蛋白质的别构作用。
蛋白质的紫外吸收作用。
维系蛋白质胶体溶液的稳定因素。
蛋白质呈色反应。
[了解]:氨基酸的单字母符号。
分子病的概念。
蛋白质执行功能的主要方式。
蛋白质分类。
课后思考题∙简述蛋白质一到四级结构的基本概念、维持的作用力以及各结构层次间的内在关系。
∙试述蛋白质多肽链中α-螺旋的结构特点及妨碍其形成的因素。
∙何谓蛋白质的变性作用?其本质是什么?引起变性的因素有哪些?举例说明其应用。
∙以血红蛋白与O2的结合为例,说明什么是协同效应?∙举例说明蛋白质结构与功能的关系。
第二章核酸的结构与功能【掌握】核酸的基本组成单位和核酸的水解产物。
核酸分子中核苷酸的连接方式。
DNA和RNA的一级结构和基本组成单位。
DNA二级结构——双螺旋结构的定义和特点。
三种RNA 的结构特点和功能。
核酸的紫外吸收作用。
DNA的变性与复性。
DNA的增色效应和解链温度。
【熟悉】DNA的超螺旋结构。
核酸的分子杂交。
【了解】DNA结构的多样性。
其他小分子RNA。
核酸酶的种类及作用。
第二章核酸的结构与功能(要点)2.1 核酸的化学组成及一级结构核苷—核苷酸—核酸,核酸的水解产物2.2 DNA的空间结构与功能一级结构DNA的空间结构:二级结构—双螺旋模式2.3 RNA的结构与功能mRNA –5’帽子结构,3’polyA尾(真核)tRNA –稀有碱基;三叶草形;倒L形rRNA –功能2.4 核酸的理化性质紫外吸收性质变性、复性和增色效应、解链温度酶[掌握]酶、单纯酶及结合酶的概念,酶的分子组成,酶蛋白和辅助因子的作用。
生物大分子的力学特性

生物大分子的力学特性生物大分子指的是生物体内的大型分子,包括蛋白质、DNA、RNA等。
这些分子在生物体内发挥着重要的功能,例如DNA携带着遗传信息,蛋白质则是生物体内的酶、激素、抗体等重要的功能性分子。
除了化学性质外,生物大分子的物理性质也是非常重要的。
力学特性是其中的一个重要方面,它指的是材料在受力作用下的反应。
在研究生物大分子的力学特性时,可以从材料的刚度、延展性、弹性等方面入手,下面分别进行介绍。
一、刚度刚度指的是材料对形变的抵抗程度,也可以理解为材料的硬度。
不同的生物大分子具有不同的刚度,这与它们的化学结构及构象密切相关。
例如,蛋白质中的α-螺旋结构具有一定的刚度,而β-折叠结构则相对柔软。
这一特性使得蛋白质能够在受到一定外界力的作用下发生构象的改变,从而完成特定的生物功能。
DNA分子也具有一定的刚度,这主要与DNA双螺旋结构中的碱基对的形态有关。
由于碱基对之间存在着特定的氢键和π-π作用,因此双链DNA分子具有一定的弯曲刚度、扭转刚度和伸长刚度。
二、延展性延展性指的是材料在受到外界力的作用下能够发生多大的形变。
对于生物大分子而言,它们的延展性与化学结构、构象以及水分子的存在都有关。
举例来说,蛋白质的延展性比较有限,这主要因为蛋白质中的氢键、电荷作用等能量势垒比较高,导致蛋白质分子在形变时需要克服一定的阻力。
但是,如果在蛋白质分子中引入一些非共价键的作用力,例如范德华力或静电相互作用等,那么蛋白质的延展性会相应地增大。
DNA的延展性则相对更高一些。
在水溶液中,DNA分子可以随意地扭曲、弯曲、拉伸,而且会随着作用力的加大而发生持续的形变,直到达到材料的极限。
这种性质是基于DNA双链分子的柔性和液态环境的作用力平衡。
三、弹性弹性指的是材料在经受一定形变之后能够恢复原状的能力。
生物大分子中的弹性主要与它们的构象有关,不同的构象对应着不同的弹性特性。
例如,蛋白质分子具有良好的弹性特性,这得益于它们的分子构象。
第二章蛋白质的结构和生理功能

二、氨基酸的性质和生理特点 (一)性质 1.物理性质 无味、无色晶体物质; 熔点200-300oC之间,会分解成胺和CO2; 具有较高的介电常数; 一般可溶于水,其水溶液为无色透明液体, 溶解度各不相同; 一般不溶于有机溶剂; 均溶于稀酸或稀碱。
2.氨基酸的晶体存在形式
氨基酸晶体是以离子晶格组成的,维系晶 格中质点的作用力是较强的静电吸引力,因而 熔点高,而一般的有机化合物晶体是由分子晶 格组成,其维系力为较弱的范德华力,此类物 质熔点较低。
蛋白质功能的多样性
• 具有储藏氨基酸的功能。用作有机体及其胚胎 或幼体生长发育的原料。如蛋类中的卵清蛋白、 乳中的酪蛋白、小麦种子中的麦醇蛋白。 • 运输功能。脊椎动物红细胞里的血红蛋白、无 脊椎动物中的血蓝蛋白在呼吸过程中起着输送 氧气的作用;血液中的脂蛋白随血流输送脂质; 生物氧化过程中的某些色素蛋白如细胞色素C 等起电子传递体的作用。
• • • • 氨基酸排列随机性 周期性的重复未发现 二硫键的数目和位置也没有明显的规律 每种蛋白质化学结构的独特性 在同源蛋白质氨基酸顺序中有许多位置的氨基 酸对所有种属来说是相同的(不变残基),但 其他位置的氨基酸却不同(可变残基)。这种 相似性被称为顺序同源现象。
蛋白质一级结构的重要性
氨基酸组成及顺序不同会导致蛋 白质生物功能的改变(病态现象)。如 镰刀形细胞贫血病就是血红蛋白(4个 亚基,582个氨基酸组成)中的一个谷 氨酸变为缬氨酸导致的。 一级结构是立体结构的基础。
在研究蛋白质氨基酸组成时一般先用完全 水解的方法,将蛋白质水解成各种氨基酸的 混合物,然后采用高效液相色谱等方法进行 定量测定。通常采用的水解方法有酸水解、 碱水解和酶水解。
酸水解
用硫酸(6 mol/L)或盐酸(4 mol/L)煮沸回流20小时。
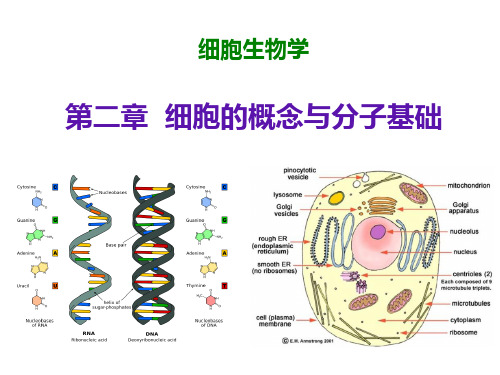
细胞生物学第二章:细胞的概念与分子基础
• U-snRNA的5‘端含甲基化稀有碱基,形成特有的帽子结构,常见为
2,2,7-三甲基三磷酸鸟苷(m32,2,7Gppp) • 主要功能:参与基因转录产物的加工
细胞的分子基础
(5) miRNA
• microRNA(微小RNA),长21~25nt的非编码 RNA,其前体 70~90nt,具有发夹结构
合成蛋白质的模板
细胞的分子基础
• mRNA指导特定蛋白质合成的过程称为翻译(translation)
• 原核细胞的mRNA是 多顺反子(polycistron) —— 每分子RNA可携 带几种蛋白质遗传信息,指导几种蛋白质合成 • 真核细胞的mRNA是 单顺反子(monocistron) —— 每分子RNA只 携带一种蛋白质信息 • 两种细胞的mRNA的5' 端和 3' 端,各有 30至几百个核 苷酸的非翻译区(UTR),是 翻译调控的靶点
细胞的分子基础
(2) rRNA
• 占RNA总量的80%~90%,分子量在RNA 中最大 • 单链结构,主要功能参与构成核糖体 • 真核细胞核糖体(80S)含5S、5.8S、28S
和18S四种rRNA
• 原核细胞核糖体(70S)含5S、23S和16S 三种rRNA
• 核糖体是细胞合成蛋白质的机器,rRNA占
• 最先在秀丽隐杆线虫发现,随后在哺乳动物中
不断发现新miRNA,哺乳动物基因的近1%可 能编码miRNA。
• miRNA普遍存在于生物界,具有高度保守性,
参与细胞分化与发育的基因表达调控
miRNA的形成与作用机制
Dicer酶 是 双链RNA专一性RNA内切酶; Dicer酶可将外源双链RNA 也加工成 22nt (nucleotide)左右的siRNA (small interference RNA)。
生物大分子的结构与功能研究及应用

生物大分子的结构与功能研究及应用随着人类认知的不断深入和技术的进步,对生物大分子的结构和功能研究也逐渐取得了突破性进展。
大分子生物学作为现代生命科学的重要分支,涉及到蛋白质、核酸、多糖等生物大分子的结构和功能方面的研究。
在这个领域,生物科学家们的探索,既解开了某些细胞水平和分子水平的奥秘,又为我们人类的健康和医学疾病的研究提供了重要的思路和方法。
本篇文将从生物大分子结构与功能的研究及应用入手,来探讨生物大分子的基础和前沿。
一、蛋白质的结构和功能蛋白质作为生命体内最常见的基本生物大分子之一,承担着许多生命活动和功能,如运输氧气、代谢、免疫防御等等。
蛋白质的结构研究一直是生物大分子领域的重要研究方向。
通过X射线晶体学、核磁共振和电子显微镜等多种技术手段,科学家们已经揭示出了大量的蛋白质结构,清晰地描述了蛋白质的三维结构。
这项工作中最著名的应当是诺贝尔奖得主Dorothy Crowfoot Hodgkin的晶体学方法在酶的结构解析中的应用。
不仅如此,蛋白质在结构研究之外,还可以被应用于许多其他领域。
比如,人类基因组计划成功之后,全球科学家开展了人类蛋白质组计划。
这一项目的目标是确定所有编码人类基因组的蛋白质。
这项研究在大规模、高通量的基础上,试图揭示人类蛋白质组的生理功能,解释基础疾病发病机理,从而为药物研发提供新思路和新目标。
二、多糖的结构和功能多糖是一种重要的生物大分子,具有多种生物学功能,如体内免疫防御系统的关键组成部分、抗氧化、与人体代谢有关等。
多糖的结构是研究该类化合物性质和活性的基础,同时也是研发药物和开发食品添加剂的前提。
其中,水溶性多糖可以被广泛地用于生产多种食品和保健品中,如杏仁酸多糖、紫花地丁多糖、胶原蛋白肽和α-淀粉酶等在保健食品领域应用广泛。
此外,多糖还可以作为支架材料用于组织工程和再生医学中,如关节软骨和尿道的再生医学。
三、核酸的结构和功能核酸是一类巨大的生物大分子,包括DNA和RNA两种类型。
生物化学第二章 核酸化学
李纳斯·鲍林(Linus Pauling)
DNA的二级结构是三螺旋?
1962年,三人分享诺贝尔生理医学奖
DNA的二级结构是双螺旋
(1)DNA分子由两条多聚 脱氧核糖核苷酸链(简称 DNA单链)组成。两条链 沿着同一根轴平行盘绕, 形成右手双螺旋结构。 螺旋中的两条链方向相 反,即其中一条链的方 向为5′→3′,而另一条链 的方向为3′→5′,螺旋结 构上有大沟和小沟。
两类 核酸在分子组成上的异同点
组分 磷酸 戊糖 碱 嘌呤 基 嘧啶
RNA
DNA
磷酸Βιβλιοθήκη 核糖脱氧核糖AG
U
C
T
核苷酸的衍生物
ⅰ ATP (腺嘌呤核糖核苷三磷酸)
d d d
核苷酸及其多磷酸化合物
ⅱ 环腺苷酸(cAMP)和环鸟苷酸 (cGMP)
•这两种环核苷酸在细胞代谢调节中具有重要作 用,是传递激素作用的媒介物。称为二级信使。
(2)两条链上的碱基通 过氢键相结合,形成碱 基对。碱基的相互结合 具有严格的配对规律, 即A与T结合,G与C结 合,碱基之间的这种一 一对应关系,称为碱基 互补配对原则。A和T之 间形成两个氢键,G与C 之间形成三个氢键。
碱基互补配对
A
T
C
G
(3)嘌呤和嘧啶碱基位于螺旋 的内侧,磷酸和脱氧核糖基 位于螺旋外侧,彼此以3 ’-5’ 磷酸二酯键连接,形成DNA 分子的骨架。碱基环平面与 螺旋轴垂直,糖基环平面与 碱基环平面成90°角。
级结构的可能性较小。
* mRNA的功能 把DNA所携带的遗传信息,按碱基互补
配对原则,抄录并传送至核糖体,用以决定 其合成蛋白质的氨基酸排列顺序。
原核细胞
真核细胞
细胞质
生物物理学重点总结考试复习资料
第一章生物大分子:蛋白质、核酸、多糖和脂质。
生物大分子特定的生物学功能取决于其特定的空间构象。
蛋白质的意义:是生命活动的物质基础,是细胞和生物体的主要组成成分。
蛋白质的化学组成:构成元素:碳C,氢H,氧O,氮N,硫S等。
N的含量一般较恒定:平均为16%,每克样品中含氮克数×6.25×100即为100克样品中蛋白质含量等电点:将氨基酸水溶液的酸碱度加以适当调节,使羧基与氨基的电离程度相等,即氨基酸所带正、负电荷数目正好相等,此时溶液的pH称为该氨基酸的等电点,用pI表示。
中性溶剂中,羟基的电离程度略大于氨基,溶液呈微弱酸性蛋白质:在水溶液中形成的颗粒具有胶体溶液的特征(布朗运动、丁道尔现象、不能透过半透膜、吸附能力等)。
按形状分类:球状蛋白质、纤维蛋白质按化学结构分:简单蛋白质、结合蛋白质根据溶解度分类:可溶蛋白质、醇溶性蛋白质、不溶性蛋白质蛋白质的一级结构:由共价键结合在一起的氨基酸残基的排列序列。
一级结构是蛋白质功能的基础蛋白质的二级结构:指多肽链向单一方向卷曲而形成的有周期性重复的主体。
α-螺旋、β-片层、无规卷曲、回折。
作用力:以肽链内或各肽间的氢键。
α螺旋:肽链骨架形成每周3.6个氨基酸的右手螺旋上升0.54nm,每个残基旋转100度。
蛋白质的三级结构:是线状、螺旋片状结构的进一步卷曲和折叠,形成球形或椭圆形的结构,它是蛋白质分子在二级结构的基础上进一步卷曲折叠,构成一个很不规则的具有特定构象的蛋白质分子。
α螺旋、β折叠、β卷曲及无规卷曲等二级结构的多肽链在三维空间的排列方式。
作用力:疏水作用(主要)、氢键、离子键、偶极与偶极间的相互作用、二硫键。
若蛋白质分子仅有一条多肽链组成,三级结构就是它的最高结构层次。
蛋白质的四级结构:具有三级结构的蛋白质亚单位通过非共价键缔合的结果。
亚基之间(维持蛋白质四级结构)的结合力主要是疏水作用,其次是氢键和离子键。
氨基酸链接的基本方式:肽键—CO—NH—结构域:是蛋白质构象中二级结构与三级结构之间的一个层次蛋白质特定的构象和功能是由其一级结构所决定的。
人教版高中化学《生物大分子》完整版PPT1
题点(一) 糖的性质
1.(2021年1月新高考8省联考·江苏卷)葡萄糖的银镜反应实验如下:
步骤1:向试管中加入1 mL 2% AgNO3溶液,边振荡边滴加2%氨水,观察 到有白色沉淀产生并迅速转化为灰褐色。
步骤2:向试管中继续滴加2%氨水,观察到沉淀完全溶解。 ②图乙是我国自行研制的氢动力概念跑车.氢气作为最清洁燃料的原因是
解析:(1)制镜工业和热水瓶胆镀银都利用了葡萄糖中含有醛基,与银氨溶液反 应还原出单质银,所以反应为反应④。
△ 答案:(1)④ (2)CH2OH(CHOH)4CHO+2Cu(OH)2――→CH2OH(CHOH)4COOH +Cu2O↓+2H2O (3)C6H12O6+6O2―→6CO2+6H2O
[题点全盘查]
D.Cr2O72-可将葡萄糖氧化而不能共存,故D错误;
D.
工业炼铁、从海水中提取镁、制玻璃、水泥过程中都需要用到石灰石
(2) 淀 粉 和 纤 维 素 的 分 子 式 可 以 表 示 为 (C H O ) , 也 可 以 表 示 为 D.离子方程式不一定表示的是一类反应,如2CH3COOH+CaCO3═2CH3COO﹣+Ca2++H2O+CO2↑,该反应只表示醋酸和碳酸钙的反应,故D错误;
实验步骤
实验现象
试管壁上有 银镜出现
②与新制氢氧化铜溶液反应
实验步骤
实验现象
试管中出现 红色沉淀
③实验结论:
葡萄糖对银氨溶液、氢氧化铜等弱氧化剂表现出还原性,属于还原糖。
(5)应用 ①葡萄糖在食品和医药工业中有广泛应用。
②葡萄糖易于被人体吸收,经酶的催化发生氧化反应,放出热量,提供了维持生
命活动所需要的能量。反应形式表示如下: C6H12O6+6O2―― 酶→6CO2+6H2O。 葡萄糖
第一专题生物大分子的结构与功能
4 53 62
1
尿嘧 啶 uracil
O
NH
胞嘧啶 cytosine
NH 2
N
胸腺嘧 啶
thymO ine
CH3 NH
N
O
H
U
N
O
H
C
N
O
H
T
稀有碱基
除上述5种基本的碱基外,核 酸中还有一些含量甚少的碱 基,通常称为稀有碱基。稀 有碱基的种类很多,大部分 是上述碱基的甲基化产物。
N6,N6 -二甲基腺嘌呤:6 A
核酸是现代生物化学、分子生物学的重 要研究领域,是基因工程操作的核心分 子。
核酸的发现和研究工作进展
1868年 Fridrich Miescher从脓细胞中提取“核素” 1944年 Avery等人证实DNA是遗传物质 1953年 Watson和Crick提出DNA双螺旋结构模型 1966年 Nirenberg发现遗传密码 1975年 Temin和Baltimore发现逆转录酶;Sanger建立DNA测序方法 1981年 T.Cech发现了核酶 1985年 Mullis发明PCR 技术 1990年 美国启动人类基因组计划(HGP) 2019年 中国获准加入人类基因组计划
第一节 核酸的种类、分布和化学 组成
一、核酸的生物学功能 二、核酸的种类和分布 三、核酸的化学组成
一、核酸的生物学功
能
肺
炎
球
菌
or
转
化
and
实
验
复制 DNA
转录
逆转录
RNA
复制
翻译
蛋白质
生物学的中心法则
二、核酸的种类及分布
98%核中(染色体中)
