吸光度与 α—淀粉酶酶浓度对照表
淀粉酶测定的方法

淀粉酶测定的方法
淀粉酶测定方法一般包括以下步骤:
1. 准备样品:样品可以是混合物、食物或者发酵物等。
如果是固体样品,需要用适量的缓冲液或水将其溶解。
2. 准备酶液:根据实验需要,选择适当的酶液。
淀粉酶通常可用来自来源的纯化酶液或商业酶液。
3. 混合样品和酶液:将准备好的样品和酶液混合,通常在一定的温度和pH条件下进行反应。
4. 反应时间:根据需要,确定反应的时间。
通常情况下,淀粉酶作用一段时间后会产生一个稳定的反应速率,可以在这个时候停止反应。
5. 停止反应:通过改变温度、pH或加入合适的试剂停止酶的作用,例如加入酸、碱或高温处理。
6. 测定产物:利用光度计测定样品中产生的产物。
淀粉酶通常作用于淀粉,产生可溶性糖或麦芽糖,可以通过吸光度测定测量其浓度。
7. 标准曲线:根据已知浓度的标准品制作标准曲线,用于计算未知样品中产物的浓度。
8. 计算结果:使用标准曲线对测得的数据进行计算,得出样品中淀粉酶的活性或者淀粉的含量。
需要注意的是,不同的淀粉酶测定方法会有一些差异,具体实验步骤可能会有所不同,可以根据具体实验方法进行操作。
α-淀粉酶测定试剂盒(EPS底物法)产品技术要求北京森美希克玛生物

α-淀粉酶测定试剂盒(EPS底物法)适用范围:用于体外定量测定人血清或尿液中α-淀粉酶的活性。
1.1规格a) 试剂1:2×50ml,试剂2:2×10ml;b) 试剂1:4×50ml,试剂2:4×10ml;c) 试剂1:2×400ml,试剂2:2×80ml;d) 试剂1:12×20ml,试剂2:12×4ml;e) 试剂1:1×50ml,试剂2:1×10ml;f) 试剂1:2×45ml,试剂2:2×9ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 外观试剂1应为无色透明溶液;试剂2应为淡黄色透明溶液。
2.2 净含量应不低于试剂瓶标示装量。
2.3 试剂空白2.3.1试剂空白吸光度测定试剂空白吸光度,应≤0.35;2.3.2试剂空白吸光度变化率试剂空白吸光度变化率△A/min≤0.002。
2.4 分析灵敏度测定浓度为1000U/L的样品,吸光度变化率△A/min应不低于0.01。
2.5 线性2.5.1在[5,2400]U/L范围内,线性回归的相关系数应不低于0.990;2.5.2测试浓度[200,2400]U/L的样品,相对偏差应不超过±10%;测试浓度[5,200)U/L的样品,绝对偏差应不超过±20U/L。
2.6 重复性2.6.1 批内重复性变异系数(CV)应不超过5%。
2.6.2 批间差对同一份样品进行重复测定,相对极差(R)应不超过10%。
2.7 准确度回收率应在85%~115%范围内。
2.8 稳定性取在2℃~8℃条件下贮存达到18个月但未超过24个月的试剂检测,应符合本技术要求2.1、2.3、2.4、2.5、2.6.1、2.7之规定。
淀粉酶活力的测定方法

淀粉酶活力的测定方法淀粉酶是一类能够催化淀粉水解的酶,在生物体内和工业生产中都具有重要的作用。
准确测定淀粉酶的活力对于研究酶的性质、生物体的代谢过程以及相关工业应用都具有重要意义。
下面将介绍几种常见的淀粉酶活力测定方法。
一、碘淀粉比色法碘淀粉比色法是一种较为经典且常用的测定方法。
其原理是淀粉经淀粉酶水解后,剩余的淀粉与碘液反应生成蓝色复合物,颜色的深浅与剩余淀粉的量成正比。
通过比色法测定反应后溶液的吸光度,即可计算出淀粉酶的活力。
具体操作步骤如下:首先,准备一系列含有不同浓度淀粉溶液的试管,并向其中加入适量的淀粉酶溶液,在一定的温度和 pH 条件下反应一段时间。
然后,迅速向各试管中加入碘液,使反应终止。
最后,使用分光光度计在特定波长下测定各试管溶液的吸光度。
根据事先绘制的标准曲线,将吸光度值转换为剩余淀粉的浓度,从而计算出淀粉酶水解淀粉的量,进而得出淀粉酶的活力。
这种方法的优点是操作相对简单、成本较低,但缺点是灵敏度相对较低,对于低活力的淀粉酶测定可能不够准确。
二、DNS 法(3,5-二硝基水杨酸法)DNS 法是另一种常用的测定淀粉酶活力的方法。
其原理是淀粉在淀粉酶的作用下水解为还原糖,还原糖能与 3,5-二硝基水杨酸在碱性条件下共热,被还原成棕红色的氨基化合物。
在一定范围内,还原糖的生成量与淀粉酶的活力成正比,通过比色测定棕红色物质的吸光度,即可计算出淀粉酶的活力。
操作过程如下:将淀粉溶液与淀粉酶溶液在适宜条件下反应一定时间后,取出适量反应液,加入DNS 试剂,在沸水浴中加热一段时间,使反应充分进行。
冷却后,使用分光光度计测定溶液在特定波长下的吸光度。
与碘淀粉比色法相比,DNS 法的灵敏度较高,能够更准确地测定低活力的淀粉酶,但操作过程相对复杂一些。
三、斐林试剂法斐林试剂法也是基于淀粉水解产生还原糖的原理。
斐林试剂由硫酸铜和酒石酸钾钠的氢氧化钠溶液组成,还原糖能将斐林试剂中的二价铜离子还原为一价铜离子,生成砖红色的氧化亚铜沉淀。
淀粉酶、蛋白酶、淀粉葡萄糖昔酶的活性要求、测定方法及判定标准

淀粉酶、蛋白酶、淀粉葡萄糖昔酶的活性要求、测定方法及判定标准1.酶活性测定 1.1活性侧定淀粉为底物,以Nelson/Somogyi还原糖测试淀粉酶活性(U/mL);10000+1000(1个酶活力单位定义为:40℃,pH6.5时,每分钟释放1μmol还原糖所需要的酶量)。
以对硝基苯基麦芽糖为底物测试淀粉酶活性(Ceralpha)(U/mL):3000+300(1个酶活力单位定义为:40℃,pH6.5时,每分钟释放1μmol对硝基苯基所需要的酶量)。
1.2活性测定酪蛋白测试蛋白酶活性:300一400U/mL[1个酶活力单位定义为:40℃,pH8.0时,每分钟从可溶性酪蛋白中水解出(并溶于三氯乙酸)1μmol酪氨酸所需要的酶量];或7一15U/mg[1个酶活力单位定义为:37℃,pH7.5时,每分钟从酪蛋白中水解得到一定量的酪氨酸(相当于1.0pmol酪氨酸在显色反应中所引起的色彩变幻,显色用Folin一Ciocalteau试剂)时所需要的酶量]。
偶氮一酪蛋白测试蛋白酶活性(U/mL);300一400[l内肽酶活力单位定义为:40℃,pH8.0时,每分钟从可溶性酪蛋白中水解出(并溶于三氯乙酸)1μmol酪氨酸所需要的酶量]。
1.3淀粉葡萄糖苷酶活性侧定淀粉/葡萄糖氧化酶一过氧化物酶法测试淀粉葡萄糖苷酶活性(U/mL);2000一3300[l个酶活力单位定义为:40℃,pH4.5时,每分钟释放1μmol葡萄糖所需要的酶量]。
对一硝基苯基一麦芽糖苷(PNPBM)法测试淀粉葡萄糖昔酶活性(U/mL):130一200[l个酶活力单位定义(1PNP单位)为:40℃时,有过量的1β-葡萄糖苷酶存在下,每分钟从对一硝基苯基-β一麦芽糖苷释放1μmol对一硝基苯基所需要的酶量]。
2.干扰酶市售热稳定a一淀粉酶、蛋白酶普通不易受到其他酶的干扰,蛋白酶制备时可能会混入极低含量的β一葡聚糖酶,但不会影响总膳食纤维测定。
α-淀粉酶
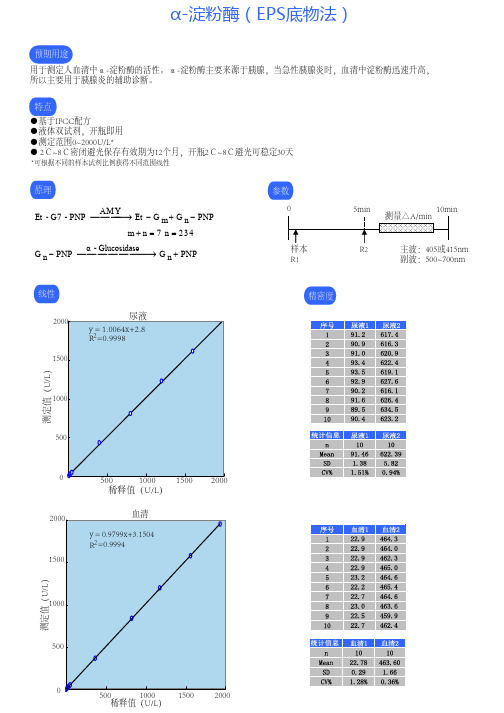
预期用途 用于测定人血清中α-淀粉酶的活性。α-淀粉酶主要来源于胰腺,当急性胰腺炎时,血清中淀粉酶迅速升高, 所以主要用于胰腺炎的辅助诊断。 特点 ●基于IFCC配方 ●液体双试剂,开瓶即用 ●测定范围0~2000U/L* ● 2℃~8℃密闭避光保存有效期为12个月,开瓶2℃~8℃避光可稳定30天
*可根据不同的样本试剂比例获得不同范围线性
原理 AM Y Et - G7 - PNP → Et − G m + G n − PNP m + n = 7 n = 2� 3� 4� � α - Glucosidase G n − PNP → G n + PNP
25 30
相关性 1200 血清 y = 1.0968x+2.0667 R2 =0.9982 1000 800 y = 1.031x+4.9164 R2 =0.9967 尿液
本试剂(U/L)
600
本试剂(U/L)
800
600
400
400 200 200
0
200
400
600 800 A公司(U/L)
600 A公司(U/L)
800
参考文献 1.Young, D.S. and Friedman, D.S., Effects of Disease on Clinical Laboratory Tests, 2nd Ed., AACC Press (1989). 2.NCCLS document “Evaluation of Precision Performance of Clinical Chemistry Devices”, 2nd Ed. (1992). 3.臨床化学34:350-361,2005
淀粉酶温氏测定法

关于淘汰血、尿淀粉酶温氏测定法淘汰血、尿淀粉酶(AMS)温氏测定法的理由及替代方法淘汰的理由淀粉酶是一类能将淀粉分子水解的酶。
人类的淀粉酶属于。
淀粉酶,或称内切淀粉酶,有任意.切割α-1,4糖苷键的能力,作用于多糖后可产生葡聚糖、麦芽糖和葡萄糖分子。
测定淀粉酶的方法很多,有粘度法,浊度法,糖化法,淀粉——碘量法,染料释放法等。
前二者由于影响因素较多,缺乏特异性和灵敏度,已被淘汰。
糖化法虽然可直接测量酶活性,但操作复杂不适用于临床常规检查。
目前应用较为广泛的为碘量法,酶速率法和染料释放法等。
温氏法是基于碘量法原理的一种半定量方法。
做为一种测定淀粉酶活性的方法,目前认为最好具备下述几个条件,即:应用性质稳定的限定性底物;有好的限定性反应产物;在30℃反应时有足够的灵敏度;没有内源性葡萄糖干扰等。
从这些条件来看,温氏法是不符舍要求的。
它以测定剩余底物反映酶活性,对淀粉的要求没有限定性规格,用生理盐水稀释而非缓冲液亦不符合酶学测定要求,肉眼观察颜色来判断结果,只能属于半定量方法,不能准确与精确的反映酶活性。
此法不敏感,淀粉酶升高的阳性率低於酶法和染料衫,易给临床造成误诊。
因此,在有许多更为灵敏且特异方法的情况下,温氏法已失去其实用价值。
可替代的方法目前应用的有碘淀粉比色法,酶法与染料释放法等。
后二聿试剂配制困难,但已有商品试剂盒供应。
现将此三种方法介绍于下。
一、碘淀粉比色法(一)原理血清(或血浆)中α-粉酶催化淀粉分子中。
α-1,4葡萄糖苷链水解,产生葡萄糖,麦芽糖及含。
α-1,6糖苷键支链的糊精。
在已知底物浓度的条件下,反应后加入的碘液与未被水解而剩余的淀粉结合成蓝色复合物。
其蓝色灼深浅与未经酶促反应的对照管比较,即可推算出淀粉酶的活力单位。
(二)试剂1、4g/L缓冲淀粉溶液于约500ml蒸馏水中,溶解9g氯化钠,22.6g无水磷酸氢二钠(或56.94g Na2HPO4。
12H2O)和12.5g无水磷酸二氢钾。
酶样品测定方法

酶样品待测酶液制备方法磷酸缓冲液的制备中性蛋白酶(pH=7.5)准确称取磷酸氢二钠6.02g和磷酸二氢钠0.5g,加水定容至1000ml,配好后用pH计校正。
淀粉酶(pH=6)称取磷酸氢二钠45.23g,柠檬酸8.07g,用水溶解并定容于1000ml,配好后用pH计校正。
脂肪酶(pH=7.5)称取磷酸二氢钾1.96g,十二水磷酸氢二钠39.62g,用水溶解并定容于500ml,配好后用pH计校正。
酶液的制备称取样品1.000g至10ml试管中,加入磷酸缓冲液5ml,置于高速匀浆机捣碎,然后连残渣一起倒入100ml容量瓶中定容,室温静置1h,期间反复震荡3次,然后取4ml在16000r/min下离心5分钟,取上清液4℃保存待测。
酶活测定淀粉酶、脂肪酶、胰蛋白酶采用建成生物工程研究所试剂盒测定,中性蛋白酶采用福林酚法测定。
淀粉酶原理:淀粉酶能水解淀粉生成葡萄糖、麦芽糖及糊精,在底物浓度已知并且过量的情况下,加入碘液与未水解的淀粉结合生成蓝色复合物,根据蓝色的深浅可推算出水解的淀粉量,从而计算出淀粉酶的活力。
单位定义:在37℃、pH6.0下,与底物作用30分钟,水解10mg淀粉定义为1个淀粉酶活力单位。
分析方法:计算:酶活力(U/g)= (空白管吸光度-测定管吸光度)/空白管吸光度×(0.4×0.5/10) ×(30分钟/7.5分钟) ÷(取样量×酶液浓度)脂肪酶原理:甘油三酯和水制成乳化液,因其胶束对入射光的吸收及散射而具有乳浊性状,胶束中的甘油三酯在脂肪酶的作用下发生水解,使胶束分裂,散射光或浊度因而降低,降低的速率与脂肪酶活力有关。
单位定义:在37℃条件下,在反应体系中与底物反应1分钟,每消耗lμmol 底物为1个脂肪酶活力单位。
分析方法:1、将分光光度计在420nm处以Tris缓冲液调零。
2、将底物缓冲液在37℃预温5分钟。
3、在试管中加入0.025ml待测样本,再加入试剂四0.025ml,然后加入4ml预温的底物缓冲液,盖住管口,颠倒混合5次,在420nm处比浊,读取吸光度值A1。
淀粉酶、α酶、β酶活力的测定

三、材料、仪器与试剂
(2) 0.1MOL/L PH=5.6的柠檬酸缓冲液A液:(0.1MOL/L柠檬酸): 称取C6H8O7·H2O 21.01克,用蒸馏水溶解并定容至1L。B液: (0.1MOL/L柠檬酸钠):称取NA3C6H5O7 · 2H2O 29.41克,用蒸馏水 溶解并定容至1L。取A液55毫升与B液145毫升混匀,即为0.1MOL/L PH=5.6的柠檬酸缓冲液。 (3)1%淀粉溶液:称取1克淀粉溶于100ML 0.1MOL/L PH=5.6的柠檬 酸缓冲液中。
Α-淀粉酶活力的测定
一、实验目的 二、实验原理 三、材料、仪器与 试剂 四、操作步骤 五、结果处理 六、思考题
一、实验目的:
• 学习和掌握测定α-淀粉酶活力的原理和方法
二、实验原理:
总淀粉酶活力测定过程中提取的淀粉酶原液主要包括Α-淀粉酶和Β-淀粉酶两种。 两种淀粉酶特性不同,A-淀粉酶不耐酸,在 PH=3.6的环境下以下迅速钝化。 Β 淀粉酶不耐热,在70°C环境下15分钟后就会钝化。根据它们的这种特性,在测定 活力时钝化其中之一,就可测出另-种淀粉酶的活力。 • 实验二采用加热的方法钝化Β -淀粉酶,测出A-淀粉酶的活力。 • 实验三采用加酸的方法钝化A-淀粉酶,测出Β -淀粉酶的活力。
四、操作步骤:
1.淀粉酶液的制备: 称取1g萌发3天的小麦种子(芽长约1cm),置于研钵中,加入少量石英 砂和2mL蒸馏水,研磨匀浆。将匀浆转入100mL容量瓶中,用蒸馏水定 容到100mL。在室温下放置提取15~20min,每隔数分钟摇动1次,使 其充分提取。取适量在3000r/min转速下离心10min,上清液即为淀粉 酶原液,稀释后用于淀粉酶总活力测定(稀释倍数依具体情况而定)。
(2)还原糖测定: 将各管摇匀,在沸水浴中准确加热5min,取出,冷却至室温。用蒸馏水定容至20mL, 加塞后颠倒混匀。在分光光度计上(波长540nm)进行比色。
