单细胞凝胶电泳(SCGE)技术
应用碱性单细胞凝胶电泳技术(SCGE)检测镉致鸡脾淋巴细胞DNA的损伤效应

刀 片 将 平 铺 薄 厚 均 匀 的 胶 片 修 成 2 5c . m× 25c 的 正 方 形 , . m
即 第 1层 胶 。 处 理 后 细 胞 悬 液 l L, 3 与 8 L用 取 O 在 7 C下 O
br eg等 [ 报 道 的 无 电泳 单 细 胞 凝 胶 分 析 技 术 。在 此 基 础 上 , 1
将 10 L 98 L 0 . MP滴 在 第 2层 胶 上 , 盖 玻 片使 -MP均 A 0 加 L 匀 平 铺 , 固化 1 n 即 第 3层 胶 。 4 C下 0mi, 13 2 细 胞 裂 解 .. 移 去第 3 胶 上 的盖 玻 片 , 即 将 凝 胶 载 层 立 玻 片浸没于 4 冷 的 新 鲜 配 制 的 裂 解 液 中 (. lL N — C预 2 5mo/ a
的 鸡 脾 脏 淋 巴 细 胞 DN 的 损 伤 效 应 。 结 果 表 明 , 浓度 在 O 3 mo/ 范 围 内 , 着 镉 浓 度 的 增 加 , 鸡 脾 脏 淋 巴 A 镉 ~ 0 ̄ lL 随 对
细 胞 DNA 的 损 伤 作 用 逐 渐 增 强 , 呈现 显著 的剂 量 效 应 ( 一 0 9 3 P一 0 04 。 果提 示 , 致 鸡 脾 脏 淋 巴 细胞 DN r .8, .0 ) 结 镉 A 损伤是镉对禽类免疫毒性的重要机制之一。 关 键 词 : ; 脾 脏 淋 巴细 胞 ; 细胞 凝 胶 电泳 ; NA 损 伤 镉 鸡 单 D
黑龙江 哈尔滨 100) 5 0 1
摘 要 : 用碱 性 单 细 胞 凝 胶 电 泳技 术 (igeclg l l to h rs , C ) 测 了 O O/ l . 2 体 外培 养 应 s l el e e crp oei S GE 检 n e s ~3  ̄ / C CI对 mo L d
单细胞凝胶电泳(SCGE)检测锰损伤神经元DNA

单细胞凝胶电泳(SCGE)检测锰损伤神经元DNA1陆彩玲,郭松超,鲁力,陈维平,邝晓聪广西医科大学公共卫生学院,广西南宁(530021)E-mail:lcling78@摘要:目的建立体外染锰细胞模型,探讨锰神经毒性的作用机制。
方法:以原代培养的成熟皮层神经元为靶,据本室前期试验结果确定低中高不同浓度的锰液(分别为0.2mmol/L,0.6mmol/L,1.0mmol/L),与神经细胞共孵育。
显微镜观察各组神经细胞形态学的变化,用单细胞凝胶电泳试验(SCGE)检测神经细胞的DNA损伤,以彗星细胞尾长及彗星样细胞百分率为评价损伤的指标。
结果:光镜下可见不同浓度锰孵育后神经细胞形态学发生改变,单细胞凝胶电泳试验显示神经细胞DNA出现不同程度的损伤,彗星尾长及彗星样细胞百分率较对照组明显增加(P<0.01)。
尤以高浓度锰组损伤组严重,显著高于中低浓度组(P<0.01)。
结论:锰不但能引起体外培养的神经细胞外在的形态学损伤,还可导致神经细胞DNA的损伤。
关键词:锰,单细胞凝胶电泳 (SCGE),DNA损伤目前,随着生产工艺的改进和预防措施的加强,严重的职业性锰中毒已很少发生,但长期低剂量的锰暴露依然存在,并对接触者的潜在影响仍不可低估。
慢性锰中毒是进行性的、不可逆的病变,并且锰对接触者的危害正由临床型向亚临床型转变,因而更为敏感、特异的效应指标,以早期筛检出亚临床中毒者及高危人群,是今后锰神经毒性研究中重点解决的问题。
DNA损伤是遗传毒理学的一个重要研究领域,长期不可逆转的DNA损伤累积可诱导细胞突变、畸变。
单细胞凝胶电泳(Singl cells gel eletrophoresis,SCGE)又称彗星试验(comet assay),由Ostling等(1984)首创,后经Singh等(1988)进一步完善并逐渐发展起来的一种快速检测单细胞 DNA损伤的实验方法,适用于多种细胞,广泛应用于检测诱变剂、射线等对DNA的损伤、监测环境污染物对机体的遗传损害、研究毒物致癌机制等方面,具有经济、简捷、灵敏等优点,日益广泛地应用在各种诱变剂的遗传毒性检测上。
DNA损伤检测—单细胞凝胶电泳技术的研究

DNA损伤检测—单细胞凝胶电泳技术的研究
朱文文;王晓涛
【期刊名称】《微量元素与健康研究》
【年(卷),期】2007(24)3
【摘要】单细胞凝胶电泳(SCGE)又称为彗星实验,是一种可以在单个细胞水平上检测DNA断裂的技术。
近年来该技术被广泛应用于特定的DNA损伤、DNA特异性染色、DNA修复、遗传毒理、环境生物监测等方面的研究。
在前人的基础上对该实验方法做了进一步的研究和改进,使改进后的方法更加快速简捷、经济可行。
【总页数】2页(P6-7)
【关键词】单细胞凝胶电泳;DNA损伤
【作者】朱文文;王晓涛
【作者单位】河南科技大学动物科技学院;河南平顶山工学院
【正文语种】中文
【中图分类】R329.27
【相关文献】
1.应用单细胞凝胶电泳技术检测K562细胞 DNA损伤的研究 [J], 景学安;张显忠;宋文刚;宗传龙;康莉
2.单细胞凝胶电泳技术检测丙烯酰胺亚急性中毒大鼠的单细胞DNA损伤 [J], 杨淑芸;李国良;付正英;张引国;张金波
3.单细胞凝胶电泳技术检测DNA损伤的方法及进展 [J], 赵琳娜;陈薛钗;钟儒刚
4.用单细胞凝胶电泳技术检测粉纹夜蛾5BI细胞DNA损伤的研究 [J], 甘耀坤;乔琰;鲁志松;刘凯于;杨旭
5.单细胞凝胶电泳技术检测蜘蛛血细胞DNA损伤研究 [J], 李锐;李生才;杨怀卿;刘佳;罗原
因版权原因,仅展示原文概要,查看原文内容请购买。
单细胞凝胶电泳技术在环境毒理学实验教学中的应用

由 于 碱 性 电 泳 液 腐 蚀 性 极 高 ( H> 3 . 记 号 p 1 )用
本 次 改 良 , 最 常 用 的还 是 碱 性 S 但 CGE 方 法 。 年 来 , 笔 等 工 具 标 记 组 别 又 极 易 脱 落 。 课 题 组 成 员 研 究 近 若 S GE 技 术 也 逐 步 推 广 到 真 核 单 细 胞 微 生 物 和 植 发 现 . 用 解 剖 针 等 锋 利 工 具 在 玻 片 的 磨 砂 端 或 非 C 如 . 2 物 细 胞 核 DNA 损 伤 的 研 究 f 调 然 而 . 于 植 物 细 磨 砂 玻 片 的 手 持 端 刻 下 处 理 组 组 别 , A一1 A一 … 1 o 由
D NA 损 伤 检 测 方 法 相 比 , 有 简 便 、 速 、 敏 、 具 快 灵 样
和 动 物 细 胞 核 DNA 损 伤 和 修 复 的 研 究 p 虽 经 多
. 品 量 少 、 需 放 射 性 标 记 等 优 点 , 广 泛 , 用 于 人 12 栽 玻 片 的 编 号 无 已 应
1 8 年 , tn 94 Osl g等 Ⅲ 次 提 出 了 单 细 胞 凝 胶 电 点 琼 脂 糖 (O i 首 1 O mL 比 较 适 宜 1 加 热 完 全 溶 解 后 置 于 .
泳 (ige c i g lee t p oe i, CG 技 术 , 利 5 - 0C 浴 锅 中 恒 温 保 存 。 手 持 预 冷 后 的 载 玻 片 sn l el e lcr h rss S E) o 并 0 6 o水
编 号 、 胞 核 的 分 离 、 埋 、 旋 、 泳 、 和 、 水 、 色 、 像 及 其 结 果 的 软 件 分 析 等 过 程 。 并 应 用 该 方 细 包 解 电 中 脱 染 摄
单细胞dna彗星实验步骤

单细胞dna彗星实验步骤彗星实验(Comet assay),又称单细胞凝胶电泳(Single cell gel electrophoresis,SCGE),各种理化因子作用细胞后引起的DNA链的断裂可用该方法检测[1~3],并在统计学基础上对损伤程度做出评估[4]。
本实验对Singh等[5]建立的碱性彗星实验的一些步骤作了改良。
用超净工作台上的紫外消毒灯[可发射波长为254 nm的紫外线(Ultraviolet,UV),属于UVC波段范围]作为DNA损伤的诱导因子[7~9],诱导K562细胞DNA损伤,用改良彗星实验检测损伤程度,验证改良的实验系统是否可靠,同时筛选并评价DNA损伤的分析指标。
1 材料与方法1.1 细胞K562细胞,来源于第四军医大学免疫学教研室,37 ℃、5%CO2培养箱中培养,取对数期细胞进行实验。
1.2 紫外线照射装置紫外消毒灯(ZSZ-20型,20 W,天津市紫晶特种光源有限公司)。
1.3 主要试剂和仪器培养基:10%新生牛血清(杭州四季青公司),90%RPMI-1640培养液(Hyclone公司);双抗(青、链霉素,100 UI/ml);Triton X-100(Genview分装);二甲基亚砜、肌苷酸钠(Sigma分装);低熔点琼脂糖(FMC分装);常熔点琼脂糖(Spanish 分装)。
其余生化试剂均为分析纯。
电泳仪:由西北大学物理系提供;电泳槽:DYC33A型(北京市六一仪器厂);显微镜:Leica DM LB 2 (Leica 公司);彗星图象分析软件:CASP软件(casp-1.2.21.4 实验分组及UV处理收集对数生长的K562细胞,台盼蓝染色计数,细胞活力大于95%,用Hank's(pH7.4)调整细胞密度至1×105/ml,接种于塑料培养皿中(ф=35 mm,2 ml/plate),然后进行紫外线照射(0.3 mW/cm2)。
实验分为对照组和8个照射组,各照射组分别照射3、5、10、40,60、120、180、240 s,对照组不进行紫外线照射,之后进行彗星实验。
凋亡细胞单细胞凝胶电泳结果 -回复

凋亡细胞单细胞凝胶电泳结果-回复什么是细胞凝胶电泳?细胞凝胶电泳是一种常用的生物物理实验技术,用于分离和检测DNA和RNA的大小、形状和电荷。
凝胶电泳通过将DNA或RNA分子放置在电泳凝胶中,并施加电场,使分子按照大小和电荷移动,从而分离这些分子。
细胞凝胶电泳则是将细胞以其整体形态进行电泳分析。
凋亡细胞单细胞凝胶电泳是一种特殊的细胞凝胶电泳技术。
凋亡是细胞程序性死亡的一种形式,与细胞自我消亡的生理活动相关。
在这种电泳实验中,我们将关注凋亡细胞的特征和分子差异。
实验步骤:第一步:样本准备首先,我们需要收集含有凋亡细胞的样品。
这些样品可以是从细胞培养基中恢复的细胞,也可以是从生物组织中提取的细胞。
确保样品含有足够数量的凋亡细胞,以便能够得到可靠的结果。
第二步:制备细胞凝胶接下来,我们需要制备细胞凝胶。
通常使用琼脂糖凝胶,如琼脂糖-磷酸盐凝胶。
根据实验需求,还可以添加DNA标记物或染料,以便更好地观察凋亡细胞。
第三步:细胞孵育将样品中的凋亡细胞混合到凝胶中,并进行细胞孵育。
在适宜的环境条件下,凋亡细胞会进一步分解和分离,使得分析结果更加准确。
第四步:电泳在孵育过程结束后,将凝胶放置于电泳槽中,并施加电场。
通常选择连续电场或脉冲电场来实现凋亡细胞的分离。
电场可以使凋亡细胞根据大小和电荷向阳极或阴极移动。
第五步:分析结果根据凋亡细胞在凝胶中的移动情况,可以分析并评估这些细胞的大小和电荷差异。
通过测量移动距离和形成的能带图案,我们可以定量地描述凋亡细胞群体的特征。
这些特征可以帮助我们了解凋亡过程中的细胞变化及其相关的生物学特性。
实验应用:凋亡细胞单细胞凝胶电泳在细胞生物学和医学研究中具有广泛应用。
通过观察凋亡细胞的大小、形状和电荷变化,我们可以了解细胞死亡过程中发生的分子事件,并研究其与疾病和病理过程之间的关系。
这项技术有助于揭示细胞凋亡的机制、筛选和评估新型药物,以及检测病理样本中的细胞凋亡情况。
总结:凋亡细胞单细胞凝胶电泳是一种用于分析凋亡细胞特征和分子差异的重要技术。
单细胞微凝胶电泳技术的研究和应用

单细胞微凝胶电泳技术的研究和应用王海燕;池翠萍【期刊名称】《癌变.畸变.突变》【年(卷),期】2001(013)004【摘要】在研究辐射生物效应中,检测DNA损伤的方法很多。
例如:细胞遗传学方法染色体畸变、微核、姐妹染色单体互换等等。
但上述方法费时费力,并有一定的局限性。
八十年代由Osting等首次提出的用微板电泳技术检测单细胞水平DNA损伤,后经Singh等进一步改进和完善了单细胞微凝胶电泳(Single Cell microgel electrophoresis简称SCGE)技术,又称彗星检测法(Comet assay)。
该方法突破了传统局限性,即设备、操作简便、所需细胞少,无需放射性示踪剂,而且灵敏、快速、整个实验过程从来样到结果分析可在一个工作日完成的新技术。
因此,该技术在国外有关研究领域已得到广泛应用。
近年来,国内一些研究领域也引进和建立此方法。
主要用于环境诱变突剂或诱癌剂引起的DNA损伤/修复的研究;癌症病人放、化疗方案的最佳选择及科学预后的研究;作为生物标记进行生物监测及流行病学;毒理遗传学等诸多领域的研究。
目前,也有一些专家学者将些技术应用于植物细胞的研究。
SCGE技术在本实验室已建立,其方法是使包埋于琼脂糖中的细胞经裂解去掉细胞浆,在碱性环境下DNA双链螺旋成为单链,在电泳电场作用下DNA断链离开细胞核向正极迁移出现“彗星”状拖尾现象,再通过荧光染料溴化乙啶结合DNA显色检测其损伤程度。
为将此技术推广于辐射生物效应体内外研究中,本实验选用在辐射生物效应中经常用的人血淋巴细胞(HBL),中国仓鼠肺细胞(CHL)和兔血淋巴细胞这3种细胞探索利用此技术检测DNA损伤的可行性,实验结果表明:SCGE技术能够对单个细胞DNA损伤进行研究,荧光测定核DNA直径和迁移DNA(即慧星尾)长度,而尾长度和尾部荧光强度与DNA 链的断裂呈正相关。
由于“彗星”成像是因损伤DNA在电泳中从核内迁出,因此它的尾长和密度等是评价与量化电泳结果的重要内容。
【国家自然科学基金】_单细胞凝胶电泳技术_基金支持热词逐年推荐_【万方软件创新助手】_20140803
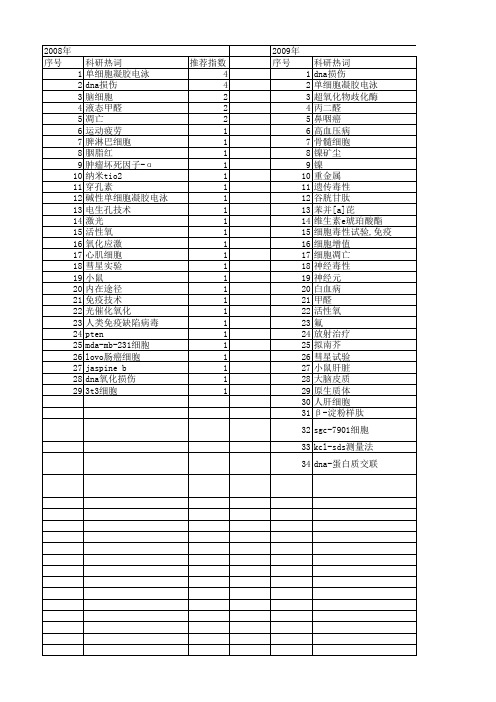
推荐指数 4 4 2 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2009年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34
2008年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29
科研热词 单细胞凝胶电泳 dna损伤 脑细胞 液态甲醛 凋亡 运动疲劳 脾淋巴细胞 胭脂红 肿瘤坏死因子-α 纳米tio2 穿孔素 碱性单细胞凝胶电泳 电生孔技术 激光 活性氧 氧化应激 心肌细胞 彗星实验 小鼠 内在途径 免疫技术 光催化氧化 人类免疫缺陷病毒 pten mda-mb-231细胞 lovo肠癌细胞 jaspine b dna氧化损伤 3t3细胞
推荐指数 7 3 2 2 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
2010年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39
2012年 序号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单细胞凝胶电泳(Single Cell Gel Electrophoresis,SCGE)技术单细胞凝胶电泳(SCGE),因其细胞电泳形状颇似彗星,又称彗星试验(Comet Assay)。
它用于检测单个哺乳动物细胞DNA的损伤,与传统方法相比,因其快捷,灵敏,样品消耗少,费用较低,时至今日已广泛应用于各种有核细胞经受试因子作用后诱导出现的DNA损伤和修复的实验,成为遗传毒理学、氧化损伤、DNA交联损伤、放射生物学等领域中一项重要的研究工具。
【1,2】近年来,国内关于这一方法的应用的报道日益增多【3~5】,可以预见,SCGE技术随着其方法的逐渐标准化,定将在今后得到更加广泛的应用。
因此,本文拟就有关SCGE方法的产生、操作程序、影响因素等作一综述。
1.SCGE的诞生(DNA损伤检测方法的研究)DNA损伤与修复是遗传毒理学及分子流行病学研究的一个重要目标,很久以前人们就在寻求一种合适的检测这一效应的方法。
从使用DNA材料上分可将各种方法归为两类:(1)以裸DNA为材料检测,即通过去污剂、蛋白水解等方法去除附着于DNA上的其他细胞组分,分离出DNA;(2)以拟核为材料,即DNA构型(环区)保留于核骨架上,超螺旋结构不变。
SCGE技术属于第二种方法,显然,拟核成分的检测较裸DNA要方便得多【6】。
在此基础之上,早期的同位素示踪法因需提供同位素标记的样品,并预先确定合适的标记部位。
为解决此不便,目前多采用直接检出DNA损伤后直接生成的单链断裂【7】。
最初,Lett等应用碱性蔗糖梯度离心法测定DNA单链分子量,用于研究哺乳动物细胞的DNA损伤【8】。
不久Kohn等又将其改进为更为灵敏的碱性洗脱法,成为一种较稳定的检测方法【9】。
但是这些技术的灵敏度仍不能满足现在研究的要求,干扰因素多,同时要有放射性同位素示踪。
1984年由Ostling和Johanson首先介绍的SCGE技术在这些方面得到了显著改善,特别在1988年经Singh等完善的单细胞碱性微板电泳技术后,本方法已成为检测单个细胞DNA单链断裂的首选方法【2】。
2.原理介绍有核细胞的DNA分子量很大,DNA超螺旋结构附着于核基质中,当细胞被琼脂糖包埋时,在细胞裂解液作用下,细胞膜、核膜及其他生物膜破坏,细胞内的RNA、蛋白质及其它成分即进入凝胶,继而扩散到裂解液中,唯独核DNA仍维持其环区附着于核骨架上,位置未发生迁移。
当细胞为受损伤时,核DNA因分子量大,荧光染色后可呈现圆形荧光团,无拖尾现象。
但在DNA单链有断裂时,由于碱性电泳液可使DNA双链解螺旋并碱变性为单链,此时单链断裂的碎片由于分子量小,即可进入凝胶中,在电泳时离开核基质向阳极迁移形成拖尾,形似彗尾。
且拖尾愈长,在相同电泳条件下,表示受损的断片越多,断片也愈小,即为核DNA受损越重【13】。
通过测定DNA迁移的部分的光密度或迁移长度就可以测定DNA损伤程度,从而确定作用因素的剂量与损伤效应间的关系。
3.操作程序【10】3.1 凝胶的制备:准备0.5%的低融点琼脂糖和0.5%的正常融点琼脂糖(以无Ca2+、Mg2+的PBS溶液配制)。
将90ul的正常融点的琼脂糖加到4℃的载玻片上,并立即加盖玻片,待胶凝固后,移下盖玻片,加入75ul混有1000个/10ul细胞的低融点琼脂糖,盖上盖玻片,将玻片放入4℃冰箱内使胶迅速凝固,取下盖玻片,加上75ul低融点的琼脂糖作为第三层。
再盖上盖玻片,放入冰箱中,以上操作均在黄光下进行,以防止DNA损伤。
有关凝胶的制备在不同文献中方法有所差异,Schmezer【11】等曾有报道在玻片上预铺0.5ml 正常融点的琼脂后再待其凝固,刮净后进行以上操作可增强第二、三层胶的附着性。
另外在琼脂糖的加入量上个实验室亦有所不同,有待统一化。
3.2 细胞的处理实验所需细胞悬液可由细胞培养或组织活检样品中获得,在加到凝胶中应达到(1~5)×10(4~6)/ml的细胞密度。
通常以胎盼蓝拒染法测定。
细胞存活率在95%以上者留用。
由于胰酶消化及刮片等机械性分离亦有可能引起DNA损伤,故Singh【12】等推荐在玻片上贴壁培养单层细胞直接供测试用。
根据不同实验目的,加受试物于培养液中。
3.3细胞的裂解移去3.1 中的盖玻片,将胶板浸于新配制的预冷的4℃细胞裂解液中至少1h(宜放于4℃冰箱中,裂解液成分为2.5mol/L NaCl, 100mmol/L NaEDTA, 10mmol/L Tris-HCl,pH 10.0和1%肌氨酸钠,用前加1%Triton 和10%的DMSO).3.4DNA展开、电泳轻轻取出裂解后玻片置于水平电泳槽内阳极端附近,玻片间不留空隙,用新配制的电泳液(含300mmol/L NaOH和1mmol/L Na2EDTA)完全盖过胶面。
勿在凝胶上产生气泡。
静置20min,待DNA充分展开后电泳(25V, 300mA), 时间约20min。
3.5 中和、染色电泳后取出玻片,用缓冲液(0.4mol/L Tris-HCl, pH7.5)将胶板浸没15min(以防碱液或去污剂干扰染色)或滴洗3次,每次5min。
然后染色2~20min,以蒸馏水洗涤后尽快阅片(此步以上在黄光下进行,宜24h内阅片)。
3.5阅片、分析放大250×于荧光显微镜下观察电泳图像,每片计数50个细胞,每组5张玻片。
4.影响SCGE结果的试验因素4.1 染毒方式对于DNA的损伤,有时需区分其为直接的DNA损伤及所致还是由在体内代谢活化后形成的间接损伤剂造成,Kasamatsu【14】提出一个SCGE的改进方案,使细胞在玻片上裂解后再行染毒,与常规方法相比,即可有效实现上述目的。
另一方面,传统染毒方式对培养瓶的细胞而言,一个培养瓶的细胞只能做一个染毒浓度,造成大规模检测时的不便。
因此,近年来又提出采用玻片上染毒的改良彗星试验,据称对SCGE的灵敏度有很大提高(约10倍),同时节约人力、时间等【15】。
4.2 裂解时间如前所述,裂解时间目前至少应为1h,为探讨能否通过延长裂解时间已解决诸如因停电而被迫终止裂解等问题,有人通过平行对照分析了裂解时间的影响后发现,低于0.5h裂解时间时,低剂量DNA损伤剂即不能很好检出;而裂解时间超过24h,高剂量组DNA迁移不再增加而对照组细胞却出现明显迁移【16】。
可见,裂解时间在1h以上是合适的。
4.3 电泳液成分由SCGE的原理可知,电泳的同时,还需将双链DNA解螺旋变性,因此电泳液的PH 值对SCGE的结果影甚大,Klaude[17]等,曾对不同浓度NaOH的电泳液进行研究发现,为提高SCGE的灵敏度,可以提高电泳液NaOH的浓度,也可以通过加入NaCL以加速DNA 碎片的分离。
适宜的NaOH浓度应在0.03mol/L左右,并加0.27mol/L NaCL。
4.4 电泳时间电泳时间对DNA迁移影响也较大,Vijayalxmi[18]等研究发现,电泳时间在30分时,对照组基本不发生迁移,而受试组均有明显DNA迁移并有较好的剂量-效应关系,电泳时间延长时,DNA迁移的增加在低剂量组更明显,导致对照组均出现迁移同时受试物组DNA 迁移长度亦渐趋稳定而无法辨别。
5.前景展望SCGE技术对检测单细胞DNA损伤具有许多优点,在国外已应用于多个领域[19-20],其广阔的应用前景无可非议,方法学上的改进,标准化也正方兴未艾,相信这一技术在我国将得到推广应用。
SCGE技术也存在一些尚待改进的不足之处,需测定其对不同毒物的检测阈,还需突破SCGE对荧光显微镜的依赖等。
随着研究工作的进一步展开,诚如Mckelvey[1]所言,本方法必将在各个应用领域发挥出其潜在价值。
参考文献1、Mckelvey-Martin VJ,Green MHL,Schmezer,et al. The single cell gel electrophoresis assay(Comet assay):AEuropean review. Mutat Res,1993,288:47-63。
2、Fairba irn DW,Olive PL,O’Neill KL. The comet assay:a comprehensive review.Mutat Res,1995,339:37-59。
3、衡正昌,张遵真。
二氯胺基酚对V79细胞DNA损伤效应的研究。
卫生毒理学杂志,1997,11:87-89。
4、王民生,Schmezer P 。
碱性单细胞微板凝胶电泳测试技术简介。
癌变畸变突变,1996,8(2):112-115。
5、张遵真,衡正昌。
用单细胞凝胶电泳技术检测铬和砷化物的损伤作用。
中华预防医学杂志,1997,31:365-367。
6、罗瑛,孙志贤,杨志彪等。
辐射后单个细胞DNA结构变化的定量检测。
生物化学与生物物理进展,1994,21:451-453。
7、Olive PL, Banath J P and Durand R. Radiation Res,1990,122:86-94。
8、Lett JJ et al. A new method for detection of mutagens. Biophys J,1970,10:227-284.9、Kohn KW. Fractionation of DNA fron mammalian cells by alkaline elution.Biochemistry,1976,156:4629-4637.10、Tice RR, Strauss GHS, Peters W P. Mutat Res, 1992, 271:101-113.11、Schmezer P, Eckert C, Liegibel UM. Tissue-specific induction of mutation by streptozotocin in vivo . MutatRes, 1994;307: 495-499.12、Singh NP, Tice RR,Stephens RE, et al. Mutat Res,1991;307:495-499.13、张慧丽,余卫,阎长会. 单细胞凝胶电泳技术在军事毒理学中的应用. 卫生毒理学杂志.1999,13(3):182-184.14、Kasamatsu T, Kohda K and Kawazoe Y. Comparison of chemically induced DNA breakage in cellular andsubcellular systems using the comet assay. Mutat Res, 1996,369:1-6.15、张遵真,衡正昌,王涛. 改良的彗星实验与标准方法的对比研究. 卫生毒理学杂志,2000,14(3):180-182.16、张遵真,衡正昌,李蕊等. 单细胞凝胶电泳试验的最适条件研究. 卫生毒理学杂志,1998,12(4):249-251.17、Klaude M. Mutat Res, 1996,363:89-96.18、Vijayalxmi, Tice RR and Strauss GHS, Mutat Res, 1992, 271: 243-252.19、Moretti M, Villarini M, Scassellatti Sforzolini G , et al. Extet of DNA damage in density-separated trouterythro cytes assessed by the ‘comet’ assay. Mutat Res, 1998,397:353-360.20、Stefan O Muller , Inge Eckert . Werner K. Lutz, Helga Stopper. Genotoxicity of the laxa-tive drug componentsemodin, aloe-emodin and danthron in mammalian cells: Topoisomerase Ⅱmediated? Mutat Res, 1996,371:165-173.。
