运城学院应用化学系有机化学实验课件(甲基橙的制备)
甲基橙的制备

甲基橙的制备一、实验目的掌握重氮化反应和偶合制备甲基橙的实验操作,进一步巩固重结晶的原理和操作。
二、试验试剂及仪器对氨基苯磺酸(含结晶水):2.1g1N氢氧化钠12ml10%亚硝酸钠溶液 8ml6N盐酸 5mlN、N-二甲基苯胺 1.2g(1.3ml)1N盐酸溶液 10ml氯化钠碘化钾淀粉试纸冰块乙醇抽滤机恒温干燥箱烧杯试管搅拌棒电炉石棉网温度计三、实验原理即反应式反应:H2N SO32N SO3Na+H2OH2N SO3Na+3HCl+3H N2Cl+2H2O+2NaClSO3H N N N(CH3)2SO3H N2Cl+N(CH3)2SO3HN N N(CH3)2NaO2SN NN(CH3)2 NaOH四、实验操作1、重氮盐的制备在150ml烧杯中,放入2.1g对氨基苯磺酸晶体和12ml氢氧化钠溶液,把烧杯置于热水中温热使晶体溶解,冷至室温后,加8ml 10%亚硝酸钠溶液,在搅拌下将该混合液慢慢倒入另一个放有5ml 6N盐酸和冰屑的烧杯中,但温度保持在5℃以下,为了保证反应完全,继续在冰浴中放置15分钟,很快就有对氨基苯磺酸重氮盐的细粒状白色沉淀生成,用检验溶液中是否有过量的亚硝酸。
2、偶合在一试管中加入1.3ml N、N-二甲基苯胺和10ml 1N盐酸,振荡使之混合,在搅拌下将此溶液慢慢加到上述重氮盐的冷溶液中,加完后,继续搅拌10分钟,再在搅拌下慢慢地加入1N氢氧化钠,直至产物变为橙色,粗制的甲基橙呈细粒状的沉淀析出。
待反应物加热至沸腾,使粗制的甲基橙溶解后,精冷,置于冰浴中冷却,甲基橙全部重新结晶析出后,抽虑收集结晶。
依次用饱和氯化钠溶液和乙醇溶液洗涤产品,挤压水份。
取出产品,在50℃下干燥。
若要得较纯产品,可用沸水进行重结晶,则可得到橙色的小叶片状晶体。
产量:几乎达理论产量五、实验操作要点1、对氨基苯磺酸是一种有机两性化合物,其酸性比碱性强,能形成酸性的内盐,它能与碱作用生成盐,与酸作用生成盐,所以不溶于酸,但是重氮化反应又要在酸性溶液中完成,因此,进行重氮化反应时,首先将氨基苯磺酸与碱作用,变成水溶性较大的对氨基苯磺酸钠。
甲基橙的制备 有机化学实验报告

甲基橙的制备有机化学实验报告
甲基橙(methyl orange)又称万能橙,是一种常用的指示剂。
它在弱酸性和弱碱性溶液中具有不同的色彩。
实验中使用苯胺、甲醛和硝酸三者混合物进行反应,制备出甲基橙。
实验步骤:
1.将25 mL苯胺放入250 mL试管内,加入12 mL甲醛,摇匀;
2.在室温下,慢慢加入20 mL硝酸,搅拌均匀;
3.加热混合物,观察色变;
4.用50 mL水洗混合物,将溶液中的无机盐沉淀放置在室温,并加热蒸发溶液;
5.将溶液中的甲基橙沉淀放置在室温,并进行精细筛选;
6.将所得到的甲基橙放入烧杯中,添加稀盐酸,并加热,蒸发掉所有水分;
7.将所得到的甲基橙粉末过筛,储存在室温。
实验结果:
实验完成后,得到了白色的甲基橙粉末,其经过pH试纸测试,结果表明,在弱酸性条件下呈橙色,在弱碱性条件下呈蓝色。
有机化学甲基橙的制备实验报告
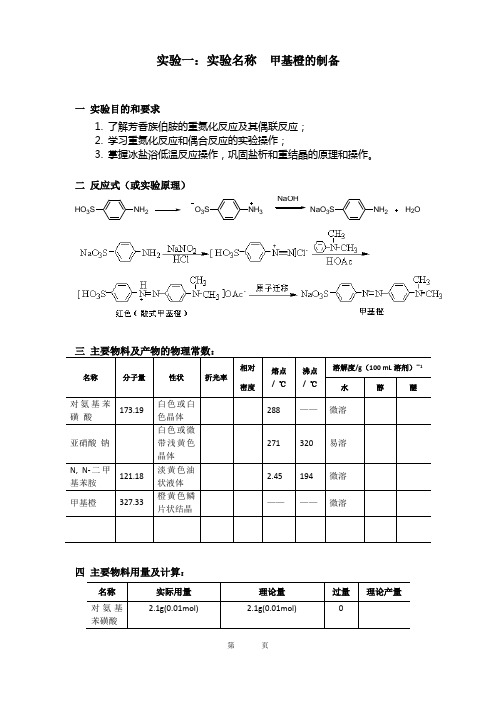
实验一:实验名称 甲基橙的制备一 实验目的和要求1. 了解芳香族伯胺的重氮化反应及其偶联反应;2. 学习重氮化反应和偶合反应的实验操作;3. 掌握冰盐浴低温反应操作,巩固盐析和重结晶的原理和操作。
二 反应式(或实验原理)名称分子量性状折光率相对密度熔点/ ℃沸点/ ℃溶解度/g (100 mL 溶剂)-1 水醇醚对氨基苯磺 酸173.19白色或白色晶体 288 —— 微溶亚硝酸 钠 白色或微带浅黄色晶体 271 320 易溶N, N-二甲基苯胺 121.18 淡黄色油状液体 2.45 194 微溶 甲基橙327.33橙黄色鳞片状结晶————微溶四 主要物料用量及计算:名称 实际用量 理论量 过量 理论产量对氨基苯磺酸2.1g(0.01mol)2.1g(0.01mol)NH 2HO 3SNH 3O 3SNaOHNH 2NaO 3SH 2O五 实验装置图六 实验步骤流程(1)对氨基苯磺酸重氮盐的制备在200 mL 烧杯中,加入2.1g 对氨基苯磺酸晶体,加10 mL5%NaOH ,热水浴温热溶解。
另溶解0.8g 亚硝酸钠于6 mL 水中,加入上述烧杯中,用冰盐浴冷至0-5℃。
在搅拌下,将3 mL 浓盐酸与10 mL 水配成的溶液缓慢滴加到上述混合溶液中,并控制温度在5℃以下。
滴加完后用淀粉-碘化钾试纸检验。
(若试纸不显蓝色,尚需补充亚硝酸钠溶液。
)然后在冰盐浴中放置15分钟以保证反应完全。
(此时,往往析出对氨基苯磺酸的重氮盐。
这是因为在重氮盐在水中可以电离,形成中性内盐,在低温时难溶于水而形成小晶体析出。
(2)偶联反应制备甲基橙在一支试管中加入1.3 mLN ,N-二甲基苯胺和1 mL 冰醋酸,振荡混合。
搅拌下,将此液慢慢加到上述冷却重氮盐中,搅拌10min 。
冷却搅拌,慢慢加入25 mL5%NaOH 至为橙色。
(若反应物中含有未反应的N,N-二甲基苯胺醋酸盐,在加入氢氧化钠后,就会有难溶于水的N,N-二甲基苯胺析出,影响产物的纯度。
已改正有机化学实验十五甲基橙的制备

实验十五甲基橙的制备Preparation of methyl orange一.实验目的:1.了解偶联反应在有机合成中的应用。
2.掌握重氮盐和甲基橙的制备原理及方法。
学会用冰水浴控温,巩固抽滤、重结晶、干燥等操作。
二.实验重点和难点:1.甲基橙制备反应原理。
2.制备反应的操作方法。
实验类型:基础性实验学时:4学时三.实验装置和药品:主要实验仪器:烧杯酒精灯试管玻棒温度计抽滤瓶布氏漏斗主要化学试剂:对氨基苯磺酸晶体亚硝酸钠N,N--二甲苯胺浓盐酸氢氧化钠95%乙醇乙醚冰醋酸冰块淀粉---碘化钾试纸四.实验装置图:五.实验原理:甲基橙变色范围3.1—4.4(红---黄),橙红色鳞状晶体或粉末状,微溶于水,易溶于热水(1份溶于500份水中),不溶于乙醇,显碱性,0.1%的水溶液是常用的酸碱指示剂。
甲基橙是一种指示剂,它是由对氨基苯磺酸重氮盐与N,N--二甲基苯胺的醋酸盐。
在弱酸性介质中偶合得到的。
偶合首先得到的是嫩红色的酸式甲基橙,称为酸性黄。
在碱中酸性黄转变为橙黄色的钠盐,即甲基橙。
甲基橙的命名:4-{[4-(二甲氨基)苯]偶氮}苯磺酸钠盐或对二甲氨基偶氮苯磺酸钠本实验主要运用了芳香伯胺的重氮化反应及重氮盐的偶联反应。
由于原料对氨基苯磺酸本身能生成内盐,而不溶于无机酸,故采用倒重氮化法,即先将对氨基苯磺酸溶于氢氧化钠溶液,再加需要量的亚硝酸钠,然后加入稀盐酸。
六.实验內容及步骤:1.重氮盐的制备:在烧杯中放置10mL 5% NaOH 溶液及2.1g 对氨基苯磺酸晶体,温热使之溶解,然后冷却至室温。
另溶解0.8g NaNO2于6mL 水中,加入到上述烧杯内,用冰盐浴冷至0-50C。
在不断搅拌下,将3mL 浓盐酸与10mL 水配成的溶液缓缓滴加到上述混合液中,(观察现象),并控制温度在50C 以下,滴加完后,用淀粉---碘化钾试纸检验(注意观察现象)(如15-20秒内不变蓝,要补充NaNO2, NaNO2过量,可用尿素水溶液使其分解)。
甲基橙的制备

2.重氮化步骤中,对于1mol芳胺,酸的用量一般为2.5一3mo1,1mo1酸与亚硝酸钠反应产生亚硝酸,1mo1酸生成重氮盐,余下的过量的酸是为了维持溶液一定的酸度,防止重氮盐与未起反应的胺发生偶联。
酸的用量一般为2.5一3mo1,1mo1酸与亚硝酸钠反应产生亚硝酸,1mo1酸生成重氮盐,余下的过量的酸是为了维持溶液一定的酸度,防止重氮盐与未起反应的胺发生偶联。邻氨基苯甲酸重氮盐是个例外,由于重氮化后生成的内盐比较稳定,故不需要过量的酸。
重氮化反应还必须注意控制亚硝酸钠的用量,若亚硝酸钠过量,则生成多余的亚硝酸会使重氮盐氧化而降低产率。因而在滴加亚硝酸钠溶液时,必须及时用碘化钾一淀粉试纸试验至变蓝为止。
十二、参考文献
周志高编,《有机化学实验》,化学工业出版社,1998.10 p143-148
备注
实验设计者:章烨
首开实验时间:2007年5月
编写人:章烨
编写时间:2006年12月
三、实验示意图
重氮化盐制备
四、实验用主要仪器设备、消耗品
仪器设备名称
规格
消耗品名称
规格
烧杯
250ml
氢氧化钠
5%
滴液漏斗
100ml
对-氨基苯磺酸
CP
锥形瓶
250ml
亚硝酸钠
CP
布氏漏斗
常量
浓盐酸
CP
抽滤瓶
250ml
N,N-二甲基苯胺
CP
圆底烧瓶
实验题目甲基橙的制备
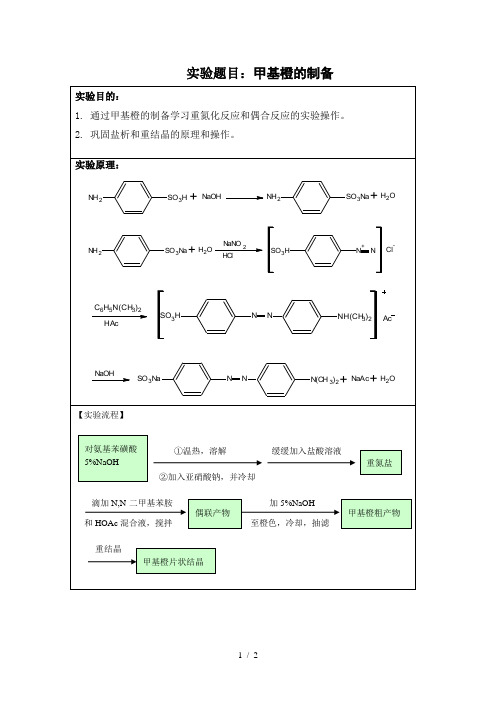
实验题目:甲基橙的制备 实验目的: 1. 通过甲基橙的制备学习重氮化反应和偶合反应的实验操作。 2. 巩固盐析和重结晶的原理和操作。
实验原理: NH2SO3H+NaOHNH2SO3Na
+H2O
NH2SO3Na+H2ONaNO2HClSO3HN+NCl-
C6H5N(CH3)2
HAcSO3HNNNH(CH3)
2Ac
NaOHSO3NaNNN(CH3)
2
+NaAc
+
H2O
【实验流程】
和HOAc混合液,搅拌 滴加N,N-二甲基苯胺 对氨基苯磺酸 5%NaOH 重氮盐 偶联产物 甲基橙粗产物 甲基橙片状结晶 ①温热,溶解 ②加入亚硝酸钠,并冷却 缓缓加入盐酸溶液 加5%NaOH 至橙色,冷却,抽滤 重结晶 主要试剂及产品的物理常数:(文献值) 名称 分子量 性状 折光率 比重 熔点℃ 沸点℃ 溶解度:克/100ml溶剂 水 醇 醚 对氨基苯磺酸 173.18 无色晶体 365 0.8/10℃
N,N—二甲苯胺 121.18 0.9500 1.5-3 194.2
甲基橙 327.33 橙色晶体 300 实验药品及仪器装置: 对氨基苯磺酸、5%NaOH、NaNO2、浓盐酸、冰乙酸、N,N-二甲基苯胺、10%NaOH、NaCl、乙醇、乙醚、磁力搅拌器、循环水真空泵
问题讨论 1、什么叫偶联反应?试结合本实验讨论一下偶联反应的条件。 2、在本实验中,制备重氮盐时为什么要把对氨基苯磺酸变成钠盐?本实验如改成下列操作步骤:先将对氨基苯磺酸与盐酸混合,再滴加亚硝酸钠溶液进行重氮化的应,可以吗?为什么? 3、试解释甲基橙在酸碱介质中的变色原因,并用反应式表示。 4. 在本实验中,重氮盐的植被为什么要控制在0-5℃中进行?偶合反应为什么在弱酸性介质中进行? 5. 在植被重氮盐中加入氯化亚铜将出现什么样的结果? 6. N,N-二甲基苯胺与重氮盐偶合为什么总是在氨基的对位上发生?
5-甲基橙的制备
有机化学实验报告实验名称:甲基橙的制备学院:专业:班级:姓名:学号指导教师:日期:年月日一、实验目的1、学习重氮反应和偶合反应的实验操作;2、巩固盐析和重结晶的实验操作。
二、实验原理三、实验试剂及仪器试剂:对氨基苯磺酸(2.00g,173.83g/mol),5%的氢氧化钠溶液(10.0mL),亚硝酸钠粉末(0.8g),浓盐酸(2.5mL),冰乙酸(1.0mL),N,N-二甲基苯胺(1.3mL,121.18g/mol),10%的氢氧化钠溶液(15mL),冰水(13mL),热水(75mL),饱和氯化钠溶液(20mL),无水乙醇。
仪器:烧杯(150mL~250mL,500mL),量筒(10mL,100mL),试管,玻璃棒,布氏漏斗,抽滤瓶,电炉,石棉网。
四、实验步骤及现象1、对氨基苯磺酸重氮盐的制备A、在200mL的烧杯I中加入2.00g白色粉末状的对氨基苯磺酸,再加入10.0mL质量分数为5%的氢氧化钠溶液,微热溶解后形成橙黄色澄清透明溶液;B、待烧杯I冷却至室温后加入0.8g亚硝酸钠粉末,溶液未变色。
将烧杯I放入大烧杯中冰浴;C、在烧杯II中加入13mL的冰水,再加入2.5mL的浓盐酸,混合后为无色澄清溶液,放入大烧杯中冰浴;D、缓慢将烧杯II中所配置的盐酸溶液加入到烧杯I中,并持续搅拌烧杯I中溶液,期间保存反应温度在5℃以下。
橙黄色澄清溶液转为乳白色略带橙红色的浊液;E、继续搅拌烧杯I中反应溶液,持续10分钟;2、偶合反应F、用10mL的量筒量取1.3mL伴有刺激性气味的N,N-二甲基苯胺溶液,加入烧杯I。
再量取1.0mL的冰乙酸,加入烧杯I。
搅拌10分钟。
搅拌过程中,乳白色浊液转为橙红色浊液转为褐色糊状继而转为棕红色糊状;G、向烧杯I中缓慢加入15.0mL的质量分数为10%的氢氧化钠溶液,反应物转为橙黄色糊状;H、将烧杯I中反应物加热至沸。
加热过程中烧杯I中逸出无色刺激性气体,橙黄色糊状反应物转为黑褐色溶液。
甲基橙
甲基橙甲基橙的变色范围是pH<时变红,pH>时变黄,~时呈橙色。
检验碱的话用酚酞现象会比较明显,因为肉眼对红色会比较敏感有机废水的最佳pH 值一般均控制在3 ~ 4 之间实验装置:实验电解槽,体积为800mL,内置两个电极,板极间距 cm,极板宽度 cm,整个电解槽放在一个恒温调速磁力搅拌器上实验试剂:1.甲基橙固体2.Na2so4和Nacl固体(使用是的浓度为L)3. mol/L的硫酸和氢氧化钠、氯化钠溶液(调节PH值)4.蒸馏水实验仪器:1.分析天平2.紫外分光光度计3.磁力搅拌器4.电化学工作站5.电极(阴极:不锈钢板(或碳棒),阳极:稀土电极)6.酸度剂7.烧杯若干,量筒,秒表,胶头滴管8.100ml 500ml 1000ml的容量瓶实验准备:1.甲基橙标准曲线的绘制准确称取甲基橙溶于1000ml容量瓶中(1000mg/L)分别取2,4,6,8,10mL溶于100mL容量瓶中,分别配成2mg/L,4 mg/L,6 mg/L与10 mg/L的甲基橙溶液。
用分光光度计对配制的甲基橙溶液进行全波扫描,找出可见光范围内的最大吸收波长为463nm,分别测定上述溶液的吸光度,绘制标准曲线。
2.配制溶液配制不同浓度的甲基橙溶液(80mg/L,120mg/L,160mg/L)以配制500mL的80mg/L甲基橙为例,步骤如下:(1)用分析天平称取40mg的甲基橙固体(2)加少量蒸馏水溶解,用玻璃棒搅拌溶解.(3)倒入500毫升容量瓶里(4)将溶液全部倒入容量瓶里,洗涤小烧杯,用玻璃棒转移,至少洗涤三次(5)定容,加水定容到刻度线,在距离刻度线一厘米左右改用胶头滴管定容(6)摇匀,将溶液摇匀,如果液面下降也不可再加水定容。
(7)将配得的溶液转移至试剂瓶中,贴好标签,备用另外两个浓度的甲基橙溶液配制方法相同.(甲基橙固体依次为60g,80g).实验过程中,在电解槽中溶液总体积为800mL,最终甲基橙的溶度分别为50mg/L,75 mg/L,100 mg/L.配制Na2SO4 溶液(1)用分析天平秤称取的Na2SO4固体(2)加少量蒸馏水溶解,用玻璃棒搅拌溶解.(3)倒入100毫升容量瓶里(4)将溶液全部倒入容量瓶里,洗涤小烧杯,用玻璃棒转移,至少洗涤三次(5)定容,加水定容到刻度线,在距离刻度线一厘米左右改用胶头滴管定容(6)摇匀,将溶液摇匀,如果液面下降也不可再加水定容。
甲基橙
于热水,溶3制备方法实验室制法【药品及用量】对氨基苯磺酸2.1g(0.01mol)、亚硝酸钠0.8g(0.11mol)、N,N-二甲基苯胺1.2g (1.3ml,0.01mol)【实验操作】1.重氮盐的制备(重氮化反应)在烧杯中放入对氨基苯磺酸,10ml 5%氢氧化钠溶液,温热使溶。
另取一小试管,将0.8g亚硝基酸钠溶解在6ml水中。
再将该亚硝基酸钠溶液倒入已冷却得对氨基苯磺酸溶液中,用冰盐浴将其冷却至5°C以下。
将3ml浓硫酸(或浓盐酸)用10ml水稀释,不断搅拌下缓慢滴加到上述冷却混合液中,保持温度在5°C以下,加完后,用淀粉-碘化钾试纸检查显蓝色即可(实际上酸可不加完,因为后面会用氢氧化钠中和,多余反而麻烦)。
另外,若不显蓝色,再补加亚硝基酸钠溶液。
[5]2.偶合反应在一试管内混合1.3mlN,N-二甲基苯胺和1ml冰醋酸,将其缓慢加到上述重氮盐溶液中。
加完后,继续搅拌10min,再缓慢加入5%的氢氧化钠溶液(约25ml),直到反应物变成橙色。
粗制的甲基橙呈细粒状沉淀析出。
将反应物在沸水浴上加热5min,冷却至室温,再在冰水浴中冷却,使甲基橙晶体析出完全。
抽滤收集结晶,依次用少量水,乙醇,乙醚洗涤,压干。
溶解少许甲基橙于水中,加几滴稀盐酸,接着用稀氢氧化钠溶液中和,观察颜色变化。
[5]工业制法1.由对氨基苯磺酸经重氮化后与N,N-二甲基苯反应而得。
将对氨基磺酸溶解于2.5%的碳酸钠溶液中,加入亚硝酸钠,待完全溶解后,加入碎冰和盐酸进行重氮化反应,析出重氮盐结晶。
向重氮盐甲基橙试剂溶液中加入N,N-二甲基苯胺和冰醋酸的混合液,搅拌10min后慢慢加入10%氢氧化钠溶液至碱性。
冷却结晶,过滤,用饱和盐水洗涤,干燥,用水重结晶,得甲基橙。
2.在盛有6L氢氧化钠(2mol/L)的搪瓷容器中,加入2kg对氨基苯磺酸,加热使之完全溶解(溶液对石蕊试纸呈碱性)。
然后加800g亚硝酸钠,搅拌溶解,并用冰冷却至5℃。
有机化学-甲基橙的制备
甲基橙的制备
江苏大学化学化工学院
Contents
1 实验目的
2
实验原理
3
实验装置与操作关键点
4
实验讨论
实验目的
1. 掌握重氮化反应和偶合反应的实验操作 。 2. 巩固盐析和重结晶的基本原理和实验操作。
实验原理
对氨基苯磺酸重氮盐与N, N-二甲基苯胺的醋酸盐,在弱酸性介 质中偶合得到嫩红色的酸式甲基橙(酸性黄),在碱性条件下,酸性 黄转变为橙黄色的钠盐,即甲基橙。
+
N N:
+[
SO3
] +
N
CH3
O
C
CH3
H CH3
O
偶合
[ O3S
NN
] +
N
CH3
O
C
CH3H CH3O源自质子转移[ O3S
+
NN H
] ..
N
CH3
O
C
CH3
CH3
O
NaOH
Na O3S
NN
N CH3 ( 甲 基 橙 ) CH3
操作关键点
操作关键点
1. 对氨基苯磺酸其酸性比碱性强,它能与碱作用生成盐,但不溶于酸。 而重氮化反应需要在酸性溶液中完成,因此,进行重氮化反应时, 首先将对氨基苯磺酸与碱作用,变成水溶性较大的对氨基苯磺酸钠。
2. 为了使对氨基苯磺酸完全重氮化,反应过程必须不断搅拌。 3. 温度控制:<5℃,防止生成的重氮盐易水解成酚类化合物,而降低
产率。 4. 反应终点用淀粉—碘化钾试纸检验,若试纸显蓝色表明亚硝酸过量。
加入少量尿素除去过多的亚硝酸。 5. 用乙醇、乙醚洗涤的目的是使产品迅速干燥。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(甲基橙的制备)
主讲人: 弓巧娟
甲基橙的制备
一、实验目的 1、通过甲基橙的制备学习重氮化反应和偶合反应的实验
操作。 2 、巩固盐析和重结晶的原理和操作。
二、实验原理
NH 2
+ SO3H NaOH
NH 2
+ SO3Na H2O
NH 2
+ SO 3Na
H2O
NaNO 2 HCl
⑥ N,N-二甲基苯胺与重氮盐偶合为什么总是在氨基的对位上发生?。
SO 3H
N+ N Cl-
C6H5N(CH 3)2 HAc
SO 3H
NaOH
SO3Na
NN
NH(CH 3)2 Ac
NN
三、仪器装置
对氨基苯磺酸、5%NaOH、NaNO2、浓盐酸、冰乙酸、N,N-二 甲基苯胺、10%NaOH、NaCl、乙醇、乙醚、磁力搅拌器、循环 水真空泵
四、实验步骤
五、问题讨论
① 什么叫偶联反应?试结合本实验讨论一下偶联反应的条件。 ② 在本实验中,制备重氮盐时为什么要把对氨基苯磺酸变成钠盐? 本实验如改成下列操作步骤:先将对氨基苯磺酸与盐酸混合,再滴加 亚硝酸钠溶液进行重氮化的应,可以吗?为什么? ③ 试解释甲基橙在酸碱介质中的变色原因,并用反应式表示。 ④ 在本实验中,重氮盐的值为什么要控制在0-5℃中进行?偶合反应 为什么在弱酸性介质中进行? ⑤ 在重氮盐中加入氯化亚铜将出现什么样的结果?
