湖北省武汉市2018届高考化学二轮复习专题测试溶液中的离子反应部分
武汉市达标名校2018年高考二月质量检测化学试题含解析
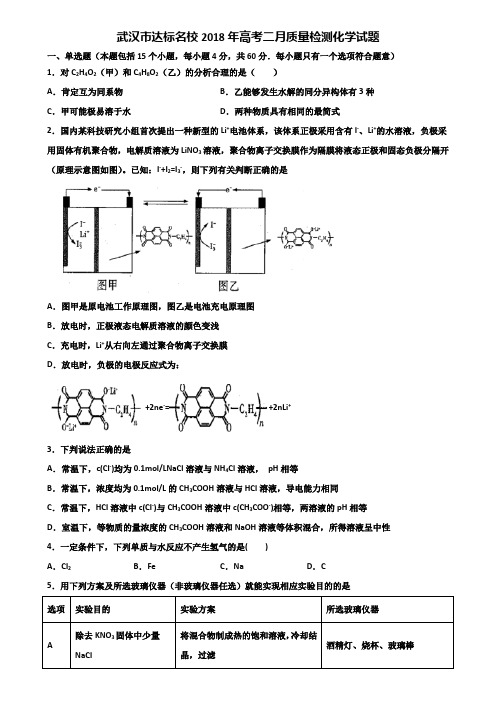
武汉市达标名校2018年高考二月质量检测化学试题一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.对C2H4O2(甲)和C4H8O2(乙)的分析合理的是()A.肯定互为同系物B.乙能够发生水解的同分异构体有3种C.甲可能极易溶于水D.两种物质具有相同的最简式2.国内某科技研究小组首次提出一种新型的Li+电池体系,该体系正极采用含有I-、Li+的水溶液,负极采用固体有机聚合物,电解质溶液为LiNO3溶液,聚合物离子交换膜作为隔膜将液态正极和固态负极分隔开(原理示意图如图)。
已知:I-+I2=I3-,则下列有关判断正确的是A.图甲是原电池工作原理图,图乙是电池充电原理图B.放电时,正极液态电解质溶液的颜色变浅C.充电时,Li+从右向左通过聚合物离子交换膜D.放电时,负极的电极反应式为:+2ne-=+2nLi+3.下判说法正确的是A.常温下,c(Cl-)均为0.1mol/LNaCl溶液与NH4Cl溶液,pH相等B.常温下,浓度均为0.1mol/L的CH3COOH溶液与HCl溶液,导电能力相同C.常温下,HCl溶液中c(Cl-)与CH3COOH溶液中c(CH3COO-)相等,两溶液的pH相等D.室温下,等物质的量浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液呈中性4.一定条件下,下列单质与水反应不产生氢气的是()A.Cl2B.Fe C.Na D.C5.用下列方案及所选玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是选项实验目的实验方案所选玻璃仪器A 除去KNO3固体中少量NaCl将混合物制成热的饱和溶液,冷却结晶,过滤酒精灯、烧杯、玻璃棒B 测定海带中是否含有碘将海带剪碎,加蒸馏水浸泡,取滤液加入淀粉溶液试管、胶头滴管、烧杯、漏斗C 测定待测溶液中I-的浓度量取20.00ml的待测液,用0.1mol·L-1的FeC13溶液滴定锥形瓶、碱式滴定管、量筒D配制500mL1mol/LNaOH溶液将称量好的20.0gNaOH固体、溶解、冷却、转移、洗涤、定容、摇匀烧杯、玻璃棒、量筒、500ml.容量瓶、胶头滴管A.A B.B C.C D.D6.K2FeO4在酸性或中性溶液中能快速产生O2,在碱性溶液中较稳定。
2018届高考化学二轮复习考点讲解:第11讲常见非金属元素及其化合物

第11讲 常见非金属元素及其化合物[考纲要求]授课提示:对应学生用书第70页[明要点·查漏补缺]1.构建知识网络2.扫除知识盲点(1)SiO 2:用于生产光导纤维、石英玻璃、光学仪器等。
(2)单质硅:可用于制作半导体材料、光伏电池、太阳能热水器等。
(3)硅酸钠:是优良的木材防火剂。
(4)硅胶:硅酸凝胶脱水后的产物,可作袋装食品的干燥剂及催化剂的载体。
(5)水煤气(H 2+CO):优良的清洁能源、常用的还原剂。
(6)金刚石:主要用于生产钻头、玻璃刀、装饰品等。
(7)硅酸钠水溶液俗称“泡花碱”或水玻璃,却是盐溶液。
■思维深化——做一做1.用方程式回答下列问题。
(1)Mg 在CO 2中燃烧。
________________________________________________________________________。
(2)“水滴石穿”的反应原理(用离子方程式表示)。
________________________________________________________________________。
(3)“钟乳石”的形成过程(用化学方程式表示)。
________________________________________________________________________, ________________________________________________________________________。
(4)向饱和Na 2CO 3溶液中通入过量CO 2的离子方程式。
________________________________________________________________________。
(5)氢氟酸不能用玻璃瓶盛放,其原因是(用化学方程式表示)。
________________________________________________________________________。
2018届高三化学二轮复习专题《Ksp计算透析》

专题11 Ksp计算透析
考查BaSO4(s)+CO32-(aq)=BaCO3(s)+SO42-(aq) 反应的平衡常数 达到饱和时,硫酸钡沉淀对应的硫酸根离子的浓度 。常温下,碳酸钠的溶解度为 26.5g , 可以计算出溶质的质量分数约为 21%,因为溶液密度ρ≈1g/cm3,所 以可以计算出碳酸根离子的浓度为 所以平衡正向移动。
专题11 Ksp计算透析
1.向沉淀中滴加少量沉淀剂,沉淀的转化很容易向生成Ksp较小的 沉淀方向进行。 这样的结论对应的问题情境: 人教版新课标教材《选修4》化学反应原理,第64页的两个
实验。实验3-4中强调了“滴加”,实验3-5更是强调了“滴加2滴
FeCl3溶液”,也就是说,在加入极少量沉淀剂后,就可以观察 到现象,可以证明生成沉淀的 Ksp 远小于原来的沉淀,在溶液中 与形成沉淀相关的离子积Qc极小的情况下也有Qc> Ksp ,所以形 成新的沉淀,沉淀得以转化,所以新的沉淀 Ksp 远小于原来的沉
专题11 Ksp计算透析
结论1和结论2的共同之处,是利用沉淀转化的方程式Q与K 的关系判断反应能否自发向右进行;当Q<K时,沉淀转化的反应 平衡向右移动,可以达到沉淀转化的目的;若Q<<K,则沉淀转 化能够进行得非常彻底。
专题11 Ksp计算透析
启示与展望: 量变引起质变,对于同样的反应物,加入不同量的沉淀剂,现象 竟然有如此大的差别,导致该差别的原因是,加入沉淀剂浓度 ( 物质的量)的不同,从而导致了Q与K的关系不同,进而导致了不 同的实验现象。可见,一个反应如何进行,最终是要通过反应原 理定量计算的,而不是靠给出结论记忆的。否则,就很容易让思 维绝对化,形成思维定式,进而忽视题目的关键细节,掉进出题 人挖好的“陷阱”。这两种结论的对比,希望能让同学们对“量 变引起质变”的哲学思想以及“定量意识”产生深刻的印象。 解题时,我们要认真审题目的情境,把握关键词,揣摩出题人意 图,避免失分。审题是至关重要的环节,要抓住问题的本质—— 沉淀能否转化,其实就是看沉淀转化的方程式Q与K的关系,或 者比较加入沉淀剂后,新沉淀Qc与Ksp的关系。
湖北省武汉市达标名校2018年高考二月质量检测化学试题含解析

湖北省武汉市达标名校2018年高考二月质量检测化学试题一、单选题(本题包括15个小题,每小题4分,共60分.每小题只有一个选项符合题意)1.某温度下,向10 mL 0.1 mol·L-l NaCl溶液和10 mL 0.1 mol·L-l K2CrO4溶液中分别滴加0.1 mol·L-l AgNO3溶液。
滴加过程中pM[-lgc(Cl-)或-lgc(CrO42-)]与所加AgNO3溶液体积之间的关系如下图所示。
已知Ag2CrO4为红棕色沉淀。
下列说法错误的是A.该温度下,K sp(Ag2CrO4)=4×10-12B.a l、b、c三点所示溶液中c(Ag+):a l>b>cC.若将上述NaCl溶液浓度改为0.2mol·L-1,则a1点会平移至a2点D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂2.下列转化不能通过一步实现的是()A.Fe Fe3O4B.Al NaAlO2C.Cu CuSO4D.Cu CuS3.下列说法正确的是( )A.可用水鉴别乙酸和乙酸乙酯B.木材纤维和土豆淀粉遇碘水均显蓝色C.一定条件下,乙酸乙酯、淀粉、乙烯都能与水发生水解反应D.向蛋白质中加入浓的Na2SO4溶液、CuSO4溶液均能凝结析出,加水后又能溶解4.多硫化钠Na2S x()在结构上与Na2O2、FeS2等有相似之处,Na2S x在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2S x与NaClO物质的量之比为1:16,则x值是A.5 B.4 C.3 D.25.铅蓄电池是历史悠久、用量非常大的蓄电池,其构造图如图所示,放电时有PbSO4生成。
下列说法中错误的是A.铅蓄电池是二次电池B.放电时负极电极式:Pb-2e- +SO42-= PbSO4C.充电时电解质溶液密度增大D.当电路中转移电子数目为2N A时,溶液中SO42-减少或增加1 mol6.混合物M中可能含有A12O3、Fe2O3、Al、Cu,为确定其组成,某同学设计如图所示分析方案。
2018版高中化学二轮复习训练题: 高考压轴大题特训 题型二 以“化工流程”为载体的综合考查型(含答案)

题型二以“化工流程”为载体的综合考查型1.(2017·湖北省武昌区高三5月调研考试)铬渣(铬主要以Cr2O3形式存在,同时含有Al2O3、SiO2等杂质)是铬电镀过程中产生的含铬污泥,实现其综合利用,可减少铬产生的环境污染。
铬渣综合利用工艺流程如下:请回答下列问题:(1)焙烧得到的产物含有Na2CrO4和一种无污染的气体,则生成Na2CrO4的反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(2)除去浸出液中的杂质最好加入________(填试剂名称)来调节pH。
除去铝元素的离子方程式为________________________________________________________________________________________________________________________________________________。
(3)理论上加入醋酸铅、硝酸铅均可以得到铬酸铅沉淀,工艺流程中不选用醋酸铅的原因是________________________________________________________________________________________________________________________________________________。
(4)铬酸铅是一种用于水彩和油彩的筑色颜料。
遇到空气中的硫化物颜色会变黑,该过程的化学方程式为____________________________________________________________________________________________________________________________________________________________________________________________________________。
2018年全国卷高考化学知识点专题突破—《离子反应》(知识点归纳总结+真题回访)
2019年全国卷高考化学知识点专题突破—《离子反应》【考纲要求】1.了解电解质的概念,了解酸、碱、盐在水溶液中的电离。
2.了解离子反应的概念,了解离子反应发生的条件,并会判断离子在溶液中能否大量共存。
3.能运用书写规则书写常见反应的离子方程式;或结合具体反应对所给离子方程式进行正误判断。
【考点梳理】考点一、电解质与非电解质2.实例分析:电解质与非电解质的辨析(1)电解质、非电解质均应是化合物。
金属属于单质,故既不是电解质,也不是非电解质。
(2)电解质导电必须有外界条件:水溶液或熔融状态。
(3)电解质应是一定条件下本身电离而导电的化合物;2、2、3、3溶于水后也导电,却是与水反应生成新物质后电离而导电的,不是本身电离导电的,故属于非电解质。
(4)能导电的物质并不一定是电解质,如铜、铝、石墨能导电,但因其为单质,故不属于电解质(也不属于非电解质);食盐水能导电,但其为混合物,不属于电解质。
溶于水不能导电的物质可能是电解质,如4难溶于水,但其溶于水的部分是完全电离的,属于电解质。
考点二、强电解质与弱电解质1.强电解质与弱电解质的比较要点诠释:电解质的强弱是以电离的程度来区分的,与物质的溶解度、溶液的导电能力没有必然联系。
①4、3等虽然在水中溶解度很小,溶液的导电性很差,但是由于都是离子化合物,溶于水的部分是全部电离的,是强电解质。
②浓氨水的导电性比极稀溶液强,但3·H2O属于弱电解质。
2.电离方程式的书写方法:(1)要求左边书写电解质的化学式,右边写电解质电离出的离子的化学式,不同离子间用加号相连。
强电解质用“”,弱电解质用“”。
如:H24242-;442—;(3)2223—+ ;3·H24+;H2+33(2)电离过程中,元素或原子团的化合价不变。
离子所带电荷数等于它在化合物中显示的化合价。
(3)检查电离方程式书写是否正确时,不仅要检查质量是否守恒(即电离前后原子的种类是否相同和个数是否相等),而且要检查电荷是否守恒(即电离后的阴、阳离子所带负、正电荷总数是否相等)。
2018届高三第二次理综化学试题及答案
2018届高三第二次理综化学考试7、下列关于化学与生产、生活的认识不正确的是()A . 使用含有氯化钙、氯化钠的融雪剂会加速桥梁的腐蚀B . 煤干馏可以得到芳香族化合物等物质,新能源汽车的推广和应用有助于减少光化学烟雾的产生C . 向海水中加净水剂明矾可使海水淡化D . 除去水垢中的CaSO4常用试剂有碳酸钠和盐酸8、已知N A 为阿伏伽德罗常数的值,下列说法正确的是()A. 8.4g NaHCO3晶体中含有0.1 N A 个CO32-B. 50mL12mol/L的浓盐酸与足量MnO2反应,转移的电子数为0.3N AC. pH=2的Fe2(SO4)3中由水电离出的H+为0.01 N AD. 铅蓄电池工作时,当电路中通过的电子为0.2 N A 时,负极质量增加9.6g9、下列指定反应的离子方程式正确的是()A.用石墨电极电解MgCl2溶液:Mg2++ 2C1- + 2H2O Mg(OH)2↓+ Cl2↑+ H2↑B. 向碳酸氢铵溶液中加入足量石灰水: Ca2++ HCO3- + OH –CaCO3↓+H2OC. 向氢氧化钡溶液中加入硫酸氢钠至溶液为中性: Ba2++OH–+ H++ SO42-BaSO4↓+H2OD.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I- == 3I2+2NO↑+4H2O10、如图W、X、Y、Z为四种物质,若箭头是能一步转化的常见反应,其中常温下能进行的是()11、原电池与电解池在生活和生产中有着广泛应用。
下列有关判断中错误的是()A.装置甲研究的是电解CuCl2溶液,它将电能转化为化学能B.装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe - 2e -- = Fe2+C.装置丙研究的是电解饱和食盐水,B电极发生的反应:2Cl- -2e-- = Cl2↑D.向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成13、下列图示与对应的叙述相符的是( )A. 图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH 的变化曲线,其中曲线II 为盐酸,且b 点溶液的导电性比a 点强B.图2表示0.1000mol/LCH 3COOH 溶液滴定20.00mL0.1000mol/LNaOH 溶液所得到的滴定曲线C.图3表示压强对可逆反应2A(g) +2B(g) 3C(g )+D(s)的影响,乙的压强比甲的压强大D.据图4,若除去CuSO 4溶液中的Fe 3+,可向溶液中加入适量CuO ,调节pH 在4左右27、(16 分)POCl 3广泛用于染料等工业。
2018版全国新课标卷化学二轮复习-选择题能力点训练:高考能力点2离子反应氧化还原反应 含答案
高考能力点2 离子反应氧化还原反应1.A 解析OH-与Ba2+、K+、N错误!未找到引用源。
、Al错误!未找到引用源。
都不反应,A正确;Na2O2有强氧化性,与S错误!未找到引用源。
不能大量共存,B错误;N错误!未找到引用源。
、H+、Fe2+发生氧化还原反应而不能大量共存,C错误;加入石蕊呈蓝色的溶液显碱性,N、HC错误!未找到引用源。
不能大量共存,D错误。
2. B 解析“84”消毒液的主要成分是次氯酸钠,与碘离子发生氧化还原反应而不能大量共存,A错误;B项溶液为酸性溶液,各离子能大量共存,B正确;使pH试纸显蓝色的溶液显碱性,铁离子不能大量共存,C错误;硫化氢和铜离子反应生成硫化铜沉淀,D错误。
3.C 解析H+、Fe2+、N错误!未找到引用源。
之间发生氧化还原反应,不能大量共存,A错误;使甲基橙呈红色的溶液显酸性,ClO-、Cl-发生氧化还原反应,不能大量共存,B错误;pH=12的溶液显碱性,该组离子之间不反应,能大量共存,C正确;与铝反应产生大量氢气的溶液为酸或强碱溶液,酸溶液中H+、C错误!未找到引用源。
反应,且Al、H+、N错误!未找到引用源。
发生氧化还原反应不生成氢气,不能大量共存,D错误。
4.C 解析水溶液中Cu2+为蓝色,A错误;能溶解Al(OH)3固体的溶液为强酸或强碱溶液,都能与HC错误!未找到引用源。
反应,B错误;水电离出的c(H+)=10-12mol·L-1的溶液是酸性或碱性溶液,Ba2+、Na+、Cl-、N错误!未找到引用源。
都能大量共存,C正确;能使淀粉-KI试纸变蓝的溶液具有氧化性,能与Fe2+发生氧化还原反应,D错误。
5.C 解析Fe3+和I-、SCN-不能大量共存,A错误;与铝反应生成氢气的溶液可能是酸溶液也可能是碱溶液,在碱溶液中铜离子和亚铁离子不能大量共存,B错误;C项溶液为酸性,离子都能大量共存,C正确;水电离出的c(H+)=10-12mol·L-1的溶液,可能是酸溶液也可能是碱溶液,酸性条件下碳酸根离子和偏铝酸根离子不能大量共存,D错误。
湖北省武汉市2018届高考化学二轮复习专题测试化学实验部分
化学实验部分1、(2017年全国卷Ⅰ)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度C.结束反应时,先关闭活塞K,再停止加热D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气2、(2017年全国卷Ⅱ)下列由实验得出的结论正确的是3、(2017年全国卷Ⅱ)由下列实验及现象不能推出相应结论的是5、A.由①中的红棕色气体,推断产生的气体一定是混合气体B.红棕色气体不能表明②中木炭与浓硝酸产生了反应C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应6、(2016年全国卷Ⅰ)下列实验操作能达到实验目的的是A.用长颈漏斗分离出乙酸与乙醇反应的产物B.用向上排空气法收集铜粉与稀硝酸反应产生的NOC.配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释D. 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl27、(8、(2016年全国卷Ⅲ)下列有关实验的操作正确的是910、(2016年天津卷)下列选用的仪器和药品能达到实验目的的是( )11、(2016年浙江卷)下列叙述不正确的是A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线1213、(2016年四川卷)根据下列实验操作和现象得出的结论正确的是()14、(2016年海南卷)下列有关实验操作的叙述错误的是A.过滤操作中,漏斗的尖端应接触烧杯内壁B.从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁C.滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁D.向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁15、(2015年江苏卷 )下列实验操作正确的是( )A.用玻璃棒蘸取CH 3COOH 溶液点在水湿润的pH 试纸上,测定该溶液的pHB.中和滴定时,滴定管用所盛装的反应液润洗2~3次C.用装置甲分液,放出水相后再从分液漏斗下口放出有机相D.用装置乙加热分解NaHCO 3固体16、(2015年广东卷)准确移取20.00mL 某待测HCl 溶液于锥形瓶中,用0.1000mol·L -1NaOH 溶液滴定,下列说法正确的是A .滴定管用蒸馏水洗涤后,装入NaOH 溶液进行滴定B .随着NaOH 溶液滴入,锥形瓶中溶液PH 由小变大C .用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定D .滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 17、18、(2015年全国卷Ⅱ)用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是19、(检验溶液中是否含有20、下列操作或装置能达到实验目的的是()21、(2018年湖南联考)利用下列实验装置进行相应的实验,不能达到实验目的的是A.利用图甲装置,可快速制取氨气B.利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液C.利用图丙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化D.利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性22.(2018桂林模拟)下列说法正确的是()A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可B.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在SO42-或SO32-C.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法D.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。
2018高考化学 离子反应 教师版 附答案
绝密★启用前2017-2018学年度达拉特旗一中学校3月月考卷试卷副标题考试范围:xxx ;考试时间:100分钟;命题人:xxx注意事项:1.答题前填写好自己的姓名、班级、考号等信息 2.请将答案正确填写在答题卡上第I 卷(选择题)请点击修改第I 卷的文字说明一、选择题1.下列离子方程式书写正确的是A .Ba(OH)2溶液中加入少量NaHSO 4:OH −+H +H 2OB .钠加入水中:Na +2H 2O Na ++2OH −+H 2↑ C .NaOH 溶液中通入足量的CO 2:OH −+CO 23HCO -D .Al 2(SO 4)3溶液中加入足量Ba(OH)2溶液:2Al 3++324SO -+3Ba 2++6OH −2Al(OH)3↓+3BaSO 4↓2.下列各组中两溶液间的反应,均可用同一离子方程式表示的是 A .CH 3COOH 和Na 2CO 3与CH 3COOH 和NaHCO 3 B .AgNO 3和HCl 与Ag 2SO 4和HClC .BaCl 2和Na 2SO 4 与Ba(OH)2与H 2SO 4D .KOH 和CH 3COONH 4与Ba(OH)2与NH 4Cl3.电解质是一类在水溶液里或熔融状态下能够导电的化合物。
下列物质属于电解质的是A .CuB .K 2SO 4C .MgCl 2溶液D .盐酸4.常温下,下列各组离子在指定溶液中一定能大量共存的是 A .1.0 mol·L −1KNO 3溶液:H +、Fe 2+、SCN −、24SO -B .c(H +)/c(OH −)=10−10的溶液:K +、Ba 2+、3NO -、Cl −C .pH=0的溶液:Al 3+、、Cl −、24SO -D .c(ClO −)=1.0 mol·L −1的溶液:Na +、23SO -、S 2−、24SO -5.下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是 A .石灰水和稀盐酸混合 B .小苏打溶液和柠檬水混合C .人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl 2溶液混合D .氯化钠溶液和蔗糖水混合6.向含有一定量盐酸和MgSO 4的混合液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m 与加入Ba(OH)2的物质的量n 之间的关系如图所示,下列说法正确的是A .a→b 段沉淀的成分为BaSO 4与Mg(OH)2B .b→c 段发生的离子反应为H ++ OH −H 2OC .e 点时的溶液中:n(Ba 2+)=2 mol D .原混合液中:n(HCl)=2 mol7.下列实验设计及其对应的离子方程式均正确的是 A .用铜电极电解NaCl 溶液制备Cl 2:2Cl −+2H 2O Cl 2↑+H 2↑+2OH − B .向MgCl 2溶液中加入氨水制备Mg(OH)2:Mg 2++2OH −Mg(OH)2↓ C .将FeS 溶于稀硝酸制备Fe(NO 3)3:FeS+4H ++3NO -Fe 3++NO↑+S↓+2H 2OD .用浓盐酸酸化的KMnO 4溶液与H 2O 2反应,证明H 2O 2具有还原性:24MnO -+6H ++5H 2O 22Mn 2++5O 2↑+8H 2O8.下列各离子能大量共存的是 A .无色透明的溶液中:Cu 2+、K +、24SO -、3NO -B .使无色酚酞试液呈红色的溶液中:Na +、K +、24SO -、23CO -C .NH 4Cl 溶液中:K +、OH −、24SO -、Cl −D .pH=1的溶液中:Na +、K +、3HCO -、3NO -9.实验室需配制一种仅含四种离子(不包括水电离出的离子)的混合溶液,且在混合液中四种离子的物质的量浓度均为0.5 mol·L −1,下面四个选项中能达到此目的的是 A .Fe 2+、Na +、3NO -、Cl−B .Mg 2+、+4NH 、24SO -、3NO -C .H +、K +、Cl −、CH 3COO−D .K +、Mg 2+、23CO -、OH −10.甲、乙、丙、丁4种易溶于水的物质,分别由+4NH 、Ba 2+、Mg 2+、H +、3HCO -、24SO -、OHˉ、Clˉ中的不同阳离子和阴离子各一种组成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶液中的离子反应1、(2017年全国卷Ⅰ)常温下将NaOH 溶液添加到己二酸(H 2X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是A .K a2(H 2X )的数量级为10-6B .曲线N 表示pH 与lgc(HX -)/c(H 2X) 的变化关系C .NaHX 溶液中c(OH -)>c(H +)D .当混合溶液呈中性时,c(Na +)>c(HX -)>c(X 2-)>c(OH -)=c(H +) 2、(2017年全国卷Ⅱ)改变0.11mol L -⋅二元弱酸H2A 2H A 溶液的pH ,溶液中的H 2A 、HA -、A 2-的物质的量分数δ(X )随pH 的变化如图所示[已知]。
下列叙述错误的是A .pH=1.2时,c(H 2A) =c(HA -) B .lg [K 2(H 2A )]=-4.2 C .Ph=2.7时,c(HA -)>c(H 2A)=c(A 2-) D .pH=4.2时,c(HA -= c(A 2-)= c(H +) 3、(2017年全国卷Ⅲ) 在湿法炼锌的电解循环溶液中,较高浓度的Cl -会腐蚀阳极板而增大电解能耗。
可向溶液中同时加入Cu 和CuSO 4,生成CuCl 沉淀从而除去Cl -。
根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是 A .SP (CuCl)K 的数量级为710- B .除Cl -反应为Cu+Cu 2++2Cl -=2CuClC .加入Cu 越多,Cu +浓度越高,除Cl -效果越好 D .2Cu +=Cu 2++Cu 平衡常数很大,反应趋于完全4.(2017年江苏卷)(双选题)常温下,K a (HCOOH)=1.77×10-4, K a (CH 3COOH)=1.75×10-5,K b (NH 3·H 2O) =1.76×10-5,下列说法正确的是A .浓度均为0.1 mol·L -1的 HCOONa 和NH 4Cl 溶液中阳离子的物质的量浓度之和: 前者大于后者B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等C.0.2 mol·L-1 HCOOH 与0.1 mol·L-1 NaOH 等体积混合后的溶液中:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)D.0.2 mol·L-1 CH3COONa 与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-) > c(Cl- ) > c(CH3COOH) > c(H+)5、(2016年全国卷Ⅰ)298K时,在20.0mL 0.10mol·L-氨水中滴入0.10mol·L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示。
已知0.10mol·L-氨水的电离度为1.32%,下列有关叙述正确的是A.该滴定过程应该选择酚酞作为指示剂B.M点对应的盐酸体积为20.0mLC.M点处的溶液中C(NH4+)=C(Cl-)=C(H+)=C(OH-)D.N点处的溶液中pH<126、(2016年全国卷Ⅲ)下列有关电解质溶液的说法正确的是A.向0.1mol·L-1 CH3COOH溶液中加入少量水,溶液中 C(H+)/C(CH3COOH)减小B.将CH3COONa溶液从20℃升温至30℃,溶液中 C(CH3COO-) /C(CH3COOH)·C(OH-) 增大C.向盐酸中加入氨水至中性,溶液中C(NH4+) /C(Cl-)>1D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中C(Cl-)/C(Br-) 不变7、(2016年上海卷)能证明乙酸是弱酸的实验事实是A.CH3COOH溶液与Zn反应放出H2 B.0.1 mol/L CH3COONa溶液的pH大于7C.CH3COOH溶液与NaCO3反应生成CO2 D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红8、(2016年天津卷)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB 和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )A.三种酸的电离常数关系:K HA>K HB>K HDB.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)9、(2016年浙江卷)苯甲酸钠(,缩写为NaA)可用作饮料的防腐剂。
研究表明苯甲酸(HA)的抑菌能力显著高于A–。
已知25 ℃时,HA的K a=6.25×10–5,H2CO3的K a1=4.17×10–7,K a2=4.90×10–11。
在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。
下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低B.提高CO2充气压力,饮料中c(A–)不变C.当pH为5.0时,饮料中C(HA)/C(A-) =0.16D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3- ))+c( CO32- )+c(OH–)–c(HA)10.【2018合肥市模拟】电导率是衡量电解质溶液导电能力大小的物理量。
常温下,将相同体积的氢氧化钠溶液和醋酸溶液分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如下图所示。
下列说法正确的是A.曲线I表示NaoH溶液加水稀释过程中溶液电导率的变化B.a、b、c三点溶液的pH: b>c>aC.将a、b两点溶液混合,所得溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)D.醋酸溶液稀释过程中,c(CH3COO-)/c(CH3COOH)不断增大11.【2018河南省诊断卷】一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。
下列有关判断不正确的是A. 该温度下,Ksp(MnS)大于1.0×10-35B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出D. 该温度下,溶解度:CuS>MnS>FeS>ZnS12.【2018曲靖质量监测】常温下,向l0mL0.1mol/L的HR溶液中逐渐滴入0.lmol/L的NH3·H2O 溶液,所得溶液pH及导电性变化如图。
下列分析不正确的是A.a〜b点导电能力增强,说明HR为弱酸B.b点溶液,c(NH3•H2O)=c(R-)+c(H+)-c(OH-)C.c点溶液,存在c(NH4+)>c(R-)>c(OH-)>c(H+)D.常温下,HR和NH3•H2O的电离平衡常数相等13.【2018武昌调研】室温下,用0.100mol·L-1的NaOH溶液分别滴定均为20.00mL0.100mol·L-1的HCl溶液和醋酸溶液,滴定曲线如图所示。
下列说法正确的是A. I表示的是滴定醋酸的曲线B. pH =7时,滴定醋酸消耗的V(NaOH)>20.00mLC. V(NaOH)= 20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)14.【2018衡水模拟】25℃时,将浓度均为0.1mol/L,体积分别为Va和V b的HA溶液与BOH溶液按不同体积比混合,保持Va+V b=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是A.K a(HA)=1×10-6mol/LB.b点c (B+)=c(A-)=c(OH-)=c(H+)C.c点时,随温度升高而减小D.a→c过程中水的电离程度始终增大15.【2018南昌冲刺卷】下列说法正确的是A. 常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-lB. 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-)C. 常温下0.1 mol.L-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L-lD. 常温下向10 mL0.1 mol.L-1的CH3 COOH溶液中滴加相同浓度的氨水,在滴加过程中,将减小16.【2018淄博市仿真模拟】某溶液由弱酸(HR)及其盐(NaR)组成,浓度均为1 mol•L-1,25℃时向该溶液通入HCl气体或滴入NaOH溶液,溶液pH随加入的H+或OH-的物质的量发生变化的情况如图。
下列说法不正确的是A. A、B、C三点所表示的溶液中水的电离程度依次增大B. 加入1 mol N aOH后,溶液中c(Na+)=c(R-)C. 通入HCl, R-的水解程度增大,HR的电离常数减小D. 未加HCl和NaOH时,溶液中c(R-)>c(Na+)>c(HR)17.【2018东台模拟】下列装置图或曲线图与对应的叙述相符的是A. 如图1所示,用0.1mol/LNaOH溶液分别滴定相同物质的量浓度、相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线B. 某温度下FeS、CuS的沉淀溶解平衡曲线如图2所示,纵坐标c(M2+)代表Fe2+或Cu2+的浓度,横坐标c(S2—)代表S2—浓度。
在物质的量浓度相等的Fe2+和Cu2+的溶液中滴加硫化钠溶液,首先沉淀的离子为Fe2+C. 如图3所示,用0.1mol/LCH3COOH溶液滴定20mL0.1mol/LNaOH溶液的滴定曲线,当pH=7时:c(Na+)=c(CH3COO—)>c(OH—)=c(H+)D. 据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在5.5左右18.【2018沈阳模拟】常温下,向1L 0.10mol/L CH3COONa溶液中,不断通入HCl气体(忽略溶液体积变化),得到c(CH3COO-)和c(CH3COOH)与pH的变化关系如下,则下列说法不正确的是A、溶液的pH比较:x>y>zB. 在y点再通入0.05molHCl气体,溶液中离子浓度大小比较:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)C. 在溶液中加入一滴强酸或强碱,溶液pH变化最小的是y点D. 该温度下,CH3COONa的K a=10-4.7519.【2018潍坊市模拟】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL 均为0.1000mol·L -1的三种酸HX 、HY 、HZ ,滴定曲线如图所示。
