《热力学》课程内容小结
第六章热力学基础小结ppt课件

2600
QQCB
3200 600
B热源共吸收热量Q=3200J; C热源共放出热量600J.
2.13一个四壁竖直的大开口水槽,其中盛水,水深 为H。在槽的一侧水下深h处开一小孔。(1)射出 的水流到地面时距槽底边的距离是多少?(2)在槽 壁上多高处再开一小孔,能使射出的水流具有相同 的射程?(3)要想得到最大的射程,小孔要开在水 面以下多深处,最大射程为多少?
(3)在工作物质经过一个循环后: 熵变S 0,
由于制冷机为可逆机,则:= T2 200 1
T1 T2 400 200
则:=1= Q2
A
Q2
A
若吸热836不变,则:Q2 A=836,Q1 1672J , 总熵变:S=1672 +-836 =0
400 200
若放热2508不变,则:Q1
卡
1
T2 T1
e卡
T2 T1 T2
(4).掌握热机和致冷机的工作原理图 .
三、热力学第二定律
1. 可逆过程和不可逆过程。
2. 热力学第二定律的两种表述。
3、 熵
2 dQ
S2 S1
1
T
,或dS dQ T
.
1. 定(1)义等:容过程
S
m M
CVm
ln
T2 T1
2.
理(2想) 等气压体过等程值过程S 的 M熵m 变CPm
ln
T2 T1
(3) 等温过程 S m R ln V2
M
V1
( 4 ) 绝热过程 S 0
(5)相变、同相温变过程的熵变
相变 : S l m , S m
T
T
(放热取 , 吸热取)
同相温变 : S cm ln T2 T1
热力学小结
7、一条等温线能否相交两次?为什么?
Pa
8、卡诺循环中,两
次膨胀的体积不等,
b
则净功多的效率高,
f
对吗?为什么?
d
T1
c e T2
V
例题:一定量的理想气体经历acb过程时吸热 200j。则经历acbda过程时吸热为: (a)-1200j; (b)-1000j; (c)-700j; (d)1000j;
例:0.1mol的单原子理想气体,经历一准 静态过程abc,ab、bc均为直线。
1、求Ta、Tb、Tc。 2、求气体在ab和bc
过程中吸收的热量, 1.5
气体内能的变化各如
何?
1
3、气体在abc过程中 0.5
最高温度如何? 4、 0 气体在abc过程中经
历一微小变化时,气
体是否总是吸热?
P(105Pa)
P Pb 5 107 (V Vb ) 1 a 再由 PV M RT 0.5
c
Mmol
0 1 2 3 V(10-3m3)
求出T。
由 dT 0
dV
Tmax
例: 一定量的理想气体,从a态出发经过
aeb 或afb 过程到达b态,acb为等温线,则
两过程中外界对系统传递的热量是放热还
是吸热?
P
a
e
例题 . 2mol单原子分子理想气体经等 容过程后,温度从 200K升高到500K。试求 气体吸收的热量?(* 如果过程是准静态过 程;*如果过程是非准静态过程)
1
a 2c
a’
0
T
例题:判断下列两图1-2-3 -1各过程中交换 的热量, 内能的变化,作功的正负? 并画 出在 p - V 图上对应的循环过程曲线。
物理热学课程总结

热学课程小结重点内容计算机及信息工程学院通信三班 0706020327 彭鹏一.主要内容:I,热力学基础①,热力学的基本概念1,热力学系统2,平衡态准静态过程3,理想气体状态方程②,热力学第一定律1,改变系统内能的两种途径热功当量2,热力学第一定律的数学描述3,准静态过程中热量、功和内能③,热力学第一定律的应用1,热力学的等值过程2,绝热过程、多方过程④,循环过程1,循环过程2,热机和制冷机3,卡诺循环及其效率⑤,热力学第二定律1,热力学过程的方向性2,热力学第二定律3,卡诺定理II,气体动理论①,气体动理论的基本概念1,分子动理论的基本观点2,分子热运动与统计规律3,理想气体的微观模型②,理想气体状态方程地微观解释1,理想气体压强的统计定义2,温度的微观意义3,理想气体状态方程地微观解释*4,真是气体的范德瓦尔斯方程③,能量按自由度均分原理1,自由度2,能量按自由度均分原理3,理想气体的内能摩尔热容④,麦克斯韦速率分布1,麦克斯韦速率分布函数 2,麦克斯韦速率分布的测定 3,三个统计速率⑤,玻耳兹曼能量分布 1,重力场中分子数密度分布 2,玻耳兹曼能量分布 3,大气垂直温度梯度⑥,气体分子的平均自由程和碰撞频率 1,分子的平均碰撞频率 2,平均自由程⑦,气体的输运现象 1,粘滞现象 2,热传导方向 3,扩散方向⑧,熵与热力学第二定律 1,热力学第二定律的统计意义 2,熵与热力学概率3,克劳修斯熵 熵增加原理二,主要内容及原点1、温度的概念与有关定义P=mV mRT =A VN NRT =nkT. 而k n P ε32=,可得kT k 23=ε。
温度标志着气体内部分子无规则的剧烈程度,乃是气体分子平均动能大小的量度。
热力学第零定律,表述为:如果两个热力学系统的每一个都与第三个热力学系统处于热平衡,则这两个系统彼此也必处于热平衡。
也就是:处在同一热平衡状态的所有热力学系统都具有一个共同的宏观特征,这一特征可以由这些系统的状态参量来描述,这个状态参量被定义为温度。
工程热力学课程总结

1).工质经历一热力循环,吸热过程吸热40kJ,膨胀过程对外作功80kJ,放热过程对外放热20kJ,压缩过程外界对工质作功50kJ;该循环不违背热力学基本定律,可以实现。
()2).有一制冷循环,工质从温度为-20℃的恒温冷物体吸热180kJ,向温度为20℃的环境放热200kJ,该循环违背热力学基本定律,不能实现。
()3).对于开口系统,引起系统熵增的因素是系统吸热和过程的不可逆性二项。
()4).水蒸气的焓熵图上,湿蒸气区的等温线既为等压线,是一组斜率相同的倾斜直线。
()5).压缩比相同时,活塞式内燃机定容加热循环的热效率比定压加热循环的热效率高。
()6).mkg理想气体从压力P1(bar),容积V1(m3),以可逆定温过程膨胀到V2(m3),过程的容积功为:W=102mP1V1 n VV21kJ。
()7).不可逆过程无法在T-s图上表示,也无法计算其熵的变化。
()8).定比热理想气体CO2(绝热指数K=1.29)进行n=1.35的膨胀过程时,吸热,熵增加。
()9)理想气体的定压比热C P和定容比热C V的差值和比值在任何温度下都是常数。
()10).因为实际滞止过程是不可逆绝热过程,实际滞止温度一定高于定熵滞止温度。
()11).某制冷机消耗功率为5kw,每分钟可从0℃的恒温冷库中取出3600kJ的热量排给30℃的恒温环境。
()12)空气进行一多变过程,当多变指数n=1.2时,空气的比热为负值。
()13).在给定的初终态之间有一热力过程,过程中工质与环境发生热交换。
已知一切过程均为可逆时耗功400kJ,若实际过程耗功380kJ,则依热力学知识可判明该实际过程可以实现。
()14).水蒸气h-s图(焓熵图)上湿蒸气区域的等压线为倾斜直线,压力越高,斜率越大。
()15)若物体吸热,则该物体熵一定增加;反之,一物体放热,则该物体熵一定减少。
()16).理想气体从同一初态绝热滞止,一为可逆,一为不可逆,则不可逆滞止温度要比可逆高些。
大一热学知识点总结

大一热学知识点总结热学是物理学的重要分支,研究热量的传递、转化和守恒的规律。
在大一学习中,我们对热学有了初步的了解,下面是对大一热学知识点的总结。
一、热力学基本概念1. 热力学系统:指所研究的物体或物质的范围,包括研究对象和周围环境。
2. 热平衡:指热力学系统内部各部分热量的传递达到平衡状态。
3. 热力学第一定律:能量守恒定律,能量可从一种形式转化为另一种形式,但总能量不变。
二、热力学过程与循环1. 等压过程:系统在恒定的压强下进行,体积发生变化。
2. 等容过程:系统的体积保持不变,在容器中发生的过程。
3. 等温过程:系统与周围环境保持温度不变。
4. 绝热过程:系统与外界不进行热量的交换。
5. 热力学循环:系统经历一系列过程后回到初始状态的过程。
三、热力学定律和公式1. 热力学第二定律:热量不会自发地从低温物体传递到高温物体,热量的自发流动方向是从高温到低温。
2. 卡诺循环效率:决定于两个温度之比,既高温与低温的比值。
3. 热力学温标:绝对温度,以绝对零度为零点的温标。
4. 热容量:表示物体吸收或释放热量的能力,单位是焦耳/摄氏度。
5. 等温线和绝热线:在PV图上代表不同过程的曲线。
四、热力学方程1. 理想气体状态方程:PV = nRT,关系压强、体积、物质的摩尔数和温度。
2. 等温变化的理想气体方程:P₁V₁ = P₂V₂,表示等温变化时的物态方程。
3. 等压变化的理想气体方程:V₁/T₁ = V₂/T₂,表示等压变化时的物态方程。
4. 等容变化的理想气体方程:P₁/T₁ = P₂/T₂,表示等容变化时的物态方程。
五、热力学热传导和传热1. 热传导:热量通过物体内部颗粒之间的碰撞传递的过程。
2. 导热系数:衡量物质传热能力的物理量。
3. 热传导的计算:热传导率 = 导热系数 ×断面积 ×温度差 / 材料的厚度。
4. 对流传热:液体或气体中由于温度差而产生的流体运动传递热量。
热力学复习要点梳理与总结

热力学复习要点梳理与总结热力学是物理学中的重要分支,研究物质及其相互作用中所涉及的能量转化与传递规律。
为了更好地复习热力学知识,以下是热力学的核心要点进行梳理与总结。
一、热力学基本概念1. 热力学系统:指所研究的物质或物质的集合。
可以分为封闭系统、开放系统和孤立系统三种。
2. 热力学平衡:指热力学系统各个部分相互之间没有宏观可观测到的差别。
3. 热力学第零定律:当两个系统与第三个系统分别达到热力学平衡时,这两个系统之间也达到热力学平衡,它们之间的温度相等。
4. 热力学第一定律:能量守恒定律,系统的内能变化等于系统对外做功加热量的代数和。
5. 热力学第二定律:自发过程只会在熵增加的方向上进行。
二、热力学方程1. 理想气体状态方程:pV = nRT,其中p表示气体的压强,V表示气体的体积,n表示气体的摩尔数,R为气体常量,T表示气体的温度。
2. 等温过程:系统温度恒定,内能不变。
pV = 常数。
3. 绝热过程:系统与外界没有能量的交换,熵不变。
pV^γ = 常数,其中γ为气体的绝热指数。
4. 等容过程:系统体积恒定,内能变化全部转化为热量。
p/T = 常数。
5. 等压过程:系统压强恒定,内能变化全部转化为热量。
V/T = 常数。
6. 等焓过程:系统焓恒定,内能变化全部转化为热量。
Q = ΔH,其中Q表示吸热量,ΔH表示焓变化。
三、热力学循环1. 卡诺循环:由等温膨胀、绝热膨胀、等温压缩、绝热压缩四个过程组成,是一个理想的热力学循环。
它能够以最高效率转换热能为功。
2. 斯特林循环:由等容膨胀、绝热膨胀、等容压缩、绝热压缩四个过程组成,可应用于制冷领域。
四、热力学熵1. 熵的定义:系统的无序程度。
dS = dQ/T,其中dS表示系统熵变,dQ表示系统吸热量,T表示系统温度。
2. 熵增原理:孤立系统熵不断增加,自发过程只能在熵增加的方向上进行。
3. 等温过程中熵变:ΔS = Q/T。
五、熵与热力学函数1. 熵与状态函数:熵是状态函数,只与初末状态有关,与过程无关。
热学热力学知识点总结
热学热力学知识点总结热学热力学是物理学中的重要分支,研究物质热现象和热传递规律,深入了解这一领域的知识对于我们理解自然界的运行机制至关重要。
本文将对热学热力学的一些重要知识点进行总结。
一、热力学基本概念1. 系统与环境:热力学中,我们将要研究的物体或者系统称为“系统”,而其周围的一切称为“环境”。
2. 边界与界面:系统与环境之间通过一条虚线或者实际存在的物理情况进行分界,在这个分界线上,称为“边界”。
而边界之间的物理现象发生的地方称为“界面”。
二、热力学定律1. 第一定律:能量守恒定律,描述了能量的转化和守恒规律。
能量从一个系统传递到另一个系统,既不会凭空产生,也不会消失。
2. 第二定律:熵增原理,描述了自然界热现象的方向性。
热量不会自动从低温物体传递到高温物体,而是相反的。
这个定律也说明了热量的传递需要有势差。
3. 第三定律:绝对零度定律,描述了当温度接近绝对零度时,物体的一些性质将趋近于零。
三、热力学过程1. 等压过程:系统中的压强恒定,系统对外界做功或者从外界接收到的功相等。
2. 等温过程:系统内部温度恒定,根据热容量对外界做功或者从外界接收到的功相等。
3. 绝热过程:系统与环境没有热量交换,系统内部熵不变。
四、热力学函数1. 内能:系统中分子的热运动所具有的能量总和称为内能。
内能是状态函数,与系统的初始状态和末状态有关。
2. 焓:系统的内能加上对外做的功,称为焓。
焓也是状态函数。
3. 熵:描述了系统的无序程度,并且是一个状态函数。
熵增原理通过熵的变化来预测自然界的趋势,即系统熵会不断增大。
4. 自由能:描述了系统能做到的最大非体积功。
分为Helmholtz自由能和Gibbs自由能两种。
五、热力学循环1. 卡诺循环:由两个等温过程和两个绝热过程组成的循环,是一个理想的热力学循环。
卡诺循环的效率反映了热机的工作效率。
2. 标准焓:在25摄氏度和1 atm压强下,各物质的标准热力学性质,如标准焓变等。
化学热力学小结
3
(4)盖斯定律:
ΔrHm = ΔrH1 + ΔrH2 + ΔrH3
(5)吉布斯自由能判据
在等温、等压, 不做非体积功的条件下:
△G<0 反应以不可逆方式自发进行 △G=0 反应以可逆方式进行 △G>0 不能自发进行
(6)Gibbs-Helmholtz公式: rGm = rHm- TrSm
(1)四个状态函数
(2)热力学第一定律:ΔU
=Q+W
1
(3)反应热(Qv)
反应热 实验测定
Qp=Qv+n RT
等压反应热(Qp)
生成热
ΔH = Qp
2
ΔrHm = ΔrUm + RT
rHӨm = if HӨm(产物) - if HӨm(反应物) rHӨm = ic HӨm(反应物) - icHӨm(产物)
课堂讨论12n1630kjmol11分析下列反应进行的温度条件2ags1270kjmol13hgoshgl910kjmol1980kjmol12通常采用的制备高纯镍的方法是将粗镍在323k与co反应生成的nico经提纯后在约473k分解得到纯镍
化学热力学小结
内能(U) 焓(H = U + PV) 熵(S = k lnΩ 或 Qr/T) 吉布斯自由能(G = H-TS)
5
2、通常采用的制备高纯镍的方法是将粗镍在 323K与CO反应,生成的Ni(CO)4经提纯后在约 473K分解得到纯镍。
323K Ni(s) + CO(g) Ni(CO)4(l) 473K
已知反应的ΔrHm = -161.0 kJ· mol-1, ΔrSm = 420.0 J· mol-1 · K-1,试分析讨论该方法提纯镍的 合理性。
大一化学热力学知识点总结
大一化学热力学知识点总结热力学是研究物质热现象和能量转化规律的科学,广泛应用于化学、物理、材料等学科领域。
作为大一化学学习的重要内容之一,热力学知识点对我们理解化学反应、能量转化等过程起着重要的指导作用。
本文将就大一化学热力学中的几个重要知识点进行总结。
一、热力学基本概念1. 系统和环境:热力学研究的对象称为“系统”,系统的外部称为“环境”。
系统和环境之间通过能量和物质的交换来实现平衡。
2. 热力学状态函数:热力学状态函数与体系的状态有关,与路径无关。
常见的热力学状态函数有内能、焓、熵等。
3. 系统的热力学工作:系统对环境做功或由环境对系统做功,即为热力学工作。
二、热力学定律1. 热力学第一定律:能量守恒定律,即能量不会凭空产生或消失,只能从一种形态转化为另一种形态。
2. 热力学第二定律:热量不会自发地从冷物体传递给热物体,也不会自发地执行不可逆过程。
三、热力学过程1. 等容过程:在等容过程中,体积保持不变,系统对环境做功为零,根据热力学第一定律,内能的变化等于吸热量。
2. 等压过程:在等压过程中,压强保持不变,系统对环境做的是等于外界对系统所做的压力乘以体积的功。
根据热力学第一定律,焓的变化等于吸热量。
3. 等温过程:在等温过程中,温度保持恒定,系统通过吸热和放热来保持温度不变。
根据热力学第二定律,无法实现百分之百的等温过程。
4. 绝热过程:在绝热过程中,系统与环境没有热量的交换。
根据热力学第一定律,绝热过程中内能的变化只与做功相关。
四、常见的熵变计算1. 熵变计算公式:ΔS = ∫(dQ/T)熵变等于系统吸热或放热与温度之比的积分。
2. 熵增原理:孤立系统总是趋向于增加熵,不可逆过程的熵增大于零。
五、热力学平衡热力学平衡是指系统达到稳定状态,不再发生宏观可观测的变化。
平衡可以分为稳定平衡、亚稳定平衡和不稳定平衡。
六、热力学函数1. 内能:内能是系统的总能量,包括系统的热能、势能和动能。
2. 焓:焓是系统的热力学函数,等于系统的内能与压力乘以体积之和。
高三热力学知识点总结
高三热力学知识点总结热力学是物理学的一个分支,研究热量转化为功的能力和与其相关的性质和过程。
在高三物理课程中,我们学习了一些重要的热力学知识点。
本文将对这些知识点进行总结。
1. 理想气体状态方程理想气体状态方程是热力学的基础公式之一,表达了理想气体的状态与温度、压力和体积之间的关系。
它可以表示为:PV = nRT,其中P为气体的压力,V为气体的体积,n为气体的物质的摩尔数,R为气体常数,T为气体的温度。
2. 热力学第一定律热力学第一定律也称为能量守恒定律,它表达了能量在物理系统中的守恒原理。
根据热力学第一定律,能量可以从一个物体传递到另一个物体,但总能量保持不变。
这个定律可以表示为:ΔU = Q - W,其中ΔU表示系统内能的改变,Q表示系统吸收的热量,W表示系统对外界做的功。
3. 热力学第二定律热力学第二定律表达了热量转化为功的方向性原理。
根据热力学第二定律,热量不会自动从低温物体传递到高温物体,而是只能从高温物体传递到低温物体。
这个定律也可以通过熵增定律来表达,熵增定律指出熵在自然过程中总是增加的。
4. 热力学循环热力学循环是由一系列热力学过程组成的过程,最终回到初始状态。
在高三物理中,我们学习了两种常见的热力学循环:卡诺循环和斯特林循环。
卡诺循环是一个理论上的完美热力学循环,它由等温膨胀、绝热膨胀、等温压缩和绝热压缩四个过程组成。
斯特林循环是一种理想化的热力学循环,常用于发动机的工作原理。
5. 热容与比热容热容是一个物体吸收一定量热量时温度的变化程度,可以表示为C = Q/ΔT,其中C表示热容,Q表示吸收的热量,ΔT表示温度的变化量。
比热容是热容和物质质量的比值,可以表示为c = C/m,其中c表示比热容,C表示热容,m表示物质的质量。
6. 相变过程相变是物质由一种相态转变为另一种相态的过程。
常见的相变过程有融化、凝固、汽化、凝华和升华。
在相变过程中,物质吸收或释放大量的潜热,但温度保持不变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
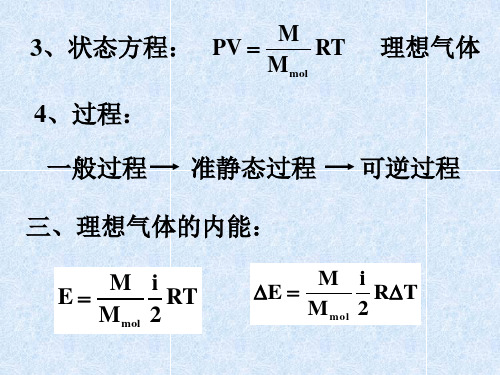
《热力学》课程各章内容小结 Ⅰ 温度、物态方程 一.热力学系统及其平衡态 热力学系统分为孤立系统、封闭系统及开放系统; 系统的平衡态是在没有外界影响的条件下,系统的宏观性质不随时间变化的状态; 状态参量——描述系统平衡状态的宏观物理量:
几何参量(V)、力学参量(p)、化学参量(1n,2n„„)、电磁参量(E,H);
对简单系统,独立变量只有两个(如p、V)。 二.温度与温标 (一)实验表明:如果两个热力学系统同时与第三个系统处于热平衡,则这两个系统必定彼此处于热平衡——热平衡定律(热力学第零定律)。 该定律为科学地建立温度概念提供了实验基础,可证明温度是状态函数。 (二)温标是温度的数值表示法 规定水的三相点温度为K15.273,则定容气体温标为
trVp
pTK15.273,trp为气体在三相点时的压强;
理想气体温标为
trpppTtrlim0K15.273,在理想气体温标确定的温度范围内,与热力学温标T完
全一致。 t(℃)=K15.273T
三.物态方程
均匀物质的物态方程是:0),,(TVpf 或 ),(VpTT 与求物态方程有关的物理量有:
pTVV1——定压膨胀系数
VTpp1——定容压强系数
TTpVV
1——等温压缩系数
因1pVTVTTppV,所以pT 几种物态方程: 理想气体 const/TpV或nRTpV 实际气体的范氏方程 RTbVVapmm2(1mol) 简单固体 pTTTVpTVT)(1)0,(),(000 Ⅱ 热力学第一定律 一.功、热量、内能 (一)准静态过程的功
体积功:VpWdd,BAVVVpWd
表面张力的功:AWdd,21dAAAW 功是过程量。 (二)热量、内能、焓、摩尔热容量 1.热量Q是各系统之间因有温度差而传递的能量,是过程量。 2.内能U是状态函数,Ud一定为全微分;两平衡态内能增量等于绝热过程中外界对系统作的功:SABWUU;
理想气体的内能遵循焦耳定律:)(TUU。 3.焓H的定义为:pVUH H为状态函数,Hd为全微分;在等压过程中,焓的增量等于系统吸收的热量:
QH
4.热容量的定义为:TQTQCTddlim0 定容热容量VVTUC,nCCVmV,——摩尔定容热容量; 定压热容量ppTHC,nCCpmp,——摩尔定压热容量; 对理想气体:nRCCVp,VpCC,1nRCV,1nRCp 0UTCUV,0HTCHp
5.理想气体绝热方程 微分方程:0ddVVpp 积分方程:constpV,或 const1TV,const1Tp(若为常数) 二.热力学第一定律 (一)表达式
有限过程: WQUUAB
微过程: WQUddd (二)应用于循环过程
正循环(热机)效率1211QQQW,对卡诺正循环:121TT
逆循环(致冷机)工作系数WQ2,对卡诺逆循环:212TTT Ⅲ 热力学第二定律 一.两种表述 1.开尔文表述:不可能从单一热源吸热使之完全变成有用的机械功而不因引起其它变化; 2.克劳修斯表述:不可能把热量从低温物体传到高温物体而引起其它变化。 开氏表述揭示了功热转换的不可逆性,克氏表述揭示了热传递的不可逆性。两种表述是等效的。 二.卡诺定理 1.表述:所有工作于两个一定温度间的热机,以可逆机效率最高,即
1211TTQW=不可逆 2.推论:所有工作于两个一定温度间的可逆热机,其效率相等,即 1212111TTQQQW=可逆 三.克劳修斯等式与不等式 0TQd,“=”——可逆循环,“<”——不可逆循环;
只经历两个热源:02211TQTQ,经历n个热源:01niiiTQ。 四.状态函数——熵、熵增加原理 1.熵的定义式 BAABTQSSd,积分路径可以是由初态A到终态B的任意可逆过程,熵为广延量; 熵是状态函数,其全微分:TQSdd 2.熵增加原理 系统从一平衡态经绝热过程到达另一平衡态,它的熵永不减少,如果过程可逆,则熵不变;如果过程不可逆,则熵增加。
0ABSS 对孤立系统,系统的状态只能向熵增加的方向进行。 五.热力学第二定律数学表达式
1.微分式:TQSdd,WSTUddd
2.积分式:BAABTQSSd 六.热力学基本方程 VpSTUddd,该式为相邻两个平衡态状态函数U、S、V的增量间的关系。
Ⅳ 均匀物质的热力学函数 一.热力学函数 主要热力学函数:内能U,熵S,物态方程,焓H,自由能F,吉布斯函数G,其中U,S和物态方程为基本热力学函数。
1.内能U,全微分:VpSTUddd
麦氏关系:VSSpVT 2.焓pVUH,全微分:pVSTHddd 麦氏关系:pSSVpT 3.自由能TSUF,全微分:VpTSFddd 麦氏关系:VTTpVS 4.吉布斯函数pVTSUG,全微分:pVTSGddd 麦氏关系:pTTVpS 二.特性函数 当均匀系统的某个特性函数确定后,其它热力学函数可由它求微商得到,特性函数有特
定的独立变量,如),(VSU,),(pSH,),(VTF,),(pTG。
两个重要的特性函数:①自由能),(VTF TFS,VFp,TFTFU(吉布斯—亥姆霍兹方程) ②吉布斯函数),(pTG
TGS,pGV,pGpTGTGU(吉布斯—亥姆霍兹方程) 三.热力学函数的物理意义 1.WTSFddd 等温过程可得:FWdd,即系统对外作的功不会大于其自由能的减少。换句话说,系统在等温过程中消耗一定自由能对外所作的功,以可逆过程对外作的功为最大——最大功原理。
2.1ddddWpVTSG(1dW为外界对系统作的非体积功)
等温等压过程可得:GWdd1,即等温等压过程中,系统对外作的非体积功不会大于其吉布斯函数的减少。 四.热力学辅助方程 1.STd方程
dVTpTdTCSTVVd , ),(VTSS
dpTVTdTCSTppd , ),(pTSS 2.能态公式与焓态公式 pTpTVUVT,pTTVTVpH 3.热容差公式 pVVpTVTpTCC 五.致冷效应 (一)节流膨胀致冷 1.气体节流过程是等焓过程;
2.节流过程的焦—汤系数:HpT,①0致冷效应,②0致热效应,③0气体温度称转变温度;
3.焦—汤系数的表达式:
VTVTCpp1,或1TCVp (二)绝热膨胀致冷 气体绝热膨胀过程,熵不变。
0pppSCVTTVCTpT,随着体积膨胀压强降低,气体的温度总下降。
Ⅴ 相平衡 一.单元系的复相平衡 (一)平衡判据 1.熵判据:一个系统在体积与内能不变的情况下,对于各种可能的变动,平衡态的熵最
大。平衡条件0S,稳定性条件02S。 2.自由能判据:一个系统在温度与体积不变的情况下,对于各种可能的变动,平衡态的自由能最小。平衡条件0F,稳定性条件02F。 3.吉布斯函数判据:一个系统在温度与压强不变的情况下,对于各种可能的变动,平衡态的吉布斯函数最小。平衡条件0G,稳定性条件02G。 (二)平衡条件与平衡稳定性条件 1.平衡条件:
TT(热平衡条件),pp(力学平衡条件),(相变平衡条件) 2.平衡稳定性条件
以T,V为变量时,0VC,0TVp ;
以T,p为变量时,0pC,0SVp。 3.开放系统的热力学方程 nVpSTUdddd,npVSTHdddd
nVpTSFdddd,npVTSGdddd (三)单元系的复相平衡 1.克拉珀龙方程
)(ddmmVVTLTp,L——相变潜热,mV——相摩尔体积,mV——相摩尔
