第四章 炔烃 二烯烃 IR
第四章 炔烃 二烯烃 红外光谱
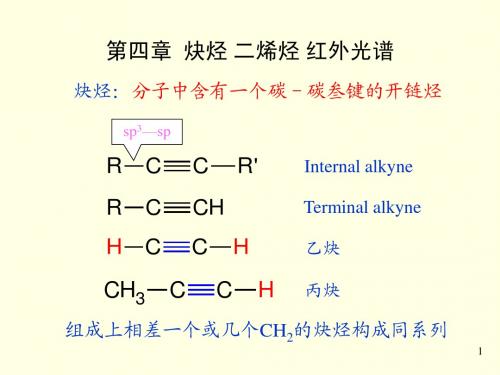
炔烃:分子中含有一个碳-碳叁键的开链烃
sp3—sp
R R H
CH3
C C C
C
C CH C
C
R'
Internal alkyne Terminal alkyne
H
H
乙炔 丙炔
组成上相差一个或几个CH2的炔烃构成同系列
1
炔烃的结构-sp杂化轨道
杂化
2
乙炔的结构-轨道重叠成键图
1,3-丁二烯的分子轨道图
反键轨道
成键轨道
29
共轭效应的解释-氢化热与键长
π键
大π键
30
共轭效应的解释-1,4-加成
Allylic: next to a double bond
31
烯丙基型碳正离子的轨道结构
32
烯丙基型碳正离子的共振结构表达式
The true structure is the combination of the two resonance hybrid A mule is the hybrid of a horse and a donkey
有机化学的四大光谱
质谱 红外光谱 核磁共振 紫外光谱
54
分子中化学键的振动形式-伸缩振动
(伸缩振动)
1 % ν= f ( m1 + m2 ) 2π c m1m2
1 % ν (cm ) = λ (cm) (波数)
−1
55
分子中化学键的振动形式-弯曲振动
(面内) (弯曲振动)
剪式(Scissoring)
7
酸性的比较-负离子的稳定性
8
负离子稳定性对酸性强弱的影响
9
炔烃的反应-催化加氢
第四章 炔烃和二烯烃

4.1 炔烃
二、炔烃的命名 1. 衍生物命名法
衍生物命名法只适用于简单的炔烃。以乙炔为母体,将其它的炔 烃看作乙炔的衍生物。
例如:
4.1 炔烃
2. 系统命名法
与烯烃的命名类似 ① 要选择含有 C≡C 的最长碳链为主链; ② 编号从最距离叁键最近的一端开始,并用阿位伯数字表示叁键的 位置。例:
837KJ/mol 0.120nm
611KJ/mol 0.134nm 0.108nm
( 3x347=1041)
347KJ/mol
0.154nm 0.110nm
H C C H H2C CH H
H3C C H2 H
原因: ① -C≡C-中有1个σ和2个π键; ② sp 杂化轨道中的 s 成份多。(s 电子的特点就是离核近,即 s 电子
CNa CNa + 2CH3I
CH3C CC2H5 + NaBr
CH3C CCH3 + 2NaI
炔化物作为亲核试剂,也可以与醛酮 发生亲核加成反应,得到 羟基炔化合物:
4.1 炔烃
(3) 过渡金属炔化物的生成及炔烃的鉴定
CH CH + 2Ag(NH3)2NO3 CH CH + 2Cu(NH3)2Cl
4.1 炔烃
③分子中同时含有双键和参键时,先叫烯后叫炔,编号要使双键和
参键的位次和最小。
1 2 3 45
CH C-CH=CHCH3
3-戊烯-1-炔
6 54 3 2 1
CH C-CH=C-CH=CH2
3-乙基-1,3-己二烯-5-炔
CH2CH3
④若双键、叁键处于相同的位次供选择时,优先给双键以最低编号。
4.1 炔烃
《有机化学》第4章 炔烃和二烯烃

5–甲基–1,3–己二烯
若有顺反异构体,还需标明其构型。例如:
纯乙炔是无色、无臭的气体,可溶于水,在0.1Mpa下乙炔溶于等体积 的水中,在丙酮中的溶解度更大,常压下1体积丙酮能溶解20体积的乙炔, 在1.2Mpa下则能溶解300体积乙炔。乙炔易爆炸,高压下的乙炔、液态或 固态的乙炔受到敲打或碰击时容易爆炸。乙炔的丙酮溶液稳定,故把乙炔 溶于丙酮中可避免爆炸的危险。为了运输和使用安全,通常把乙炔在 1.2Mpa下压入盛满丙酮浸润饱和的多孔性物质(如硅藻土,软木屑或石棉) 的钢筒中。
图4-1 乙炔分子的直线形结构
乙炔分子中的C原子是以一个三键和一个单键分别与另一个C原子和H原
子相连接的。
2023/6/13
2
2.炔烃的异构和命名
炔烃的异构是由于碳链不同或官能团三键的位置不同引起的。三键是直线型结 构,炔烃没有顺反异构体,因此,炔烃的异构现象比烯烃简单。
炔烃的系统命名法是以含有叁键的最长碳链作为主链,把支链当作取代基来命 名。
炔烃被高锰酸钾氧化后高锰酸钾溶液的紫色褪去,生成棕褐色的二氧
化锰,因此通过高锰酸钾溶液的紫色褪去也可以用来检验炔烃,也可用来 推断三键的位置。
2023/6/13
8
3.金属炔化物的生成 ⑴ 炔钠的生成——炔烃的制备
在液氨中,用氨基钠(1 mol )处理乙炔是实验室中制备乙炔钠常用的方法。
氨基钠
乙炔钠
第四章 炔烃和二烯烃
第四章炔烃二烯烃

炔烃
掌握炔烃的命名、结构、同分异构现象; 掌握炔烃的物理性质; 掌握炔烃的化学性质。
二烯烃
掌握二烯烃的分类、命名; 掌握1,3-丁二烯的结构; 了解1,3-丁二烯结构的分子轨道理论; 掌握共轭二烯烃的化学性质; 掌握共轭效应与超共轭效应。
第一节 炔烃
一、炔烃概述 二、炔烃的物理性质 三、炔烃的化学性质 四、炔烃的制备
Na,3(N l) H
BrEt
EtCCC3H
CCC3H
BrBr
➢ 从四卤代物制备H3CCHC2HKoOrHN,2aENtHO H 3CH C,ChHeat
BrBr H3CCCHZn H3CCCH
BrBr
第二节 二烯烃
通式:CnH2n-2,与炔烃属于官能团异构。
1. 二烯烃的分类
➢ 孤立二烯烃: H 2 CCC H 2C HC H 2H 双键之间相隔一个以上的CH2,彼此影响较小,与单烯烃类似。
能量
➢三种二烯烃的稳定性比较: C>A>B
B
HB= - 297KJ/mol A
C
HA= - 252KJ/mol
HC=-226KJ/mol
反应进程
2 . 丁二烯的结构
(1) 表观数据
变短 0.147nm(0.154nm)
0.137nm(0.134nm) 变长
键长平均化
(2) 共价键理论的解释 ➢ 四个碳原子均为sp2杂化,碳碳之
较小,sp杂化轨道较短,成键时电子云偏向sp轨
道,电负性比较:sp>sp2>sp3
z y
➢ 没有杂化的两个p轨道与sp杂化轨道互成90o夹角(如图)。
(2)、乙炔的结构
➢ 一个(Csp-Csp)键;
华中科技大学有机化学第四章炔烃与二烯烃
按分子轨道理论,四个p轨道可以组成四个分子轨道.
组合得到二个成键轨道和两个反键轨道。 填充有电子的能量最高的分子轨道,称作最高已占轨道,用HOMO (highest occupied mo1ecular orbital)表示。 未填充电子的能量最低分子轨道,称作最低未占轨道,用LUMO (lowest unoccupied mo1ecular orbital)表示。 1,3-丁二烯分子中π电子云的分布并不局限于C(1)-C(2)和C(3)-C(4)之间,C(2)和C(3)之间也有部分π电子云,因而形成了离域的大π键。
炔烃 炔烃含有碳碳三键,由两个π键和一个σ键组成。三键的碳原子是sp杂化,s成分大,所以碳碳三键比单键和双键都短,也使炔烃具有更大的极性。 炔烃能发生亲电加成反应(包括加卤素、加卤化氢、加水等)、硼氢化氧化反应、加氢反应、氧化反应,这些反应与烯烃的相关反应非常相似。在进行亲电加成反应时,产物也符合马氏规律,加过氧化物,产物为反马氏规律产物。炔烃的亲电加成反应比烯烃的慢,主要是因为乙烯基正碳离子中间体不稳定。 与乙烯最大的区别是能与强碱如NaNH2生成炔化物,也能与一些重金属盐在氨水溶液中生成炔化物沉物与卤代烷反应可以生成更高级的炔烃。
4.4 共轭二烯烃的结构和性能
01
02
03
04
05
一、共轭二烯烃的结构
以1,3-丁二烯为例,和简单的烯烃双键一样,每个双键的碳为sp2杂 化,没有杂化的p轨道相互平行排列,形成一个大π键。按照这种成键 方式,所有原子都在一个平面上。
1955年,工业上使用Ziegler—Natta催化剂,使1,3-丁二烯定向加成聚合,得到单纯的(Z)-1,4-聚丁二烯,称为顺丁橡胶,其性能优良,与天然橡胶不相上下。用 2-甲基-1,3-丁二烯(异戊二烯)在Ziegler—Natta催化剂作用下,聚合得到主要为Z构型的聚合物,其结构和性能与天然橡胶几乎完全相同,称为合成天然橡胶。
第四章炔烃和二烯烃全解

1
2
CH2
CH CH2 C CH
1-戊烯-4-炔
3
4
5
应命名为 3-戊烯-1-炔,而不命名为 2-戊烯-4-炔。
H3C C C CH2CHCH3
H3C C C C CH H H
5-乙基-1-庚烯-6-炔
not 3-乙基-6-庚烯-1-炔
(CH3)2CH C C H
H CH2C CH
(E)-6-甲基-4-庚烯-1-炔
CH3C CNa
HBr ROOR CH3CH2CH2Br
CH3C
CH
H2
Lindlar
CH3CH=CH2
CH3C
H2 Ni
CNa CH3C lig . NH3
CCH2CH2CH3
CH3CH2CH2CH2CH2CH3
3、与重金属盐的反应
♦ 1- 炔烃与银氨溶液反应,立即生成白色的炔化银沉 淀;与氯化亚铜氨溶液反应则生成砖红色的炔化亚 铜沉淀,只有端炔有此性质,是 区别端炔与非端炔 及烯烃的方法。
[Ag(NH3)2]
+
R C CH
R C CAg
炔化银
白色沉淀
HC
CH
[Cu(NH3)2]
+
CuC
CCu
砖红色沉淀
乙炔亚铜
区别乙烷、乙烯、乙炔
CH CH CH2=CH2 CH3CH3
Ag(NH3)2+
白色 ( ( ) )
(CH CH )
Br2/CCl4
褪色(CH2=CH2) ( -)
爆炸品——炔化银
炔烃的命名
炔烃的普通命名法是将其他炔烃看成乙炔 的衍生物命名。例如: (CH3)3C–C≡C–H 叔丁基乙炔 (CH3)3C–C≡C–C(CH3)3 二叔丁基乙炔 F3C–C≡C–H 三氟甲基乙炔 系统命名法与烯烃相似,只是将“烯”字 改为“炔”字。
第四章 炔烃和二烯烃
思考:炔烃是否有顺反异构? 思考:炔烃是否有顺反异构?
杂化的碳上只连接一个基团。 无!因为炔烃的sp杂化的碳上只连接一个基团。
(二) 物理性质
Physical Properties
简单炔烃的沸点、 简单炔烃的沸点、熔点以及密度比碳 原子数相同的烷烃和烯烃高一些。 原子数相同的烷烃和烯烃高一些。炔烃 分子极性比烯烃稍强。炔烃不易溶于水, 分子极性比烯烃稍强。炔烃不易溶于水, 而易溶于石油醚、乙醚、 而易溶于石油醚、乙醚、苯和四氯化碳 中。
酸 性 逐 渐 增 强
C-H键中,C使用的杂化轨道 轨道成分越多,H的酸性越强。 键中, 使用的杂化轨道 轨道成分越多, 的酸性越强 使用的杂化轨道S轨道成分越多 的酸性越强。 键中
碳氢化合物中H的酸性顺序: 的 C H> sp
HC CH Na
C H> sp
2
C H sp3
HC CNa
H2
生成的炔钠是一个亲核试剂
1. 分别用纽曼投影式和锯架式画出1-氯丙烷 分别用纽曼投影式和锯架式画出1 的优势构象。 的优势构象。
CH3CH2CH2Cl
CH3 H H Cl H H
CH3 H H Cl H H
第四章
炔烃和二烯烃
第一节
炔烃( 炔烃(alkynes) )
(一) 结构和命名
C C
H C C H 线型分子
一个σ键两个π 一个σ键两个π键
聚集二烯 二烯烃 共轭二烯 隔离二烯
CH2=C=CH2 CH2=CH-CH=CH2 CH2=CH-CH2-CH=CH2
聚集二烯: 聚集二烯
sp2
H C=C=C H
H H
CH2=C=CH2 sp
是一类少见的结构,聚集的双键使分子能量高 是一类少见的结构 聚集的双键使分子能量高。 聚集的双键使分子能量高 隔离二烯: 隔离二烯: 分子中的两个双键缺少相互影响, 分子中的两个双键缺少相互影响,其性质与 单烯烃无差别。 单烯烃无差别。 共轭二烯: 共轭二烯: 分子中两个双键存在相互影响, 分子中两个双键存在相互影响,共同组成共轭 体系,含共轭体系的多烯烃称为共轭烯烃。 体系,含共轭体系的多烯烃称为共轭烯烃。
第四章 炔烃和共轭二烯烃
CH3C CCH2CH2CH3
末端炔烃
鉴别
CH CH CH CH Ag(NH3)2NO3 Cu(NH3)2Cl AgC CAg 白 CuC CCu 红
过渡金属炔化物
14
末端炔烃与醛酮的加成
CH CH + KOH CH C CH2O H2 O O CH CH + CH3 C CH3 OH CH3 C C CH CH3
RCH 2CHX 2
偕二卤代烷
RCH CHX
KOH, EtOH 或 NaNH2, 矿物油
RC CH
32
Example
33
作 业
P59: 4.2 4.3 P60: 4.5 P62: 4.7
34
4.6 共轭二烯
4.6.1 二烯烃的分类 4.6.2 共轭二烯的特性 4.6.3 共轭二烯的化学性质
35
末端炔烃酸性比水、醇弱,但比氨强 HC≡CH >CH2=CH2>CH3CH3
sp sp2 sp3
12
金属炔化物的生成
CH CH + NaNH2 NH3(l) - 33℃ CH CNa NaNH2 NaC CNa
合成
CH CNa (1) NaNH2 (2) CH3I
CH3CH2CH2Br
CH CCH2CH2CH3
CH3CH2CHO + CH3CHO
30
8. 乙炔的聚合
2 HC CH
CuCl, NH4Cl HCl
CH2
CH
C
CH
乙烯基乙炔
31
4.5 炔烃的制备
• 炔化物的烃化
RC CH NaNH2 RC CNa R'X RC CR'
• 二卤代烷去卤化氢
专业 有机化学第 4 章 炔烃 二烯烃
(2)编号:主链的编号从官能团(双键、叁 键)最近的一端编号;若双键、叁键的位次相 同,则从双键一端开始编号。
1 2 3
(3)书写名称:与烯烃或炔烃相同。例如 3戊烯 -1炔 CH3CH=CHC CH (不叫2-戊烯-4-炔)
CH2=CHCH2CHC CCH3 4-甲基-1-庚烯-5-炔 CH3 1-丁烯-3-炔 CH2=CHC CH
Hg2+, H2SO4
O [H C H CH ] O-H CH3-C
HC≡ CH
H2O
~100℃
H
该反应是库切洛夫在1881年发现的,故称为 库切洛夫反应。其他炔烃水化时,则变成酮 。
CH3C ≡ CH + H2O
HgSO4 H2SO4 HgSO4 H2SO4
[CH3-C=CH] OH C CH3 O
91%
CH3-C-CH3 O
C ≡ CH + H2O
2016/2/20
C、汞盐的毒性大,环境污染严重。 5、与HCN加成 乙炔在Cu2Cl2-NH4Cl的酸性溶液中与HCN加成
HC CH
+HCN
Cu2Cl2 / NH4Cl CH2=CHCN
二、氧化反应 炔烃的氧化反应发生在碳碳叁键。
2016/2/20
4-辛炔
(E)-4- 辛烯
(97%)
2016/2/20
2、与X2加成
炔烃与X2加成,反应速度比烯烃的加成速 度慢,炔烃与X2加成可以得到二卤代物、四卤 代物。例如:
CH CH Br2(H2O) BrCH=CHBr Br2 Br2CHCHBr2
Br R-C ≡ C-R' Br2 R-C=C R'
Br
第4章-2 不饱和烃-炔烃及二烯烃
2. 还原反应
(1) 催化加氢反应
炔烃的还原反应可以还原到烯烃, 也可以还原到烷烃。
炔烃加氢反应也需要催化剂,可以加一分子氢,也可以加两分 子氢,实际应用中多数控制在加一分子氢。
如果使用钝化催化剂,可以得到顺式烯烃:
CH3CH2 CH3CH2C CCH2CH3 + H2 钝化催化剂 C C H H CH2CH3
H3 C C C CH3 HCI CI HCI H3 C C C H CH3 CI CH3 CH2C CH3 CI
乙炔与HCl加成需要有催化剂才能顺利反应,是合成氯乙烯 的工业方法: HgCI2/C + HCI HC CH H2C CHCI 溴化氢也能与炔烃加成:
CH3CH2CH2CH2C CH + HBr 无水 Fe
对称内炔烃 不对称内炔烃
例如: NaC
R1C
R C R1 C
+ R2
炔烃的重要合成方法之一
3.过渡金属炔化物的生成
乙炔、端炔烃能与硝酸银或氯化亚铜的氨溶液反应,生成白色 炔化银或砖红色炔化亚铜沉淀,可用来鉴定乙炔和端炔的存在:
白色 砖红色
乙炔 和 端炔 的特征反应
干燥的炔化银、炔化亚铜易爆炸。 20
(2)亲核加成反应的机理:
CH3OH + -OH HC CH + CH3O
以乙炔与甲醇在氢氧化钾催化下反应为例说明: CH3O + H2O
慢
快
HC C OCH3 H H2C C OCH3 + CH3O H
12
- HC C OCH + CH OH 3 3 H
4.6.2 氧化和还原反应
1. 氧化反应
炔烃经KMnO4或臭氧氧化后再水解,在叁键 处断裂,生成相应的酸:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章 炔烃、二烯烃 二、用系统命名法或衍生物命名法命名下列化合物。 1.(CH3)3CCCCH2CH
3
2.HCCCH2Br
3.CH2=CHCCH
4.CH2=CHCH2CH2CCH
5.CH3CHClCCCH2CH
3
6.CH3CCC=CHCH2CH
3
CH=CH2
7. 三、写出下列化合物的构造式。
CHCCH2CHCH3
CH3
CHCC=CHCH
3
CH3
(CH3)2CHCCCH(CH3)
2
CHCCH2CCHCH=CH2
CH3
CH2=C
CH3CH2CCCCH
3
CH3
CH3
H2C
2,2-二甲基-3-己炔 (乙基叔丁基乙炔) 3-溴-1-丙炔
1-丁烯-3-炔
1-己烯-5-炔
2-氯-3-己炔
4-乙烯基-4-庚烯-2-炔
1,3,5-己三烯
4-甲基-1-戊炔
3-甲基-3-戊烯-1-炔
二异丙基乙炔
1,5-己二炔
异戊二烯
乙基叔丁基乙炔
四、写出1-丁炔与下列试剂作用的反应式。 CHCCH2CH3KMnO4CO2+CH3CH2COOHCHCCH2CH3+
H
2
PtCH3CH2CH2CH3
CHCCH2CH3
CHCCH2CH3
CHCCH2CH3
CHCCH2CH3Br2HC=CBrBrCH2CH3+Ag(NH3)2OHAgCCCH2CH3+CuClCuCCCH2CH3+H2OHgSO4/H2SO4CH3CCH2CH
3
O
五、完成下列反应式。
CH3CCCH3
2CH3COOHCH3CH=CHCH3
Br2/CCl4
CH3
Br
BrCHCHCH3
2KOHCH3CCCH3
H2SO4,H2O,HgSO4
CH3CCH2CH
3
O
六、以反应式表示以丙炔为原料,并选用必要的无机试剂,合成 下列化合物。
CHCCH3+
H2O
HgSO4,H2SO4
CH3COCH3
CHCCH3+
H
2
Lindlar
CH2=CHCH3HBrCH3CHCH3
Br
1.热高锰酸钾水溶液
2.H2/Pt
3.过量Br2/CCl4 低温
4.硝酸银氨溶液
5.氯化亚铜氨溶液
6.H2SO4,HgSO4,H2O
热高锰酸钾
硝酸银氨溶液 不反应
1.丙酮
2.2-溴乙烷
H2 Lindlar 醇 七、完成下列反应式。 1.CH2=CH-CH=CH2+
CH2=CHCHO
CHO
2.CH2=CHCH=CH
2+
COO
COCO
OCO
3.CH2=CHCH=CH
2+CH2=CHCN
CN
4.CH2=CCH=CH2Cl[CH2C=CHCH2]
n
Cl
聚合 CHCCH3+
CHCCH3+H2LindlarCH2=CHCH32HBrCH3CH3BrCBrB2H6, 1.2.H2O2,NaOHCH3CH2CH2OH+NaCH3CCNaCH3CCH
CH3CCH+H2LindlarCH3CH=CH2
HBr/ROORCH3CH2CH2Br
CH3CCH3CH2CH2Br+CH3CCNaCCH2CH2CH3
2H2/PtCH3CH2CH2CH2CH2CH3
3.2,2-二溴丙烷 4.丙醇 5.正己烷
加热 八、指出下列化合物可由那些原料通过双烯合成而得。 1.CH2=CH=CH2+
CHCH
2.CH=CH22
CH2=CHCH=CH
2
CH=CH2
3.CH3
CNCH3
CH2=CCH=CH2+
CH2=CHCN
CH3
CN
九、以反应式表示以乙炔为原料,并可选用必要无机试剂合成下列化合物。
解: CHCH+H2LindlarCH2=CH2
HBrCH3CH2Br
CHCH+NaCH
Na
CH3CH2BrCHCCH2CH3
HgSO4,H2SO4,H2OCH3COCH2CH3
H2/PtCH3CH2CHCH3
OH
CH3CH2CHCH3
OH
1.
2.CH3CH2CCH
3
Cl
ClCH3CHCCH+2HClCH3CH2CCH3
Cl
Cl3.CH3CH2CH2CH2Br
CH3CH2CH=CH2HBr+
ROOR
CH3CH2CH2CH2Br
解解解十、以四个碳原子以下烃为原料合成下列化合物。 1.
OCHCNa+
CH3CH2CH2CH2Br
CHCCH2CH2CH2CH
3
HgSO4,H2SO4,H2O
O2.
O
CHCNa+
CH2=CHCH2BrCHCCH2CH=CH
2
HgSO4,H2SO4,H2OCH3CCH2CH=CH2
O
CH2=CHCH=CH2
O
3.
ClClCN
CH2=CHCH=CH2+CH2=CHCNCN
Cl2
Cl
ClCN
十一、用化学方法区别下列各组化合物。 1.乙烷、乙烯、乙炔 解 乙烷 乙烯 乙炔 Br2/CCl4 不变 褪色 褪色
解解:
解: 硝酸银氨溶液 不变
2.CH3CH2CH2C三CH和CH3C三CCH3 解:分别加入硝酸银氨溶液,有炔银沉淀的位1-丁炔。 十二、试用适当的化学方法将下列混合物中的少量杂志除去。 1, 1, 除去粗乙烷中少量的乙炔。 解:将混合物通入硝酸银的氨溶液,乙炔生成乙炔银而沉淀除去。 2, 2, 除去粗乙烯中的少量乙炔。 解:将混合物进行Lindlar催化加氢,则乙炔变为乙烯。 十三、 1. 1,3-丁二烯和溴化氢的1,2-加成和14-加成,那种速度快?为什么? 解:1,2-加成速度比1,4-加成速度快。因为1,2-加成生成的中间体稳定,说明活化能低,反应速度快。
CH2=CHCH=CH2
HBr
CH3CH+CH=CH2
BrCH3CHCH=CH2
CH3CH=CHCH2
+
Br-Br-CH3CH=CHCH2Br
1,2-加成生成的中间体正碳离子为P-л共轭和有三个C-H键与其超共轭,而1,4-加成的中间体比其少三个C-H键超共轭。 2.为什么1,4-加成产物比1,2-加成产物稳定? 解:1,2-加成产物有一个C-H键与双键超共扼,而1,4-加成产物有五个C-H键与双键超共扼。与双键超共扼的C-H键越多,产物越稳定。
1,4-加成 1,2-加成
