物理化学B
物理化学知识点(全)
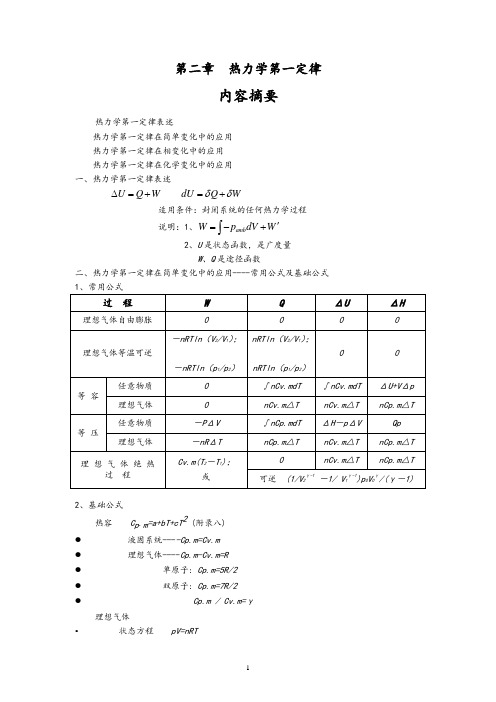
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物理化学试题及答案重点

选择题1.下面的表达中违背平衡移动原理的是(A) 升高温度平衡向吸热方向移动 (B) 增加压力平衡向体积缩小的方向移动(C) 参加惰性气体平衡向总压力减少的方向移动(D) 降低压力平衡向增加分子数的方向移动答案:C。
参加惰性气体平衡向总压力增大的方向移动2.要使一个化学反响系统在发生反响后焓值不变, 必须满足的条件是(A) 温度和内能都不变 (B) 内能和体积都不变 (C) 孤立系统 (D) 内能, 压力与体积的乘积都不变答案:D。
因ΔH=ΔU+Δ〔pV〕3.在等温等压下,当反响的∆r G m = 5kJ·mol-1时,该反响能否进行(A)能正向自发进行(B) 能逆向自发进行(C)不能推断(D)不能进行答案:C。
应该用∆r G m 推断而不是∆r G m 。
4.已知反响 2NH3 = N2 + 3H2,在等温条件下,标准平衡常数为0.25,那么,在此条件下,氨的合成反响1/2 N2 + 3/2 H2 = NH3的标准平衡常数为:(A) 4 (B)0.5 (C) 2 (D)1答案:C 。
5.反响 2C(s) + O 2(g) ←→ 2CO(g),其∆r G m /(J ·mol -1) = -232600 - 167.7T /K ,假设温度升高,则:(A) ∆r G m 变负,反响更完全 (B) K p 变大,反响更完全 (C)K p 变小,反响更不完全 〔D 〕无法推断 答案:C6.对于气相反响,当体系总压力p 变化时(A) 对K f 无影响 (B) 对K r 无影响 (C) 对K p 无影响 (D) 对K f 、K r 、K p 均无影响答案:A 。
理想气体的K p 不受压力的影响而真实气体的K p 将随压力而变。
7.理想气体反响CO(g)+2H 2(g) = CH 3OH(g)的∆r G m 与温度T 的关系为:∆r G m = -21660+52.92T ,假设要使反响的平衡常数K p >1,则应操纵的反响温度:(A) 必须低于409.3℃ (B) 必须高于409.3K (C) 必须低于409.3K (D) 必须等于409.3K 答案:C 8.某化学反响在298K 时的标准吉布斯自由能变化为负值,则该温度时反响的K p 将是:(A)K p = 0 (B) K p < 0 (C) K p > 1 (D) 0 < K p < 1 答案:C 。
物理化学公式及概念

摘自南大物理化学第五版第1页物理化学公式及概念一、气体222111., , 33i i in u p mnu pV mNu u u n===å为根均方速率为根均方速率,,2.,(BBARpV nRT Nk T k N == =理想气体状态方程:玻尔兹曼常数)123.Dalton i i p p p p x p =++= 道尔顿()分压定律:…………;;分压:在同一温度下,各别气体单独存在,并占有与混合气体相同体积时的压力,3334., , 22B t t m B k TE k T E RT u m ===21.5*2245.()2mv kT m Maxwell f v e v kT -æö =ç÷p èø麦克斯韦麦克斯韦(()速率分布定律:06.()lnp MghBoltzmann p RT=-玻尔兹曼分布:7.A BB Av M v M =气体扩散定律:()()228.), m m m a a van der Waals p V b RT p V nb nRT V V æöæö+-=+-=ç÷ç÷èøèø范德华范德华((方程方程::二、热力学第一定律1. 隔离系统(孤立系统)、封闭系统、敞开系统2. 广度性质、强度性质3. 热动平衡、力学平衡、相平衡、化学平衡4. 等温过程、等压过程、等容过程、绝热过程、环状过程5.W p dVd =-体外体积功:6.,U Q W dU Q W D =+=d +d 7. 功与过程、准静态过程、可逆过程8.,pdefHU PV H Q +D =焓:化学分析的重量分析是多少?通过适当的方法如沉淀、挥发、电解等使待测组分转化为另一种纯的、化学组成的固定的化合物而与样品中其他组分得以分离,然后称其质量,根据称得到的质量计算待测组分的含量摘自南大物理化学第五版摘自南大物理化学第五版p v Q Q H U d d -==¶¶æöæö====ç÷ç÷2211pCp V p V -cT D En n def d d ooorBrHHn D D oo o o o H Ho rmHD R Q d =max 21R W Q V p -化学分析有哪些分类?化学分析根据其操作方法的不同,可将其分为滴定分析(比如摘自南大物理化学第五版摘自南大物理化学第五版H D (相变)o2,p oo C dT D *2()f R T M *2()b R T M RTP defC S dp HD ooClausius -克劳修斯21111vap m sub mH H p D æöæD 摘自南大物理化学第五版摘自南大物理化学第五版vap m H D oo 2()ln 11o o or m r moH H K T d K æöD D =Þ=-ç÷or mo H D =ò=´´按法拉第定律计算所需理论电荷量电极上产物的实际质量;11defI Gl k), A c 11mooc cL 1def2;lg oA z z II I+--摘自南大物理化学第五版摘自南大物理化学第五版0.059ooRT[氧化型氧化型]][氧化型氧化型]]E E E E ¶¶¶æöæöæöç÷ç÷ç÷¶æöç÷oRT +[氧化型氧化型]](),x s E E F-11[]1(B defdp dd B rx 具有简单级数反应的速率公式和特征:级数级数 反应类型反应类型 速率公式的定积分式速率公式的定积分式浓度与时间的线性关系线性关系半衰期t 1/2速率常数k 的单位的单位一级一级A →产物→产物 1lnak ta x =-1ln~ta x - 1ln 2k (时间)-1二级二级A+B →产物→产物(a=b) 211k ta x a -=-1~t a x -21k a(浓度)-1·(时间)-1 A+B →产物→产物 (a ≠b)21()ln ()b a x k t a b a b x -=--()ln ~()b a x t a b x --1/21/2()()t A t B ¹ 三级三级A+B+C →产物→产物322111k t éù-=êú21~t2331(浓度)-2·-1(a b c) 2()a x a -ëû()a x -32k a(时间) 零级零级表面催化反应表面催化反应x k t =~x t2ak (浓度)·(时间)-1摘自南大物理化学第五版摘自南大物理化学第五版n 级(n ≠1) 反应物→产物反应物→产物111111()n n kt n a x a --éù-=êú--ëû11~()n t a x -- 1()n A A a -为常数 (浓度)1-n· (时间)-11/2''1/21/2'lg t t t a a æöç÷æöèø=+ç÷æöç÷1e e e x x a x k -==11lnk x a==2121211(ln ln k k a k k eek k k =-+æö-=ç÷2ln 11a E a a E E k d k-æö12[][][],,11111,m M r k k E S r S K -+====与呈线性关系第6页。
物理化学名词解释归纳

一.名词解释1.离子迁移数:是指在一电解质溶液中各种离子的导电份额或者导电百分数。
2.独立组分数:用以确定平衡体系中所有各相组成所需的独立物质的最少数目称为独立组分数。
3.摩尔燃烧焓:是指1mol有机化合物在指定温度标准大气压下完全燃烧生成稳定的产物时的反应热。
4.等电点:蛋白质所带的正负电荷数相等即净电荷为0时的pH称为蛋白质的等电点。
5.扩散:物质从高浓度区自发向低浓度区迁移,使其分布趋向均匀的过程称为扩散。
6.对峙反应:也称可逆反应,是指在正方向和逆方向上可以同时进行的反应,且正逆反应速率的大小可相比拟。
7.可逆过程:是指系统内部及系统与环境之间每一瞬间都接近于平衡态的过程。
8.摩尔电导率:表示在两个相距1m的平行电极间,1mol电解质溶液所具有的电导。
9.HLB值:即亲水亲油平衡值,用来表示表面活性物质的亲水性和亲油性的相对强弱。
10.乳状液转型:是指在外界某种因素的作用下,乳状液由O/W型变成W/O型,或者由W/O型变成O/W 型的过程。
11原子发射光谱:是指由物质内部运动的原子和分子受到外界能量后而得到的光谱。
12.自由度:在不引起旧相消失和新相生成的前提下,可以在一定范围内变动的独立变量如浓度温度压力的数目称为自由度。
13.离子选择电极:是指具有离子感应膜,可以把溶液中某种离子的活度转换成相应电势的电极,它是某离子的指示电极。
14.负吸附:溶液的表面张力随着溶质的加入儿升高,表面过剩为负,称为负吸附。
15.吸附平衡:当气体分子在吸附剂表面聚集与逃离吸附剂表面两个过程的速率相等时,体系达到平衡,称为吸附平衡。
16.乳状液:是由一种或几种液体以小液滴的形式分散于另一种与其互不相容的液体中形成的多相分散体系。
二.简答题1.简述可逆过程的特点.(1)可逆过程是由一连串无限接近平衡态额微小变化组成,因变化的动力和阻力相差为一无穷小量,因而过程进行得无限缓慢。
(2)若循原过程相反的方向无限缓慢变化,可使体系与环境同时恢复原状。
物理化学涉及的高等数学内容

2 2
a pc 27b 2
一般以Tc、pc 求算 a 、b
,
RTc b 8 pc
V f (T , p, nB nC )
偏摩尔体积的定义
V V dV dT dp T p ,nB ,nC p V ,nB ,nC V V dnB dnC n n B T , p ,nC C T , p ,nB
将
cA cA0 (1 xA ) 代入积分式
lnc A = - kA t + lnc A , 0
一级反应速率方程积分的另一种形式:
1 ln = k At 1- xA
§4.3 气体组分的化学势
1. 理想气体的化学势
纯理想气体的化学势* 即为其摩尔吉布斯函数Gm*
恒T 下,将1mol 理想气体从 p 变到 p :
c c
p V m
RTc 2a V b 2 V 3 0 Tc m m
2 p 2 RTc 6a 4 0 2 3 V m Tc Vm b Vm
联立求解,可得:
V m ,c
8a 3b , Tc , 27Rb
理想气体绝热可逆体积功:
pV
p1V1
V2 V1
W
dV pdV p1V1 V1 V
V2
p1V1 1 1 1 1 W 1 V V 1 2
(2 )
速率方程的积分形式
1 dc B nA nB = kc A c B 形式的情况。 只考虑速率方程具有 v = n B dt
物理化学期末试题及参考答案

一、填空题(每小题2分,共20分)1、热力学第零定律是指:。
2、熵与热力学概率之间的函数关系式是。
3、补全热力学函数关系式:C P= (S/T)P4、一定量的单原子理想气体定压下从T1变化到T2的熵变与定容下从T1变化到T2的熵变之比为:5、化学势的表示式中,是偏摩尔量。
6、稀溶液的依数性包括、、和。
7、反应NH4HS(s)=NH3(g)+H2S(g),在298K时测得分解压为,则该温度下该反应的K pΘ= ;K p= 。
8、1atm压力下水和乙醇系统的最低恒沸混合物含乙醇质量分数为,现将含乙醇50%的乙醇水溶液进行分馏,最终得到的物质为。
9、水在时沸点为373K,汽化热为 kJ/mol(设汽化热不随温度变化);毕节学院的大气压约为 kPa,则在毕节学院水的沸点为 K。
10、反应NH4HS(s)=NH3(g)+H2S(g)已达平衡;保持总压不变,往系统中充入一定量的惰性气体,平衡移动方向为。
得分评卷人二、选择题(每小题2分,共30分)1、下列属于化学热力学范畴的是()(A)物质结构与性能的关系(B)化学反应速率(C)化学变化的方向和限度(D)反应机理2、下列关于热力学方法叙述正确的是()(A)热力学研究所得的结论不适用于分子的个体行为(B)热力学可以解决某条件下怎样把一个变化的可能性变为现实性的问题(C)经典热力学详细讨论了物质的微观结构(D)经典热力学常需计算一个变化所需要的时间3、下列函数中为强度性质的是:()(A) S (B) (G/p)T (C) (U/V)T (D) C V4、一定量的纯理想气体,下列哪组量确定后,其他状态函数方有定值。
()(A)T (B)V (C)T、U (D)T、p5、对一化学反应,若知其△C p,m= ∑νB C p, m, B > 0,则该反应的()(A)△H随温度升高而增大(B)△H随温度升高而减少(C)△H大于零(D)△H小于零6、某气体的压缩因子Z> 1,表示该气体()(A)易于压缩(B)不易压缩(C)易于液化(D)不易液化7、下列说法错误的是()(A)热容的大小与系统所含物质的量有关(B)对于气体来说,其C p, m恒大于C V, m(C)对于任意系统,因为体积随温度升高可能减小,所以其C p,可能小于C V(D)对于体积不变的刚性容器中的系统,因为定容,所以有C V而没有C p值8、某可逆热机的高温热源为T2,低温热源为T1(1)若选用水蒸气为工作物质,其热机效率为ηW(2)若选用汽油为工作物质,其热机效率为ηO则下列关系正确的是:()(A)ηW >ηO (B)ηW<ηO(C)ηW=ηO (D)无法比较9、已知某温度下,∆f H mΘ(CO2)=- kJ/mol,∆c H mΘ(CO)=- kJ/mol,则∆f H mΘ(CO)为()(A)- kJ/mol (B) kJ/mol(C)- kJ/mol (D)- kJ/mol10、过饱和溶液中的溶质的化学势与纯溶质的化学势相比较,前者()(A) 大 (B) 小(C)与后者相等 (D)无法比较11、两支烧杯各有1kg水,向A杯中加入蔗糖,向B杯中加入 NaCl,两支烧杯在相同条件下按同样的速度降温,则()(A)A杯先结冰(B)B杯先结冰(C)两杯同时结冰(D)都不会结冰12、I2(s)与I2(g)平衡共存,系统自由度为()(A) 0 (B) 1(C) 2 (D) 313、化学反应等温式∆r G m=∆r G mΘ+RT lnQ,当选取不同标准态时()(A)∆r G m和Q的值都改变(B)∆r G m和Q的值都改变(C)∆r G m的值改变,Q不变 (D) ∆r G m不变,Q的值改变14、反应C(s)+O2(g)=CO2(g),2 CO(g) +O2(g)= 2CO2(g),C(s)+ 1/2 O2(g)=CO(g)的平衡常数分别为K1Θ、K2Θ、K3Θ,这三个平衡常数之间的关系是()(A) K3Θ=K1ΘK2Θ (B) K3Θ= K1Θ/K2Θ(C) K3Θ= K1Θ/ (D) K3Θ=15、等温等压下,A和B组成的均相系统中,当改变浓度时A的偏摩尔体积增加,则B的偏摩尔体积将()(A) 增加 (B) 减小(C) 不变 (D) 随A和B的比例不同而不同三、解答题(计算过程必须有公式、代入数据后的式子、计算结果以及必要的文字说明;回答问题须简要说明理由。
物理化学简要复习
01-02 热力学第一定律与热力学第二定律基本概念系统分类:①敞开系统。
这种系统与环境之间既可以有物质的交换,亦可以有能量的交换。
②密闭系统,或称封闭系统。
这种系统与环境之间不可以能有物质的交换,只可以有能量的交换。
③隔绝系统,或称孤立系统。
这种系统与环境之间既不可能有物质的交换,亦不可能有能量的交换。
热力学性质(状态性质):⑴容量性质,又称广度性质。
这种性质的数值与系统中物质的量成正比;这种性质在系统中有加和性,即整个系统的容量性质的数值,是系统中各部分该性质数值的总和。
体积、质量热容等是容量性质。
⑵强度性质,这种性质的数值与系统中物质的量无关;这种性质在系统中无加和性,而是整个系统的强度性质的数值与各个部分的强度性质的数值是相同的。
压力、温度、黏度、密度是强度性质。
往往两个容量性质之比成为系统的强度性质。
摩尔体积是体积与物质的量之比;摩尔热容是热容与物质的量之比,这两个是强度性质。
状态函数的三个特征:①系统的状态一定,它的每一个状态函数具有唯一确定的值。
用数学语言表达:状态函数是系统状态的单值函数。
②系统经历一过程的状态函数差值,只取决于系统的始末两态。
用数学语言表达:状态函数在数学上具有全微分的性质,用符号d表示,如dV、dp。
③系统经过一系列过程,回到原来的状态,即循环过程,状态函数数值的变化为零。
(以上三个特征只要具备其中一条,其他两个特征就可以推导出来。
以上关于状态函数的特征可以反过来说:如果一个系统的有一个量符合上述三个特征之一,可以判定有某一状态函数的存在。
)功和热:当系统的状态发生变化并引起系统的能量发生变化时,这种能量的变化必须依赖于系统和环境之间的能量传递来实现。
系统与环境之间的能量传递形式可区分为两种方式,一种叫做“热”,另一种叫做“功”。
热:由于系统与环境之间的温度差而造成的能量传递称为热;系统吸热为正值,而系统放热为负值。
功:除了热以外,在系统与环境之间其他形式的能量传递统称为功。
物理化学主要公式
物理化学主要公式物理化学主要公式第一章气体的pVT 关系1. 理想气体状态方程式nRT RT M m pV ==)/(或 RT n V p pV ==)/(m式中p ,V ,T 及n 单位分别为Pa ,m 3,K 及mol 。
m /V V n =称为气体的摩尔体积,其单位为m 3 · mol -1。
R =8.314510 J · mol -1 · K -1,称为摩尔气体常数。
此式适用于理想气体,近似地适用于低压的真实气体。
2. 气体混合物(1)组成摩尔分数 y B (或x B ) = ∑AA B /n n体积分数 /y B m,B B *=V ?∑*AVy Am,A式中∑AA n 为混合气体总的物质的量。
A m,*V 表示在一定T ,p 下纯气体A 的摩尔体积。
∑*AA m,A V y 为在一定T ,p 下混合之前各纯组分体积的总和。
(2)摩尔质量∑∑∑===BBBB B BB mix //n M n m M y M式中∑=BB m m 为混合气体的总质量,∑=BB n n 为混合气体总的物质的量。
上述各式适用于任意的气体混合物。
(3)V V p p n n y ///B B B B *=== 式中p B 为气体B ,在混合的T ,V 条件下,单独存在时所产生的压力,称为B 的分压力。
*B V 为B 气体在混合气体的T ,p 下,单独存在时所占的体积。
3. 道尔顿定律p B = y B p ,∑=BB p p上式适用于任意气体。
对于理想气体V RT n p /B B =4. 阿马加分体积定律V RT n V /B B =*此式只适用于理想气体。
5. 范德华方程RT b V V a p =-+))(/(m 2mnRT nb V V an p =-+))(/(22式中a 的单位为Pa · m 6 · mol -2,b 的单位为m 3 · mol -1,a 和b 皆为只与气体的种类有关的常数,称为范德华常数。
物理化学学科分类
物理化学学科分类
物理化学学科分类是指对物理化学这一学科进行分类和划分的
过程。
物理化学是研究物质的物理和化学性质及其相互关系的学科,涉及领域广泛,包括热力学、动力学、量子化学、表面化学、光化学、电化学等多个分支学科。
根据研究对象和研究方法的不同,物理化学可以分为以下几个分类:
1. 热力学:热力学是研究热、功、能量转化等宏观性质的物理化学分支。
2. 动力学:动力学是研究反应速率和反应机理的物理化学分支。
3. 量子化学:量子化学是以量子力学为基础研究分子和原子结构及其性质的物理化学分支。
4. 表面化学:表面化学是研究固体表面及其与周围环境相互作用的物理化学分支。
5. 光化学:光化学是研究光与化学反应及光能转化的物理化学分支。
6. 电化学:电化学是研究电与化学反应及电能转化的物理化学分支。
除此之外,物理化学还包括了许多其他的分支学科,如超分子化学、化学热力学、化学动力学、电子化学等。
不同的分类方法可以帮助人们更好地理解和掌握物理化学的基本概念和知识,同时也为物理化学的深入研究提供了基础和方向。
- 1 -。
物理化学主要内容包括
物理化学主要内容包括物理化学主要内容包括如下:物理化学是以物理的原理和实验技术为基础,研究化学体系的性质和行为,发现并建立化学体系中特殊规律的学科。
随着科学的迅速发展和各门学科之间的相互渗透,物理化学与物理学、无机化学、有机化学在内容上存在着难以准确划分的界限,从而不断地产生新的分支学科,例如物理有机化学、生物物理化学、化学物理等。
物理化学还与许多非化学的学科有着密切的联系,例如冶金学中的物理冶金实际上就是金属物理化学。
研究内容随着科学的迅速发展和各门学科之间的相互渗透,物理化学与物理学、无机化学、有机化学之间存在着越来越多的互相重叠的新领域,从而不断地派生出许多新的分支学科,如物理有机化学、生物物理化学、化学物理学等。
物理化学还与许多非化学的学科有着密切的联系,如冶金过程物理化学、海洋物理化学。
一般公认的物理化学的研究内容大致可以概括为三个方面:1、化学体系的宏观平衡性质以热力学的三个基本定律为基础,研究宏观化学体系(含有分子数目量级在10左右的体系)在气态、液态、固态、溶解态以及高分散状态的平衡态物理化学性质及其规律性。
由于以平衡态为前提,时间不再是变量。
属于这方面的物理化学分支学科有化学热力学、化学统计力学、溶液化学、胶体化学和表面化学。
2、化学体系的微观结构和性质以量子力学为理论基础,研究分子、分子簇和晶体的结构,物体的体相中原子和分子的空间结构、表面相的结构,以及结构与物性之间的关系与规律性。
属于这方面的物理化学分支学科有结构化学、晶体化学和量子化学。
3、化学体系的动态性质研究由于化学或物理因素的扰动而引起的体系的化学变化过程速率和变化机理。
此时,时间是与过程密切相关的重要变量之一。
属于这方面的物理化学分支学科有化学动力学、化学动态学、催化科学与技术、光化学、电化学、磁化学、声化学、力化学(以摩擦化学为代表)等。
在理论研究方面,快速大型电子计算机和数值方法的广泛应用,扩展了量子化学在定量计算方面的能力。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物理化学BPhysical Chemistry B课程编号:学分: 3学时: 45 (其中:讲课学时:45)先修课程:无机化学、有机化学、分析化学适用专业:药学、药物制剂学、生物技术、食品科学与工程、食品质量与检验、生物工程、制药工程、生物工程、食品安全教材:《物理化学》,濮良忠,人民卫生出版社,2009年2月第3版开课学院:化学化工学院一、课程的性质与任务《物理化学B》是药学类专业核心课之一,是一门从物质的物理现象和化学现象的联系入手探求化学变化一般规律的科学。
它的任务是使学生掌握化学热力学、化学平衡、多相平衡、化学动力学、电化学、表面化学和胶体化学的基本知识。
通过学习,加深对无机化学、有机化学和分析化学等课程的理解, 着重学习与药学专业有关的化学新知识、新理论、新技术;用物理化学的基本原理和方法解决实际问题,为后续课程和以后的工作及科学研究打下坚实的基础。
《物理化学》的主要内容是:化学热力学(热力学第一定律、第二定律),溶液和相平衡,化学平衡,电化学(电解质溶液和可逆电池), 化学动力学, 表面现象和胶体溶液。
内容的深广度以“加强基础,联系专业”为原则,体现检验专业的特点。
二、课程的基本内容及要求绪论1、教学内容(1)物理化学的由来、发展、能解决的问题(2)物理化学与药学专业的关系(3)物理化学的学习方法2、基本要求(1)了解本课程的性质、研究对象与方法、任务;(2)掌握学习本课程的几个基础概念。
3、重难点重点:物理化学的基本内容和任务,物理量的表示与运算。
难点:物理量的表示与运算。
第一章热力学第一定律1、教学内容(1)热力学的几个基本概念: 体系和环境,过程和途径,状态和状态函数,热力学平衡, 热量和功。
(2)热力学第一定律和内能,热力学第一定律的数学表达式,内能变化的物理意义,理想气体的内能。
(3)焓的定义,焓变化的物理意义,理想气体的焓,热容的几种定义(平均热容、比热、摩尔热容、等压摩尔热容、等容摩尔热容)。
热容与温度的关系, 由热容求单纯变温过程中的热、内能和焓的变化(只考虑热容是常数的情况)。
(4)反应进度,反应热效应和热化学方程式,盖斯定律,由生成热计算反应热,由离子生成热计算溶液反应热,由燃烧热计算反应热。
2、基本要求(1)了解内能和焓等概念(2)熟悉热力学第一定律和化学反应的热效应(3)掌握盖斯定律、生成热、燃烧热及有关计算。
3、重点难点重点:基本概念、可逆过程、热力学能、功、热、焓的定义和性质。
体积功的计算。
热力学第一定律,在相变过程、理想气体在各种过程中的ΔU、ΔH、Q及W的计算,理想气体的绝热可逆过程的过程方程式的推导,焦耳-汤姆逊效应。
化学反应热及用燃烧热、生成热计算反应热;基尔霍夫定律。
难点:状态与状态函数、可逆过程、热力学能与焓的概念。
理想气体的绝热可逆过程的过程方程式的推导。
焦耳-汤姆逊效应。
化学反应热及用燃烧热、生成热计算反应热;基尔霍夫定律。
第二章热力学第二定律1、教学内容(1)热力学第二定律的两种表述法,卡诺热机和卡诺循环(热机、卡诺热机、卡诺循环、任意热机和卡诺热机的工作效率)。
(2)卡诺原理及其推论,卡诺循环的热温商,熵的热力学定义,熵增加原理和熵判据,热力学第三定律,规定熵。
物理过程中体系的熵变化(单纯变温过程、理想气体状态变化过程、相变过程), 化学反应的熵变化。
(3)吉布斯自由能,自由能判据,根据dG=Vdp-SdT、△G=△H-T△S以及标准生成自由能计算化学反应的自由能变。
(4)封闭体系的热力学基本公式,自由能变化与温度的关系(只引出吉布斯-亥姆霍兹公式),多组分体系中物质的偏摩尔量,化学势,理想气体的化学势,化学势判据。
化学热力学基本原理在生物体系中的应用简介。
2、基本要求熟悉热力学第二定律的数学表达式及热力学第三定律,掌握自由能变化计算的应用。
3、重难点重点:热力学第二定律,克劳修斯不等式及其推导,熵和熵增原理,熵变的计算及熵判据,吉布斯函数G。
热力学基本关系式及麦克斯韦关系式。
ΔS、ΔG与ΔF计算,吉布斯-亥姆霍兹公式。
克拉贝龙方程和克拉贝龙-克劳修斯方程。
难点:从卡诺原理得出克劳修斯原理和熵函数的逻辑推理,熵函数概念,熵增原理,热力学函数判据,ΔS、ΔG与ΔF值的计算。
第三章溶液和相平衡1、教学内容(1)偏摩尔量(2)化学势(3)气体组分化学势(4)拉乌尔定律和亨利定律(5)稀溶液(6)理想溶液(7)相律(8)杠杆规则(9)水的相图(10)完全互溶双液系T~X相图(11) 部分互溶双液系T~X相图(12)完全不互溶双液系T~X相图(13)简单低共熔体系T~X相图2、基本要求理解并掌握偏摩尔量、化学势、活度和标准态等基本概念及物理意义。
掌握稀溶液的两大定律拉乌尔定律和亨利定律。
掌握气体和溶液中物质化学势的表示式。
明确相、组分数、自由度的物理意义,掌握相律的推导,并应用于相图的分析中,掌握典型相图的制作方法。
了解相平衡知识在化工领域中的某些应用。
3、重难点重点:偏摩尔量与化学势,拉乌尔定律与亨利定律,气体的化学势、逸度及逸度系数的定义,标准态选择,理想液态混合物的热力学通性和微观特征,各组分的化学势。
溶液中组分的化学势,标准态的选择,活度与活度系数的定义和测定方法。
稀溶液的依数性。
相律的推导及其应用。
二组分气液平衡的p -x 图、T -x 图、杠杆规则。
形成简单低共熔混合物的固-液体系,形成稳定和不稳定化合物的固-液体系,固态完全互溶、部分互溶的固-液体系。
相图的绘制,相图的一些应用。
难点:偏摩尔量、化学势,逸度及逸度系数的定义,标准态的选取。
相律的应用。
二组分完全互、溶部分互溶双液系的p -x 图、T -x 图。
形成稳定化合物和形成不稳定化合物的固-液体系,固态部分互溶的固-液体系。
第四章 化学平衡1、教学内容(1)化学反应的等温式方程(2)理想气体反应的活度商和标准平衡常数(3)温度对标准平衡常数的影响(4)其它因素对理想气体标准平衡常数的影响2、基本要求理解并掌握化学反应吉布斯函数变化和化学势。
掌握化学反应等温式方程的意义及应用。
掌握化学反应的标准吉布斯函数变化和标准生成吉布斯函数的概念及意义。
掌握标准平衡常数。
掌握平衡常数及活度商的各种计算以及影响平衡移动的各种因素。
3、重难点重点:化学反应等温方程式,Δr G m ??=-RT ln K ??、平衡组成及平衡转化率的计算。
化学反应等压方程式,各种因素对平衡的影响。
分解压力和分解温度的概念和计算。
难点:反应过程G 的意义,实际气体反应、液相反应的平衡常数及其各种表达式。
等压方程式,固体分解压力和分解温度的概念和计算。
第五章 电解质溶液1、教学内容(1) 电导及电导率,摩尔电导率;(2)离子独立移动定律;(3)电导率的测定及其应用 (测定水的纯度、弱电解质电离常数的测定、难溶电解质溶度积常数的测定、电导滴定)。
2、基本要求(1)了解电解质溶液的特点(2)熟悉电导、电导率及摩尔电导率的概念(3)掌握电导率的有关计算及电导测定的应用。
3、重难点重点:电解质溶液的摩尔电导率,平均活度和平均活度系数。
难点:摩尔电导率,电解质的平均活度和平均活度系数的概念。
第六章原电池和电解池1、教学内容(1)原电池的组成,电池反应及电极反应方程式,由化学反应式组成电池(写出电池表达式),由电池表达式写出化学反应的反应式, 可逆电池。
(2)电动势的温度系数,电动势与电池反应的△G、△H、△S的关系(根据电池电动势的符号判断化学反应方向), 电动势的能斯特方程。
(3)电动势的产生,标准电极电势,电极的组成和分类,电极电势的能斯特方程(从电动势的能斯特方程推出), 电极电势和电动势的计算(非标准状态下电极电势和电动势的计算, 由相关电极电势求未知电极电势) 。
(4)浓差电池,盐桥的作用。
(5)分解电压(6)极化作用(7)分解时的电极反应(离子的析出顺序)2、基本要求(1)了解原电池组成、电池反应、电极电势的产生;.(2)熟悉可逆电池的热力学;(3)掌握电极电势的计算及电动势测定的应用;(4)了解电极极化的原因,理解分解电压、超电势、极化作用等概念;(5)掌握电解池与原电池极化的差别;(6)掌握电解时两极上发生电极反应的顺序;(7)了解金属的电化学腐蚀机理和防护方法。
3、重难点重点:可逆电池,电池图式,由化学反应设计可逆电池。
可逆电池反应热力学量的求算方法,Nernst方程,标准电极电位。
测定电动势的方法。
极化现象,电解时电极上的反应,金属离子的分离与共同析出。
难点:电池反应与电池表达式的互译。
利用电极极化现象进行电化学分析中的有关计算。
第七章化学动力学1、教学内容(1)反应速率表示法,反应速率的测定,基元反应,非基元反应,反应速率方程式,质量作用定律,反应级数和反应分子数,反应速率的测定(代入法、试探作图法、半衰期法、对数作图法)。
(2)具有简单级数的反应(一级反应、二级反应、零级反应)的动力学特征(积分式、微分式、半衰期、线性关系式) 。
(3)复杂反应(对峙反应、平行反应、连串反应)的动力学特征;阿累尼乌斯经验式(积分式、指数式、微分式、定积分式),求不同温度时的化学反应速率常数,活化能,活化能对反应速率的影响、活化能的求得,药物化学稳定性预测。
(4)催化剂的基本特性,催化活性曲线,酶催化反应动力学。
2、基本要求(1)了解酶催化反应的动力学特征、质量作用定律和反应速率方程式;(2)熟悉零级反应、一级反应、二级反应、对峙反应、平行反应和连串反应的动力学特征;(3)熟悉反应级数、反应活化能及浓度、温度、催化剂等对反应速率的影响;(4)掌握一级反应,二级反应和阿累尼乌斯公式的计算及其应用。
3、重难点重点:反应速率方程,速率常数,反应级数及其确定,简单级数反应动力学特征与计算,简单复杂反应的动力学特征与计算,平衡近似法、稳态近似法推导速率方程,温度对反应速率影响,活化能,碰撞理论和过渡状态理论基本假设与基本术语,气固相催化反应机理及动力学特征。
难点:反应级数与反应分子数区别与联系,连串反应、链反应速率方程推导,温度对速率常数的影响及表观活化能计算,碰撞理论速率常数计算与物理量单位变换,过渡状态中能势面与速率常数、活化能、活化焓、活化熵计算。
第八章界面现象1、教学内容(1)分散度和比表面,表面自由能和表面张力,弯曲表面的附加压力,弯曲液面的蒸气压。
(2)溶液的表面张力,吉布斯吸附方程式(3)表面活性物质,表面活性剂的分类,表面活性剂在水溶液中的分布情况,表面活性剂两个重要特性,表面活性剂的几个重要作用及其在药学中的应用。
(4)固体表面吸附作用的分类, 吸附等温式, 离子吸附, 润湿与铺展。
2、基本要求(1)了解表面自由能、表面张力和固体表面吸附;(2)熟悉弯曲表面现象和溶液表面吸附;(3)熟悉表面活性剂的特性和几种独特作用。
