课时作业13 化学反应进行的方向
化学反应进行的方向教案

化学反应进行的方向教案教案:化学反应进行的方向教学目标:1. 理解化学反应进行的方向的概念和意义;2. 掌握影响化学反应进行方向的因素;3. 学会判断和预测化学反应进行方向的方法;4. 进一步培养学生的实验操作能力和观察能力。
教学过程:一、导入(10分钟)1. 引入化学反应进行性质的概念,以常见的反应为例进行简单介绍。
二、理论讲解(15分钟)1. 讲解化学反应进行方向的定义和意义,以及确定反应进行方向的方法。
2. 介绍影响化学反应进行方向的因素,如温度、浓度、压力等。
3. 通过理论知识和实例说明不同因素对反应进行方向的影响。
三、实验操作(30分钟)1. 选择一个适合的反应进行操作,如盐酸和氢氧化钠的中和反应。
根据理论知识,判断和预测反应进行的方向。
2. 进行实验操作,观察反应进行的方向和现象,并记录实验数据。
3. 根据实验结果,分析反应进行方向的原因。
四、讨论与总结(15分钟)1. 学生就实验结果进行分组讨论,总结影响反应进行方向的因素。
2. 以课堂小结的方式回顾化学反应进行方向的知识点,让学生进一步巩固所学内容。
五、拓展练习与延伸活动(10分钟)1. 通过给出不同反应的条件和反应方程,让学生预测和判断反应进行的方向,提高学生预测能力。
2. 提供一些化学反应进行方向的应用实例,引导学生思考反应进行方向对实际问题的影响和应用。
六、课堂反思与作业布置(5分钟)1. 学生针对本课所学内容进行反思和总结,指出不足之处,并提出改进意见。
2. 布置相关阅读材料或作业,进一步拓宽学生的知识面。
教学资源准备:1. 实验所需的化学试剂和器材;2. 相关的实验操作指导书;3. 相关的教学课件或教学PPT;4. 预先准备好的实验数据记录表。
教学评估方式:1. 学生的实验操作完成情况和观察记录;2. 学生对实验结果的分析和判断的准确性;3. 学生对课堂讲解和掌握情况的评价;4. 学生对化学反应进行方向的应用和拓展能力。
第四节化学反应进行的方向

。 。 。 。
如果反应△G >0则不自发进行
思考:
1、根据理论计算H2与O2反应的△G<0该反应可 以自发进行,但为什么H2与O2的混合物放置 100年也没有明显反应? 2、理论计算H2O分解为H2与O2的反应△G>0该 反应无法自发进行,但实验室中却可以使该反 应发生,为什么? △G可以判断反应能否自发进行,但不能判断反应 速率的快慢; 如果有外界的影响,△G >0的反应也可以发生; △G只能判断反应进行的可能性,反应真实能否进 行还要看具体条件。
ΔH=-
4. 下列说法正确的是 能自发进行 B . NH4HCO3(s)===NH3(g) + H2O(g) + CO2反应一般能自发进行,吸热反应都不 ΔH =+
185.57 kJ· mol- 1,能自发进行,原因是体系有自发地 C.因为焓变和熵变都与反应的自发性有关,因此焓变和 熵变均可以单独作为反应自发性的判据 D.在其他外界条件不变的情况下,使用催化剂,可以改 变化学反应进行的方向
非自发过程: 热由低温流向高温(电冰箱) 水由平原流向高山(扬水机) 气流由低压流向高压(压缩机) 电流由低电势流向高电势(电池充电) 常温常压下水分解为氢气、氧气(电解)
阅读课本:P34-35面,回答下列问题 1、什么是焓、什么是熵?什么是焓变、什么是 熵变? 2、仅仅根据焓判据,什么反应能够自发进行? 3、仅仅根据熵判据,什么反应能够自发进行? 4、同种物质状态不同,熵是否相同? 5、同种物质固、液、气三态熵的大小关系如何? 6、这两种判断依据是否完全合理?如果不合理 应该如何判断反应是否能够自发进行?
- -1
-1
(3)4Fe(OH)2(s)+ 2H2O(l)+ O2(g)===4Fe(OH)3(s) 444.3 kJ· mol- 1 ΔS=- 280.1 J· mol-1· K -1 ΔS=+ 169.6 J· mol-1· K-1 (4)CaCO3(s)===CaO(s)+ CO2(g) ΔH=+ 178.2 kJ· mol-1
化学平衡的移动 化学反应进行的方向

(3)复合判据 过程的自发性只能用于判断过程的 ________,不能确定 过程是否一定发生和过程发生的速率。综合考虑________和 ________的复合判据,将更适合于所有的过程。
答案: 1.外力 2. (1)焓变 (2)混乱 于 熵变 (3)方向 焓判据 熵判据 混乱 S J· mol 1· K
知识梳理· 打基础
速效提升· 提素能 合作学习· 速通关 课时作业 方法技能· 破难点
知识梳理· 打基础01
夯实基础 厚积薄发
一、外界条件对化学平衡的影响 1.化学平衡移动的过程:
2.化学平衡移动与化学反应速率的关系: (1)v(正 )______v(逆 ):平衡向正反应方向移动。 (2)v(正 )______v(逆 ): 反应达到平衡状态, 平衡不发生移 动。 (3)v(正 )<v(逆 ):平衡向 ________方向移动。
必考部分
第七单元 化学反应速率和化学平衡
第3节
化学平衡的移动 化学反应进行的方向
考纲解读
1.理解外界条件浓度、温度、压强、催化剂等对 化学平衡的影响,认识其一般规律。 2.了解化学平衡的调控在生活、 生产和科学研究领 域中的重要作用。
考情剖析
本节重点考查: 1会判断条件改变引起的平衡移动方向; 2平衡、速率有关的图象分析与判断。 分析近三年高考,仍会以图表或图象的形式分析 判断化学平衡移动的方向或分析影响化学平衡移动 的因素等方面进行命题。
3.外界因素对化学平衡的影响。 增大反应物浓度或减小生成物浓度,平衡 向移动;减小反应物浓度或增大 浓度→ 生成物浓度,平衡 向移动 对于反应前后气体分子数不等的反应,增 大压强,平衡向气体分子数 的方向移动; 的 压强→减小压强,平衡向气体分子数 方向移动。若反应前后气体分子数相等, 改变压强平衡 移动
高二化学人教版暑假作业(13)化学反应进行的方向
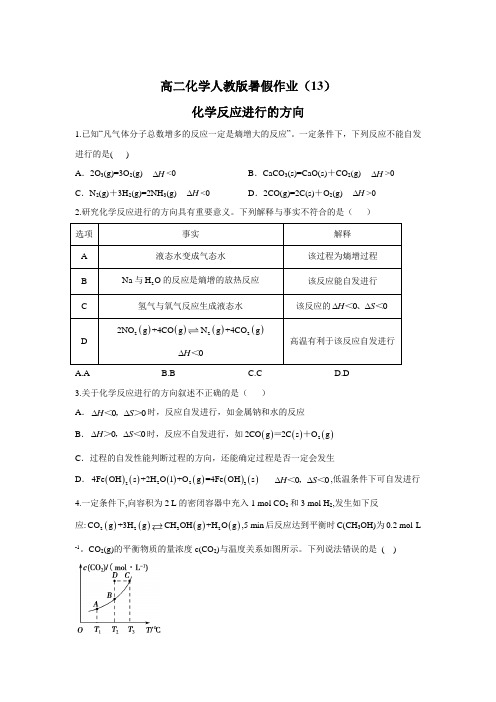
高二化学人教版暑假作业(13)化学反应进行的方向1.已知“凡气体分子总数增多的反应一定是熵增大的反应”。
一定条件下,下列反应不能自发进行的是( )A .2O 3(g)=3O 2(g) H ∆<0B .CaCO 3(s)=CaO(s)+CO 2(g) H ∆>0C .N 2(g)+3H 2(g)=2NH 3(g) H ∆<0D .2CO(g)=2C(s)+O 2(g) H ∆>02.研究化学反应进行的方向具有重要意义。
下列解释与事实不符合的是( ) 选项 事实 解释 A 液态水变成气态水该过程为熵增过程 B Na 与2H O 的反应是熵增的放热反应该反应能自发进行 C氢气与氧气反应生成液态水 该反应的00H S ∆∆<、<D ()()()()2222NO g +4CO g N g +4CO g 0H ∆<高温有利于该反应自发进行A.AB.BC.CD.D3.关于化学反应进行的方向叙述不正确的是( )A .00H S ∆∆<,>时,反应自发进行,如金属钠和水的反应B .00H S ∆∆>,<时,反应不自发进行,如()()()22CO g 2C s O g =+ C .过程的自发性能判断过程的方向,还能确定过程是否一定会发生D .()()()()()()22234Fe OH s +2H O l +O g =4Fe OH s 00H S ∆∆<,<,低温条件下可自发进行 4.一定条件下,向容积为2 L 的密闭容器中充入1 mol CO 2和3 mol H 2,发生如下反应:()()()()2232CO g +3H g CH OH g +H O g ,5 min 后反应达到平衡时C(CH 3OH)为0.2 mol·L-1。
CO2(g)的平衡物质的量浓度c(CO 2)与温度关系如图所示。
下列说法错误的是 ( )A.0~5 min,CO 2的平均反应速率为0.04 mol·(L·min) -1反应B.()()()()2232CO g +3H g CH OH g +H O g <0H ∆的C.在T 2 ℃时,若反应处于状态D,则一定有V 正<V 逆D.若T 1 ℃、T 2 ℃时的平衡常数分别为K 1、K 2,则K 1>K 25.化学反应方向的确定不仅与焓变(H ∆)有关,也与温度(T )、熵变(S ∆有关。
化学化学反应的方向教案范文(13篇)

化学化学反应的方向教案范文(13篇)(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如工作总结、工作报告、党团范文、工作计划、演讲稿、活动总结、行政公文、文秘知识、作文大全、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!Moreover, our store provides various types of practical materials for everyone, such as work summaries, work reports, Party and Youth League model essays, work plans, speeches, activity summaries, administrative documents, secretarial knowledge, essay summaries, and other materials. If you want to learn about different data formats and writing methods, please stay tuned!化学化学反应的方向教案范文(13篇)教学工作计划的制定需要考虑学生的实际情况和特点,以及教学资源的合理利用。
化学反应进行的方向完整版

化学反应进行的方向集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]《化学反应进行的方向》教学设计张蓬〖教学目标〗知识与技能:了解反应的自发性与反应过程中能量变化及熵值变化的关系;能用焓变和熵变说明化学反应的方向。
过程与方法:通过联系日常生活中的见闻以及自然界的普遍变化规律,引导学生理解判断反应自发进行的两个因素,使学生构建化学反应方向的判据,学会从现象分析到理论探究的科学方法,学会运用比较、归纳、概括等方法对信息进行加工,构建新知识。
情感态度与价值观:体会事物的发展、变化常常受多种因素的制约,学会全面分析问题。
〖教学重点〗焓变和熵变与化学反应方向的关系〖教学难点〗焓变和熵变与化学反应方向的关系〖教学方法〗讨论交流、分析、概括、归纳〖教学过程〗1.下列过程属于熵增过程的是()。
A.硝酸钾溶解在水里面B.氨气和氯化氢反应生成氯化铵晶体C.水蒸气凝结为液态的水D.(NH4)2CO3分解生成二氧化碳、氨气和水【解析】硝酸钾溶解在水里面,电离成自由移动的离子,混乱程度增大;(NH4)2CO3分解生成二氧化碳、氨气和水时,生成大量气体物质,混乱程度增大;而由气体变成液体或固体的过程均为熵减的过程。
【答案】AD。
2.自发进行的反应一定是()。
A.吸热反应B.放热反应C.熵增加反应D.熵增加或者放热反应【解析】焓变和熵变都是影响化学反应进行的方向的因素,需要综合考虑二者的影响。
【答案】D。
3.某化学反应的△H=–122kJ·mol-1,S=+231J·mol-1·K-1,则此反应在下列哪种情况下可自发进行()。
A.在任何温度下都能自发进行B.在任何温度下都不能自发进行C.仅在高温下自发进行D.仅在低温下自发进行【解析】从焓变考虑,该反应是放热反应,可自发进行;从熵变考虑,该反应是熵增反应,也可以自发进行。
综合考虑,该反应在任何温度下,都能自发进行。
【答案】A。
第四节 化学反应进行的方向
度下则能自发进行。如
CaCO3(s) ==== CaO(s)+CO2(g)
高温
Δ H>0
(3)结论。
能量变化是一个与反应能否自发进行有关的因素,但不是决定
反应能否自发进行的惟一因素。
2.与熵变的关系 (1)自发反应的特点。 大多数自发反应都有趋向最大混乱度的倾向。 (2)与熵变的关系。 ①许多熵增加的反应在常温、常压下可以自发进行。如 2H2O2(aq)====2H2O(l)+O2(g) Δ S>0
【特别提醒】从能量角度(即焓变)看,化学反应有趋向于最低 能量状态的倾向,而从熵变角度看,化学反应有趋向于最大混
乱度的倾向,在实际的化学变化中,ΔH与ΔS倾向有时会出现
矛盾,因此,在分析一个具体化学反应自发进行的方向时,不 能孤立地使用焓判据或熵判据来分析,否则,可能会得出错误 的结论,要注意应用焓判据和熵判据进行综合分析。
第四节 化学反应进行的方向
点击进入相应模块
1.了解自发过程和化学反应的自发性。
2.通过“有序”和“无序”的对比,了解熵和熵变的概念。
3.初步了解焓变和熵变对化学反应方向的影响,能用焓变和 熵变解释化学反应的方向。
一、化学反应自发进行的判据 (1)化学反应自发进行有哪些判据? (2)这些判据与化学反应的自发性有何关系? 1.自发过程的特点 高能 状态转变为_____ 低能 状态。 (1)能量角度:体系趋向于从_____ 有序 状态转变为_____ 无序 状态。 (2)混乱度角度:体系趋向于从_____
在恒温恒压下,自由能变化(Δ G)的正负决定着化学反应进行 的方向和程度。
2.化学反应的自发性与反应能否进行的关系 (1)非自发性反应在一定条件下也能够进行。
《化学反应进行的方向》教学案例设计
【 文章编号】 2 0 9 5 — 3 O 8 9 ( 2 O 1 4 ) 2 — 0 2 4 6 - 0 1 么变化 。让 幼 儿 自身在观 察 、 体会、 想 象 中来组 织语 言 , 进 而 表达 出来 , 这样 的教 学情 境很 自然的锻 炼 了幼 儿的 口语表 达 能力 。 还有 , 科 学运 用提 问推 动语 言教 学活 动 , 活跃教 学氛 围。 提问
教师把教学内容制作成了动物聚会的flash课件在课堂上教师通过演示课件幼儿会被这些又蹦又跳又叫的小动物给吸引住教师让幼儿在观察之后通过一句话来表达一些不爱说话的幼儿可能会因为其中的某个他喜爱的小动物其积极性被调动起来活跃的小朋友则更乐于表达进而形成一个活跃的语言表发氛围使得全体幼儿处于一种自由的说话情境中从而 是 教 师提 问要 适 度 。 教 师 所 提 问 题 是 针 对 幼 儿 的 , 因 此 问 题 不
对性 。 二是 。 幼 儿教 师忽视 幼 儿的 口语表 达 能力 的培 养 。 一些教 师 宜过 难 , 不是 让 学 生在 问题 中得到 很 大 的 思想提 高 , 而是 如何 激 认 为学 生能 够认 识 更 多的汉 字教 学水 平就 高 , 家长也 能 看 出学 生 发学 生的语 言表 达 。 例如 , 在《 猪 八戒 吃 西瓜 》 故事中, 教 师提 问到 的 长进 . 而忽视 了幼 儿语 言表 达 的培 养 ; 一 些教 师 培 养 学生 的语 小朋 友 最喜欢 什 么? 孩子 回答 : ” 我 觉得猪 八 戒踩 到 自己吃 的 西瓜 言表 达 也 只是通 过 简单 的对话 和模 仿 . 而 未能体 现 幼儿 口语表 达 皮摔 一跤 最 好玩 了” , ”我觉得 八 戒馋 得 流 口水 的样 子 最 有趣 ” 等 能力。 三是 , 语 言教 学活 动缺 乏创 新 , 幼儿 学 习兴趣 不 高。 在幼儿 等, 幼儿 的回答 没有 对错 , 目的在 于让 幼儿敢 想 、 敢说 、 能说 。 语 言教 学中 , 教 师把语 言教 育作 为教 学 内容 的 一部 分 , 而未 能将 最后 , 多媒 体 与 幼儿语 言教 学的 结合 , 提 高幼 儿 学习热情 。 由 语 言教 育 与其他 学科 和 幼儿 园活动 相联 系 . 教 学活动 缺 乏对语 言 于幼 儿本 身存 在 一 定 的性 格 差异 , 一 些 幼 儿活 泼 开 朗 。 一些 沉默 的综合 性把 握 , 而且 。 教 师在 进 行 语 言教 学时 只是 按 照教 学 方 案 少语 ,如 果教 师 只是采 取 简单的静 态图 片对 学生进 行语 言教 学 , 进 行教 学 . 本 身 对幼 儿教 育具 有 突发 性 , 教 师 无法做 到 教 学 活 动 很 难 激发 所有 幼 儿的语 言表 达积 极性 。 因此 , 选择运 用 多媒 体 来 中的 紧急应 对 和 因势 利 导 , 使 得 教 学活 动 单 一 、 死板 。 缺 乏创 造 丰 富语 言教 学素 材 , 调 动 幼儿 语 言表 达欲 望 . 促 进 整 体 幼儿 们 的 性 。接 下 来本 文就如 何 实施 幼儿语 言教 学活动进 行探 讨 。 语 言表 达 能 力均衡 发展 。 例 如 《 过 河》 一课 , 课 程教 学 目标是 教 幼 首先 。 教 师 富有 节奏 和情 感 的语 言表 达 。 提 高 幼儿语 言 听力 。 儿练 习说 一 句 完整 的话 。教 师把 教 学 内容 制作 成 了动物 聚会 的 幼 儿语 言 听力是 培 养幼 儿语 言表 达的 前提 , 幼 儿通过 听在 思 维 的 F L A S H课件 , 在课 堂上教 师 通过 演 示课 件 , 幼儿 会被 这 些 又蹦 又 教 师 让幼 儿在观 察之 后 通过 一 句话 来 反 映 下理 解 , 因此 , 听力与 记 忆、 思维、 语 言表 达发 展 有 密切 关 系 , 跳 又叫 的小动 物给 吸 引住 , 而活跃 的 幼儿容 易被 被 有 节奏 、 有 情感 、 有表 现 力的语 言所 吸 引 , 表达 , 一 些不 爱说话 的 幼儿 可能会 因为其 中的 某个他 喜 爱 的小动 教 师在 幼 儿 听力 培 养 中 占有 重要 作 用 , 因此 , 教 师要 注意 自身 的 物其 积 极性 被调 动起 来 , 活跃 的 小朋 友 则 更 乐 于表 达 , 进 而 形成 语 言表 达 , 来提 高幼 儿语 言 听力 。 例如 , 教 师给 幼儿描 述 响 雷下 雨 个 活跃 的语 言表 发氛 围, 使 得全 体 幼儿 处 于一 种 自由的说 话情 的 情景 时 , 老 师 可用 急促 的语 调说 : 北风 呼 呼地吹 着 , 大 雨哗 啦啦 境 中, 从 而提 高幼儿 的语 言表 达 能力 。 的下。 还时 不 时的 出现 轰隆 隆的 雷声 。 这样 形 象 、 有 节奏 感得 语 言 总之 , 对 幼 儿进 行 语 言教 育 不是 一 朝 一 夕的 事 , 而 需要教 师 促使 幼儿 专心 听。 在长期 的不 断实践 中, 需找 适合 幼儿 的教 学方 式 。 因人 而异 , 因时 其次. 创设 教 学环境 引导幼 儿 , 激 发 幼儿 的学 习兴趣 。 幼儿 园 而异 。 有 针对 性 的从 幼儿 本 身 出发 进 行教 学 , 才是 教 师语 言教 学 教 育指 导 纲要 指 出 : 发 展 幼儿 语 言的 关键是 创设 一 个能使 他 们 想 活 动 的 核 心 。 说、 敢说 、 喜 欢说 、 有机 会说 并 能得 到积极 应 答 的环境 。语 言 环境 参考文献 : 对 孩 子的 语 言发 展 尤 为重 要 。在 幼 儿教 学 中创设 一 定的 教 学 环 f 1 ] 廖 贵英 . 幼儿语 言教 学活 动设 计与 实施 才 智, 2 0 1 0 ( 3 0 ) 境。 例如, 生 活剧 、 模仿、 游 戏 等方 式 来激 发 幼 儿 学 习兴趣 提 高幼 [ 2 ] 武艳英 . 如何 开展 幼儿语 言 艺术 性 的教 学. 教 育教 学 论 坛
化学反应进行的方向通用课件
熵变的计算方法
熵变计算公式
$Delta S = sum{S_{products}} sum{S_{reactants}}$
熵变计算注意事项
在计算过程中,需要考虑到物质的状 态和温度等因素对熵值的影响。
熵变在化学反应中的应用
01
02
03
判断反应方向
通过比较反应前后的熵变 值,可以判断化学反应进 行的方向。
化学反应进行的方向通用 课件
CATALOGUE
目 录
• 化学反应进行方向的概述 • 焓变与化学反应进行方向 • 熵变与化学反应进行方向 • 温度与化学反应进行方向 • 化学反应进行方向的实例分析
01
CATALOGUE
化学反应进行方向的概述
化学反应进行方向的定义
01
化学反应进行方向是指化学反应 在一定条件下自发进行的趋势和 方向。
详细描述
在氧化还原反应中,电子从还原剂转移到氧 化剂,形成新的物质。这种电子转移的过程 促使反应向着更稳定的方向进行,即电子更 倾向于集中在某一物质中。
水解反应的进行方向
总结词
水解反应通常向着与水分子结合生成稳定化 合物的方向进行。
详细描述
水解反应是某些离子或分子与水分子结合生 成更稳定化合物的过程。例如,盐的水解生 成相应的酸和碱,促使反应向着更稳定的方
02
化学反应进行方向由反应体系的 自由能变化决定,自由能变化越 负,反应自发进行的趋势越大。
化学反应进行方向的判断依据
判断依据一
根据反应焓变和熵变的正负号来 判断。当反应焓变小于零、熵变 大于零时,反应自发正向进行; 反之,则自发逆向进行。
判断依据二
根据温度和压力条件下的自由能 变化来判断。在等温、等压条件 下,自发反应总是向着自由能减 少的方向进行。
人教版高中化学教案-化学反应进行的方向
5、下列反應中,熵減小的是( D )
A. (NH4 )2CO3(s)=NH4HCO3(s)+NH3(g) B. 2N2O5(g)=4NO2(g)+O2(g) C. MgCO3(s)=MgO(s)+CO2(g) D. 2CO(g)=2C(s)+O2(g)
6、某化學反應其△H= —122 kJ·mol-1, ∆S= 231 J·mol-1·K-1,則此反應在下列哪 種情況下可自發進行 ( A ) A.在任何溫度下都能自發進行 B.在任何溫度下都不能自發進行 C.僅在高溫下自發進行 D.僅在低溫下自發進行
自發反應未必一定發生,不自發反應未必不會發生
課堂練習
1、碳酸銨〔(NH4)2CO3〕在室溫下就 能自發地分解產生氨氣,對其說法中
正確的是( A )
A、其分解是因為生成了易揮發的氣體, 使體系的熵增大;
B、其分解是因為外界給予了能量; C、其分解是吸熱反應,據能量判據不
能自發分解; D、碳酸鹽都不穩定,都能自發分解。
2、自發進行的反應一定是∶( D ) A、吸熱反應; B、放熱反應;
C、熵增加反應; D、熵增加或者放熱反 應。
3、下列說法不正確的是( C )
A. 焓變是一個與反應能否自發進行有 關的因素,多數的能自發進行的反應都 是放熱反應。
B. 在同一條件下不同物質有不同的熵 值,其體系的混亂程度越大,熵值越大。
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3 kJ/mol
(2)鐵生銹: 2Fe(s)+3/2O2(g)=Fe2O3(s) △H= - 824 kJ/mol
(3)氫氣和氧氣反應:
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课时作业13化学反应进行的方向时间:45分钟分值:100分一、选择题(每小题5分,共70分)1.可用于判断化学反应的自发与否的是()A.仅用焓变B.仅用熵变C.仅用焓变与熵变的和D.用ΔH-TΔS解析:判断一个化学反应的自发与否,仅从焓变或熵变分析是不全面的,用焓变与熵变的和是不正确的,要利用复合判据:ΔH-TΔS,若差为小于零的,则为自发;若差大于零,则为非自发。
答案:D2.下列对熵的理解不正确的是()A.同种物质气态时熵值最大,固态时熵值最小B.体系越有序,熵值越小;越混乱,熵值越大C.与外界隔离的体系,自发过程将导致体系的熵减小D.25℃、1.01×105 Pa时,2N2O5(g)===4NO2(g)+O2(g)是熵增的反应解析:熵指的是混乱程度,越混乱其熵值越大;对于同一物质,由固→液→气三态熵值逐渐增大,故A、B正确;自发过程是熵增的过程,故C错误;对于D选项中的反应,由于反应后分子数增多,故熵值逐渐增大。
答案:C3.下列关于判断过程的方向的说法正确的是()A.所有自发进行的化学反应都是放热反应B.高温高压条件下石墨转化为金刚石是自发的化学反应C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的过程D.同一物质的固、液、气三种状态的熵值相同解析:有些吸热反应也可以自发进行。
如2N2O5(g)===4NO2(g)+O2(g)是吸热反应,又是熵增的反应,所以A不正确。
高温高压条件下石墨转化为金刚石,要向体系中输入能量,本质仍然是非自发的,所以B不正确。
同一物质:气态时的熵值最大,液态时次之,固态时熵值最小,所以D不正确。
答案:C4.在298 K及101.325 kPa下发生下列反应:(1)2H2(g)+O2(g)===2H2O(l)(2)CaO(s)+CO2(g)===CaCO3(s)其熵变分别为ΔS(1)和ΔS(2),则下列情况中正确的是()A.ΔS(1)>0,ΔS(2)>0B.ΔS(1)<0,ΔS(2)<0C.ΔS(1)<0,ΔS(2)>0 D.ΔS(1)>0,ΔS(2)<0解析:当反应的气体分子数增多时,熵增加,反之,则减小。
由反应方程式(1)和(2)的各物质的状态分析,上述反应均为熵减小的反应,即ΔS(1)<0,ΔS(2)<0。
答案:B5.下列关于冰融化为水的过程判断正确的是()A.ΔH>0,ΔS<0 B.ΔH<0,ΔS>0C.ΔH>0,ΔS>0 D.ΔH<0,ΔS<0解析:融化是吸热的变化,故ΔH>0,冰融化成水,分子活动能力增强,混乱度增大,故ΔS>0。
答案:C6.下列说法正确的是()A.在常温下,放热反应一般能自发进行,吸热反应都不能自发进行B.NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g)ΔH=+185.57 kJ/mol,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向解析:正确解答本题,首先要明确焓判据和熵判据对化学反应方向的影响,然后利用自由能变化(复合判据)进行综合分析判断,同时要注意催化剂在化学反应中的作用。
A项错误,有些能使熵值增大的吸热反应可以自发进行;C项错误的原因是要将二者综合起来即利用复合判据进行判断;D项中使用催化剂只能降低反应的活化能,不能改变反应的方向。
答案:B7.下列说法不正确的是()A.铁生锈和氢燃烧均为自发放热过程B.冰融化的过程中,熵值增加C.无热效应的自发过程是不存在的D.同一物质固态时熵值最小解析:自发过程是在一定条件下不需要外力就能进行的过程。
铁生锈和氢燃烧均为混乱度减小,有序性增加、稳定性增强、放出热量的自发反应,A项正确;冰融化即有序性减小,混乱度增加,即熵值增加,B项正确;物质由有序转化为无序时,不一定发生热效应,如分子的扩散现象,C项错误;同一物质在固态时有序性最高,混乱度最小,熵值最小,D项正确。
答案:C8.已知在等温等压条件下,化学反应方向的判据为:ΔH-TΔS<0反应能正向自发进行ΔH-TΔS=0反应达到平衡状态ΔH-TΔS>0反应不能自发进行设反应A(s)===D(g)+E(g)ΔH-TΔS=(-4500+11T) J·mol-1,要防止反应发生,温度必须()A.高于409 KB.低于136 KC.高于136 K而低于409 KD.低于409 K解析:要防止反应发生,需满足ΔH-TΔS>0的条件,解不等式得T>409 K。
答案:A9.对下列过程的熵变的判断不正确的是()A.溶解少量食盐于水中,ΔS>0B.炭和氧气反应生成CO(g),ΔS>0C.H2O(g)变成液态水,ΔS>0D.CaCO3(s)加热分解为CaO(s)和CO2(g),ΔS>0答案:C10.下列过程属于熵增加的是()A.一定条件下,水由气态变为液态B.高温高压条件下,使石墨转化为金刚石C.2N2O5(g)===4NO2(g)+O2(g)D.散落的火柴的无序排列解析:熵增加,则体系的混乱度增加。
答案:CD11.在相同条件下有三个反应:①2A-+B2===2B-+A2;②2C-+A2===2A-+C2;③2B -+D===2D-+B2,由此得出的下列推断中你认为不合理的是()2A.氧化性:A2>B2>C2>D2B.还原性:C->A->B->D-C.2A-+D2===2D-+A2该反应能进行D.2C-+B2===2B-+C2该反应能进行解析:根据已知方程式可以判断氧化性物质的氧化性顺序为:D2>B2>A2>C2,还原性物质的还原性顺序为:C->A->B->D-;由于氧化性:D2>A2,因而C所述反应可以发生;又因氧化性:B2>C2,D所述反应也可以发生,这样,B、C、D三个选项所描述的是合理的,故选A。
答案:A12.对于化学反应方向的确定,下列说法正确的是()A.固体的溶解过程与焓变有关B.反应焓变是决定反应能否自发进行的唯一因素C.温度、压力一定时,放热的熵增加反应一定能自发进行D.在温度、压力一定的条件下,焓因素和熵因素共同决定一个化学反应的方向解析:ΔH-TΔS<0,在常温、常压下反应能自发进行,所以焓变和熵变是一定温度下化学反应能否自发进行的复合判据。
放热反应的焓变小于0,熵增加反应熵变大于0,都对ΔH -TΔS<0有利。
显然,放热的熵增加的反应一定能自发进行。
固体的溶解过程,体系的混乱度增大,它是熵增加的过程。
答案:CD13.25℃和1.01×105Pa时,反应2N2O5(g)===4NO2(g)+O2(g)ΔH=+56.7 kJ/mol,自发进行的原因是()A.是吸热反应B.是放热反应C.是熵减少的反应D.熵增大效应大于能量效应答案:D14.对于反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)ΔH=-444.3 kJ·mol-1ΔS =-280.1 J·mol-1·K-1在常温、常压下反应能自发进行,对反应的方向起决定性作用的是()A.熵变B.温度C.压强D.焓变答案:D二、非选择题(共2个小题,共30分)15.(15分)有A、B、C、D四个反应:在任何温度下都能自发进行的反应是__________;任何温度下都不能自发进行的反应是__________;另两个反应中,在温度高于__________℃时可自发进行的反应是__________;在温度低于__________℃时可自发进行的反应是________________________。
解析:本题考查了化学反应的复合判据。
由焓判据和熵判据组合的复合判据ΔH-TΔS 适合于所有过程和反应。
当ΔH-TΔS<0时,反应能自发进行;当ΔH-TΔS>0,反应不能自发进行。
在任何温度下都能自发进行的反应,ΔH-TΔS恒小于0,即ΔH<0,ΔS>0,满足此条件的为反应C;任何温度下都不能自发进行的反应,ΔH-TΔS恒大于0,即ΔH>0,ΔS<0,满足此条件的为反应B;反应A的复合判据ΔH-TΔS=10500 J/mol-T×30.0 J/(mol·K),当T>350 K,即t>77 ℃时,ΔH-TΔS<0,反应能自发进行;反应D的复合判据ΔH-TΔS=-11700 J/mol+T×105.0 J/(mol·K),当T<111.4 K,即t>-161.6 ℃时,ΔH-TΔS<0,反应能自发进行。
答案:C B77A-161.6 D16.(15分)电子工业中清洗硅片上的SiO2(s)的反应是SiO2(s)+4HF(g)===SiF4(g)+2H2O(g)ΔH(298.15 K)=-94.0 kJ·mol-1ΔS(298.15 K)=-75.8 J·mol-1·K-1,该反应为焓________(填“增”或“减”,下同),熵________的反应。
答案:减减。
