含有Th细胞表位的合成PCV2ORF2Cap多肽抗原的表达及免疫原性分析
Fh8明显增强PCV2 Cap蛋白的可溶性表达及抗原性

Fh8明显增强PCV2 Cap蛋白的可溶性表达及抗原性郭芸芸;张碧成;孙小涵;汪伟;何孔旺;牛家强;张雪寒【摘要】猪圆环病毒2型(Porcine circovirus type 2,PCV2)的主要功能蛋白Cap 蛋白,很难在体外获得可溶性表达.本研究旨在以Fh8蛋白为融合标签实现PCV2 ORF2基因在大肠杆菌中的可溶性表达,以小鼠评价可溶性Cap蛋白的抗原性.以病毒基因组为模板,扩增ORF2靶基因,插入pCold原核表达质粒,成功构建的pCold-ORF2阳性质粒转入大肠杆菌BL21中.利用SDS-PAGE分析Cap蛋白的可溶性表达情况,利用Western blotting鉴定Cap蛋白的反应原性.重组蛋白与佐剂乳化制备免疫原,免疫Balb/c小鼠,ELISA方法检测血清中Cap抗体,利用PCR检测组织脏器中病毒载量,以评估可溶性Cap蛋白的免疫原性.PCR结果表明,Fh8和PCV2 ORF2基因被成功扩增.SDS-PAGE结果表明Fh8标签显著提高了ORF2在大肠杆菌中的可溶性表达,分子量35000.Western blotting结果显示,猪PCV2阳性血清能够特异性的识别可溶性Cap蛋白.小鼠一次接种Cap蛋白28 d后,抗体全部转阳,免于PCV2的攻击.表明通过新型小标签实现了PCV2 ORF2基因的可溶性表达,且具有良好的免疫原性.%Cap protein is the main functional protein of porcine circovirus type 2(PCV2),but it is difficult to obtain soluble expression in vitro.Our object was to realize soluble expression of PCV2 ORF2 gene by Fh8-tagged in Escherichia coli ,and to evaluate the antigenicity of the recombinant Cap protein in mice. PCV2 DNA was used as template to amplify ORF2 gene and was cloned into prokaryotic expression vector pCold. The resultant pCold-ORF2 plasmid was transformed into E.coli BL21. SDS-PAGE and Western blotting assay were used to analyze the solubility of the recombinant protein and to identify its reactivity,respectively.Therecombinant protein and adjuvant were emulsified to prepare vaccine to immune Balb/c mice.The specific antibody of Cap recombinant protein in sera was detected by ELISA method,and virus loading in tissues was detected by PCR. So,the immunogenicity of Cap protein could be assessed. The PCR results showed that Fh8 and PCV2 ORF2 genes were successfully amplified. SDS-PAGE results showed that soluble expression of ORF2 in E. coli was significantly increased by Fh8 tag,and the molecular weight was 35 000. Western blotting results showed that the soluble Cap protein was recognized specifically by porcine PCV2 positive sera. Mice inoculated with the Cap protein vaccine produced high antibody titers at 28 d after initial immunization and could be well protected from PCV2 attack. The soluble expression of PCV2 ORF2 gene was achieved by a novel small label,and the Cap vaccine had good immunogenicity.【期刊名称】《江苏农业学报》【年(卷),期】2018(034)002【总页数】5页(P356-360)【关键词】猪圆环病毒2型;结构蛋白;Fh8;可溶性表达;抗原性【作者】郭芸芸;张碧成;孙小涵;汪伟;何孔旺;牛家强;张雪寒【作者单位】江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室/江苏省食品质量安全重点实验室——省部共建国家重点实验室培育基地,江苏南京210014;西藏农牧学院动物科学学院,西藏林芝860000;江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室/江苏省食品质量安全重点实验室——省部共建国家重点实验室培育基地,江苏南京210014;江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室/江苏省食品质量安全重点实验室——省部共建国家重点实验室培育基地,江苏南京210014;江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室/江苏省食品质量安全重点实验室——省部共建国家重点实验室培育基地,江苏南京210014;江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室/江苏省食品质量安全重点实验室——省部共建国家重点实验室培育基地,江苏南京210014;西藏农牧学院动物科学学院,西藏林芝860000;江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室/江苏省食品质量安全重点实验室——省部共建国家重点实验室培育基地,江苏南京210014【正文语种】中文【中图分类】S852.65+9.2猪圆环病毒2型(Porcine circovirus type 2,PCV2)可导致断奶仔猪多系统衰竭综合征(Postweaning multisystemic wasting syndrome, PMWS),它是猪圆环病毒家族中重要的成员,也是猪群中最常见的猪圆环病毒型[1-4]。
猪圆环病毒2型(PCV2)核衣壳蛋白免疫原性的鉴定和应用及其多抗在PCV2感染诊断中的应用

猪圆环病毒2型(PCV2)核衣壳蛋白免疫原性的鉴定和应用及其多抗在PCV2感染诊断中的应用帅江冰;李肖梁;陈宁;陈雪燕;方维焕【期刊名称】《微生物学报》【年(卷),期】2008(048)001【摘要】猪圆环病毒2型ORF2编码与病毒毒力相关的结构蛋白--核衣壳蛋白(Cap),该蛋白可以用于PCV2感染的血清学调查,但不同区域的PCV2分离株的ORF2特别是其抗原表位序列存在一定的突变.本研究将PCV2浙江分离株ORF2的主要抗原表位以及PCV1 ORF2进行了原核表达,将分别纯化的融合蛋白Cap2s 和Cap1s免疫SPF兔后制备多抗,并进一步分析了纯化蛋白的免疫原性和多抗的特性.Western blot结果表明无论Cap2s和Cap1s均能与两个多抗发生交叉反应,而PCV2或PCV1阳性猪血清只能分别特异性地识别Cap2s和Cap1s.IFA结果则证明两个多抗对于天然Cap蛋白无交叉反应性.利用Cap2s作为包被抗原对13个猪场的259份血清样品的PCV2抗体进行ELISA检测,平均阳性率为80.69%(209/259),而各猪场的阳性率差异较大(48.28%~100%).以上结果表明Cap2s可作为一个型特异性抗原用于浙江省本地猪场猪群血清中PCV2抗体的监控,而其多抗也可用于免疫组化对PCV2感染进行有效诊断.%As porcine circovirus 2 (PCV2) ORF2 encodes the major structural protein (capsid) that is closely related to the pathogenesis, the capsid (Cap) protein could be used as a target antigen for serological analysis. The immunoactivities of the truncated capsid proteins containing immunogenic epitopes of PCV2 (Cap2s) or PCV1 (Cap1s) expressed in Escherichia coli were described,aswell as the characteristic of their polyclonal antibodies in diagnosis ofPCV2 infection. Western blot analysis revealed that both Cap2s and Cap1s gave strong signals on nitrocellulose membranes to their corresponding polyclonal antibody. Furthermore, either PCV2-positive sera from PMWS cases or PCV1-positive swine sera could only recognize Cap2s or Cap1s, respectively. There was also no cross-reactivity between the two polyclonal antibodies when reacted with natural Cap proteins of viral particles on cells by immunofluorescence assay (IFA). Thus, an ELISA was then developed using PCV2 Cap as coating antigen to evaluate the sero-prevalence ofPCV2 infection in pigs. The PCV2-positive rate ranged from 48.28% to 100% among different herds (n=13) with an average of 80.69% (209/259). These results indicate that Cap2s was type-specific and could be used as a discriminative antigen for monitoring PCV2 antibody in serum. The polyclonal antibodies were also useful for differential identification ofPCV1 and PCV2 infection by immunohistochemistry.【总页数】6页(P85-90)【作者】帅江冰;李肖梁;陈宁;陈雪燕;方维焕【作者单位】浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,杭州,310029;浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,杭州,310029;浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,杭州,310029;浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,杭州,310029;浙江大学动物预防医学研究所,浙江省动物预防医学重点实验室,杭州,310029【正文语种】中文【中图分类】Q93;S852【相关文献】1.ELISA在猪圆环病毒2型血清流行病学调查中的应用 [J], 蒋成砚;李开明;谢昆;薛春丽2.PCR技术在猪圆环病毒2型检测中的应用 [J], 胡嘉彦3.猪圆环病毒2型( PCV2)灭活疫苗(LG株)在规模猪场的应用效果观察 [J], 夏伟;罗玉均;张宇辉;唐志芬;付朝阳4.英国三周龄仔猪应用猪圆环病毒2型(PCV2)疫苗的效果 [J], I.von Richthofen; N.Woolfenden; A.Lischewski; W.D.Strachan; 徐大为5.猪圆环病毒2型病毒样颗粒的制备及其在疫苗研制中的应用 [J], Chi J N;谢冰因版权原因,仅展示原文概要,查看原文内容请购买。
Th1-Th2细胞检测
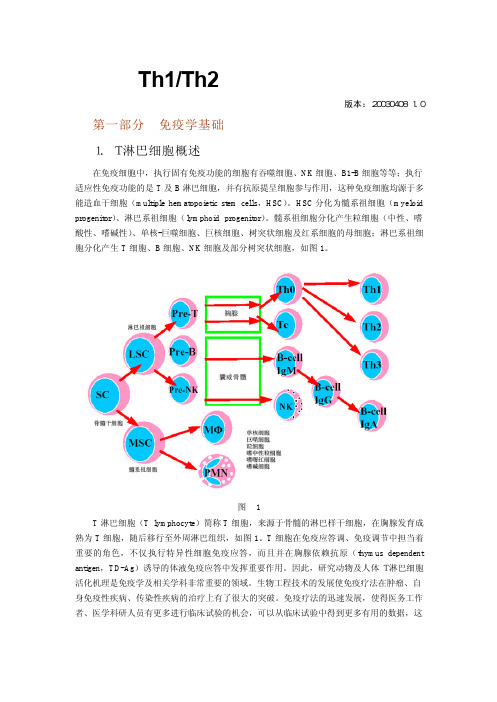
图1 T 淋巴细胞(T lymphocyte)简称 T 细胞,来源于骨髓的淋巴样干细胞,在胸腺发育成 熟为 T 细胞,随后移行至外周淋巴组织,如图 1。T 细胞在免疫应答调、免疫调节中担当着 重要的角色,不仅 执行特异性细胞免疫应答,而且并在胸腺依赖抗原(thymus dependent antigen,TD-Ag)诱导的体液免疫应答中发挥重要作用。因此,研究动物及人体 T 淋巴细胞 活化机理是免疫学及相关学科非常重要的领域。生物工程技术的发展使免疫疗法在肿瘤、自 身免疫性疾病、传染性疾病的治疗上有了很大的突破。免疫疗法的迅速发展,使得医务工作 者、医学科研人员有更多进行临床试验的机会,可以从临床试验中得到更多有用的数据,这
图4和图5详细描述了抗原递呈细胞向CD4+T细胞递呈抗原肽:MHCⅡ类分子复合物的免疫 学过程,详细解释可以参考相关专业著作。
同种瘤细胞杀伤(不确定)
(10)亚群名称:K细胞
分类标准:CD16(FcR-Ⅲ)
其它标记:CD2、CD3+/-、CD8+/-
细胞功能:抗体依赖的细胞介导的细胞毒作用(ADCC)
(11)亚群名称:NK样T细胞
分类标准:NK1.1、CD4下调(小鼠)
其它标记:CD3、CD2、限制性TCR、Vα14(Jα281)/Vβ7(小鼠)、Vα24(JαQ) /Vβ11(人)
细胞功能:上调Th2细胞免疫应答
(12)亚群名称:γδT淋巴细胞
分类标准:TCRγδ
Th1/Th2 细胞检测方法
第一部分 免疫学基础
版本:20030408 1.0
1.T 淋巴细胞概述
在免疫细胞中,执行固有免疫功能的细胞有吞噬细胞、NK 细胞、B1-B 细胞等等;执行 适应性免疫功能的是 T 及 B 淋巴细胞,并有抗原提呈细胞参与作用,这种免疫细胞均源于多 能造血干细胞(multiple hematopoietic stem cells,HSC)。HSC 分化为髓系祖细胞(myeloid progenitor)、淋巴系祖细胞(lymphoid progenitor)。髓系祖细胞分化产生粒细胞(中性、嗜 酸性、嗜碱性)、单核-巨噬细胞、巨核细胞、树突状细胞及红系细胞的母细胞;淋巴系祖细 胞分化产生 T 细胞、B 细胞、NK 细胞及部分树突状细胞,如图 1。
丙型肝炎病毒多表位抗原基因的构建与免疫原性研究

346 中国科学 C 辑 生命科学 2006, 36 (4): 346~354丙型肝炎病毒多表位抗原基因的构建与免疫原性研究*高 军 龚育平 赵 平 杨晓平 戚中田**(第二军医大学, 上海 200433)摘要 丙型肝炎病毒(HCV)基因易发生变异, 尤其是含中和抗原表位的高变区1(HVR1)变异性最大. 模拟HVR1的B 细胞表位具有涵盖多种天然表位的抗原特性, 保守的T 细胞表位具有各型间的相对保守性. 为解决HCV 高变性造成的疫苗研究障碍, 我们选取HCV E2区HVR1(384~410 aa)模拟B 细胞表位9条、C 区的保守CTL 表位2条(35~44 aa, 132~140 aa)、NS3区保守的CTL 表位1条(1073~1081 aa)及NS3区保守的Th 表位1条(aa 1251~1259), 各表位之间以插入3个氨基酸为连接臂, 人工合成上述13条表位基因串联的HCV 多表位抗原基因(mfc ). 将mfc 与gst 基因融合, 表达了多表位抗原蛋白GST-MFC. 同时, 构建了白介素-2信号肽基因、PADRE 表位基因和mfc 基因串联的候选HCV DNA 疫苗, 即质粒pVAX1.0-st -mfc . 以GST-MFC 蛋白免疫家兔和质粒pVAX1.0-st -mfc 免疫小鼠, 采用ELISA 和Western blot 方法, 应用10条具有代表性的HCV HVR1合成肽进行检测, 证明有9条HVR1合成肽能与所有免疫动物血清反应, 交叉反应率(cross reactivity, CR)为90%. 应用HCV 抗体阳性的感染者血清与多表位抗原GST-MFC 蛋白进行反应, 证明其反应识别率(reactivity frequency, RF)为75%. 上述结果表明, 筛选合成的HCV 多表位抗原基因mfc 具有HCV 中和抗原表位的特征, 可作为HCV 疫苗研制的候选基因. 关键词 丙型肝炎病毒 多表位肽 丙型肝炎病毒高变区1 模拟表位 T 细胞保守表位收稿日期: 2005-06-03; 接受日期: 2005-12-24* 国家高技术研究发展计划(863计划, 2002AA214161)和国家自然科学基金(批准号: 30471596)资助项目 **联系人, E-mail: qizt@丙型肝炎病毒(HCV)的感染呈世界性分布, 全球HCV 感染率约为3%, 约1.7亿人感染HCV, 每年新发丙型肝炎病例约 3.5万例. 我国一般人群抗HCV 阳性率约为3.2%, 急性感染者中约50%~80%发展成慢性, 其中约20%可发展为肝硬化, 1%~4%可发展为肝癌. 丙型肝炎治疗常用干扰素和利巴韦林, 其应答率约为40%. 由于HCV 高度变异、缺乏体外培养系统及无可靠的小动物模型等, HCV 疫苗的第4期高 军等: 丙型肝炎病毒多表位抗原基因的构建与免疫原性研究347研究困难重重. 如何突破常规疫苗研究方法, 研制出具有广泛交叉保护性的疫苗, 是目前HCV研究的热点之一[1~4].HCV基因组E2区的N端存在一个由27个(384~410 aa)氨基酸组成的高变区1(HVR1). 研究表明, HVR1区含有HCV主要的中和表位, 但自然状况下为株特异性, 而且, 在免疫压力下此区段极易发生变异, 导致HCV免疫逃逸[5,6]. Puntoriero等人[7]采用噬菌体展示肽库技术, 以不同丙肝患者的血清对肽库进行筛选, 鉴定出了具有交叉反应性的多条HVR1模拟B 细胞表位. 这些模拟B细胞表位的合成肽不仅可以被不同的HCV感染者血清抗体识别, 具有很高的反应识别率(reactivity frequency, RF), 而且, 免疫动物的血清可以与不同型别的HVR1合成肽发生交叉反应, 具有较高的交叉反应率(cross reactivity, CR), 表明HVR1模拟B细胞表位合成肽具有用于HCV疫苗研究的前景. 同时, 越来越多的实验证明, T细胞免疫在控制HCV感染中有重要作用, HCV各组成蛋白中的Th 和CTL抗原表位[8,9]以及外周血和肝脏内的Th1/Th2与HCV感染后的转归相关[10]. 因此, 将诱导体液免疫和细胞免疫的表位同时引入, 已成为HCV疫苗研究的一个新趋势.本研究选取HCV E2蛋白HVR1模拟B细胞表位9条、C区的保守CTL表位2条、NS3区保守CTL表位及保守Th表位各1条, 将上述13条表位之间以3个氨基酸连接, 人工合成了一段表位基因串联的HCV多表位抗原基因(multi-epitope fragment combination, mfc). 以此基因为基础, 进行了蛋白质表达、核酸疫苗构建及动物免疫接种, 检测了反应识别率、交叉反应率, 评价了该HCV多表位抗原的B 细胞免疫原性.1 材料与方法1.1 HVR1表位基因片段的选择根据Puntoriero等人[7]报道的HCV HVR1区模拟B细胞表位中选取9条, 从Renard等人[11]报道的C区保守CTL细胞表位中选取2条, 从Brinster等人[12]报道的NS3区保守CTL细胞表位及Diepolder等人[13]报道的Th细胞表位中各选取1条. 各表位的序列见图1. 1.2 多表位抗原基因的串联合成、表达和DNA 疫苗的构建应用兼顾pichia酵母偏性密码子和大肠杆菌偏性密码子来设计基因, 各个模拟B细胞表位之间和B 细胞表位与细胞T表位之间, 以GPG(甘氨酸-脯氨酸-甘氨酸)作为连接臂分开, 因为脯氨酸可在两个小氨基酸间形成钢性扭转, 从而保证各个B细胞表位的相对独立. 同时, 在各个T细胞表位之间, 以AAY(丙氨酸-丙氨酸-酪氨酸)作为连接臂分开, 因为这个序列具有优先被蛋白酶切割的特点, 有利于T表位的独立提呈. 设计合成的mfc基因长969 bp, 为了便于合成及克隆, 在mfc基因的5′端引入Bam HⅠ和Eco RⅠ酶切位点, 中间561 bp处(从第一个密码子起)引入KpnⅠ酶切位点, 3′端引入NotⅠ和SalⅠ酶切位点, 以KpnⅠ酶切位点分为A、B两段分别合成, 合成策略及合成后DNA序列和氨基酸序列见图1. A, B两段合成基因分别与T-载体连接, 获得重组质粒pMD18-T-A和pMD18-T-B.分别将质粒pMD18-T-A经Bam HⅠ/Kpn lⅠ双酶切、质粒pMD18-T-B经KpnⅠ/SalⅠ双酶切、GST融合表达载体pGEX-4T-1(购于Amersham Biosciences)经Bam HⅠ/SalⅠ双酶切后, 回收目的片段A, B和载体片段. 三片段连接后, 转化大肠杆菌DH5α, 酶切鉴定出重组表达质粒, 并进行测序检测其全基因序列, 命名为pGEX-4T-gst-mfc, 表达框架见图2(a).本实验室前期工作证明[14], 应用信号肽和通用型辅助性T细胞表位PADRE串联基因(st)可增强DNA 疫苗的免疫原性. 质粒pUC-mT-st(本室赵平博士提供)经Hin dⅢ和Bam HⅠ酶切, 回收st基因; 质粒pGEX-4T-mfc经Bam HⅠ和XhoⅠ酶切, 回收mfc基因; 载体质粒pV AX1.0(购于Invitrogen)经Hin d Ⅲ和XhoⅠ酶切, 回收载体大片段. 3个片段同时连接, 转化大肠杆菌DH5α, 酶切鉴定出重组表达质粒, 并进行测序检测其全基因序列, 命名为pV AX1.0-st- mfc, 质粒结构见图2(b). 按常规方法大量抽提超螺旋质粒DNA, 即获得HCV候选DNA疫苗.348中国科学 C 辑 生命科学第36卷图1 HCV 多表位抗原基因mfc 的合成策略、DNA 序列和氨基酸序列(a) 表示mfc 基因分为A 与B 两段合成和所用26条部分重叠的核酸序列排列方式; (b) 显示mfc 基因的DNA 序列和相应的氨基酸序列1.3 多表位抗原基因的融合表达用构建的pGEX-4T-gst -mfc 转化大肠杆菌BL21(DE3), 同时用质粒pGEX-4T-1转化的大肠杆菌DE3作为对照, 分别在3 mL 的2×YT 培养基中37℃扩增12 h, 加入异丙基硫代半乳糖苷 (IPTG)至终浓度为0.6 mmol/L 诱导3 h. 诱导结束后取1 mL菌液, 常规变性裂解处理及7.5%P AGE 电泳检测, 筛选高表达菌株. 对高表达株进行诱导条件优化, 大量扩增重组表达菌, 按常规方法进行超声破菌, 上清用Glutathione Sepharose TM 4B(购于Amersham Biosciences)纯化, 获得多表位抗原蛋白GST-MFC. 多表位抗原蛋白冷冻干燥后用纯水溶解, 并用Brandford 法测定蛋白浓度.第4期高 军等: 丙型肝炎病毒多表位抗原基因的构建与免疫原性研究349图2 原核表达载体pGEX-4T-mfc和真核表达载体pV AX-1.0-st-mfc的构建策略、表位基因结构及连接处读码序列(a) 原核表达载体pGEX-4T-mfc; (b) 真核表达载体pVAX1.0-st-mfc1.4 多表位抗原蛋白与HCV感染者阳性血清的反应20份丙型肝炎患者血清由上海长海医院传染科提供, 均为HCV抗体检测阳性(检测试剂盒购于上海复星长征医学科学有限公司). 正常人血清4份取自健康自愿者, HCV抗体均为阴性.(1) ELISA方法检测多表位抗原蛋白与HCV感染者阳性血清的反应[15]: 用50 mmol/L的NaHCO3缓冲液作为包被缓冲液, 调整多表位抗原GST-MFC蛋白浓度为0.2 μg/μL, 每孔100 μL加入酶标板. 按常规方法封闭后, 加入100 μL待检血清(1︰10稀释), 设复孔. 室温下震荡反应2 h, 洗板3次, 加入100 μL HRP-兔抗人IgG(1︰1000稀释), 室温震荡反应1 h, 洗板3次, 加入100 μL TMB显色液, 避光反应15 min. 用波长A450 nm参照A630 nm检测, 以空白孔校零, 读取A450nm值, 每个检测设复孔, 取平均值为检测结果.检测标准为:P/N≥2.1时为阳性;反之为阴性.(2) Western blot方法检测多表位抗原蛋白与HCV阳性血清的反应: 配制12.5%的SDS聚丙烯酰胺分离胶. 检测孔加入上述亲和层析纯化获得的多表位抗原蛋白GST-MFC(其中含GST单体蛋白成分)2 μg/泳道. 电泳结束后, 以电转移法将凝胶中的蛋白条带转至1张硝酸纤维素膜, 水洗硝酸纤维素膜数次, 加入封闭液(20 mmol/L Tris-HCl, pH 7.4, 150 mmol/L NaCl, 0.1% Tween20, 5% 脱脂奶粉), 室温封闭1.5 h, 弃封闭液, 加入HCV抗体阳性血清(1︰10稀释)作为一抗, 室温反应 2 h, 用洗液(20 mmol/L Tris-HCl, pH 7.4, 150 mmol/L NaCl, 0.1% Tween20)漂洗硝酸纤维素膜6次, 弃洗液, 加入HRP-兔抗人IgG(1︰1000稀释)作为二抗, 室温反应1.5 h, 用洗液再次漂洗硝酸纤维素膜6次, 放入显色液(0.01 mol/L Tris-HCl , pH 7.6, 6 mg二氨基联苯胺, 临用时加入30% H2O2 20 μL混匀)中轻轻摇动显色, 条带出现后, 即用水漂洗终止反应, 晾干保存.1.5 动物接种实验(1) 多表位抗原蛋白免疫家兔: 健康新西兰家兔购于上海海军医学研究所实验动物中心, 雌、雄各1只, 体重 2.5~2.6 kg. 用纯水调整多表位抗原蛋白浓度至0.2 g/mL, 加入等体积的完全弗氏佐剂(首次接种使用)和不完全弗氏佐剂(加强免疫使用)乳化. 选择家兔背部6~8个部位分别接种0.5~1 mL/处, 首次接种剂量为1.0 mg/(只·次), 以后每隔1周加强接种1次, 加强接种剂量为0.2~1.0 mg/(只·次), 共接种5次.(2) 多表位抗原DNA候选疫苗免疫小鼠: 健康BALB/c小鼠购于本校实验动物中心, 雌雄不限, 6周龄, 共12只, 体重(18.5±1.5) g, 设定实验组和对照组各6只. 实验组小鼠于双侧胫骨前肌肉注射质粒pV AX1.0-st-mfc, 每侧50 μL, 质粒浓度为2 μg/μL, 隔2周加强1次, 连续注射3次, 同时, 对照组注射PBS.1.6 多肽合成为了检测多表位抗原蛋白免疫动物后的效果, 评价特异性及保护性免疫反应, 从本实验室前期研350中国科学 C 辑 生命科学第36卷断标准为:P/N ≥2.1时为阳性; 反之为阴性.究结果及GenBank 中挑选自然HVR1变异株序列, 合成了10条具有代表性的HVR1多肽(见表1). 这些合成肽长度均为27aa(384~410 aa), 代表不同的HCV 变异株, 可用于检测免疫血清的交叉反应性.2 结 果2.1 多表位抗原基因的合成和候选DNA 疫苗的构建表1 HCV HVR1合成肽的氨基酸序列编号氮基酸序列P1 NTRITGGSAARTTGGFVGLFSFGAKQN P2 GTYTTGGAQGRATQGLTSLFSRGSAQK P3 STHVTGGVQGHSLQRLTSLFTFGPAQK P4 HTRTTGGVAARTTSGLTSLFSSGPSQK P5 GTRVTGGAQGRYHRSLTSLFTPGPTQR P6 ETHTSGGSVARAAFGLTSIFSPGAKQN P7 NTYVTGGSQGRAVAGRFAGLLQPGAKQN P8 ETHSVGGSAAHTTSRFTSLFSPGPQQN P9 STYSMGGAAAHNARGLTSLFSSGASQRP10 ETYIIGAATGRTTAGLFSLFSSGSQQN 将合成的mfc 基因克隆到pGEX-4T-1中, 构建成原核表达载体pGEX-4T-1-mfc . 用Bam H Ⅰ和Kpn Ⅰ以及Eco R Ⅰ和 Sal Ⅰ两组双酶切进行鉴定, 见图3(a), DNA 测序证明重组载体中的mfc 基因序列与设计的序列一致.重组真核细胞表达载体pVAX1.0-st -mfc 经Hin d Ⅲ和 Bam H Ⅰ双酶切后, 得到120 bp 的st 基因, 经Bam H Ⅰ和Xho Ⅰ双酶切后, 得到970 bp 的mfc 基因, 经Hin d Ⅲ和Xho Ⅰ双酶切后, 得到1090 bp 的st-mfc 基因. 酶切鉴定结果见图3(b), DNA 测序证实pVAX1.0-st -mfc 接头连接与读码框架正确、完整.1.7 动物免疫血清的检测(1) 诱生抗体的检测: 应用上述第1.4小节(1)的ELISA 方法, 待检免疫动物血清(1︰100稀释)作为一抗, HRP-羊抗兔或兔抗鼠IgG 作为二抗, 测定A 450nm 值. 同时, 应用上述第1.4小节(2)的Western blot 方法检测诱生抗体特异性识别GST 蛋白情况.2.2 多表位抗原蛋白的表达重组质粒pGEX-4T-1-mfc 转化的大肠杆菌BL21(DE3)经IPTG 诱导后, 多表位抗原蛋白GST-MFC 的表达量约占菌体蛋白的1%~5%, 从7 g 湿菌中可纯化出约 2 mg 蛋白质. 从纯化获得的GST- MFC 蛋白电泳图(图4(a))中可以看出, 纯化液中除包含相对分子量约为57.6 kD 的GST-MFC 蛋白外, 也含有较大量的GST 单体.(2) 诱生抗体与天然HVR1合成肽的交叉反应性检测: 采用ELISA 方法, 用包被缓冲液稀释多聚赖氨酸偶联(MAPs)的HVR1合成肽为100 μg/mL, 而后包被ELISA 板(Nunc). 免疫动物血清(1∶100稀释)作为一抗, HRP-羊抗兔或兔抗鼠IgG 作为二抗. 用无关合成肽作为对照. 测定各个合成肽同免疫血清反应的A 450nm 值, 每个检测设复孔取平均值. 结果判2.3 多表位抗原蛋白与丙肝患者血清反应Western blot 检测发现, 丙型肝炎患者血清可特图3 质粒pGEX-4T-1-mfc 和pVAX1.0-st -mfc 的酶切鉴定(a) 质粒pGEX-4T-1-mfc 的酶切鉴定. 1示λDNA/Hin dmarker Ⅲ; 2和3示质粒 pGEX-4T-mfc ; 4示pGEX-4T- mfc ( Bam H Ⅰ和 Kpn Ⅰ酶切); 5示pGEX-4T-1-mfc (EcoR Ⅰ和Sal Ⅰ酶切). (b) 质粒pVAX1.0-st -mfc 的酶切鉴定. 1示pVAX1.0-st-mfc 被Hin d Ⅲ和Bam H Ⅰ酶切产生的 120 bp 和3970 bp 片段; 2示pVAX1.0-st -mfc 被Bam H Ⅰ和Xho Ⅰ酶切产生970 bp 和3120 bp 片段; 3示pVAX1.0-st -mfc 被Hin d Ⅲ和Xho Ⅰ酶切产生1090bp 和3000 bp 片段; 4示质粒pVAX1.0-st -mfc ; 5示DL15000 marker第4期高 军等: 丙型肝炎病毒多表位抗原基因的构建与免疫原性研究 351异性识别多表位抗原蛋白, 而不识别单纯的GST 蛋白(图4(b)). 表明MFC 蛋白具有模拟HCV 抗原表位的特性, 但实验中将丙型肝炎患者血清稀释到1︰200以上时, 几乎不能检测到杂交带, 提示丙肝患者血清中的抗HVR1抗体滴度较低.图4 HCV 多表位抗原蛋白及同丙型肝炎患者血清的反应(a) 1和2分别为0.5和1 μg 的纯化的多表位抗原蛋白; (b) 3为牛血清白蛋白对照, 4为0.5 μg 纯化的多表位抗原蛋白ELISA 检测发现, 多表位抗原蛋白能与20份丙型肝炎抗体阳性血清中的15份血清发生反应, 识别反应率(RF)为75%, 具体测定值见表2.2.4 多表位抗原蛋白和DNA 疫苗诱生抗体的检测结果(1) 抗体生成量的ELISA 检测结果: 多表位抗原蛋白免疫家兔后第2周即可检测到低水平的抗多表位抗原蛋白抗体, 自第6周开始明显升高, 至10周升达高峰, 抗体的动态变化见图5(a).质粒pVAX1.0-st -mfc 肌肉注射免疫小鼠后, 于第2周即可检到低水平的抗体, 与免疫前及对照小鼠相比有显著差异(P <0.05), 第3次注射后2周(即首次免疫后第6周), 抗体升至最高. 而后, 在首次免疫后8周特异性抗体滴度迅速下降(图5(b)). 在第12周再次注射质粒pVAX1.0-st -mfc 加强免疫后, 抗体在1周内迅速升高.(2) 抗体特异性的Western blot 印迹结果: 将多表位抗原蛋白与免疫动物的血清进行Western blot 杂交, 免疫家兔和小鼠的血清均能与多表位抗原蛋白GST-MFC 反应. 由于免疫家兔所用的抗原是亲和层析纯化的多表位抗原蛋白, 其中含有融合的GST 成分和单纯的GST 单体, 所以家兔免疫血清还能同GST 单体蛋白反应(见图5(c)), 而免疫小鼠的质粒pVAX1.0-st -mfc 表达的抗原不含有GST 成分, 所以DNA 免疫小鼠血清只表现出同多表位抗原蛋白GST-MFC 的杂交带.(3) 抗体与10条HVR1合成肽的交叉反应性检测结果: ELISA 检测结果显示, 以无关肽作为检测对照, 设定P/N 大于2.1为检测阳性, 多表位抗原蛋白免疫家兔后第8周血清(1︰1000稀释)和质粒pVAX1.0-st -mfc 免疫小鼠后第6周混合血清(1∶100稀释)均能同10条肽中的9条发生反应, 各条肽同血清的反应强度不尽相同, 其中第5条均不能被识别, 交叉反应率(CR)均为90%(图6). 此结果提示, 多表位抗原蛋白中包含的模拟表位可诱导出一定程度的交叉反应性中和抗体, 预示其作为疫苗应用时, 具有预防多数HCV 变异株感染的能力.表2 HCV 多表位抗原蛋白MFC 同20份丙型肝炎患者阳性血清的识别反应的ELISA 检测结果a)血清编号A 450 nm 值判定结果血清编号A 450 nm 值判定结果血清编号A 450 nm 值判定结果P1 0.144 + P9 1.00 + P17 0.045 − P2 0.132 + P10 0.15 + P18 0.051 − P3 0.065 −P11 0.12 + P19 0.034 −P4 0.382 + P12 0.20 + P20 0.131 + P5 0.657 + P13 0.13 + C1 0.032 − P6 0.041 −P14 0.11 + C2 0.042 −P7 0.111 + P15 0.84 + C3 0.035 − P8 0.163 + P16 0.90 + C4 0.028 − a) P1~P20为20份丙肝阳性血清, C1~C4为4份正常人血清, GST-MFC 为纯化的HCV 多表位抗原蛋白. A 450 nm 值为两次独立实验的平均值. “+”表示判定结果为阳性, “−”表示判定结果为阴性(检测标准为: 设4份正常人血清的平均A 450 nm 值为N, 各方格内的A 450 nm 检测值为P, P/N 大于2.1为检测阳性)352中国科学C辑生命科学第36卷图5 HCV多表位抗原蛋白及DNA疫苗pVAX1.0-st-mfc诱生抗体的ELISA和Western blot检测(a) 为HCV多表位抗原蛋白免疫家兔诱生抗体的变化图. ◆为兔1诱生抗体检测值, ●为兔2诱生抗体检测值, ▲表示接种时间; (b) 为HCV多表位抗原DNA疫苗pVAX1.0-st-mfc免疫小鼠诱生抗体的变化图. ◆为DNA注射免疫组诱生抗体检测值, ●为PBS注射对照组的诱生抗体检测值, ▲表示接种时间; (c) 为诱生抗体同纯化的HCV多表位抗原蛋白的Western blot杂交结果. T1图为DNA疫苗pVAX1.0-st-mfc免疫小鼠血清的杂交图, 1为BSA对照, 2为多表位抗原蛋白. T2图为纯化的HCV多表位抗原蛋白电泳图, 3为纯化的多表位抗原蛋白, 4为标准分子量Marker. T3为多表位抗原蛋白免疫家兔血清的杂交图, 5为多表位抗原蛋白, 6为BSA对照图6 HVR1合成肽与HCV多表位抗原诱生抗体的交叉反应结果(ELISA检测, 方格内为A450 nm值)P1~P10为10条自然HCV变异株的HVR1序列的合成肽, 方格内的数值为两次独立实验的A450nm值, 灰色方格表示检测结果为阳性(检测标准为: 以无关的合成肽作为N, 以各方格内的检测值为P, P/N大于2.1为检测阳性), 浅灰色为2.1<P/N<3, 深灰色为P/N>33 讨论众多研究及本实验室前期工作表明, HVR1区存在中和表位, 但高度的变异性限制了其疫苗应用研究[15]. 近年来对HVR1区免疫特性深入分析, 得到部分启示性结果. Penin等人[16]对EMBL收集的1382条和6个经IFN-α2a治疗前后的HVR1序列分析发现, 其27个氨基酸(384~410 aa)存在一定的功能保守性. Puntoriero等人[7]提出: HVR1的免疫原性变化较其基因结构变化小, 以变异的HVR1序列为基础, 设计出简并保守的HVR1氨基酸序列, 以此构建噬菌体展示肽库, 以不同丙型肝炎患者的血清对肽库进行筛选, 鉴定出了具有交叉反应性的模拟表位. 以此模拟表位免疫动物, 可诱导出能与不同株HVR1交叉反应的抗体. Watanable等人[17]发现天然的HVR1序列同Puntoriero提出的HVR1保守序列的相似性可决定与HCV患者血清的交叉反应性. 而且, Zucchelli等人[18]用HVR1模拟表位替换天然E2蛋白中的HVR1序列, 构建了多个模拟E2蛋白的核酸疫苗, 以单一和“鸡尾酒”形式免疫家兔, 提出了HVR1模拟表位联合性疫苗研究的新途径.由于分子生物学和免疫分子学的快速发展, 人工合成含多个抗原表位基因已逐步用于复合多价疫苗的研究. 本研究应用了多个HVR1模拟表位串联构建人工抗原基因, 以期增加模拟表位的涵盖范围及开发应用的方便性. 选用的9条模拟B细胞表位参照了Puntoriero等人[7]报道的噬菌体展示肽库中筛选得到的HVR1模拟表位. 为增加疫苗的免疫原性, 我们还参考有关文献选用了4条HCV保守的T细胞表第4期高 军等: 丙型肝炎病毒多表位抗原基因的构建与免疫原性研究353位, 主要是经HLA-A2转基因鼠和临床丙型肝炎患者外周血验证的两段C区35~45(YLLPRRGPRL)和132~140(DLMGYIPLV) CTL表位[11]、NS3区1073~1081(CVNGVCWTV)[12], 能同多种MHCⅡ类分子结合(HLA-DR4, HLA-DR11, HLA-DR12, HLA-DR13和HLA-DR16)的NS3区(1251~1259 aa, VLVLNPSVA)Th表位[13]. 这些表位的联合应用在某种程度上也集合模拟了HCV的主要保护性抗原表位.在分析体液免疫反应时, 我们进行了两方面的评价. 一方面评价了HCV感染者血清是否可以识别结合MFC蛋白, 即识别反应率RF的测定, 检测结果显示HCV抗体阳性血清能同MFC蛋白特异性结合, 推测结合位点应该是MFC包含的HVR1模拟B细胞表位, 具体哪些表位参与结合, 需进一步实验分析, 但从某种程度上说, MFC包含的HVR1模拟B细胞表位具有独立的免疫原性. 但实验中我们发现多数HCV感染者阳性血清同MFC反应性较弱, 而且有些不能发生反应, 分析可能的原因在于本研究选用的模拟B细胞表位模拟了HVR1中和表位的特性, 推测丙型肝炎慢性患者体内抗HVR1中和表位的抗体滴度一般较低或缺如, 这也从一个侧面说明为什么丙型肝炎容易慢性化. 另一方面评价了MFC蛋白诱生的抗体是否具有交叉结合中和活性, 即交叉反应性CR的测定, 因为国内外研究者普遍认为存在于HCV病毒HVR1区内的中和表位为线性表位, 所以, 参照自然感染的不同HCV病毒株HVR1序列, 人工肽合成的HVR1合成肽在某种程度上可以代替完整病毒, 用于评价免疫抗体的中和活性, 而且, 针对HVR1序列中每个位点上存在的氨基酸特性, 应用软件分析自然感染HCV变异株HVR1序列的相似性, 选取多条彼此存在较大差异性的HVR1序列, 组成评价交叉反应性的“评价肽组”, 对免疫抗体的交叉中和活性进行评价[7]. 本研究依据上述理论, 选用了10条HVR1合成肽组成自己的“评价肽组”, 其中5条来源于GenBank登录序列, 5条来源于本实验室前期报道的中国HCV变异株. 应用本研究的“评价肽组”检测表明MFC蛋白免疫血清具有90%的交叉反应性, 尤其全部可以同5条中国HCV变异株HVR1合成肽交叉结合, 预示本研究构建的HCV多表位抗原MFC具有用于预防中国人群HCV感染的前景. 我们还对质粒pVAX1.0-st-mfc DNA疫苗小鼠免疫后的脾细胞增殖、Th1型细胞因子分泌和迟发型超敏反应等细胞免疫反应进行了检测, 结果证实尚需在HLA转基因动物体内进一步证实.参考文献1 中华医学会肝病学分会, 中华医学会传染病与寄生虫学分会.丙型肝炎防治指南. 中华医学杂志, 2004, 84(9): 775—7802 戚中田, 杜平. 丙型肝炎病毒与丙型肝炎. 上海: 上海科学技术出版社, 1992. 1—103 Fried M W, Shiffman M L, Reddy R K, et al. Peginterferon alfa-2aplus ribavirin for chronic hepatitis C virus infection. N Engl J Med, 2002, 347(13): 975—982 [DOI]4 庄辉. 重视丙型肝炎的研究. 中华肝脏病杂志, 2004, 12(2):65—665 Pavio N, Lai M M. The hepatitis C virus persistence: how toevade the immune system? J Biosci, 2003, 28(3): 287—3046 Forns X, Thimme R, Govindarajan S, et al. Hepatitis C viruslacking the hypervariable region 1 of the second envelope protein is infectious and causes acute resolving or persistent infection in chimpanzees. Proc Natl Acad Sci USA, 2000, 97(24): 13318—13323 [DOI]7 Puntoriero G, Meola A, Lahm A, et al. Towards a solution forhepatitis C virus hepervariability: mimotopes of the hypervariable region 1 can induce antibodies cross-reacting with a large number of viral variants. EMBO J, 1998, 17: 3521—3533 [DOI]8 Thimme R, Oldach D, Chang M K, et al. Determinants of viralclearance and persistence during acute hepatitis C virus infection.J Exp Med, 2001, 194(10): 1395—1406 [DOI]9 Major M E, Mihalik K, Puig M, et al. Previously infected and re-covered chimpanzees exhibit rapid responses that control hepatitisC virus replication upon rechallenge. J Virol, 2002, 76(13): 6586—6595 [DOI]10 Puig M, Major M E, Mihalik K, et al. Immunization of chimpan-zees with an envelope protein-based vaccine enhances specific humoral and cellular immune responses that delay hepatitis C vi-rus infection. Vaccine, 2004, 22(8): 991—1000 [DOI]11 Renard N, Boucreux D, Lemonnier F, et al. HLA-A2 transgenicmouse model: potential utility for development of an HCV vac-cine. J Hepatol, 2000, 32(2): 363—364 [DOI]12 Brinster C, Muguet S, Lone Y C, et al. Different hepatitis C virusnonstructural protein 3 (Ns3)-DNA-expressing vaccines induce in354中国科学C辑生命科学第36卷HLA-A2.1 transgenic mice stable cytotoxic T lymphocytes that target one major epitope. Hepatology, 2001, 34(6): 1206—1217 [DOI]13 Diepolder H M, Gerlach J T, Zachoval R, et al. ImmunodominantCD4+ T-cell epitope within nonstructural protein 3 in acute hepati-tis C virus infection. J Virol, 1997, 71(8): 6011—601914 赵平, 赵兰娟, 曹洁, 等. 信号肽和辅助性T细胞表位增强HBV核心抗原DNA 疫苗诱导的免疫应答. 生物化学与生物物理学报, 2002, 34(3): 341—34615 赵兰娟, 刘厚奇, 朱诗应, 等. 丙型肝炎病毒致病新模式: 包膜蛋白2对MAPK/ERK途径的激活. 中国科学, C辑, 2003, 33(3):246—25216 Penin F, Combet C, Germanidis G, et al. Conservation of the con-formation and positive charges of hepatitis C virus E2 envelope glycoprotein hypervariable region 1 points to a role in cell at-tachment. J Virol, 2001, 75(12): 5703—5710 [DOI]17 Watanable K, Yoshioka K, Ito H, et al. The hypervariable region 1protein of hepatitis C virus broadly reactive with sera of patients with chronic hepatitis C has a similar amino acid sequence with the consensus sequence. Virology, 1999, 264: 153—158 [DOI]18 Zucchelli S, Roccasecca R, Meola A, et al. Mimotopes of thehepatitis C virus hypervariable region 1, but not the natural se-quences, induce cross-reactive antibody response by genetic im-munization. Hepatology, 2001, 33: 692—703 [DOI]。
猪圆环病毒2型衣壳蛋白(Cap)在293T细胞中的亚细胞定位

猪圆环病毒2型衣壳蛋白(Cap)在293T细胞中的亚细胞定位符芳;李曦;李雪松;李海忠;陈欣;王伟;魏萍【期刊名称】《中国预防兽医学报》【年(卷),期】2010(032)005【摘要】猪圆环病毒2型(PCV2)ORF2基因编码病毒的核衣壳蛋白(Cap),该蛋白属于病毒保护性抗原,具有重要免疫功能.本研究以PCV2 871毒株基因组为模板,用特异性上下游引物扩增获得ORF2基因,利用真核表达载体构建了表达PCV2 Cap 蛋白的重组质粒pCAGGS-ORF2.采用脂质体将pCAGGS-ORF2转染至293T细胞,用抗PCV2-Cap单克隆抗体对重组质粒转染细胞进行了免疫活性分析和免疫荧光检测,表明Cap蛋白在细胞中获得表达;利用共聚焦显微镜对Cap蛋白在293T 细胞中的亚细胞定位观察结果表明,转染24 h后可见Cap蛋白的表达随培养时间延长显著增多,72 h达到高峰,表达的Cap蛋白主要分布在细胞核中.构建的pCAGGS-ORF2真核表达重组质粒在293T细胞中的表达,为进一步PCV2基因疫苗的研制奠定了基础.【总页数】4页(P338-341)【作者】符芳;李曦;李雪松;李海忠;陈欣;王伟;魏萍【作者单位】东北农业大学动物医学学院.黑龙江,哈尔滨,150030;中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江,哈尔滨,150001;中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江,哈尔滨,150001;中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江,哈尔滨,150001;中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江,哈尔滨,150001;中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江,哈尔滨,150001;中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江,哈尔滨,150001;东北农业大学动物医学学院,黑龙江,哈尔滨,150030【正文语种】中文【中图分类】S852.65【相关文献】1.猪圆环病毒2型重组衣壳蛋白在昆虫细胞中的表达及免疫原性分析 [J], 徐铮;马晓莉;林彦星;董建国;王磊;刘燕玲;刘清神;宋长绪2.陆川猪保育猪圆环病毒2型和细环病毒2型混合感染病例的诊断 [J], 李莹莹;赵武;秦毅斌;何颖;李斌;卢冰霞;陈忠伟;闭炳芬;梁家幸3.猪圆环病毒衣壳蛋白在昆虫细胞中表达形成病毒样颗粒的研究 [J], 李玲;李国新;徐彦召;高景鹏;周艳君;童光志4.表达猪圆环病毒2型衣壳蛋白的重组猪痘病毒的构建及鉴定 [J], 钟罗华;邓舜洲;胡杨;徐昌满;罗锋;张文波;陈松昌5.同时检测猪圆环病毒2型、猪细小病毒、猪伪狂犬病病毒和猪细环病病毒1型和2型的多重SYBR Green Ⅰ实时荧光定量PCR方法的建立[J], Pérez L J;刘丹因版权原因,仅展示原文概要,查看原文内容请购买。
猪圆环病毒2型(PCV2):发病机理及与先天性免疫的相互作用(I)

猪圆环病毒2型(PCV2):发病机理及与先天性免疫的相互作用(I)作者:张凡庆来源:《国外畜牧学·猪与禽》2014年第05期摘要:猪圆环病毒2型(Porcine Circovirus type 2,PCV2)是猪圆环病毒相关疾病(Porcine Circovirus–Associated Disease,PCVAD)的主要病原。
病毒对淋巴组织具有嗜性,会导致猪的淋巴系统功能衰竭和免疫抑制。
免疫刺激或其他病原共同感染会使该病加重。
PCV2寄生在特定的免疫细胞,如巨噬细胞和树突状细胞中,并调节它们的功能。
感染猪的IL-10和促炎性细胞因子上调会促进发病。
猪的遗传特性将影响其对PCV2的易感性,但是病毒毒力的遗传决定簇目前还不清楚。
PCV2 DNA和蛋白质与多种细胞基因相互作用,控制免疫反应,调节病毒的复制和致病。
中和抗体和细胞介导免疫是重要的免疫相关保护。
虽然目前有有效的疫苗,但是PCV2的变异株不断出现。
尽管现在对了解PCV2的致病机理和免疫相互作用已经有了很大的进步,但仍旧存在很多问题有待解决。
关键词:猪圆环病毒2型;断奶仔猪多系统衰竭综合症;猪圆环病毒相关疾病;致病机理;免疫相互作用;细胞因子中图分类号:S816 文献标识码:C 文章编号:1001-0769(2014)05-0074-021998年发现的猪圆环病毒2型(Porcine Circovirus type 2,PCV2)是一种新出现的猪病病原[1],对全世界养猪业造成重大经济损失[2-4]。
由PCV2引发的疾病综合征最早被称为断奶仔猪多系统衰竭综合征(Postweaning Multisystemic Wasting Syndrome,PMWS)[5,6]。
PCV2感染还与越来越多的疾病表现有关,如繁殖障碍、肠道疾病和呼吸道症状。
在美国,该病被重新命名为猪圆环病毒相关疾病(Porcine Circovirus–Associated Disease,PCVAD),欧洲命名为猪圆环病毒病(Porcine Circovirus Disease,PCVD)[7-8]。
一株高病毒载量PCV2毒株的基因组特征及序列分析
一株高病毒载量PCV2毒株的基因组特征及序列分析常鑫;蒋智勇;卞志标;徐民生;杨冬霞;杨傲冰;翟少伦【期刊名称】《广东农业科学》【年(卷),期】2024(51)3【摘要】【目的】了解广东省某猪群中猪圆环病毒2型(Porcine circovirus type 2,PCV2)流行毒株的遗传进化情况,丰富PCV2分子流行病学数据,为当地PCV2疫苗候选株的选用和研发提供参考。
【方法】使用qPCR方法对疑似PCV2的样品进行检测,发现1株具有高病毒载量的PCV2毒株,命名为GD222858。
通过PCR方法进行全基因组分子克隆及遗传进化分析。
使用MegAlign软件将该毒株ORF1、ORF2基因编码的氨基酸序列与PCV2同亚型参考毒株进行比对,分析氨基酸序列的相似性;采用DNAStar预测该毒株的Cap蛋白二级结构及B细胞表位,并与4株疫苗株DBN-SX07-2(HM641752)、LG(HM038034)、SH(HM038027)、ZJ(AY686764)的Cap蛋白抗原指数进行比对分析。
【结果】GD222858毒株基因组长度为1767 bp。
遗传进化分析表明该毒株属于PCV2d亚型。
与国内外82株参考毒株的核苷酸相似性为91.4%~99.6%,与越南毒株Han8(GenBank登录号:JQ181600)的亲缘关系最近。
在ORF1编码的Rep蛋白处发现多个特异性突变位点F70Y、F77L、W202R、N256S;ORF2编码的Cap蛋白相对保守。
Protean预测Cap蛋白的氨基酸第5~18、24~25、39~41、48~49、57~65、99、101、112~114、139~140、145~150、162~165、175~181、188~189、205~211、227~232位置处均可能存在潜在的B细胞表位。
GD222858毒株的Cap蛋白抗原指数与4株疫苗株均有差异,在氨基酸45~57、124~132、223~233位置处抗原指数明显高于4株疫苗株,且与疫苗株HM038034差异最大。
重组杆状病毒表达猪圆环病毒2型Cap蛋白的优化及蛋白免疫原性研究
重组杆状病毒表达猪圆环病毒2型Cap蛋白的优化及蛋白免疫原性研究李天增;潘晓梅;张伟;师小潇;徐龙飞;贺笋【摘要】为获得高蛋白含量和良好免疫原性的抗原,利用杆状病毒表达体系进行猪圆环病毒2型(PCV2)重组Cap蛋白表达,采取正交试验设计确定三因素(High five 细胞浓度、病毒感染量、蛋白表达时间)的最佳组合,对重组病毒株vBac-SP-PCV2的表达条件进行优化,利用His Bind蛋白质纯化试剂盒对表达产物进行纯化,纯化蛋白作为标准蛋白用于Western blotting中蛋白质定量分析和蛋白免疫原性检测.结果显示:2.0×106/mL High five细胞浓度、1.5 MOI病毒感染量、蛋白表达时间168 h为重组PCV2-rCap蛋白表达的最佳条件,表达产物纯化良好,并能被PCV2多克隆抗体识别,免疫豚鼠可诱导产生高水平PCV2抗体.研究表明纯化PCV2-rCap 蛋白可作为标准蛋白用于后续表达蛋白的定量分析和PCV2亚单位疫苗研发候选抗原.【期刊名称】《中国兽药杂志》【年(卷),期】2019(053)008【总页数】6页(P30-35)【关键词】PCV2-rCap蛋白;表达;纯化;免疫原性【作者】李天增;潘晓梅;张伟;师小潇;徐龙飞;贺笋【作者单位】天康生物股份有限公司,乌鲁木齐 830032;天康生物股份有限公司,乌鲁木齐 830032;天康生物股份有限公司,乌鲁木齐 830032;天康生物股份有限公司,乌鲁木齐 830032;天康生物股份有限公司,乌鲁木齐 830032;天康生物股份有限公司,乌鲁木齐 830032【正文语种】中文【中图分类】S852.65猪圆环病毒病 (Porcine circovirus disease,PCVD) 是由猪圆环病毒2型(Porcine circovirus type 2,PCV2)引起的猪传染性疾病,自1997年Clark等首次分离PCV2以来,该病已给全世界养猪业造成了巨大的经济损失。
表达PCV2 Cap蛋白重组复制缺陷型腺病毒黏膜免疫效果
河南农业科学,2020,49(10):143-148Journal of Henan Agricultural Sciencesdoi :10.15933/ki.1004-3268.2020.10.020收稿日期:2020-04-12基金项目:国家自然科学基金项目(31772781);河南省高校科技创新人才支持计划项目(14HASTIT022)作者简介:邓祖丽颖(1969-),女,河南郑州人,副教授,硕士,主要从事动物生物技术研究㊂E -mail:892743592@ 通信作者:陈㊀陆(1971-),男,河南罗山人,教授,博士,主要从事病毒分子生物学研究㊂E -mail:chenluhau@表达PCV2Cap 蛋白重组复制缺陷型腺病毒黏膜免疫效果邓祖丽颖1,2,刘雨丰2,马宁宁2,陈㊀陆2(1.郑州幼儿师范高等专科学校,河南郑州450000;2.河南农业大学,河南郑州450000)摘要:为研发高效的猪圆环病毒2型(PCV2)黏膜疫苗,通过口服㊁肌内和滴鼻途径,将表达PCV2Cap 蛋白主要抗原表位的重组复制缺陷型腺病毒(rAd /Cap /518)免疫Balb /c 小鼠,同时以无外源基因的空腺病毒(wild -rAd )经滴鼻途径免疫Balb /c 小鼠作为对照组,分别检测小鼠血清中IgG 和唾液㊁肺部㊁肠道灌洗液中IgA 抗体水平,脾脏T 淋巴细胞亚群及相关细胞因子IFN -γ和IL -4的分泌水平以及淋巴结㊁脾脏和肺组织中PCV2病毒载量,评价其黏膜免疫效果㊂结果显示,与对照组相比,rAd /Cap /518经肌内途径免疫诱导产生的血清IgG 抗体水平显著增加;经滴鼻和口服途径免疫诱导产生的局部黏膜部位IgA 抗体水平显著增加㊂rAd /Cap /518经滴鼻㊁肌内和口服3种途径免疫诱导产生的CD3+T 细胞百分率为46.60%~55.65%,经滴鼻免疫诱导产生的CD3+CD4+T 细胞百分率为34.43%~37.29%,经肌内和口服途径免疫诱导产生的CD3+CD4+T 细胞百分率为36.35%~41.58%,经滴鼻途径免疫诱导的CD3+CD8+T 细胞百分率为12.39%~18.32%,经口服免疫诱导的CD3+CD8+T 细胞百分率为16.29%,均显著高于对照组㊂rAd /Cap /518经滴鼻途径免疫后,能诱导小鼠脾脏和肠系膜淋巴细胞分泌IFN -γ㊂攻毒后免疫鼠体内病毒载量显著降低㊂综上,rAd /Cap /518经肌内途径免疫主要诱导全身性免疫应答,经滴鼻和口服途径免疫能诱导全身性和局部黏膜免疫应答,是一种很有前景的黏膜免疫候选疫苗㊂关键词:猪圆环病毒2型;Cap 蛋白;复制缺陷型腺病毒;黏膜免疫;免疫效果中图分类号:S852.65㊀㊀文献标志码:A㊀㊀文章编号:1004-3268(2020)10-0143-06Evaluation of Mucosal Immunity of Replication Defective RecombinantAdenovirus Expressing Capsid Protein of PCV2DENG Zuliying 1,2,LIU Yufeng 2,MA Ningning 2,CHEN Lu 2(1.Zhengzhou Preschool Education College,Zhengzhou 450000,China;2.Henan Agricultural University,Zhengzhou 450000,China)Abstract :To develop efficient porcine circovirus type 2(PCV2)vaccine,the mucosal immune effect of PCV2Cap protein epitope recombinant replication-deficient adenovirus (rAd /Cap /518)was evaluated.The Balb /c mice were immunized by oral,intramuscular and intranasal routes with rAd /Cap /518,and the mice were immunized by intranasal routes with wild rads without exogenous genes as the control group.IgG in serum,IgA antibody in saliva,lung and intestinal lavage fluid,secretion of T lymphocyte subsets and related cytokines IFN-γand IL-4in spleen,and PCV2viral load in lymph nodes,spleen and lung were detected.The results showed that,compared with the control group,the level of serum IgG antibody induced by rAd /Cap /518via intramuscular route increased significantly.The level of IgA antibody in local mucosa significantly increased by intranasal and oral immunization.The percentage of CD3+T cells induced by rAd /Cap /518was 46.60% 55.65%by intranasal,intramuscular and oral routes.The percentage of CD3+CD4+T cells was 34.43% 37.29%,the percentage of CD3+CD4+T cells induced河南农业科学第49卷by intramuscular and oral immunization was36.35% 41.58%,the percentage of CD3+CD8+T cells induced by intranasal immunization was12.39% 18.32%,and the percentage of CD8+T cells induced by oral immunization was16.29%,which were significantly higher than that of the control group. Intranasal immunization with rAd/Cap/518could induce IFN-γproduction in spleen and mesenteric lymphocytes.The virus load of immunized mice decreased significantly.These results indicate that rAd/ Cap/518mainly induces systemic immune response via intramuscular immunization,and systemic and local mucosal immune response via intranasal and oral immunization.It is a promising mucosal vaccine candidate for PCV2.Key words:Porcine circovirus type2;Cap protein;Replication defective recombinant adenovirus;Mu-cosal immunity;Immune efficiency㊀㊀猪圆环病毒2型(Porcine circovirus type2, PCV2)是仔猪断奶后多系统衰竭综合征(PMWS)的病原㊂PCV2主要侵害2~8周龄断奶仔猪,死亡率高达50%,给养猪业带来巨大的经济损失㊂PCV2主要经口腔㊁呼吸道等黏膜侵入机体并侵害免疫系统,能直接或间接导致免疫抑制[1-2]㊂因此,PCV2疫苗设计应侧重于诱导机体产生有效的黏膜免疫[3]㊂圆环病毒增殖能力较低,常规灭活疫苗抗原含量不足,免疫反应缓慢而微弱,且易在动物体内引起过敏反应,且无法有效诱导病原体特异性黏膜免疫应答[4-5]㊂CD3+㊁CD3+CD4+㊁CD3+CD8+T淋巴细胞及细胞因子水平的变化趋势可以间接反映感染猪的免疫能力,尤其以IFN-γ参与的Th1型细胞免疫在抗病毒免疫防御中最为重要㊂腺病毒载体携带抗原种类多,抗原递呈能力强,且产生的免疫力持久㊁安全性高,适合作为病毒疫苗载体[6]㊂Cap蛋白是PCV2的主要免疫原蛋白,含有主要保护性抗原表位,是制备PCV2疫苗的理想靶抗原㊂目前,各国学者已研究出有效的疫苗,如重组亚单位疫苗㊁灭活疫苗和DNA疫苗等[7-9],但许多研究成果仍处于实验室研究阶段㊂新型基因工程疫苗的价格普遍较高,且其基因改造是否会带来潜在危害还不清楚[10]㊂因此,研制高效廉价的新型疫苗尤为重要[11-12],是增强免疫效果和降低经济损失的关键㊂研究表明,表达PCV2Cap蛋白的重组腺病毒可诱导动物机体产生特异性抗体[13-16]㊂鉴于此,在前期构建PCV2Cap蛋白主要抗原表位重组复制缺陷型腺病毒(rAd/Cap/518)的基础上,将其经滴鼻㊁口服和肌内3种免疫途径免疫小鼠,评价其所诱导的全身性和局部黏膜免疫应答效果,旨在为研发PCV2新型黏膜免疫疫苗奠定基础㊂1㊀材料和方法1.1㊀材料PCV2Cap蛋白主要表位重组复制缺陷型腺病毒(rAd/Cap/518)和原核表达的PCV2Cap蛋白由河南农业大学兽医传染病实验室构建㊁表达和保存;腺病毒载体(wild-rAd)由南京农业大学姜平教授惠赠;PCV2YY株由河南农业大学兽医传染病实验室分离㊁保存;DNA提取试剂盒㊁SYBR Premix Ex Taq 酶等均购自TaKaRa公司;FITC-CD3㊁PE-CD4和PerCP-CD8a单克隆抗体等均购自Biolegend公司; HRP标记兔抗小鼠IgG购自博奥森公司;HRP标记羊抗小鼠IgA购自Bethyl公司;商品化细胞因子ELISA试剂盒购自CST公司㊂供试Balb/c小鼠由河南农业大学兽医传染病实验室饲养㊂1.2㊀方法1.2.1㊀引物设计㊀根据GenBank公布的PCV2Cap 基因序列(登录号:KU960941.1),应用Primer Premier5.0软件设计实时荧光定量PCR(Real-time quantitative PCR,qPCR)引物㊂上㊁下游引物序列分别为5ᶄ-TATCAATCTAACCACAGTC-3ᶄ和5ᶄ-ATG-GCGGGAGGAGTAGTT-3ᶄ㊂引物由生工生物工程(上海)股份有限公司合成,扩增目的基因长276bp㊂1.2.2㊀免疫和攻毒试验㊀将80只6~8周龄的雌性Balb/c小鼠随机分成4组,每组20只㊂rAd/ Cap/518通过滴鼻(rAd/Cap/518i.n)㊁肌内注射(rAd/Cap/518i.m)和口服免疫(rAd/Cap/518 oral),每只小鼠10lgTCID50,设空腺病毒(wild-rAd)滴鼻免疫(wild-rAd i.n)为对照㊂首免后14d以相同剂量和方法加强免疫㊂加强免疫后14d,每组取5只小鼠滴鼻攻毒3ˑ105TCID50PCV2YY株㊂1.2.3㊀间接ELISA检测抗PCV2特异性IgG和IgA 抗体㊀采集首免后14㊁21㊁28㊁35㊁42d小鼠血清样品及首免后14㊁21㊁28㊁35d唾液㊁肺部灌洗液㊁肠道灌洗液㊂用间接ELISA分别检测PCV2特异性IgG 和IgA抗体水平[17]㊂1.2.4㊀T细胞亚群分析及细胞因子检测㊀分离首441㊀第10期邓祖丽颖等:表达PCV2Cap蛋白重组复制缺陷型腺病毒黏膜免疫效果免后14㊁21㊁28d小鼠脾脏淋巴细胞,用含10%犊牛血清的RPMI1640稀释至1ˑ107个/mL,加入96孔细胞培养板,100μL/孔㊂每孔加入PCV2Cap蛋白1μg,5%CO2的37ħ培养箱中培养48h,收集细胞,PBS液洗2次,分别加入FITC-CD3㊁PE-CD4和PerCP-CD8a单克隆抗体,避光孵育30min㊂洗细胞2次后,用FACS Calibur流式细胞仪分析CD3+T 细胞㊁CD3+CD4+T细胞及CD3+CD8+T细胞亚群百分比㊂商品化细胞因子ELISA试剂盒检测IFN-γ㊁IL-4的分泌水平[18]㊂1.2.5㊀qPCR检测病毒载量㊀PCV2YY株攻毒后14d,收集小鼠淋巴结㊁脾脏和肺组织㊂使用DNA 提取试剂盒提取核酸,通过qPCR法检测PCV2病毒载量[19]㊂qPCR扩增体系(20μL):上㊁下游引物各0.8μL,SYBR Premix Ex Taq10μL,样品DNA模板500ng,ddH2O补足至20μL㊂qPCR扩增条件:94ħ10s,55ħ5s,72ħ10s,40个循环㊂1.3㊀数据分析利用GraphPad Prism对数据进行差异显著性分析,结果以数值平均值ʃ标准误表示㊂2㊀结果与分析2.1㊀免疫小鼠血清IgG和唾液、肺部及肠道灌洗液IgA抗体为检测全身体液免疫应答,采用间接ELISA方法测定免疫小鼠后14~42d抗PCV2特异性IgG和IgA抗体水平(图1)㊂免疫后21~42d,rAd/Cap/ 518经肌内注射小鼠诱导产生的血清IgG抗体水平显著高于wild-rAd对照组及滴鼻和口服免疫组(图1A)㊂rAd/Cap/518经滴鼻免疫后21~28d以及经口服免疫后35~42d小鼠唾液诱导产生的特异性IgA抗体水平均显著高于对照组(图1B)㊂免疫后21~A:rAd/Cap/518经不同途径免疫小鼠血清中PCV2特异性IgG抗体动态变化;B D:分别为rAd/Cap/518经不同途径免疫小鼠唾液㊁肺部灌洗液和肠道灌洗液中特异性IgA抗体动态变化㊂不同字母表示同一时间不同处理间差异显著(P<0.05),下同A:The levels of PCV2specific IgG antibodies in the serum of rAd/Cap/518immunized mice through different pathways;B D:The levels of PCV2of specific IgA antibodies in saliva,lung lavage and intestinal lavage of rAd/Cap/518immunized mice through different pathways.Different letters indicate significant differences amongdifferent treatment at the same time(P<0.05),the same below图1㊀rAd/Cap/518经不同途径免疫小鼠IgG和IgA抗体水平变化Fig.1㊀IgG and IgA levels of mice immunized with rAd/Cap/518via different routes541河南农业科学第49卷35d,rAd /Cap /518经滴鼻免疫诱导肺部灌洗液中产生的特异性IgA 抗体水平显著高于对照组(图1C)㊂免疫后21~35d,rAd /Cap /518经口服途径免疫后诱导肠腔灌洗液中产生的特异性IgA 抗体水平显著高于对照组(图1D)㊂2.2㊀免疫小鼠脾脏T 淋巴细胞亚群分析由表1可知,在14㊁21㊁28d,rAd /Cap /518经滴鼻㊁肌内和口服3种途径免疫诱导产生的CD3+T 细胞百分率为46.60%~55.65%,显著高于对照组(P <0.05)㊂在21㊁28d,rAd /Cap /518经滴鼻免疫诱导产生的CD3+CD4+T 细胞百分率为34.43%~37.29%;在14㊁21㊁28d,rAd /Cap /518经肌内和口服途径诱导产生的CD3+CD4+T 细胞百分率为36.35%~41.58%,均显著高于对照组㊂在14㊁21㊁28d,rAd /Cap /518经滴鼻途径诱导的CD3+CD8+T 细胞百分率为12.39%~18.32%;在28d ,rAd /Cap /518经口服免疫诱导的CD3+CD8+T 细胞百分率为16.29%,均显著高于对照组㊂表1㊀rAd /Cap /518经不同途径免疫小鼠脾脏淋巴细胞中T 细胞亚群变化Tab.1㊀The changes of T cell subsets from spleen lymphocyte in mice immunized with rAd /Cap /518via different routes%处理Treatment首免后时间/dDays post first-immunzationT 细胞亚群T cell subsetCD3+CD3+CD4+CD3+CD8+rAd /Cap /518i.n1446.61ʃ1.83a 31.25ʃ0.95c 15.64ʃ2.05a 2152.36ʃ2.08a 34.43ʃ1.82b18.32ʃ1.05a 2850.66ʃ1.53a 37.29ʃ2.06a 12.61ʃ2.46a rAd /Cap /518i.m1450.54ʃ3.58a 37.65ʃ1.07a 13.44ʃ1.70a2150.50ʃ2.98a 41.58ʃ2.10a12.36ʃ1.01b 2849.96ʃ2.56a 38.30ʃ1.79ab 11.55ʃ1.51b rAd /Cap /518oral1449.31ʃ0.92a 36.35ʃ1.08ab 13.35ʃ1.93b 2148.66ʃ1.59a 36.71ʃ1.56a 12.39ʃ1.06b 2855.65ʃ3.04a 37.97ʃ2.10ab16.29ʃ2.15a wild -rAd i.n1436.41ʃ2.00b 25.39ʃ1.08c 10.74ʃ1.16b 2140.08ʃ1.58b 28.04ʃ1.00c 12.46ʃ1.73b 2840.65ʃ0.56b29.64ʃ2.51c11.71ʃ1.76b㊀注:同列数据后不同字母表示同一时间不同处理间差异显著(P <0.05)㊂㊀Note:In the same column,different letters indicate significant differences among different treatments at the same time(P <0.05).2.3㊀免疫小鼠脾脏淋巴和肠系膜淋巴结细胞因子检测从图2可以看出,与对照组相比,滴鼻免疫组小鼠脾脏淋巴和肠系膜淋巴结细胞中IFN -γ分泌量显著升高,分别达到299.5pg /mL 和635.5pg /mL㊂各组均未检测到IL -4㊂图2㊀不同途径免疫rAd /Cap /518小鼠脾脏和肠系膜淋巴细胞因子的分泌表达Fig.2㊀Production of cytokine in mesenteric LN and spleenfrom the mice immunized with rAd /Cap /518via different routes2.4㊀qPCR 检测免疫小鼠淋巴结、脾脏和肺组织PCV2病毒载量从图3可以看出,与对照组相比,经滴鼻㊁口服和肌内3种途径免疫rAd /Cap /518后,小鼠脏器组织中PCV2病毒载量显著降低㊂图3㊀小鼠脏器组织中PCV2病毒载量Fig.3㊀PCV2genomic copy loads in mice organ tissue3㊀结论与讨论PCV2通过黏膜侵入机体,是引起PMWS 的主641㊀第10期邓祖丽颖等:表达PCV2Cap蛋白重组复制缺陷型腺病毒黏膜免疫效果要病原,各国学者均致力于研究有效的疫苗来防控PMWS㊂本研究将rAd/Cap/518经滴鼻㊁口服和肌内3种免疫途径免疫小鼠,评价其所诱导的全身性和局部黏膜免疫应答效果㊂结果显示,rAd/Cap/ 518经不同途径免疫小鼠均可不同程度诱导血清PCV2特异性IgG抗体的产生,这与WANG等[15]的报道结果一致㊂黏膜疫苗能在黏膜部位有效诱导机体产生特异性IgA抗体[20]㊂rAd/Cap/518经滴鼻和口服免疫诱导产生较高水平的PCV2特异性IgA抗体,这与前人研究结果一致[21-22]㊂rAd/Cap/518经滴鼻和口服途径免疫能在唾液㊁肺部和肠道灌洗液中产生较高水平IgA抗体,肌内途径免疫后期肠道灌洗液中检出微弱的IgA抗体,与CRAIG等[23]的研究结果一致㊂本研究结果表明,腺病毒载体疫苗经黏膜途径免疫后可诱导局部黏膜部位产生IgA抗体以及血清IgG抗体㊂细胞免疫应答在控制免疫缺陷性疾病中起重要作用[24]㊂本研究结果显示,与对照组相比,rAd/ Cap/518诱导小鼠脾脏CD3+T细胞含量显著增加,肌内和口服途径免疫组CD3+CD4+T细胞显著增加,滴鼻免疫组CD3+CD8+T细胞显著增加㊂可见, rAd/Cap/518可以诱导细胞免疫反应,且滴鼻免疫可能会起到更好的免疫保护作用㊂通过检测细胞因子分泌水平进一步研究rAd/Cap/518所诱导的细胞免疫反应类型,结果显示,滴鼻免疫组检测到高水平的IFN-γ,但各组均未检出IL-4㊂表明诱导的细胞免疫反应以Th1型为主㊂攻毒后体内病毒载量检测结果显示,rAd/Cap/518经3种途径免疫组病毒载量均显著降低,表明rAd/Cap/518免疫后能有效阻止病毒感染㊂综上,本研究将rAd/Cap/518经口服㊁滴鼻和肌内3种途径免疫小鼠,发现经滴鼻和口服途径免疫能诱导全身性和局部黏膜免疫应答,并且能显著清除PCV2感染,因此其具有很大应用前景㊂虽然小鼠可作为PCV2感染研究的理想动物模型[25],但rAd/Cap/518在猪体内的应用效果还有待进一步研究㊂参考文献:[1]㊀OPRIESSNIG T,MENG X J,HALBUR P G.Porcine cir-covirus type2associated disease:Update on current ter-minology,clinical manifestations,pathogenesis,diagnosis,and intervention strategies[J].J Vet Diagn Invest,2007,19(6):591-615.[2]㊀AFGHAH Z,WEBB B,MENG X J,et al.Ten years ofPCV2vaccines and vaccination:Is eradication a possibili-ty?[J].Veterinary Microbiology,2017,206:21-28. [3]㊀TUTYKHINA I L,LOGUNOY D Y,SHCHERBININ D N,et al.Development of adenoviral vector-based mucosalvaccine against influenza[J].J Mol Med,2011,89(4):331-341.[4]㊀LI D,DU Q,WU B,et al.Immunogenicity of adenovirusvaccines expressing the PCV2capsid protein in pigs[J].Vaccine,2017,35(36):4722-4729.[5]㊀HU G,WANG N,YU W,et al.Generation and immunoge-nicity of porcine circovirus type2chimeric virus-like par-ticles displaying porcine reproductive and respiratory syn-drome virus GP5epitope B[J].Vaccine,2016,34(16):1896-1903.[6]㊀胡永新,赵永刚,张永强,等.表达非洲猪瘟病毒P72蛋白复制缺陷型重组腺病毒的构建及鉴定[J].畜牧兽医学报,2019,50(8):1635-1641.HU Y X,ZHAO Y G,ZHANG Y Q,et al.Constructionand identification of replication defective recombinant ad-enovirus expressing ASFV P72protein[J].Acta Veterinaet Zootechnica Sinica,2019,50(8):1635-1641. [7]㊀BEACH N M,MENG X J.Efficacy and future prospects ofcommercially available and experimental vaccines againstporcine circovirus type2(PCV2)[J].Virus Res,2012,164(1/2):33-42.[8]㊀MARTELLI P,FERRARI L,MORGANTI M,et al.Onedose of a porcine circovirus2subunit vaccine induces hu-moral and cell-mediated immunity and protects againstporcine circovirus-associated disease under field condi-tions[J].Vet Microbiol,2011,149(3/4):339-351. [9]㊀DONG B,FENG J,LIN H,et al.Immune responses ofmice immunized by DNA plasmids encoding PCV2ORF2gene,porcine IL-15or the both[J].Vaccine,2013,31(48):5736-5744.[10]㊀刘畅,陈艳,颜秋,等.基于Cap蛋白研制的猪圆环病毒2型疫苗研究进展[J].动物医学进展,2019,40(6):83-87.LIU C,CHEN Y,YAN Q,et al.Progress on PCV-2vac-cines based on cap protein[J].Progress in VeterinaryMedicine,2019,40(6):83-87.[11]㊀CHANG H T,HE X Y,LIU Y F,et al.Enhancing muco-sal immunity in mice by recombinant adenovirus express-ing major epitopes of porcine circovirus-2capsid proteindelivered with cytosine-phosphate-guanosine oligodeoxy-nucleotides[J].J Vet Sci,2014,15(3):399-407. [12]㊀CHOI J Y,LYOO K S,KIM K,et al.A pilot compara-tive study of recombinant protein and whole-virus inacti-vated vaccines against porcine circovirus type2in con-ventionally reared pigs[J].Res Vet Sci,2019,123(4):741河南农业科学第49卷192-194.[13]㊀LI D,XU D,WANG Z,et al.Immunogenicity evaluationof modified adenovirus vaccines expressing porcine circo-virus type2capsid protein in pigs[J].Viral Immunol,2017,30:111-119.[14]㊀ZHANG Z,LUO Y,ZHANG Y,et al.Enhanced protec-tive immune response to PCV2adenovirus vaccine by fu-sion expression of Cap protein with InvC in pigs[J].JVet Sci,2019,20(4):e35.[15]㊀WANG X,JIANG P,LI Y,et al.Protection of pigs a-gainst post-weaning multisystemic wasting syndrome by arecombinant adenovirus expressing the capsid protein ofporcine circovirus type2[J].Vet Microbiol,2007,121(3):215-24.[16]㊀GENMEI L,MANLIN L,RUIAI C,et al.Constructionand immunogenicity of recombinant adenovirus express-ing ORF2of PCV2and porcine IFN gamma[J].Vac-cine,2011,29(47):8677-8682.[17]㊀CAO W,KIM J H,REBER A J,et al.Nasal delivery ofprotollin-adjuvanted H5N1vaccine induces enhancedsystemic as well as mucosal immunity in mice[J].Vac-cine,2017,35(25):3318-3325.[18]㊀GALLICHAN W S,JOHNSON D C,GRAHAM F L,etal.Mucosal immunity and protection after intranasal im-munization with recombinant adenovirus expressing her-pes simplex virus glycoprotein B[J].J Infect Dis,1993,168(3):622-629.[19]㊀李志娟,王永生,陈陆,等.荧光定量PCR检测猪圆环病毒2型方法的研究与应用[J].扬州大学学报(农业与生命科学版),2011,32(1):49-54.LI Z J,WANG Y S,CHEN L,et al.Study and applica-tion of SYBR greenⅠ-based fluorescent quantitativePCR assayin type2porcine circovirus detection[J].JYangzhou University(Agricultural and Life Science Edi-tion),2011,32(1):49-54.[20]㊀NEUTRA M R,KOZLOWSKI P A.Mucosal vaccines:The promise and the challenge[J].Nature Reviews Im-munology,2006,6(2):148-158.[21]㊀YU J R,KIM S,LEE J B,et al..Single intranasal immu-nization with recombinant adenovirus-based vaccine in-duces protective immunity against respiratory syncytialvirus infection[J].J Virol,2008,82(5):2350-2357.[22]㊀LEMIALE F,KONG W P,AKYUREK L M,et al.En-hanced mucosal immunoglobulin A response of intranasaladenoviral vector human immunodeficiency virus vaccineand localization in the central nervous system[J].J Vir-ol,2003,77(18):10078-10087.[23]㊀CRAIG S W,CEBARBRA J J.Peyer s patches:An en-riched source of precursors for IgA-producing immuno-cytes in the rabbit[J].J Immunol,2008,180(3):1295-1307.[24]㊀VANG F W,NGUYEN H H,MCGHEE J R.Vaccines formucosal immunity to combat emerging infectious diseases[J].Emerg Infect Dis,2000,6(2):123-132. [25]㊀OUYANG T,LIU X H,OUYANG H S,et al.Mouse mod-els of porcine circovirus2infection[J].Anim ModelsExp Med,2018,1(1):23-28.841。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
畜牧兽医学报
2015,46(12):2273-2281
ActaVeterinariaetZootechnicaSinica
doi:10.11843/j.issn.0366-6964.2015.12.020
含有Th细胞表位的合成
PCV2ORF2Ca
p
多肽抗原的表达及免疫原性分析
陈善真,赵 焱,李中圣,罗 均,陈克宏,王贵平,李其昌
*
(广东海大畜牧兽医研究院有限公司,广州511400)
摘 要
:拟测定在PCV2ORF2CapP1多肽抗原中添加从PCV2ORF1、
ORF3中筛选的Th
细胞表位多肽在促进
其免疫原性中的作用,以及合成表达的PCV2ORF2CapP1多肽抗原作为疫苗抗原的可行性。采用生物信息学及
分子生物学方法,筛选获得1条泛宿主新型Th细胞表位多肽和3条PCV2特异的含有Th细胞抗原表位的多肽序
列,然后将这4条Th细胞多肽氨基酸序列与筛选自ORF2Cap1上的1条B细胞表位多肽序列进行串联组合,密
码子优化,插入酶切位点、终止密码子,然后进行密码子适应指数和分布频率分析,预测可以实现高效表达后再进
行化学合成。合成的P1多肽抗原连接到pET-30a表达载体,并转化至BL21(DE3)pLysS感受态细胞中,构建表达
工程菌BL21(DE3)pLysS-pET-30a-P1。经IPTG诱导表达后P1可实现高效表达,SDS-PAGE鉴定表达量
,
WesternBlot鉴定其生物活性,然后分别免疫小鼠和猪,测定小鼠免疫后的抗体水平以及猪免疫后P1
合成多肽抗
原对外周血淋巴细胞的刺激增殖情况。结果表明,设计合成表达的PCV2P1多肽抗原序列,密码子适应性指数为
0.89,能够实现高水平表达,目的片段大小约为28.29ku,具有良好的免疫原性;MTT试验结果表明,P1
多肽抗原
免疫后机体内IFN-γ和IL-4的表达量明显增加,且与对照组差异显著(P<0.05)。这说明P1能够诱导机体产生
细胞免疫和体液免疫反应,为其作为疫苗用抗原的进一步研究奠定了理论基础
。
关键词
:PCV2;Th细胞表位多肽;
Ca
p
蛋白
中图分类号:S852.4 文献标志码:A 文章编号
:0366-6964(2015)
12-2273-09
收稿日期
:
2015-03-31
基金项目
:广东省科技计划星火计划项目(2012A020603026)
作者简介
:陈善真(1984-),女,山东安丘人,兽医师,硕士,主要从事动物疫病诊断及疫苗相关研究,E-mail:
chensz2@haid.com.cn
*通信作者:李其昌,博士,E-mail:liqc2@
haid.com.cn
ExpressionandImmunogenicityAnalysisofPCV2CapRecombinant
ProteinAntigenWhichContainsHelperTcellEpitopePeptides
CHENShan-zhen,ZHAOYan,LIZhong-sheng,LUOJun,CHENKe-hong,WANGGui-ping,LIQi-chan
g
*
(GuangdongHaidInstituteofAnimalHusbandry&Veterinary,Guangzhou511400,China)
Abstract:TodeterminetheroleofThcellepitopes,whichwerescreenedfromPCV2ORF1,and
ORF3,inimprovingthePCV2ORF2CapP1immunogenicitywhentheywereaddedtothese-
quence,andthefeasibilityofsyntheticexpressionofPCV2ORF2CapP1asavaccineantig
en
,
bioinformaticsandmolecularbiologymethodswereemployedtoscreenthepeptidesequences.A
pan-hostofThelpercellepitopepeptidesandthreeThcellepitopespeptideseq
uencesofPCV2-
specificwereidentified.These4ThcellspeptidessequenceswerecombinedwithaB-cellepitope
peptidesequencescreenedfromPCV2ORF2Cap1gene,andthencodonwasop
timizedandinsert-
edtherestrictionsitesandstopcodons.Afteranalyzingthecodonadaptationindexandthefre-
quencydistribution,predicteditcanachieveefficientexpression,furtherchemicalsy
nthesisor
peptideswerecarriedout.ThesyntheticpolypeptideantigenP1wasconnectedtothep
ET-30aex-
pressionvector,andtransformedintoBL21(DE3)pLysScompetentcells,theexp
ressioninthe
