高三化学总复习《“看图说话”描述微观结构变化过程》专项练习题-带答案
高考化学总复习 专题二 微观结构与物质的多样性测试卷

专题二微观结构与物质的多样性请同学们根据老师阅卷需要把选择题的答案填入答题栏中。
一、单项选择题(本大题共6小题,每小题4分,共24分。
每小题只有1个选项符合题目要求)1.(2011·佛山二模)金属钛可用于火箭发动机、宇宙飞船、人造卫星天线等制造。
下列有关48 22Ti和5022Ti的说法正确的是( )A.4822Ti和5022Ti为同一核素B.4822Ti和5022Ti在元素周期表中位置相同,都在第4纵行C.分别由4822Ti和5022Ti组成的金属钛单质互称同分异构体D.4822Ti和5022Ti原子中均含有22个中子2.(2012·广州调研)短周期元素X、Y、Z原子序数之和为36,X2-与Y+具有相同的核外电子层结构,Y、Z位于同一周期。
下列推测不正确的是( )A.原子半径:Z>YB.同周期元素中Y的金属性最强C.同主族元素中X的氢化物稳定性最高D.同周期元素中Z的最高价氧化物对应水化物的酸性最强3.(2012·安徽省城名校联考)下列有关说法正确的是( )A.电子层结构相同的微粒其化学性质一定相同B.元素的原子失去电子数越多该元素还原性就越强C.同种元素形成的双原子分子中一定含有非极性共价键D.单质中一定含有化学键4.(2012·湖北部分重点中学联考)下列对化学键的认识正确的是( )A.化学变化中一定存在化学键的断裂和形成,物理变化中一定不存在化学键的断裂和形成B.化学键可以使原子相结合,也可以使离子相结合C.断裂化学键要放出能量,形成化学键要吸收能量D.离子键、共价键、金属键、氢键均属于化学键5.(2012·山西师大附中)下列说法正确的是( )A.C60气化和I2升华克服的作用力相同B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键D.用作高温结构陶瓷材料的Si3N4固体是分子晶体6.(2013·深圳一模)Q、W、X、Y、Z都是短周期元素。
苏教版高中化学一轮复习专题质检卷六微观结构与物质的多样性(含答案)

专题质检卷六 微观结构与物质的多样性一、选择题1.下列化学用语表达正确的是( )。
A.氯离子的结构示意图:B.HClO 的结构式:H —Cl —OC.乙酸的分子式:CH 3COOHD.氯化镁的电子式: [··Cl ······]-Mg 2+[··Cl ······]- 2.X 、Y 、Z 、W 为原子序数依次增大的短周期元素。
X 与Y 可组成一种红棕色有刺激性气味的气体,Z 的周期数是族序数的3倍,工业上常用冷的烧碱溶液吸收W 的单质制取漂白液。
下列叙述中正确的是( )。
A.简单离子半径的大小顺序:Z>WB.最高价氧化物对应的水化物的酸性:W>XC.常温常压下,X 、Z 、W 的氢化物都为气体D.Y 和Z 组成的化合物中,阴、阳离子数之比为1∶13.下列有关物质结构的说法正确的是( )。
A.第3周期非金属元素氧化物对应水化物的酸性从左到右依次增强B.水加热到很高的温度都难以分解是因为水分子间存在氢键C.同主族元素从上到下,单质的熔点逐渐降低D.元素的种类由核内质子数决定4.(2021河南驻马店高三检测)W 、X 、Y 、Z 为短周期主族元素,在元素周期表中的相对位置如图所示,常温下,这四种元素形成的常见单质中只有两种是气体。
下列说法错误的是( )。
XY Z WA.X 、Y 、Z 都能形成10电子、18电子的氢化物B.X 、Y 、W 分别与Z 都能形成两种或两种以上化合物,这些化合物都能与NaOH 溶液反应C.X 、Y 、Z 与氢四种元素能形成离子化合物,该化合物能发生水解D.W 能形成多种不同颜色的单质,且均难溶于水5.(2021四川遂宁高三期中)短周期主族元素W 、X 、Y 、Z 原子序数依次增大,W 与Y 同主族,X 与Z 同主族。
高中化学第三单元从微观结构看物质的多样性专项测试同步训练4814

高中化学第三单元从微观结构看物质的多样性专项测试同步训练2020.031,对于相同物质的量的SO2和SO3,下列说法中正确的是()A、氧元素的质量比为1∶1 B、分子数之比为1∶1C、原子总数之比为1∶1D、质量之比为1∶12,水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。
请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2。
(加热装置和导管等在图中略去)回答下列问题:⑴盛浓H2SO4的装置用途是______________________________,盛NaOH 溶液的装置用途是_______________________________________。
⑵仪器B中需加入试剂的名称(或化学式)是:_______________,所发生反应的化学方程式是:___________________________________________________。
⑶仪器C中需加入试剂的名称(或化学式)是:___________,其目的是:______________________________________。
⑷能证明混合气中含有CO的实验依据是_____________________________________________________________ ___________。
3,在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )A、Na+、K+、OH-、Cl-B、Na+、Cu2+、SO42-、NO3-C、Mg2+、Na+、SO42-、Cl-D、K+、Ba2+、HCO3-、NO3-答案1, B2, ⑴除去水蒸气除去CO2⑵氧化铜(CuO) CuO+H2△══Cu+H2O CuO+CO△══Cu+CO2⑶无水硫酸铜检验H2O ⑷原混合气中的CO2已被除去,其中CO与CuO反应生成的CO2使澄清石灰水变浑浊3, C。
高考化学二轮专题复习 综合训练(二)微观结构与物质多样性

综合训练(二) 微观结构与物质多样性1.(2017·天津卷)根据元素周期表和元素周期律,判断下列叙述不正确的是( )A.气态氢化物的稳定性:H2O>NH3>SiH4B.氢元素与其他元素可形成共价化合物或离子化合物C.如图所示实验可证明元素的非金属性:Cl>C>SiD.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族2.(2017·绿色评价联盟)W、X、Y、Z、V五种主族元素,它们在周期表中的位置如图,W、X、Y、Z属于短周期元素,W的质子数为Y的两倍。
下列说法不正确的是( )YZ W XVA.Y的最简单氢化物的沸点比W的最简单氢化物的沸点高B.X元素含氧酸的酸性强于W元素含氧酸的酸性C.根据在周期表中的位置,可推测V具有半导体特性D.X的单质在水溶液中可置换出W3.某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。
下列说法中错误的是( )A.原子半径大小顺序:r(B)>r(C)>r(A)B.B、C最高价氧化物的水化物可以相互反应C.虚线相连的元素处于同一族,A、C元素都位于元素周期表第ⅥA族D.A分别与B、C形成的化合物中化学键类型相同4.据国外媒体报道,“火星快车”号和“金星快车”号探测器分别在火星和金星大气层中发现了一种非常特殊的气态化合物。
这种化合物的存在不仅会导致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生。
它的结构式为16O C O。
下列说法正确的是( )。
A.16O与18O为同种原子B.16OC18O与16OC16O互为同位素C.16OC18O与16OC16O的化学性质几乎相同D.16OC18O与N O2反应生成的氧气中含18O5.下列说法正确的是( )A.元素周期律是指元素的性质随着相对原子质量的递增呈周期性变化B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱C.14~17号元素含氧酸的酸性从左到右依次增强D.元素周期律是元素原子核外电子排布周期性变化的结果6.a、b、c、d是原子序数依次增大的前20号元素,它们的最外层电子数分别为1、6、7、1。
2023年中考化学专项复习之微粒结构示意图练习汇总(十)

中考化学专项复习之微粒结构示意图练习汇总(十)1.下列粒子结构示意图中,表示阴离子的是()A.B.C.D.2.如图①是铬元素在元素周期表中的信息,②、③为两种原子的结构示意图,④为元素周期表中的部分信息,下列说法正确的是()A.铬原子的核外电子数为52B.图②是氮原子的结构示意图,它与图④中S原子的电子层数相同C.图③中x=11,该元素与图④中氯元素组成的化合物是由离子构成的D.图④中甲、乙对应的原子的最外层电子数相同,均为83.根据图中提供的信息判断,下列说法不正确的是()A.镉属于金属元素B.镉元素位于元素周期表中第四周期C.镉的相对原子质量是112.4D.镉原子核内有48个质子4.铁是年产量最高的金属,结合如图所示有关信息分析,下列说法正确的是()A.铁原子结构示意图中x=14B.铁原子核内含有26个中子C.Fe转化为Fe2+需得到2个电子D.Fe2+与Fe3+质子数不同5.硬铝常用于制造火箭、飞机的外壳,铝元素的相关信息和铝原子的结构示意图如图所示,下列说法正确的是()A.铝的元素符号为ALB.铝原子的中子数为26.98C.铝原子在反应中易失去电子D.铝是地壳中含量最多的元素6.图甲是氧原子的原子结构示意图,图乙是氟元素在元素周期表中的信息。
下列说法正确的是()A.x的值为8B.9表示氟原子核内的中子数C.氟的相对原子质量为19.00gD.等质量的O2和F2,F2含有的原子数目较少7.对于下列化学用语,有关说法不正确的是()①SiO2②ClO3﹣③K2MnO4④⑤A.①表示的是一种非金属氧化物B.②可以表示一个氯酸根离子C.③中锰元素的化合价为+6价D.④⑤表示的元素位于同一周期8.依据图中所给内容,不能得到的信息是()A.铝是地壳中含量最多的金属元素B.铝原子的质子数、核外电子数均为13C.铝元素的相对原子质量为26.98D.在化学变化中每个铝原子可失去3个电子变成Al3+9.如图是钾元素在元素周期表中的部分信息及钾离子的结构示意图,根据图示判断下列表述正确的是()A.钾原子的核电荷数为19B.钾的相对原子质量为39.10gC.钾元素位于元素周期表第三周期D.1个钾离子带1个单位的负电荷10.硒是人体内的一种必需微量元素,有防癌、抗癌的作用,被誉为“抗癌大王”,可以改善免疫功能,增加机体抵抗力,根据如图提供的硒的有关信息,下列有关说法中正确的是()A.硒的原子结构示意图中x=4B.硒的相对原子质量是78.96gC.硒属于金属元素,硒原子在化学反应中易得电子D.硒原子的质子数是34,硒元素位于第四周期11.下列是几种粒子的结构示意图,有关说法正确的是()A.①和②两种粒子的化学性质相似B.③和④均属于离子结构示意图C.粒子②在化学反应中容易失去电子D.①②③④的元素种类各不相同12.奥运会场馆的“冰丝带”是由3360块发电玻璃拼成。
2021年中考化学总复习专题训练: 微观示意图(含答案)
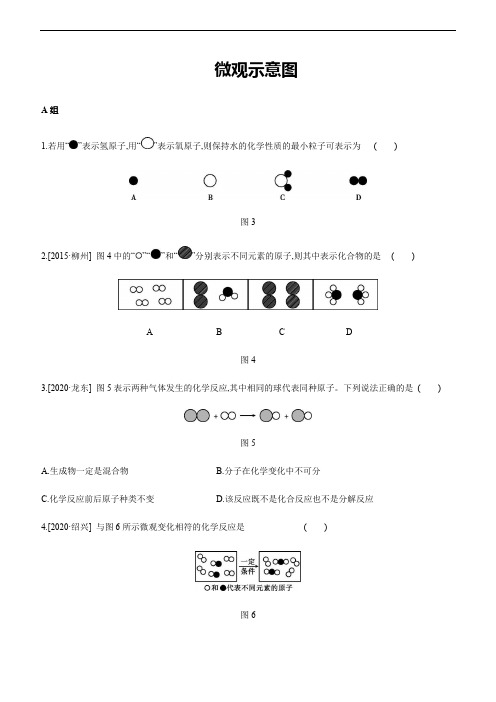
微观示意图A组1.若用“”表示氢原子,用“”表示氧原子,则保持水的化学性质的最小粒子可表示为()图32.[2015·柳州] 图4中的“”“”和“”分别表示不同元素的原子,则其中表示化合物的是()A B C D图43.[2020·龙东] 图5表示两种气体发生的化学反应,其中相同的球代表同种原子。
下列说法正确的是()图5A.生成物一定是混合物B.分子在化学变化中不可分C.化学反应前后原子种类不变D.该反应既不是化合反应也不是分解反应4.[2020·绍兴] 与图6所示微观变化相符的化学反应是()图6A.2CO+O22CO2B.H2+CuO H2O+CuC.2H2+O22H2OD.H2CO3H2O+CO2↑5.[2020·德州] 化学是在分子、原子层次上研究物质性质、组成、结构与变化规律的科学。
图7是某反应的微观示意图,根据图示得到的信息正确的是()图7A.氧化汞由汞原子和氧分子构成B.反应前后原子的数目没有增减C.反应前后分子的种类没有改变D.生成汞和氧气的质量比是2∶16.[2020·东营] 某反应的微观示意图如图8,该反应的化学方程式是,其中由原子直接构成的物质是。
请结合图示,从微观的角度谈一下对化学反应的认识:。
图8B组1.[2020·深圳] 我国化学家研究出一种新型催化剂,在太阳光照射下实现了水的高效分解。
该反应过程的微观示意图如图9所示:图9下列说法错误的是()A.表示的物质属于氧化物B.反应Ⅰ的化学方程式为H2O H2O2+O2↑C.反应Ⅰ中,反应前后原子的种类和数目均不变D.该成果对氢能源的推广应用有重要的实践意义2.[2020·广西北部湾] 图10是制取乙醇的反应微观示意图。
下列说法正确的是()图10A.反应前后共有四种分子B.反应物中只有一种物质是氧化物C.反应前后催化剂的性质不变D.参加反应的和分子个数比是3∶23.[2020·眉山] 如图11是用来表示物质间发生化学反应的模型示意图,图中“”“”“”分别表示O、F、H原子。
高考化学二轮专题复习综合训练二微观结构与物质多样性

综合训练(二) 微观结构与物质多样性1.(2017·天津卷)根据元素周期表和元素周期律,判断下列叙述不正确的是( )A.气态氢化物的稳定性:H2O>NH3>SiH4B.氢元素与其他元素可形成共价化合物或离子化合物C.如图所示实验可证明元素的非金属性:Cl>C>SiD.用中文“”(ào)命名的第118号元素在周期表中位于第七周期0族2.(2017·绿色评价联盟)W、X、Y、Z、V五种主族元素,它们在周期表中的位置如图,W、X、Y、Z属于短周期元素,W的质子数为Y的两倍。
下列说法不正确的是( )YZ W XVA.Y的最简单氢化物的沸点比W的最简单氢化物的沸点高B.X元素含氧酸的酸性强于W元素含氧酸的酸性C.根据在周期表中的位置,可推测V具有半导体特性D.X的单质在水溶液中可置换出W3.某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“·”代表一种元素,其中O点代表氢元素。
下列说法中错误的是( )A.原子半径大小顺序:r(B)>r(C)>r(A)B.B、C最高价氧化物的水化物可以相互反应C.虚线相连的元素处于同一族,A、C元素都位于元素周期表第ⅥA族D.A分别与B、C形成的化合物中化学键类型相同4.据国外媒体报道,“火星快车”号和“金星快车”号探测器分别在火星和金星大气层中发现了一种非常特殊的气态化合物。
这种化合物的存在不仅会导致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生。
它的结构式为16O C O。
下列说法正确的是( )。
A.16O与18O为同种原子B.16OC18O与16OC16O互为同位素C.16OC18O与16OC16O的化学性质几乎相同D.16OC18O与N O2反应生成的氧气中含18O5.下列说法正确的是( )A.元素周期律是指元素的性质随着相对原子质量的递增呈周期性变化B.HF、HCl、HBr、HI的热稳定性和还原性均依次减弱C.14~17号元素含氧酸的酸性从左到右依次增强D.元素周期律是元素原子核外电子排布周期性变化的结果6.a、b、c、d是原子序数依次增大的前20号元素,它们的最外层电子数分别为1、6、7、1。
高中化学第三单元从微观结构看物质的多样性专项测试同步训练

高中化学第三单元从微观结构看物质的多样性专项测试同步训练2020.031,一定温度下,在固定体积的密闭容器中发生下列反应:2HI H 2+I2。
在c(HI)由0.1mol/L降到0.07mol/L时,需要15s,那么c(HI)由0.07mol/L 降到0.05mol/L时,需要反应的时间为()A.等于5s B.等于10s C.大于10s D.小于10s2,某学生设计了如下实验:回答下列问题:①、该同学的实验目的是;②、上图括号内的操作步骤都为;③、按此实验方案得到的NaCl固体中肯定含有 (填化学式)杂质;④、为了解决这个问题可以向过滤得到的滤液中加入适量的;⑤、写出生成B的离子方程式。
3,下列有关环境问题的说法正确的是()A.燃煤时加入适量石灰石,可减少废气中SO2的量B.臭氧的体积分数超过10-4%的空气有利于人体健康C.pH在5.6~7.0之间的降水通常称为酸雨D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染4,不同元素的原子或离子,一定具有不同的()A、质量数B、质子数C、中子数D、电子数5,下列物质只能作还原剂的是:()A、S2-B、Fe2+C、Fe3+D、H+6,下列有关Na2CO3和NaHCO3性质的比较中,正确的是()A、热稳定性:Na2CO3<NaHCO3B、常温时水溶性:Na2CO3>NaHCO3C、106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3D、与稀盐酸反应的快慢:Na2CO3>NaHCO37,在物质分类中,前者包括后者的是()A、化合物、电解质B、氧化物、化合物C、溶液、胶体D、溶液、分散系8,下列关于能量的说法中错误的是()A.化石能源物质内部蕴藏着大量的能量B.绿色植物进行光合作用时,将太阳能转化为化学能“储存”起来C.物质的化学能可以在不同条件下转化为热能、电能为人类所利用D.吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值9,某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150,若已知其中氧的质量分数为50%,则分子中碳原子的个数最多为()A.4 B.5 C.6 D.710,下列关于元素周期表和元素周期律的说法错误的是()A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多B.第二周期元素从Li到F,非金属性逐渐增强C.因为Na比K容易失去电子,所以Na比K的还原性强D.O与S为同主族元素,且O比S的非金属性强11, a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4 的物质的量之比为()A.1 :7 B.7 :1 C.7 :8 D.8 :712,有一表面被氧化成氧化钠的金属钠样品5.22g,投入到60g水中,产生气体2.24L(标况)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第 1 页 共 7 页
高三化学总复习《“看图说话”描述微观结构变化过程》专项练习题
-
带答案
学校:___________班级:___________姓名:___________考号:
___________
考点1:关键词“电负性”
例1:(2022江苏卷节选)②随着反应进行,3FeCO迅速转化为活性34-xFeO,活性34-xFeO是-3HCO转化
为-HCOO的催化剂,其可能反应机理如图所示。根据元素电负性...的变化规律。如图所示的反应步骤②可
描述为
。
练习1:MgO催化2CO合成碳酸乙烯酯( )可能的反应机理如图所示,根据元素电负性...的变化规律,
步骤②、②的过程可描述为
。
考点2:关键词“得失电子”
例2:将一定量纳米零价铁和少量铜粉附着在生物炭上,也可用于去除水体中3NO,其部分反应原理如图
所示。与不添加铜粉相比,添加少量铜粉时去除3NO的效率更高,其主要原因是 ;
3
NO
转化为4NH的反应机理可描述为
。
第 2 页 共 7 页
练2:利用某复合材料催化活化228SO并去除废水中有机污染物的可能反应机理如图所示。该机理可描述为
。
考点3:关键词“吸附、脱附”
例3:活性炭-臭氧可处理氨氮废水。氧化氨氮的机理如图所示。*表示吸附在活性炭表面的物种,OH为
羟基自由基,其氧化性比3O更强。
①活性炭-
臭氧氧化氨氮的机理可描述为
。
练3:气体分子吸附至催化剂表面后发生反应。500℃时,反应原理如图右上。
主反应:
422
CHg+COg=2COg+2Hg
-1
ΔH=246.5kJmol
主反应过程机理模型如图所示(*表示吸附在催化剂表面的活性物种)。根据反应机理,生成CO的过程可描
述为
。
考点4:关键词“中间产物”
例4:金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图所示。
X为 。补全Y的结构 。
练4:在Pt-Pd合金表面上甲醇与水蒸气重整反应的机理如图所示(“*”表示此微粒吸附在催化剂表面,M为
反应过程中的中间产物)。
第 3 页 共 7 页
M的结构简式为 ,根据元素电负性的变化规律,描述步骤2
的反应机理
。
微专题:“看图说话”描述微观结构变化过程(巩固练习)
1.一种镍磷化合物催化氨硼烷水解制氢的可能机理如图所示。
①“中间体I”中B、N上所连H分别吸附在Ni和P上的原因是 。
②“中间体III”可以进一步水解,则氨硼烷水解最终所得含硼化合物的化学式为 。
2.种活性炭载纳米铁粉吸附剂去除废水中3NO的可能反应机理如图1所示。图中“*”表示微粒处于吸附状态。
①
相同条件下,将活性炭载纳米铁粉和纳米铁粉分别加入含3NO废水中,反应相同时间,采用活性炭载
纳米铁粉去除3NO的效率更高,原因是 。
②图1
所示反应机理可描述为
。
3.在GaCuMg催化剂表面上甲醇与水蒸气重整的机理如图所示.
第 4 页 共 7 页
其中“*”表示该微粒吸附在催化剂表面,BS为带有一定电性的吸附位点.表示微粒从催化剂表面脱附.
①用2DO替换2HO,生成氢气的化学式是 .
②
从电负性的角度分析,32CHOHHO、均通过O原子吸附在催化剂BS位点上的原因是
。
③从化学键断裂和形成以及微粒吸附与脱附的角度,步骤℃
的反应过程可描述为
。
4.
34
Pd/FeO
催化剂可将酸性废水中的32NONO、转化为2N,机理如图所示。34FeO中含有2价和3价的
铁,分别用Fe(II)和Fe(III))表示。
①Fe(II)中基态2Fe的核外电子排布式为 。
②H
2
还原3NO的过程可描述为
。
5.工业上利用CO2氧化乙苯制苯乙烯的反应为:
在催化剂MxOy作用下,该反应可能存在如下图所示反应机理:
写出该机理表示的两个基元反应:
i 。Ii
。
第 5 页 共 7 页
6.2CO参与的乙苯脱氢机理如图所示(
α
、β表示乙苯分子中C或H原子的位置;A、B为催化剂的活性位
点,其中A位点带部分正电荷,1B、2B位点带部分负电荷)。
图中所示反应机理中步骤℃和步骤℃可描述为
。
微专题:“看图说话”描述微观结构变化过程(参考答案)
学案参考答案:
例1:H的电负性大于Fe,小于O,在活性34-xFeO表面,H2断裂为H原子,一个吸附在催化剂的铁离子上,
略带负电,一个吸附在催化剂的氧离子上,略带正电,前者与-3HCO中略带正电的碳结合,后者与-3HCO中
略带负电的羟基氧结合生成H2O,-3HCO转化为-HCOO
练1:环氧乙烷中的电负性大的氧原子吸附在镁离子上,环氧乙烷中的碳氧键断裂,二氧化碳中的一个氧
原子与环氧乙烷中的一个碳原子结合,二氧化碳中的碳原子与氧离子结合
例2: 3NO得到纳米零价铁失去的电子生成2NO,2NO在纳米零价铁、铜粉得电子转化为4NH
练2: 228SO得到34MnO中Mn(Ⅱ)和石墨烯失去的电子,生成4SO和24SO;24SO和34MnO中的Mn(Ⅲ)
反应生成4SO和Mn(Ⅱ);水体中的还原性有机污染物被4SO氧化生成2CO和2HO
例3: O3与活性炭表面吸附的OH-作用生成·OH,·OH将活性炭表面吸附的4NH转化为N2,N2逸出。
第 6 页 共 7 页
练3: 吸附在催化剂表面的CO解离成CO和O* (活性氧原子),吸附在催化剂表面的CH4解离成H2和CH2* (活
性亚甲基), O*和H2反应生成H2O, CH2*和H2O反应生成H2和CO*, CO从催化剂表面脱附成CO。
例4:He
练4:
M的结构简式为 ,
吸附在催化剂表面的H2O断裂为H和OH,H原子与甲醛分子中的氧原子结合,OH上的O原子与碳原子结
合,生成的 (通过氧原子)吸附在催化剂表面
巩固练习参考答案:
1.电负性N>H>B,P>Ni,所以B上所连H带负电性、N上所连H带正电性、P带负电性、Ni带正电性,因
为不同电性间原子相互吸引,所以B、N上所连H分别吸附在Ni和P上 44NHBOH或42NHBO
2. ①活性炭具有吸附性,能吸附3NO;活性炭载纳米铁粉能形成铁碳原电池,加快反应速率
②Fe失去电子转化为2Fe,2Fe失去电子转化为3Fe或FeOOH,吸附于活性炭表面的3NO得到电子转化
为4NH进入溶液(或离开活性炭表面)
3. ①H2、HD ②在CH3OH和H2O中O的电负性比较大,较易吸附在带正电性的SB位点上。
③吸附在SB位点上氧原子的H-O以及氧原子相邻碳原子的C-H断裂,碳原子与氧原子形成碳氧双键,产生
的氢原子形成H-H并吸附于SA位点,继而脱附产生H2。
4. ①2262661s2s2p3s3p3d ②2H被Pd原子吸附并失去电子生成H,通过FeIII和FeII相互转化传
递电子给Pd,3NO得电子被还原为2NO,进一步被还原为4NH,4NH与2NO反应生成2N
5.
H
C
HO
H
OH
H
C
HO
H
OH
x(y-1)2(g)xy(s)(g)
MO+CO=MO+CO
第 7 页 共 7 页
6.乙苯αH带部分正电荷,被带部分负电荷的1B位点吸引,随后解离出H并吸附在1B位点上;1B位点
上的H与2B位点上2CO中带部分负电荷的O作用生成生成,带部分正电荷的C吸附在带
部分负电荷的2B位点上
