从废旧锂电池中分离提取锰钴镍的方法研究
废旧锂电池的回收和综合利用研究

废旧锂电池的回收和综合利用研究摘要:在当前人类生产生活中会产生各种废旧电池,尤其是废旧锂电池,对于废旧锂电池而言因为正极上的钴和锂元素稀缺,制作难度大,导致价格成本高、产品少,因为具有一定的回收市场价值,对此需要人们对废旧锂电池进行回收处理,可以在改造后综合利用。
此外在废旧锂电池的正负极流体中的铝箔和铜箔资源也有可以回收利用,众所周知,对废旧锂电池进行回收和利用不仅可以节约资源,也可以减少污染,可以有效对其中的各种有价值的金属进行回收,对此本文主要浅谈废旧锂电池的回收和综合利用研究。
关键词:废旧锂电池;回收;综合利用引言:废旧锂电池内含有镍钴和三元动力锂离子,这些金属物质可以通过放电、热解、破碎、分选、湿法冶金等工艺进行处理,以此重新生产出高质量的镍钴产品,在此过此中为了降低材料制作成本,需要对冶金溶液进行改进。
但是在具体的回收和综合利用中还存在各种问题,比如开发工艺自动化下的拆解分选工艺和设备问题,对此需要在后期加强对各种废旧锂电池的正极材料的处理,以此作为研究方向。
一、废旧锂电池的概述在当前科学技术的发展下,电子产品越来越多样化,极大的改变了人们的生产生活方式,锂离子电池和隔镍电电池、氢镍电池不同,其体积小、重量小、电压高、能量高,具有无记忆效应、自放电小、温度较为稳定、使用寿命长,因为这些优点的存在,导致锂离子电池产品在当前但是电子产品市场中占据较大的地位。
但是在此电子产品的出现下也带来了各种环境、气候、能源问题,随着锂离子电池在电动汽车中的广泛应用也为电动汽车的发展带来了一定的问题。
虽然锂离子电池中没有汞和铅等有毒有害的金属元素,但是当废旧锂电池已经被多个国家定义成为了危险废品,如果废旧锂电池处理不科学会对人体健康、环境产生影响。
当前在废旧锂电池中的正负极材料中含有很多的金属氧化物,贵重和稀缺金属,其电池极片中,也有一些金属物质,这些物质都需要科学处理。
二、废旧锂电池回收和综合利用的必要性众所周知,化石能源是工业发展,社会发展的基础,是人类社会生活不可或缺的东西,尤其是内燃机的利用对化石能源需求多,该设备在物流运输中发挥着重要的作用,其在提高运输效率,降低成本的同时也导致各种环境问题,资源短缺问题的发生。
废旧三元锂电池浸出及纯化技术研究进展

废旧三元锂电池浸出及纯化技术研究进展摘要:三元锂电池的安全性高、成本低、能量密度较高特点明显,被广泛应用在新能源汽车、移动电源和电动车等交通工具上,正负极的材料含有有价金属,废旧电池回收价值较高。
其中,浸出及纯化技术常被应用在废旧电池的正极金属的回收中。
对此,本文结合废旧三元锂电池正极有价金属特点,研究分析浸出及纯化技术,并提出技术使用建议。
关键词:废旧电池;三元锂电池;纯化技术引言:锂电池的产业发展,若没有及时采取合理的锂电池处理方式,则会污染环境、浪费资源。
由于废旧三元锂电池数量较多,材料汇总内含有价元素,存在较大的潜在资源和回收价值。
若系统回收废旧三元锂电池,开发创新锂电池回收再利用技术,在防治锂电池环境污染的同时,能缓解锂电池有价元素资源的短缺,进而形成行业内良性发展。
废旧三元锂电池的正负极材料技术的研究进展,涉及到材料预处理、碱浸出、铜箔回收、酸浸出等,电池浸出及再回收技术的现实价值较高,并且电解液的回收同样具有经济价值。
1.废旧三元锂电池有价金属浸出预处理三元锂电池的正极材料,选择合理的浸出工艺,将正极有价金属离子进入到浸出溶液中,为提取三元锂电池的正极材料做好准备工作,便于接下来的合成工作[1]。
现阶段,电池浸出方式主要有酸性、生物性的浸出类型,具体为:1.1无机酸浸出方式三元锂电池正极材料的活动物质的有价金属,多数是碱性化合物,金属离子游离到软性浸出液中,如HCI、HNO3、H2SO4的酸浸液,加入一定量的还原剂,目的是将锂电池活性物质还原成为低价态,进而便于浸出。
相关学者研究结果指出,使用HCI浸出液,其浸出方式的条件是:固液比20g/L、HCI浓度是4mol/L、温度是80℃、时间是1h,三元锂电池的正极浸出物质包括镍、钴、锰,浸出率接近100%。
使用HCI浸出液,其优势表现在HCI本身就是还原剂,操作工艺省去了很多步骤。
H2S O4结合H2O2浸出有价金属的方式,其操作条件是:H2SO4的浓度是6mol/L、固体和液体的比例是1:8,反应温度是60℃,浸出金属是镍、钴、锰,浸出率大约为95%[2]。
废旧锂离子电池回收及其资源化利用研究

废旧锂离子电池回收及其资源化利用研究摘要:随着社会不断的发展,电子产品也越来越多,也逐渐成为社会科技发展的重要标志,其中锂离子电池的使用量也逐步增加中,使用量加大后废弃的锂离子电池的回收也成为一个让人头疼的问题。
废弃的锂离子电池所使用的正极的材料是含锂的金属复合氧化物,负极的材料是石墨,这些东西如果没有经过分离处理就和平时的垃圾扔到一起,这些东西会逐步进入土、水里,会对大自然、土地、水资源及人体造成严重的金属污染和伤害,所以对废弃的旧锂离子电池进行回收和资源再利用处理迫在眉睫,这样就可以减轻大自然的负担,有很大的环保效果。
综上所述重点在于要研究出锂离子电池的回收及其资源化再利用,提出一些问题建议为环境保护做一些力所能及的贡献。
关键词:锂离子电池资源化利用引言:锂离子电池是经过不断的技术升级和工艺进步而研发出来的环境友好型的新一代化学电池,其性能比早期的锂一次电池有较大优势。
随着社会、经济、科技的发展,其用量也在快速的增加中,随之而来的是废旧的锂离子电池也越来越多了,为了避免废旧的锂离子电池污染环境,加快对废旧锂离子电池的回收及其资源化利用的研究也要加快脚步。
一、锂离子电池的组成传统的锂系电池可以大体分为两个品种,分别是锂原电池也叫锂一次电池和锂离子电池。
随着电子产品的使用率越高对锂离子电池的需求也越来越大,如手机和笔记本电脑、平板电脑、蓝牙耳机、电动汽车、UPS、通讯基站等等使用的基本上都是锂离子电池。
锂离子电池的正极一般采用的是含锂的过度族金属氧化物材料。
锂离子电池最先是被日本索尼公司开发研制成功投入使用的。
其原理就是把锂离子嵌入碳元素或者石墨中形成负极。
正极的材料最常用的是LiCoO2 或者或者LiNix CoyMnzO2或者LixMnO4 或者LiFePO4,电解液用的是以LiPF6为电解质,以二乙烯碳酸酯(EC)和二甲基碳酸酯(DMC)等为溶剂的有机体系电解液。
其中是石墨类的石油焦、针状焦、中间相碳微球、鳞片石墨是常见的负极材料,此类材料是环境友好型,而且这种资源相对比较充足。
废旧锂电池中钴分离回收的环境影响评估

废旧锂电池中钴分离回收的环境影响评估随着现代社会对电子设备和电动汽车的需求不断增加,废旧锂电池的处理问题逐渐凸显。
这些电池中含有重要的金属元素,如钴,对环境和资源的可持续性产生影响。
本文将探讨废旧锂电池中钴分离回收的环境影响评估,以期更好地理解这一过程对我们的生态系统和资源利用的影响。
## 1. 废旧锂电池及其成分废旧锂电池是电子设备和电动汽车中常见的能源储存装置,它们在性能下降或寿命结束后被废弃。
这些电池通常包含锂、钴、镍、铝、锰等重要材料。
其中,钴是废旧锂电池中的关键元素之一,因为它是电池正极材料中的主要成分。
## 2. 钴的重要性和供应状况钴是电池的必要组成部分,特别是用于锂离子电池。
然而,钴资源的供应存在限制,大部分钴来自于有限的矿产资源。
这导致了钴价格的波动和资源供应的不确定性。
因此,废旧锂电池中的钴分离回收变得尤为重要。
## 3. 钴分离回收的过程废旧锂电池中的钴分离回收是一项复杂的工艺,通常包括以下步骤:### 3.1 收集和拆解首先,废旧锂电池需要被收集和拆解。
这个过程需要严格的安全措施,以确保工作人员不受有害物质的影响。
拆解后,废旧电池的各个组件被分离。
### 3.2 钴的提取提取钴的方法多种多样,包括化学浸出、氧化还原反应和电解。
这些方法可以高效地将钴从废旧电池中分离出来。
### 3.3 钴的精炼分离后的钴通常需要经过精炼过程,以提高其纯度,以便再次用于电池制造。
这一过程也需要控制废物和污染物的排放。
## 4. 环境影响评估钴分离回收的环境影响评估是至关重要的,以确保这一过程对生态系统和资源的影响最小化。
以下是一些可能的环境影响因素:### 4.1 能源消耗分离和提取钴需要能源,这可能导致额外的碳排放和自然资源的消耗。
因此,使用可再生能源和能源高效的方法对环境有利。
### 4.2 废物处理废旧锂电池的拆解和钴提取可能会产生废物和有害物质。
合适的废物处理方法和废物减量化是关键。
分离镍钴的方法

分离镍钴的方法
镍钴的分离主要有以下几种方法:
1. 沉淀法:这是一种利用沉淀物的特性来分离镍钴的方法。
通过添加化学沉淀剂,如氢氧化钠和碳酸钠,可以使镍和钴分别沉淀,达到分离的目的。
2. 萃取法:通过将混合物加入适当的有机溶剂中,再利用镍和钴在不同有机溶剂中的溶解度不同,用适当的方法将它们分离出来。
目前,溶剂萃取法具有高选择性、高直收率、流程简单、操作连续化和易于实现自动化等优点,被广泛应用于镍钴分离。
3. 电渗析法:这是一种利用离子在电场作用下运动方向的不同来分离镍钴的方法。
在直流电场作用下,镍离子和钴离子分别向阳极和阴极迁移,从而达到分离的目的。
4. 离子交换法:这是一种利用离子交换树脂的特性来分离镍钴的方法。
离子交换树脂具有选择性吸附镍离子和钴离子的能力,从而达到分离的目的。
5. 吸附法:利用吸附剂的表面活性来分离镍钴。
吸附剂具有吸附镍离子和钴离子的能力,将混合物通过吸附剂时,镍离子和钴离子分别被吸附在不同的表面上,从而达到分离的目的。
6. 其它方法:例如催化沉淀法、电渗析-离子交换法、电化学分离法等,也可以用来分离镍钴。
以上这些方法中,沉淀法和萃取法在工业生产和新能源领域具有重要的应用价值。
但是每种方法都有其优缺点,需要根据具体情况选择合适的方法。
萃取法从废旧锂离子电池回收钴
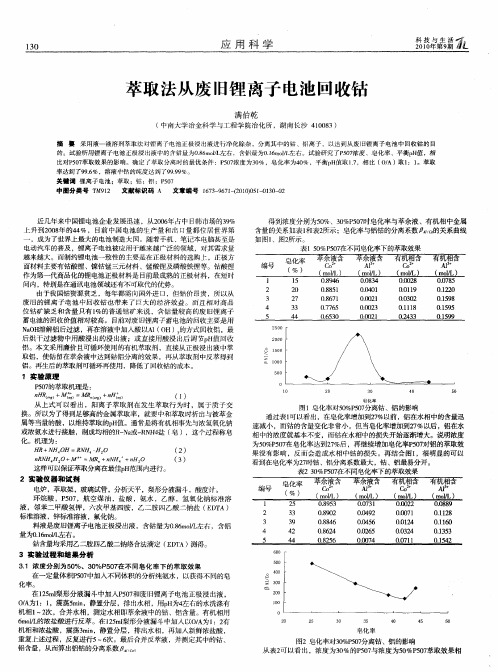
应 科 学
2宰9 科0蒜霸 0年 蔫 1 第期
萃取法从废 旧锂 离子 电池回收钴
满伯乾
( 中南大学冶金科学与工程学 院冶化所 ,湖南 长沙 4 0 8 1 0 3)
摘 要 采用液一 液溶剂萃 取法对锂 离予 电池 正极浸 出液进行净 化除杂 ,分离其 中的钴 、铝离子 ,以达 到从 废 旧锂 离子 电池 中 回收钴 的 目
一
,
得 到浓度分别为5%、3%P0H皂化率与萃余 液、有机相 中金属 0 0 57 ̄ 含量的关 系如表1 和表2 所示;皂化率与铝钴的分离系数 的关系曲线 如图1 、图2 所示 。 表 1 0 57 %P 0 在不同皂化率下的萃取效果 5
取铝 , 使钴 留在萃余液 中达到钻铝分离的效果 ,再从萃取剂中反萃得到 铝。再生后的萃取剂可循环再使用 ,降低了回收钴 的成本。
1 实 验原 理 P o的萃取机理是: 57
n HR ) (窖 + , ) ) I
从 上式可以看 出,阳离子 萃取剂在发生萃取行 为时 ,属于质子交 换。所以为 了得到足够高的金属萃取率 , 就要中和萃取时析出与被萃金 属等当量的酸 ,以维持萃取的p 值。通常是将有机相事先与浓氢氧化钠 H 或浓氨水进行接触 , 制成均相 的1 N 或一 N 4 ( ) t a R H 盐 皂 ,这个过程称皂 —
化 。机 理 为 : H N 0 =N ・ 0 R+ H4H R H4 ( 2) nN H2 M =M N H2 R H4 0+ R +n H4+n 0 ( 3) 这样可以保证萃取分离在最佳p H范围内进行。
皂化率
图1皂化率对5 %P 0 分离钴、铝 的影响 0 57 通过表 l 可以看 出,在皂化 ̄ t 7 以前 , 1 % N2 铝在水相 中的含量迅 速减小 ,而钴的含量变化非常小 。但当皂化率增加到2 %以后 , 7 铝在水 相 中的浓度就基本不变 ,而钴在水相中的损失开始逐渐增大。说明浓度 为5% 57 0 P 0在皂化率达到2% ,再继续增加皂化率P0对铝的萃取效 7后 57 果没有影响 ,反而会造成水 相中钴 的损失 。再结合图1 ,很明显 的可以 看到在皂化率为2 时钴 、铝分离系数最大 , 、铝最易分开。 7 钴 表23 %P 0在不同皂化率下的萃取效果 O 5 7
酸浸—萃取—沉淀法回收废锂离子电池中的钴
酸浸—萃取—沉淀法回收废锂离子电池中的钴张新乐;徐金球;张晓琳【摘要】采用酸浸—萃取—沉淀法回收废锂离子电池中的钴.实验结果表明:废锂离子电池在600℃下煅烧5h可将正极材料上的有机黏结剂与正极活性物质分离;正极活性物质在NaOH溶液浓度为2.0 mol/L、n(NaOH)∶n(铝)=2.5、碱浸温度为20℃的条件下碱浸反应1h后,铝浸出率达99.7%;已除铝的正极活性物质在硫酸浓度为2.5 mol/L、H2O2质量浓度为7.25 g/L、液固比为10、酸浸温度为85℃的条件下酸浸反应120min,钴浸出率高达98.0%;酸浸液在pH为3.5、萃取剂P507与Cyanex272体积比为1∶1的条件下,经2级萃取,钴萃取率为95.5%;采用H2SO4溶液反萃后在硫化钠质量浓度为8 g/L、反萃液pH为4的条件下沉淀反应10 min,钴沉淀率达99.9%.【期刊名称】《化工环保》【年(卷),期】2016(036)003【总页数】6页(P326-331)【关键词】酸浸;萃取;沉淀;废锂离子电池;钴【作者】张新乐;徐金球;张晓琳【作者单位】上海第二工业大学环境与材料工程学院,上海201209;上海第二工业大学环境与材料工程学院,上海201209;上海第二工业大学环境与材料工程学院,上海201209【正文语种】中文【中图分类】X705锂离子电池具有较高的工作电压和能量密度,自放电率低,无记忆效应,被广泛应用于移动电子设备[1]。
我国是锂离子电池的消费和出口大国,但对锂离子电池的回收率较低[2],大量废锂离子电池处于被暂存或遗弃的状态,不仅浪费资源,也对环境造成污染。
锂离子电池中含镍5%~10% (w)、锂5%~7%(w)、钴5%~20%(w)[3-4]。
锂离子电池主要由正极、电解液和负极组成,其中正极主要由LiCoO2活性物质、炭黑、铝箔集流体和黏结剂组成。
回收废锂离子电池就是对其正极物质进行回收[5-6]。
回收废旧锂离子电池有价金属的研究进展
锂 离子 电池 自2 世 纪 9 年 代进入商业 化 O 0 以来 , 已广泛 应 用 于便 携 式 电子 产 品领 域 , 包 括 移 动 电话 、 笔 记 本 电 脑 、 摄 像 机 、 数 码 相机 、医疗 器 械 等 。重量 轻 , 体积 小 是 当 前 这些机 器 的发展趋 势 。锂 离子 二次 电池是 这 些便 携式 设 备 仪 器首选 的 高能 动 力 电池 。 但是 , 几年 来 , 近 随着锂 离子 电池 用量 急 速 增加 ,报废 的锂 离子 电池也 将逐 年 大幅 度 增 多。当这些数 以吨 计的锂 离子 电池 报废后 , 如果 处理 不 当会产生 严重 的安 全隐 患及 环境 污 染 ,同时 还会 造 成极 大 的资 源浪 费 … 。西 方 发达 国家对 电池的 使用 和废 旧 电池 的 回收 已经制定 了严 格的管 理法 规并 开展 了积极 的 研 究 工 作 ,例 如 : 久 前 ,欧 盟委 员会 通 】 不 过 了一项 关于制 定 电池 回收再利 用新 指令 的 建议 , 根据规 定 , 生产商应 承担 电池 回收 、 处 理和再利 用的费 用。 我 国, 管 目前还 没有 在 尽 相应 的法 律法规 ,但 随着 社会 和经 济的发 展 以及 人们 对环保 的 日益重 视 ,废 旧锂离子 电 池 的 回收将 成 为十 分迫 切 的 问题 I 。 锂 离子二 次 电池 中含有 多种 有 回收价 值 的 贵 金 属 , 如 钴 、 锰 、 锂 等 。 因此 , 回 收处理 废 旧锂 离子 二次 电池 不仅 具有 较大 的 经济 价 值 ,还有 益 于保 护 环境 ,保 护生 态 。 本文 综述钴 、锂 和锰 的国 内外 回收处理 工艺 的研究进展 。
1锂 离子电池的结构
目前 ,锂 离子二 次 电池 中使 用的 负极 材 料 多为石 墨 ,正极 材料 则为嵌 锂过 渡 金属氧 化 物 , 如 L C 0, i 0 、L V0 、及 i 0 、L Ni i L MnO 等 。 i 24 锂 离子 电池 的外 壳材 料为 不锈 钢 、镀镍 钢 、铝 等 ,形 状 有方 型和 圆柱 型 ,正 极 与 负极用隔 膜隔 开后 卷绕而 成 。正 极 由约 8 % 8 ( 质量分 数) 的正 极活性 物 质、7 %~8 ( % 质量 分数 ) 的导 电剂 、3 %~4 ( % 质量分 数) 的有机 粘 合剂 均 匀混 合后 ,涂 布 于 厚约 2 m 的 0 铝箔集 流体上 。负极 由约 9% ( 0 质量分 数) 的 负极 活性 物 质碳 素材 料 、4 %~5 ( % 质量 分 数) 的导 电剂 、6 %~7 ( % 质量 分数 ) 的有机 粘 合剂 均匀 混 合后 ,涂布 于 厚约 l 的 铜 5um 箔集 流体 上 。 电解 液 为 l l L的 L P mo / i F 的
废旧锂电池的回收与再利用研究
废旧锂电池的回收与再利用研究随着锂离子电池的广泛应用,废旧锂电池成为一个值得重视的问题。
废旧锂电池不仅占用资源、浪费能源,还会对环境及人体造成较大的危害。
因此,对于废旧锂电池的回收与再利用研究至关重要。
1. 废旧锂电池的危害废旧锂电池中含有大量的有害物质,如果随意处理将会对环境及人体造成极大的危害。
其主要危害如下:1.1 重金属的污染废旧锂电池中含有大量的有害重金属,如镉、铅、汞等,这些重金属可以渗入土壤、水源,对环境造成污染。
1.2 热化性废旧锂电池失去容量后会出现热化现象,甚至会爆炸,对人身安全造成严重威胁。
1.3 能源的浪费废旧锂电池中含有大量的有用金属和化学物质,如果随意处理将浪费资源,造成经济损失。
目前,废旧锂电池的回收技术主要包括物理方法和化学方法两种。
2.1 物理方法物理方法主要是采用机械破碎、吸附或分离等物理处理过程,将废旧锂电池中的有用成分分离出来。
其中,机械破碎是最常用的方法,通过破碎设备对废旧锂电池进行初步的分离和粉碎处理,将有用成分和废弃部分分离出来。
吸附法则是利用特殊材料吸附废旧锂电池中的有用成分,如正极材料中的锂离子、钴、镍等,通过更换材料、再生材料等方式,实现有用成分的回收和再利用。
分离法则是利用物理分离方法将废旧锂电池中的有用成分分离出来,如使用磁力分离器将废弃部分中的钢铁材料分离出来,通过筛分、重力分离等方式将有用成分分离出来,实现资源的回收和再利用。
化学方法主要是采用化学溶解、浸出等化学处理过程,将废旧锂电池中的有用成分溶解出来。
其中,化学溶解法是最常用的方法,通过酸碱法、高温高压法等方式将废旧锂电池中的有用成分溶解出来,然后再进行过滤、浓缩、还原等后续处理,实现有用成分的回收和再利用。
废旧锂电池中的有用成分主要包括正极材料中的锂离子、钴、镍等,负极材料中的石墨、锡、铜等,以及电解液中的有机溶剂、盐等。
这些有用成分可以被重新制成新的锂离子电池或其他新材料。
3.1 制备新锂离子电池废旧锂电池中的有用成分可以被重新制成新的锂离子电池。
2021年福建省新高考“八省联考”高考化学适应性试卷-解析版
2021年福建省新高考“八省联考”高考化学适应性试卷1.福建省三钢集团近年来大气污染治理成须显著,厂区“绿”意盎然。
治理后,钢铁厂排放的尾气中,下列物质含量最大的是()A. CO2B. NO2C. SO2D. PM10【答案】A【解析】解:A.钢铁厂产生二氧化碳气体,二氧化碳属于无污染的气体,治理后污染气体减少,二氧化碳最多,故A正确;B.二氧化氮是污染气体,治理后减少排放,故其含量不能最大,故B错误;C.二氧化硫属于污染气体,治理后减少排放,含量不是最大,故C错误;D.PM10含量最大的话,加重了大气污染,厂区不能绿意盎然,故D错误;故选:A。
A.钢铁厂产生二氧化碳气体,二氧化碳属于无污染的气体;B.二氧化氮是污染气体;C.二氧化硫属于污染气体;D.PM10含量最大的话,大气污染严重。
本题考查环境的污染与保护,为高频考点,把握常见物质的性质、发生的化学反应及是否改善空气质量为解答的关键,题目难度不大。
2.山奈酚是中药柴胡的药物成分之一。
下列有关该化合物叙述错误()A. 分子式为C15H10O6B. 能够发生加成反应C. 苯环中含有单双键交替结构D. 可溶于NaOH溶液【答案】C【解析】解:A.由该物质的结构简式可知其分子式为C15H10O6,故A正确;B.含有苯环和羰基,可以发生加成反应,故B正确;C.苯环中的键是介于单双键之间的特殊的键,不是单双键交替的结构,故C错误;D.含有3个酚羟基,可与NaOH溶液反应生成溶于水的物质,故D正确;故选:C。
由结构可知分子式,分子中含酚−OH、碳碳双键、醇−OH、羰基及醚键,结合酚、烯烃、醇等有机物的性质来解答。
本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的易错点,题目难度不大。
3.已知N A是阿伏加德罗常数的值,下列说法正确的是()A. 0.1mol⋅L−1KNO3溶液中离子总数大于0.2N AB. D218O和T2O的混合物1.1g,含有的质子数为0.5N AC. 5.6gFe与足量的S反应转移的电子数为0.3N AD. 0.1molH2和0.2molI2充分反应后分子总数小于0.3N A【答案】B【解析】解:A.溶液体积未知,无法确定溶液中离子数目,故A错误;=B.D218O和T2O的摩尔质量均为22g⋅mol−1,所以1.1g混合物的物质的量为 1.1g22g⋅mol−10.05mol,一个D218O分子和一个T2O分子均含有10个质子,所以混合物含有的质子数为0.5N A,故B正确;=0.1mol,与足量的S反应生成FeS,转移电子数为0.2N A,C.5.6gFe的物质的量为 5.6g56g⋅mol−1故C错误;D.H2和I2反应方程式为H2+I2⇌2HI,反应前后分子数不变,所以0.1molH2和0.2molI2充分反应后分子总数为0.3N A,故D错误;故选:B。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
从废旧锂电池中分离提取锰钴镍的方法研究一、方法研究概述本研究提出一种新型的从废旧锂电池中分离回收钴镍锰的工艺。
该工艺采用物理擦洗−稀酸搅拌浸出的方法分离集流体与活性物质,采用H2SO4+H2O2为浸出剂对活性物质进行浸出,然后采用黄钠铁矾法去除浸出液中的铁,再采用N902萃取分离铜,通过水解沉淀法除铝最后采用碳酸盐共沉淀法制备镍钴锰碳酸盐前躯体。
结果表明:最优浸出条件为液固比10:1、H2SO4浓度2.5 mol/L、H2O2加入量2.0 mL/g(粉料)、温度85 ℃、浸出时间120 min;在此条件下,钴、镍和锰的浸出率分别达到97%、98%和96%;除去浸出液中的铁、铜和铝后,钴、镍和锰的损失率分别为1.5%、0.57%和4.56%;总体来说,废旧锂离子电池中钴、镍和锰的回收率均可以达到95%。
二、锂电池的历史沿革锂电池自1990年实现商业化以来,以其具有能量密度大、质量轻、寿命长且无记忆性等诸多优点,被广泛应用于移动电话、笔记本电脑和照相机等便携式电子设备中。
据统计,2000年全球锂离子电池生产量达到5亿只,预计2010年产量将超过46亿只[1]。
由于技术和经济等方面的原因,目前锂电池回收率很低,大量废旧锂电池被遗弃,给环境造成巨大威胁和污染,同时对资源也是一种浪费,分析表明:锂电池中含钴5%~20%、锂5%~7%、镍5%~10%。
因此,如何在治理“电池污染”的同时,实现废旧电池有色金属资源尤其是钴的综合循环回收,已成为社会关注的热点难题。
目前,世界各国对锂电池中有价金属钴的回收与电池材料的再生工艺研究很多,LI等先用超声清洗分离集流体与活性物质,并使用高浓度盐酸浸出,沉淀回收钴;LIU等[5]采用有机溶剂浸泡极片,使集流体与活性材料分离,通过高温固相法重新合成LiCoO2;LEE等[6]使用两级热处理两级过筛后高温煅烧的方法预选活性物质,分别采用HNO3 和HNO3-H2O2 体系对筛后活性物质浸出;WANG等采用盐酸浸出,高锰酸钾氧化沉锰,丁二酮肟萃取镍,氢氧化钠沉淀回收钴。
由于以上研究实际应用效果欠佳,一般不具备经济可行性。
造成这一局面的原因一方面是废旧锂离子电池拆分过程效率低,集流体与活性物质分离过程能耗大,成本较高,环境污染严重;另外一方面是LiNiO2、LiMnx NiyCo1−x−yO2和LiMn2O4等替代品也逐渐进入市场,使回收锂电池中钴的同时不得不进行多种金属如锰和镍的分离。
针对废旧锂离子电池回收工艺中所面对的上述问题,本研究试图寻求一条回收效率高、经济合理、且环境友好的废旧锂离子电池的回收工艺。
三、方法的实验研究1 实验1.1 实验材料实验所用的粉料来自湖南某废旧锂电池拆解厂。
对回收的大量废旧锂电池进行手工拆壳和电池芯粉碎,经过预处理后获得活性粉料,其主要化学成分如表1所列,其XRD谱如图1所示。
表1 粉料金属成分含量1.2 实验原理与方法锂离子电池中,正极活性物质或负极活性物质通常是与溶于NMP 的有机粘结剂(如PVDF)调浆后涂覆在金属集流体上制成薄膜电极。
将活性物质和集流体进行分离主要有以下3条途径:1) 高温分解或溶解粘结剂;2) 溶解集流体;3)破坏接触界面。
本研究采用手工除去塑料及金属外壳,取出电芯,将电芯机械破碎至1~5 mm,破碎后的电芯置于热水中搅拌擦洗,过滤烘干后过筛,分出大部分活性物质。
通过稀酸局部溶蚀集流体表面和活性物质,造成表面缺陷,再通过搅拌擦洗作用使残留的活性物质从电极集流体上脱落,二次过筛后实现其与正负极集流体分离。
铝箔、铜箔经洗涤、干燥后可直接作为产品回收,两次筛分的活性粉体合并经进一步处理回收有价组分。
2Al+3H2SO4→Al2(SO4)3+3H2↑(1)4LiCoO2+6H2SO4→2Li2SO4+4CoSO4+6H2O+O2↑(2)本实验采用H2SO4+ H2O2浸出废旧锂电池中的活性物质,浸出过程中发生的反应为2LiCoO2+3H2SO4+H2O2→2CoSO4+O2↑+ Li2SO4+4H2O (3)浸出后的滤液中含有Fe3+、Cu2+、Al3+等杂质,本实验采用黄钠铁矾法除铁[14],其反应式为Fe2(SO4)3 + 12H2O + Na2SO4 →Na2Fe6(SO4)4(OH)12↓+ 6H2SO4(4)目前市场上流行多种铜的特效萃取剂,如LIX 系列、Cyanex系列等。
由实验选用的萃取剂为N902。
相对于这些萃取剂而言,虽然N902萃取铜的pH值范围和萃取容量相对较小,但其价格相对便宜,适合大规模的工业化生产[15]。
实验结果表明:N902对铜具有很强的选择性,且反萃性能优良,有利于实现产业化。
萃余液经水解沉淀除铝后,通过碳酸盐共沉淀法制备三元锂离子电池正极材料前躯体。
综上所述,实验工艺流程如图2所示。
1.3 分析方法试样中钴以及其余元素的液相分析采用PS−6等离子原子发射光谱ICP-AES,pH值测定使用PHS−3C型pH计,物相分析采用日本RigakuD 型X射线衍射仪。
2 结果讨论2.1 活性物质与集流体的分离将破碎后的电芯碎片加入热水中机械搅拌,过滤烘干后进行第一次振动筛分,分离出的粉体材料留作他用。
取一定量筛上碎料,置于一定浓度的稀硫酸溶液中机械搅拌浸泡,控制试验温度为25 ℃,转速为400 r/min,液固比为10:1,搅拌时间为60 min,考察硫酸浓度对活性物质与集流体分离的影响。
反应结束后过滤溶液,用热水多次淋洗渣相,滤液和洗液合并送入下段浸出工序;渣相用孔径为180 µm(80目)筛子进行筛分,筛上产物为铝箔和铜箔;筛下产物经过滤、干燥得到活性粉料。
不同硫酸浓度对试样溶解性的影响如表2所列。
由表2可知,筛上碎料中活性物质与铝箔、铜箔得到有效分离时的最佳硫酸浓度为0.5 mol/L。
在筛上碎料的浸出过程中,除了有少量铝浸出外,还有少量的铜浸出。
这可能是由于铜箔上的石墨化碳很容易脱落,铜箔表面被氧化生成氧化铜而溶于稀硫酸。
表2 不同硫酸浓度对试样溶解性的影响2.2 还原酸浸每次试验使用10 g 活性粉料,粉末平均粒径为0.178 mm,固定搅拌速度为400 r/min,分别考察反应温度和时间、硫酸浓度、双氧水加入量、液固比对浸出率的影响。
2.2.1反应温度和时间对浸出过程的影响在硫酸浓度2.5 mol/L、加入H2O21.0 mL/g(粉料)、液固比10:1的条件下进行试验,考察温度和时间对活性粉料浸出效果的影响,结果如图3~5所示。
从图3~5中可以看出,粉末中钴、镍和锰的浸出速率随反应温度的升高和反应时间的延长而提高。
酸浸过程中,粉末的溶解为固−液非均相反应,温度的升高对浸出过程的化学反应速率和扩散速率都有促进作用。
25 ℃时,钴、镍和锰的浸出率都不高;当温度升至85 ℃后随着温度的增加,浸出率的变化较小。
反应60 min时,钴、镍和浸出率急剧增加;反应120 min后,钴、镍和锰浸出率增加趋势变缓。
因此,综合考虑三者的浸出效果和能耗的损失,选择浸出反应温度为85 ℃,反应时间为120 min。
2.2.2硫酸浓度对浸出过程的影响在温度85 ℃、时间120 min、加入H2O21.0 mL/g(粉料)、液固比10:1的条件下进行试验,考察硫酸浓度对活性粉料浸出效果的影响,结果如图6所示。
从图6中可以看出,粉末的钴、镍和锰浸出率随硫酸浓度的增加而升高,当硫酸浓度为2.5 mol/L时,钴、镍和锰浸出率趋于平缓,钴、镍和锰浸出率分别为92.3%、93.5%和90.1%;继续增加硫酸浓度,浸出率增加不大,故选择硫酸浓度为2.5 mol/L。
2.2.3双氧水加入量对浸出过程的影响在硫酸浓度2.5 mol/L、温度85 ℃、时间120 min、液固比10:1的条件下进行试验,考察双氧水加入量对活性粉料浸出率的影响,结果如图7 所示。
从图7中可以看出,粉末中钴、镍和锰的浸出率随双氧水加入量的增加而增大。
当不加双氧水时,浸出率始终低于60%,此时LiCoO2发生的是自身氧化还原反应,反应方程如式(3)所示。
加入双氧水后,反应方程如式(4)所示,双氧水的加入大大促进了LiCoO2的溶解,提高了活性粉料的浸出率和溶解速率。
当双氧水加入量大于2.0 mL/g(粉料)后,继续增加其用量,对钴、镍和锰浸出率的影响都非常小,此时钴、镍和锰的浸出率分别为95.6%、96.1%和93.5%。
2.2.4液固比加入量对浸出过程的影响在硫酸浓度2.5 mol/L、温度85 ℃、时间120 min、加入H2O22.0 mL/g(粉料)的条件下进行试验,考察液固比对活性粉料浸出效果的影响,结果如图8所示。
从图8中可以看出,粉末中钴、镍和锰的浸出率随液−固比的增加而增大。
当液−固比增加时,溶解一定量固体的溶液体积增大,主体溶液中反应生成物的浓度也随之降低。
反应生成物浓度梯度减小可提高溶液中新生成产物的扩散速率,从而有利于粉末的溶解;但液−固比过高时,则要求反应容器较大,增加了浸出工序的负担,同时又必然降低了浸出液的溶度,对回收工艺不利。
因此,选择合适的液−固比为10:1。
通过对影响浸出各因素的考察,综合考虑经济、能耗及反应容器体积等原因,选择最佳浸出条件如下:2.5 mol/L硫酸、2.0 mL H2O2/g粉料、120 min、85 ℃、液固比10:1。
在最佳浸出条件下,钴、镍和锰的浸出率分别为97%、98%和96%,终点pH值为0.5~0.8,各元素在浸出液中的质量浓度见表3。
表3 浸出液中各离子的质量浓度2.3 浸出液的净化2.3.1 黄钠铁矾法除铁将浸出液预中和调节pH值至1.0后,加热至95 ℃,再缓慢加入质量分数为10%的NaOH溶液调节pH值至1.7~1.9,反应2 h后调节终点pH至3.0~3.5,除铁后溶液中铁离子含量为0.006 g/L。
结果表明,采用黄钠铁矾法除铁时,钴的回收率较高, 铁的除去率为99.9%,而钴、镍和锰的损失率均小于1%。
2.3.2 N902 萃取除铜1) 水相pH值对N902萃取铜的影响萃取剂N902为酸性萃取剂,在萃取过程中会产生大量的H+,且浸出过程是在硫酸过量的条件下进行的,因此浸出液也具有一定的酸度。
为了达到最优的分离效果,需将水相的pH调节至最适合萃取的范围。
在固定萃取剂组成(体积分数)为10%N902+90%璜化煤油、O/A为1:1的条件下进行试验,考察水相不同pH值对N902萃取性的影响,结果如图9所示。
由图9可知,水相pH值对N902萃取铜的影响较大,随着水相pH值的增加,铜萃取率上升明显;pH值大于1.25后,铜萃取率的增加趋于缓慢,此时铜的萃取率为97.72%,钴、镍、锰和铝的萃取率分别为0.82%、0.31%、1.9%和0.53%;继续增加pH值时,铜萃取率缓慢上升,同时大量的钴、镍、锰和铝将进入有机相,达不到萃取分离的目的,故选择萃取水相pH值为1.25。
