植物中游离氨基酸的测定
游离氨基酸的测定实验报告

游离氨基酸的测定实验方案(茚三酮比色法)一、实验目的茚三酮比色法测定发酵液中游离氨基酸含量,利用氨基酸含量这个参数,控制发酵过程.二、实验原理游离氨基酸的游离氨基可与水合茚三酮作用,产生蓝紫色的化台物二酮茚一二酮茚胺,产物的颜色深浅与游离氨基酸含量成正比,用分光光度计在570nm 下测其含量.因蛋白质中的游离氨基酸也会产生同样反应,在测定前必须用蛋白质沉淀剂将其除掉。
三、实验材料发酵液样品;实验试剂:水合茚三酮;氨基酸标准液;0.1%抗坏血酸实验仪器:100ml容量瓶;漏斗;三角瓶;研钵;移液器;枪头;沸水浴;具塞刻度试管20 ml×10;分光光度计四、实验方法1.溶液配制(1)水合茚三酮称取0。
6g重结晶的茚三酮放烧杯中,加入15ml 正丙醇、30ml正丁醇、60ml乙二醇及9 ml PH4。
54的醋酸盐缓冲液混匀,棕色瓶中冰箱内保存,10天内有效。
(2)氨基酸标准液称取80℃烘干的亮氨酸23.4mg,以10%的异丙醇溶解定溶至50ml(含氮为50ug/ ml),取此液5ml,用水定容至50 ml,此为含氮量5ug/ ml工作液。
(3)0.1%抗坏血酸称取0。
1g抗坏血酸定容100 ml,随用随配。
2.标准曲线绘制取6支20ml 试管,按下表加剂:试剂管号12 3 4 5 6 亮氨酸标准液(ml ) 0 0.2 0.4 0。
6 0。
8 1.0 无氨蒸馏水(ml ) 2.0 1。
8 1。
6 1.4 1.2 1.0 水合茚三酮(ml) 3.0 3。
0 3。
0 3.0 3.0 3。
0 抗坏血酸(ml ) 0.1 0.1 0.1 0.1 0。
1 0.1 氨基氮量(ug/管 )1.02.03.04.05.0将各管溶液混合均匀,封口,在沸水中加热15min ,取出后立即用冷水摇动冷却,用60%乙醇定容至20 ml ,摇匀。
λ=570nm 处测定吸光度0 0.025 0.055 0。
0990。
146 0.186以吸光度为纵坐标,氨基氨ug 数为横坐标,绘标准曲线如图:茚三酮比色法测定游离氨基氮标准曲线-0.0500.050.10.150.2氨基氮(ug)吸光度A3.样品中游离氨基酸的测定取20ml 试管,取待测液1ml ,加蒸馏水l ml ,水合茚三酮3.0 ml,坏血酸0。
实验三十六 植物体内游离脯氨酸的测定,更改

实验三十六植物体内游离脯氨酸的测定原理在正常环境条件下生长的植物,体内游离脯氨酸的含量较低,但在逆境(如旱、寒、盐等)条件下,植物体内游离脯氨酸的含量可增加10-100倍,因此有人提出游离脯氨酸的含量可作为植物抗逆性指标。
植物体内的游离脯氨酸用磺基水杨酸或酒精提取。
在酸性条件下,脯氨酸和茚三酮反应生成稳定的红色产物(结构如下),用比色法于520nm波长下测定脯氨酸的含量。
仪器设备1.分光光度计2.分析天平3.恒温水浴4.研钵5.容量瓶6.具塞试管:25毫升9支7.移液管:2毫升4支、5毫升2支8.漏斗9.滤纸试剂1.酸性茚三酮:称取2.5克茚三酮,加入60毫升冰醋酸和40毫升6M磷酸,于70℃下加热溶解。
冷却后贮于棕色试剂瓶中备用。
4℃下2~3日内有效。
2.脯氨酸标准溶液:称取0.0250克脯氨酸,溶解在250毫升蒸馏水中,其浓度为100微克/毫升。
再取此液10毫升,用蒸馏水稀释至100毫升,即为10微克/毫升之脯氨酸标准液。
3.冰醋酸4.甲苯若用磺基水杨酸提取,需要配制3%的磺基水杨酸溶液。
(若用酒精提取,需要80%的酒精,活性炭,人造沸石)。
材料生长在灌水及干旱条件下的小麦或其它作物。
方法步骤1.制作标准曲线:取7支25毫升具塞试管,编号。
分别向各管准确加入脯氨酸标准液(每毫升含脯氨酸10微克)0、0.2、0.4、0.8、1.2、1.6、2.0毫升,再用蒸馏水将体积补至2毫升,摇匀,便配成了分别含0、2、4、8、12、16、20微克脯氨酸的标准系列。
再向各管加入冰醋酸和酸性茚三酮各2毫升。
摇匀后,在沸水浴中加热显色30分钟,取出后冷却至室温,向各管加入5毫升甲苯,充分摇动,以萃取红色产物。
萃取完后(避光静置4小时以上),待完全分层后,用吸管吸取甲苯层,用分光光度计在520nm波长下测定消光值,以脯氨酸含量为横座标,消光值为纵座标,绘制标准曲线。
2.游离脯氨酸提取:植物体内的游离脯氨酸可以用3%的磺基水杨酸提取。
游离氨基酸测定(完整版)
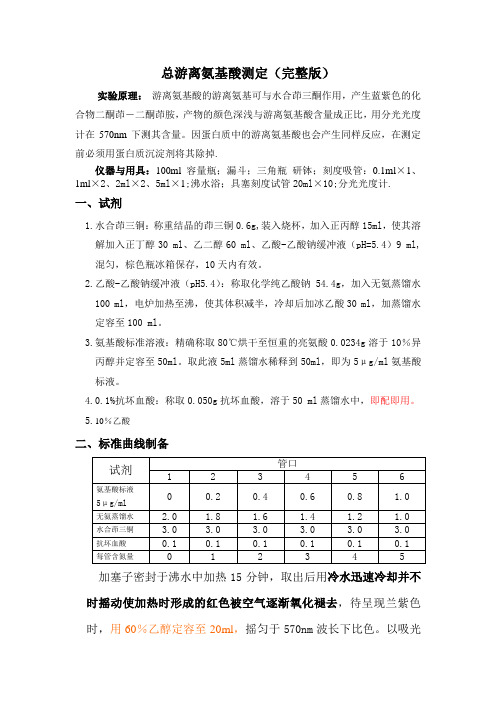
总游离氨基酸测定(完整版)实验原理:游离氨基酸的游离氨基可与水合茚三酮作用,产生蓝紫色的化合物二酮茚-二酮茚胺,产物的颜色深浅与游离氨基酸含量成正比,用分光光度计在570nm下测其含量。
因蛋白质中的游离氨基酸也会产生同样反应,在测定前必须用蛋白质沉淀剂将其除掉.仪器与用具:100ml容量瓶;漏斗;三角瓶研钵;刻度吸管:0.1ml×1、1ml×2、2ml×2、5ml×1;沸水浴;具塞刻度试管20ml×10;分光光度计.一、试剂1.水合茚三铜:称重结晶的茚三铜0.6g,装入烧杯,加入正丙醇15ml,使其溶解加入正丁醇30 ml、乙二醇60 ml、乙酸-乙酸钠缓冲液(pH=5.4)9 ml,混匀,棕色瓶冰箱保存,10天内有效。
2.乙酸-乙酸钠缓冲液(pH5.4):称取化学纯乙酸钠54.4g,加入无氨蒸馏水100 ml,电炉加热至沸,使其体积减半,冷却后加冰乙酸30 ml,加蒸馏水定容至100 ml。
3.氨基酸标准溶液:精确称取80℃烘干至恒重的亮氨酸0.0234g溶于10%异丙醇并定容至50ml。
取此液5ml蒸馏水稀释到50ml,即为5μg/ml氨基酸标液。
4.0.1%抗坏血酸:称取0.050g抗坏血酸,溶于50 ml蒸馏水中,即配即用。
5.10%乙酸二、标准曲线制备加塞子密封于沸水中加热15分钟,取出后用冷水迅速冷却并不时摇动使加热时形成的红色被空气逐渐氧化褪去,待呈现兰紫色时,用60%乙醇定容至20ml,摇匀于570nm波长下比色。
以吸光度为纵坐标,氨基氮ug数为横坐标,绘标准曲线三、实验步骤:1.烟末0.5g于研钵中加入5 ml10%乙酸,研磨匀浆后用蒸馏水定容100 ml,用滤纸过滤到三角瓶中备用。
2.1ml滤液加入到20ml 干燥试管中,加1 ml蒸馏水,水合茚三铜3ml, 0.1%抗坏血酸0.1ml, 加塞子密封于沸水中加热15分钟,取出后用冷水迅速冷却并不时摇动使加热时形成的红色被空气逐渐氧化褪去,待呈现兰紫色时,用60%乙醇定容至20ml,摇匀于570nm波长下比色。
实验一 氨基酸总量的测定(发园艺.设施等)
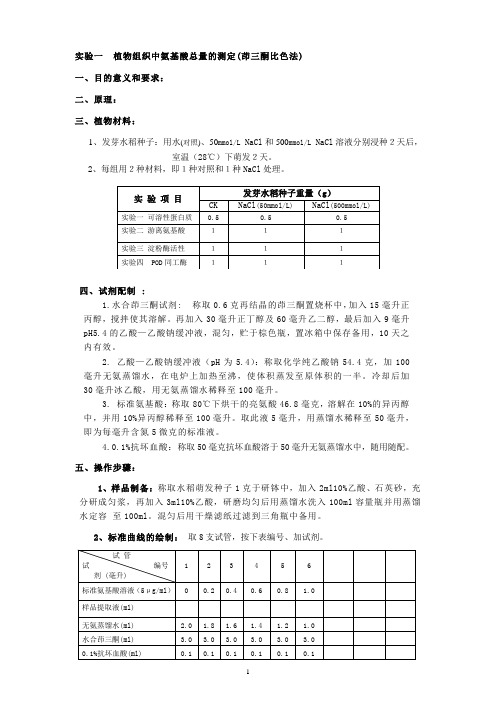
实验一植物组织中氨基酸总量的测定(茚三酮比色法)一、目的意义和要求:二、原理:三、植物材料:1、发芽水稻种子:用水(对照)、50mmol/L NaCl和500mmol/L NaCl溶液分别浸种2天后,室温(28℃)下萌发2天。
2、每组用2种材料,即1种对照和1种NaCl处理。
四、试剂配制 :1.水合茚三酮试剂: 称取0.6克再结晶的茚三酮置烧杯中,加入15毫升正丙醇,搅拌使其溶解。
再加入30毫升正丁醇及60毫升乙二醇,最后加入9毫升pH5.4的乙酸—乙酸钠缓冲液,混匀,贮于棕色瓶,置冰箱中保存备用,10天之内有效。
2. 乙酸—乙酸钠缓冲液(pH为5.4):称取化学纯乙酸钠54.4克,加100毫升无氨蒸馏水,在电炉上加热至沸,使体积蒸发至原体积的一半。
冷却后加30毫升冰乙酸,用无氨蒸馏水稀释至100毫升。
3. 标准氨基酸:称取80℃下烘干的亮氨酸46.8毫克,溶解在10%的异丙醇中,并用10%异丙醇稀释至100毫升。
取此液5毫升,用蒸馏水稀释至50毫升,即为每毫升含氮5微克的标准液。
4.0.1%抗坏血酸:称取50毫克抗坏血酸溶于50毫升无氨蒸馏水中,随用随配。
五、操作步骤:1、样品制备:称取水稻萌发种子1克于研钵中,加入2ml10%乙酸、石英砂,充分研成匀浆,再加入3ml10%乙酸,研磨均匀后用蒸馏水洗入100ml容量瓶并用蒸馏水定容至100ml。
混匀后用干燥滤纸过滤到三角瓶中备用。
2、标准曲线的绘制:取8支试管,按下表编号、加试剂。
2、样品测定:取3支20ml刻度试管,按下表编号、加试剂。
加完试剂后,混匀,盖上玻塞,置沸水浴中加热15分钟,然后取出放在冷水浴中迅速冷却并经常摇动,使加热时形成的红色逐渐被空气氧化而褪色,直至溶液呈蓝紫色时,用60%的乙醇定容至20毫升,摇匀,用光径为1厘米的比色杯,在波长570nm下测定其消光值,制作标准曲线。
3、样品测定:取2支试管,分别加入2亳升过滤液,加入0.1%抗坏血酸0.1毫升,水合茚三酮3ml,混匀加盖,置沸水浴加热15min,取出后用冷水迅速冷却,用60%乙醇定容至20ml。
植物体内游离脯氨酸含量的测定

实验20 植物体内游离脯氨酸含量的测定一、原理当植物缺水时体内的脯氨酸含量增加。
植株体内脯氨酸含量在—定程度上反映了植株体内的水分情况,因而可以作为植物缺水情况的参考性生理指标。
用人造沸石在 pH 1~7 范围内振荡溶液,可除去干扰的氨基酸或使不与茚三酮反应(如甘氨酸、谷氨酸、天冬氨酸、丙氨酸、缬氨酸、胱氨酸、苯丙氨酸、精氨酸等),脯氨酸与茚三酮试剂呈显色反应,其含量与颜色深浅成正相关,可用分光光度计测定。
此法有专一性。
二、实验材料、试剂与仪器设备(一)实验材料植物叶片。
(二)试剂• 80% 乙醇。
•人造沸石。
•活性炭。
4 .茚三酮试剂:将 2.50 g 茚三酮于 60 mL 冰醋酸和 40 mL 6 mol/L 磷酸中,加热( 70 ℃)溶解。
试剂至少在 24 小时内稳定。
5 .脯氨酸标准液:准确称取 25 mg 脯氨酸溶于少量 80 % 乙醇中,再用蒸馏水定容至 250 mL ,其浓度为 100 μg/mL 。
再取此液 10 mL ,用蒸馏水稀释至 100 mL ,即成 10 μg/mL 的脯氨酸标准液。
(三)仪器设备分光光度计,水浴锅,移液管,容量瓶,冰醋酸,仪器药品,离心机,烧杯,研钵,试管,恒温水浴三、实验步骤1 .绘制标准曲线吸取脯氨酸标准母液 0 、 0.2 、 0.4 、 0.8 、 1.2 、 1.6 、 2.0 mL 分别放入 7 支具塞刻度试管,分别加入蒸馏水至 2.0 mL, 其脯氨酸含量分别为 0 、 2.0 、4.0 、 8.0 、 12.0 、 16.0 、 20.0 μg 。
分别吸取上述标准溶液 2 mL ,加冰醋酸 2 mL, 茚三酮试剂 2 mL 加入试管中,混匀后加玻璃球塞,在沸水浴中加热 15 min 。
用分光光度计于波长 515 nm 下进行比色测定,以零浓度为空白对照。
将测定结果以脯氨酸浓度为横坐标,以吸光度为纵坐标作标准曲线。
2. 植株样品液的提取选取植株功能叶片 2 g ,用 3 mL 80 % 乙醇研磨(放少许石英砂)成浆状。
植物体内游离脯氨酸含量测定

植物体内游离脯氨酸含量的测定一、目的在逆境条件下(旱、热、冷、冻),植物体内脯氨酸的含量显著增加,植物体内脯氨酸含量在一定程度上反映了植物的抗逆性,抗旱性强的品种积累的脯氨酸多。
因此测定脯氨酸含量可以作为抗旱育种的生理指标。
另外,由于脯氨酸亲水性极强,能稳定原生质胶体及组织内的代谢过程,因而能降低冰点,有防止细胞脱水的作用。
在低温条件下,植物组织中脯氨酸增加,可提高植物的抗寒性,因此,亦可作为抗寒育种的生理指标。
二、原理磺基水杨酸对脯氨酸有特定反应,当用磺基水杨酸提取植物样品时,脯氨酸便游离于磺基水杨酸溶液中。
然后用酸性茚三酮加热处理后,茚三酮与脯氨酸反应,生成稳定的红色化合物,再用甲苯处理,则色素全部转移至甲苯中,色素的深浅即表示脯氨酸含量的高低。
在520nm波长下测定吸光度,即可从标准曲线上查出脯氨酸的含量。
三、材料、仪器及试剂1. 材料:植物叶片。
2. 仪器:分光光度计;电子分析天平;离心机;小烧杯;普通试管;移液管;注射器;恒温水浴锅;漏斗;漏斗架;滤纸;剪刀;洗耳球。
3 .试剂及配制:2.5﹪酸性茚三酮溶液配制:将1.25g茚三酮溶于30ml冰醋酸和20ml 6 mol·L-1磷酸中,搅拌加热(70℃)溶解,贮于冰箱中。
3%磺基水杨酸配配制:3g磺基水杨酸加蒸馏水溶解后定容至100ml。
10μg·ml-1脯氨酸标准母液配制:精确称取20mg脯氨酸,倒入小烧杯内,用少量蒸馏水溶解,再倒入200ml容量瓶中,加蒸馏水定容至刻度(为100μg·m l-1脯氨酸母液),再吸取该溶液10ml, 加蒸馏水稀释定容至100ml, 即为10μg·ml-1脯氨酸标准液。
冰醋酸;甲苯。
四、实验步骤1.脯氨酸标准曲线的制作1.1取6支试管,编号,按下表配制每管含量为0~12μg的脯氨酸标准液。
加入表中试剂后,置于沸水浴中加热30min。
取出冷却,各试管再加入4ml甲苯,振荡30秒钟,静置片刻,使色素全部转至甲苯溶液。
植物组织中游离脯氨酸含量的测定

*******************实践教学*******************兰州理工大学计算机与通信学院2014年秋季学期面向对象课程设计题目:ATM柜员机专业班级:姓名:学号:指导教师:成绩:问题描述:此次课题的任务旨在设计一个ATM模拟程序。
余额查询在设计中,我们对它尽可能的与真实的ATM模拟的相近一些,我们把它抽象出一些小模块:用户帐号信息,登录密码验证,用户余额查询,用户存取款(交易过程),用户密码的更改,用户退出程序,对于一个在线用户,如果密码输入次数达三次后,ATM 锁机,直到用户退卡为止,此外,ATM向用户显示欢迎词及其他提示性信息,这样,方便了用户对ATM的使用。
背景:自2000年以来,中国的ATM机总保有量便以24.62%的年均复合增长率高速增长。
截至2010年底,中国联网ATM机保有量已经达到27.10万台,同比增长26.11%。
我国已经取代日本成为全球第二大ATM市场,排在美国之后。
现今的社会发展迅速,人们的物质生活得到极大的提高,手中的剩余资金日益增多,受传统影响,绝大多数人喜欢把资金存起来,而在需要现金的时候又可以很方便的取到现金,就这样,ATM成为了人们在银行方面不可缺少的使用工具,使用ATM的人越来越多,所以ATM的数量以及技术指标也在迅速的增长着,模拟此程序其极大的方便了人们的日常生活,同时又在使用的过程中也会遇到这样那样的问题,如果有一款软件模拟ATM,可以帮助人们了解其运行过程,避免有些不必要的麻烦,方便了人们的生活。
实现方式:要求ATM柜员机模拟程序利用面向对象的方法以及C++的编程思想来完成系统的设计。
C++相对众多的面向对象的语言,具有相当高的性能。
C++引入了面向对象的概念,使得开发人机交互类型的应用程序更为简单、快捷。
在设计的过程中,建立清晰的类层次,各个类中要有各自的属性和方法,运用面向对象的机制(继承、派生及多态性)来实现系统功能,基于Microsoft visual C++6.0条件下实现的.。
绿茶中游离氨基酸的测定

绿茶中游离氨基酸的测定
绿茶作为一种传统流行的饮料,在人们日常生活中极具普及性,它也是一种有益的饮品,因为它含有大量的氨基酸。
随着科技的发展,对绿茶中游离氨基酸的测定越来越受到关注,它不仅能够为我们提供更多有关绿茶的资讯,而且有助于提高绿茶的品质,提高饮料的饮用安全性。
在测定绿茶中游离氨基酸时,使用的主要技术是HPLC和GC。
HPLC 是一种高效液相色谱技术,可以用来快速测定绿茶中游离氨基酸的含量,且结果准确可靠,但相较于其他分析方法,耗时较长,且设备成本较高。
GC(气相色谱)分析技术也常用于测定游离氨基酸的含量,它的优点就是快速、灵敏度高、分辨力强,但是GC分析技术不适用于大分子物质,在测定中使用燃料便利,污染严重,不利于环境保护。
在测定游离氨基酸时,还可以使用酶联免疫电泳法,这种方法具有灵敏度高、反应简单、操作实用的优点,可以有效测定绿茶中的游离氨基酸,但是需要大量的试剂,且反应效率较低。
此外,近年来,许多研究者也开始尝试使用质谱技术来测定绿茶中的游离氨基酸,质谱技术可以快速、准确地分析游离氨基酸,而且不受物质大小的限制,而且检测速度快,重复性较好,可以作为测定绿茶中游离氨基酸的新手段。
总之,对绿茶中游离氨基酸的测定,有HPLC、GC和酶联免疫电泳法、质谱技术等多种方法可供选择,具体的选择要根据实际的要求而定。
例如,如果要高精度测定氨基酸,则可以选择HPLC技术;如
果要追求快速、灵敏度高,可以选择质谱技术。
测定完毕后,可以通过对结果的分析,有助于我们提高对绿茶品质的认知,为我们提供更高质量、更安全饮料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物中游离氨基酸的测定
植物中游离氨基酸的测定是检测植物中氨基酸含量的重要方法。
它对于评估植物营养价值,鉴定新品种以及研究植物体内生理功能具有十分重要的意义。
一般而言,植物中游离氨基酸测定分为三个步骤:样品前处理、含氮量测定和氨基酸分析。
样品前处理需要将植物样本进行固相萃取或者电解质萃取,以去除杂质;含氮量测定采用Kjeldahl法或者Dumas法;而氨基酸分析则包括HPLC-UV/MS、GC-MS、IR、MS/MS 等不同方法。
其中HPLC-UV/MS方法是常用的方法之一。
在使用HPLC-UV/MS 方法时,样品先通过回归装置进行净化、分离及回收,然后在HPLC端盘上使用循环优化的方式进行分析;最后通过UV/MS 技术对所得的产物
进行定量测定。
以上就是关于植物中游离氨基酸的测定的详情介绍,从上文可以看出对于正确地进行检测都必不可少地依赖于专业人士对样本处理、测试方法选取以及数字应用方式的正确使用。
只有采取正确的方法才能确保最终的测定结果的准确性,以便更好地利用植物的营养价值,获得更好的生产和使用效果。
