2019高考化学一轮复习强酸(碱)与弱酸(碱)的比较学案(含解析)
2023年高考化学总复习第一部分考点指导第五章 高考热点微专题 一元强酸(碱)和一元弱酸(碱)的比较

高考热点微专题一元强酸(碱)和一元弱酸(碱)的比较1.相同物质的量浓度、相同体积的一元强酸与一元弱酸的比较类别一元强酸一元弱酸c(H+) 大小中和碱的能力相同相同与足量Zn反应产生H2的体积相同相同开始与金属反应的速率大小2.相同pH、相同体积的一元强酸和一元弱酸的比较类别一元强酸一元弱酸物质的量浓度小大中和碱的能力弱强与足量Zn反应产生H2的体积少多开始与金属反应的速率相同相同3.一元强酸与一元弱酸的图示比较(1)相同体积、相同浓度的盐酸、醋酸加水稀释到相同的倍数,醋酸的pH大;加水稀释到相同的pH,盐酸加入的水多加入足量锌粉,盐酸和醋酸产生氢气的体积相同;但盐酸产生氢气的速率比醋酸快(2)相同体积、相同pH的盐酸、醋酸加水稀释到相同的倍数,盐酸的pH大;加水稀释到相同的pH,醋酸加入的水多加入足量锌粉,醋酸产生氢气的体积比盐酸大;且醋酸产生氢气速率比盐酸快【典例】(2018·浙江4月学考真题)相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是( )A.pH相等的两溶液中:c(CH3COO-)=c(Cl-)B.分别中和pH相等、体积相等的两溶液,所需NaOH的物质的量相同C.相同浓度的两溶液,分别与金属镁反应,反应速率相同D.相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中(忽略溶液体积变化):c(CH3COO -)=c(Cl-)【解析】选A。
电荷守恒,c(H+) =c(CH3COO-)+c(OH-),c(H+)=c(Cl-)+c(OH-),pH相等,所以溶液中的c(H+)、c(OH-)都相等,所以c(CH3COO-)=c(Cl-),A正确;pH相等的两溶液,酸性越弱,浓度越大,相同体积所含的物质的量就越多,所以中和醋酸时需要更多的NaOH,B错误;溶液中的c(H+)越大,与镁反应速率越快,同浓度的两溶液,盐酸完全电离,醋酸部分电离,所以盐酸反应速率更快,C错误;相同浓度的两溶液,分别与NaOH固体反应后呈中性的溶液中,c(CH3COO-)=c(Na+),c(Cl-)=c(Na+),但盐酸需要消耗更多的NaOH,盐酸中和后的溶液中c(Na+)更大,故c(CH3COO-)<c(Cl-),D错误。
2024届高考化学大一轮复习教师用书:第8章第1节考点3强酸(碱)与弱酸(碱)的比较

2024届高考化学大一轮复习老师用书:第8章第1节考点3强酸(碱)与弱酸(碱)的比较点考点 3 强酸( 碱) 与弱酸( 碱) 的比较 1..一元强酸与一元弱酸的比较相同体积,相同酸浓度的强酸 HA 酸与弱酸HB 同相同体积,相同 pH 酸的强酸 HA 与酸弱酸 HB pH 或物质的量浓度 pH HA lt;pH HB c(HA)lt;c(HB) 与金属反应的起始速率HAgt;HB HA =HB 与过量的碱反应时消耗碱的量 HA =HB HAlt;HB 与过量活泼金属生反应产生 H 2 的量 HA =HB HAlt;HB c(A- ) 与 c(B- ) 大小 c(A- )gt;c(B - ) c(A- ) =c(B- ) 分别加入固体 NaA 、NaB 后 pH 改变 HA :不变 HB :变大 HA :不变 HB :变大加水稀释 10 倍后 pH HA lt;pH HB pH HA gt;pH HB 溶液的导电性 HAgt;HB HA =HB 水的电离程度 HAlt;HB HA =HB 说明一元强碱与一元弱碱的比较规律与以上类似 2..液稀释时溶液 pH 改变特点比较如图:a 、b 分别为 pH 相等的 NaOH 溶液和氨水稀释曲线。
c、、d 分别为 pH 相等的盐酸和醋酸溶液稀释曲线。
请体会图中的两层含义:(1) 加水稀释相同倍数后的 pH 大小:1/ 3氨水gt;NaOH 溶液,盐酸gt;释醋酸溶液。
若稀释 10 n 倍,盐酸、NaOH 溶液 pH 改变 n 个单位,但pHlt;7 或或 pHgt;7 ,不能 pH =7 ,而氨水与醋酸溶液 pH 改变不到 n 个单位。
个单位。
(2) 稀释后的 pH 仍旧相等,则加水量的大小:氨水gt;NaOH 溶液,醋酸溶液gt; 盐酸。
易错警示 (1)酸碱的强弱和溶液酸碱性的强弱不是等同关系,前者看电离程度,后者看溶液中酸碱的强弱和溶液酸碱性的强弱不是等同关系,前者看电离程度,后者看溶液中 c(H+ )和和 c(OH - )的相对大小。
2019高考化学一轮复习盐类水解及其规律学案(含解析).docx
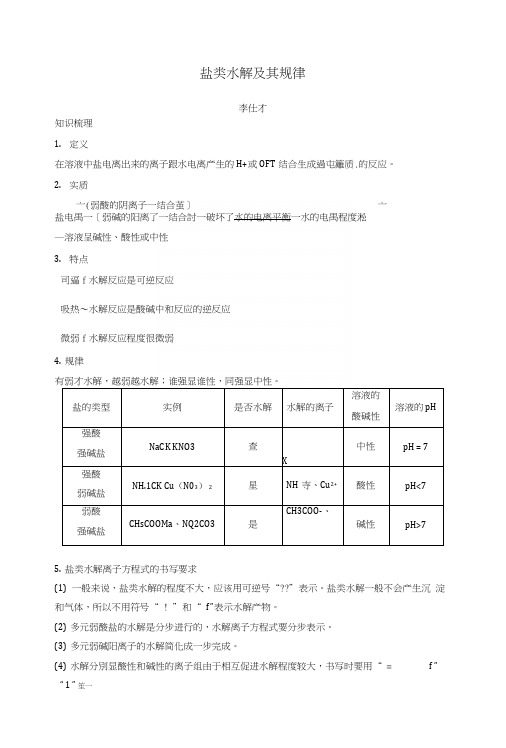
盐类水解及其规律李仕才知识梳理1.定义在溶液中盐电离出来的离子跟水电离产生的H+或OFT结合生成過屯籬质.的反应。
2.实质亠(弱酸的阴离子一结合茧]亠盐电禺一〔弱碱的阳离了一结合討一破坏了水的电离平衡一水的电禺程度淞―溶液呈碱性、酸性或中性3.特点司逼f水解反应是可逆反应吸热〜水解反应是酸碱中和反应的逆反应微弱f水解反应程度很微弱4.规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCK KNO3查X中性pH = 7强酸弱碱盐NH.1CK Cu(N03)2星NH寺、Cu2+酸性pH<7弱酸强碱盐CHsCOOMa、NQ2CO3是CH3COO-、碱性pH>75.盐类水解离子方程式的书写要求(1)一般来说,盐类水解的程度不大,应该用可逆号“??”表示。
盐类水解一般不会产生沉淀和气体,所以不用符号“ ! ”和“ f ”表示水解产物。
(2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
(3)多元弱碱阳离子的水解简化成一步完成。
(4)水解分別显酸性和碱性的离子组由于相互促进水解程度较大,书写时要用“ = f ”“ 1 ” 笙一「正误判I断・辨析易错易混J(1)溶液呈中性的盐一定是强酸、强碱生成的盐(X)(2)酸式盐溶液可能呈酸性,也可能呈碱性(J)(3)某盐溶液呈酸性,该盐一定发生了水解反应(X)(4)常温下,pH=10的CHsCOONa溶液与pH=4的WC1溶液,水的电离程度相同3)(5)常温下,pH=ll的CDCOONa溶液与pH=3的CH3COOH溶液,水的电离程度相同(X)(6)WHCO3、NaHSOi都能促进水的电离(X)(7)向NaA102溶液中滴加NaHCO3溶液,有沉淀和气体生成(X)(8)S2_+2H 2O^^?H2S + 2Oir( X)(9)FJ+ + 3HQ?k^?Fe(0H)31 +3H+(X)(10)明矶溶液显酸性:A13++3H2O^^A1 (OH)3+3H+( V)r规范描述・培养答题能力」1.怎样用最简单的方法区别NaCl溶液、氯化钱溶液和碳酸钠溶液?答案三种溶液各取少许分别滴入紫色石蕊溶液,不变色的为NaCl溶液,变红色的为氯化鞍溶液,变蓝色的为碳酸钠溶液。
学案1:3.1.2 电离平衡平衡常数 强酸与弱酸比较

第三章水溶液中的离子反应与平衡第一节电离平衡第2课时电离平衡常数强酸与弱酸比较学习目标1.了解电离平衡常数的含义。
2.能利用电离平衡常数进行分析和计算。
知识梳理活动·探究1.实验目的比较CH3COOH与H2CO3的酸性强弱及电离常数的大小。
2.实验操作如图所示,向盛有2 mL 1 mol·L-1醋酸的试管中滴加1 mol·L-1Na2CO3溶液。
3.实验现象:有气泡产生。
[思考交流]1.写出实验中所涉及化学反应的离子方程式。
2.盛放醋酸溶液的试管中有大量气泡产生,试比较CH3COOH和碳酸酸性的相对强弱及其电离常数的大小关系。
3.向饱和H3BO3溶液中滴加Na2CO3溶液无明显现象,试比较H3BO3和H2CO3酸性的相对强弱,及其电离常数的大小关系。
4.通过上述实验,你得出的实验结论是什么?归纳·总结1.电离常数的概念在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。
对于一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K 表示(弱酸用K a 表示,弱碱用K b 表示)。
2.表达式(1)一元弱酸、一元弱碱的电离常数 例如:CH 3COOH CH 3COO -+H +,K a =c (CH 3COO -)·c (H +)c (CH 3COOH );NH 3·H 2ONH +4+OH -,K b =c (NH +4 )·c (OH -)c (NH 3·H 2O )。
(2)多元弱酸、多元弱碱的电离常数①多元弱酸或多元弱碱的每一步电离都有电离常数,这些电离常数各不相同,通常用K a1、K a2或K b1、K b2等加以区别。
例如25 ℃时,H 2CO 3的电离分两步: H 2CO 3H ++HCO -3,K a1=c (H +)·c (HCO -3 )c (H 2CO 3)=4.5×10-7,HCO -3H ++CO 2-3,K a2=c (H +)·c (CO 2-3 )c (HCO -3 )=4.7×10-11。
高考过关知识点10一元强酸(碱)和一元弱酸(碱)的比较

2019届高考过关知识点10一元强酸(碱)和一元弱酸(碱)的比较命题点1一元强酸(碱)和一元弱酸(碱)的一般性质比较(1)相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较(2)相同pH、相同体积的一元强酸与一元弱酸的比较说明:一元强碱与一元弱碱的比较规律与以上类似。
[对点训练1]相同温度下,关于物质的量浓度、体积均相等的①NaOH溶液,②氨水,说法正确的是()A.[OH-]:①>②B.pH:①=②C.导电性:①<②D.中和酸的能力:①>②A[pH:①>②,导电性:①>②,中和酸的能力:①=②。
][对点训练2]25 ℃下,在①pH=2的CH3COOH溶液、②pH=2的HCl 溶液、③pH=12的氨水、④pH=12的NaOH溶液中,下列说法正确的是________(填字母)。
A.等体积的①、②分别与足量铝粉反应,生成H2的量:②>①B.将等体积①②加水稀释至pH=4,加水较多的是②C.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③D.将四种溶液分别稀释100倍后,溶液的pH:③>④>②>①E.将等体积的③、④加H2O稀释100倍,pH较大的为③F.将等体积的③④加等浓度盐酸中和,所需盐酸的体积相同[答案]CDE[对点训练3]相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是()C[相同体积、相同pH的某一元强酸和一元弱酸中,H+浓度相等,所以刚开始与锌反应的速率是相同的,随着反应的进行,弱酸继续电离,故反应速率较强酸快,排除B、D;又因弱酸的物质的量浓度大于强酸,所以与足量的锌反应生成氢气的量较多,排除A项。
]一元弱酸和一元强酸与金属的反应图中,a、b为pH相等的NaOH溶液和氨水,c、d为pH相等的盐酸和醋酸。
对于该图像,要深刻理解以下4点:(1)对于pH=y的强酸溶液稀释时,体积每增大10n倍,pH就增大n个单位,即pH=y+n;对于pH=y的弱酸溶液来说,体积每增大10n倍,pH增大不足n 个单位,即pH<y+n;无论怎样稀释,酸溶液的pH不能等于或大于7,只能趋近于7。
深圳优质课件 人教版高三化学强酸与弱酸的比较

水的电离程度
HA:不变 HB:变大
3=pHHA<pHHB HA>HB
HA<HB
HA:不变 HB:变大
3=pHHA>pHHB>2 HA=HB
HA=HB
改变下列条件,请在横线上写出下列曲线代表哪种酸的变化曲 线。 (1)相同体积、相同浓度的盐酸和醋酸 ①加入足量的Zn,V(H2)与时间的变化曲线
H+ +
CH3COO-
初始微粒数 1000
0
0
电离后微粒数 987
13
13
浓度1
0.1 mol·L-1
0.1 mol·L-1 × 1.3% 0.1 mol·L-1 × 1.3%
浓度2 0.01 mol·L-1 ÷ α
0.01 mol·L-1
0.01 mol·L-1
2.同浓度、同 pH 强酸与弱酸的比较
体积相同时与过量的 碱反应时消耗碱的量
HA=HB
HA<HB
体积相同时与过量活 泼金属反应产生H2的量
c(A-)与c(B-)大小
HA=HB
c(A-)>c(B-)
HA<HB c(A-)=c(B-)
浓度均为0.01 mol·L-1 pH均为2的强酸HA与
的强酸HA与弱酸HB
弱酸HB
分别加入固体NaA、NaB后 pH变化
1000
浓度1 0.1 mol·L-1
0.1 mol·L-1
浓度2 0.01 mol·L-1 0.01 mol·L-1
Cl-
0 1000 0.1 mol·L-1 0.01 mol·L-1
25℃时,0.1 mol·L-1CH3COOH溶液中, Ka=1.7×10-5 α ≈ 1.3%
2020年高考化学一轮总复习模块1 第六单元 小专题七 强酸(碱)与弱酸(碱)的比较
答案:(1)a>1 因醋酸是弱酸,不能完全电离 (2)盐酸的 pH=5,醋酸的 pH<5 (3)正确 由于醋酸是弱酸,随着反应的进行,醋酸不断电 离,c(H+)变化小,醋酸产生H2的速率比盐酸快 (4)将 CH3COONa 晶体、NaCl 晶体分别溶于适量水配成溶 液,再分别滴入酚酞溶液,CH3COONa 溶液变为浅红色,NaCl 溶液不变色
A.X 为弱酸,VX<VY B.X 为强酸,VX>VY C.Y 为弱酸,VX<VY D.Y 为强酸,VX>VY 解析:分析图象可知,X、Y 两种酸的溶液稀释 10 倍,X 的 pH 增大 1,则 X 为强酸,Y 的 pH 增大的范围小于 1,则 Y 为弱酸,c(Y)>c(X),体积相同的 pH=2 的 X、Y 两种酸的溶液 被 NaOH 溶液滴定至 pH=7,则 Y 消耗的 NaOH 溶液多。 答案:C
考向2 强、弱电解质的图象分析
[典例 2](2017 年新课标Ⅱ卷)改变 0.1 mol·L-1 二元弱酸 H2A 溶液的 pH,溶液中的 H2A、HA-、A2-的物质的量分数 δ(X)随 pH 的变化如图所示[已知 δ(X)=cH2A+ccHXA-+cA2-]。下 列叙述错.误.的是( )。
(3)丙分别取 pH=3 的盐酸和醋酸各 10 mL,然后加入质量 相同的锌粒,醋酸放出 H2 的速率快,则认定醋酸是弱电解质, 你认为这一方法正确吗?___________________,请说明理由: ________________________________。
(4)丁用 CH3COONa 晶体、NaCl 晶体、蒸馏水和酚酞做实 验,也论证了醋酸是弱酸的事实,该同学的实验操作和现象是 ____________________________________________________。
高考化学一轮复习 考点备考 核心素养提升 强酸(碱)与弱酸(碱)的实验确定和性质比较课件
二、反思归纳
强酸弱酸比较 以一元强酸(HCl)与一元弱酸(CH3COOH)的比较为例。 (1)相同物质的量浓度、相同体积的盐酸与醋酸溶液的比较
与活泼
比较
中和
开始与金
金属反
项目 c(H+) pH 碱的
属反应的
应产生
酸
能力
速率
H2的量
盐酸
大小
大
相同 相同
醋酸溶液 小 大
小
(2)相同pH、相同体积的盐酸与醋酸溶液的比较
弱
D.0.1 mol·L-1 NH3·H2O能使无色酚酞试液变红色
只能说明氨水显碱性,无法证明是强碱还是弱碱
转解析
3.(2015·海南高考)下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和 一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( B )
酸性:乙>甲 浓度越大,电离度越小
转解析
(2018·厦门模拟)25 ℃时,相同pH的两种一元弱酸HA与HB溶液分
别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正
确的是( D )
HA的酸性强于HB
A.同浓度的NaA与NaB溶液中,c(A-)小于c(B-) B.a点溶液的导电性大于b点溶液 C.a点的c(HA)大于b点的c(HB) D.HA的酸性强于HB
比较
中和项目 c(H+Fra bibliotek c(酸) 碱的
酸
能力
与足量活泼 金属反应产 生H2的量
开始与 金属反 应的速
率
盐酸
小小
少
醋酸溶 相同
相同
大大
多
液
三、试题备选
在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则 如图所示符合客观事实的是( C )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
强酸(碱)与弱酸(碱)的比较 李仕才 考点梳理 1.一元强酸(HA)与一元弱酸(HB)的比较 浓度均为0.01 mol·L-1 pH均为2
pH或物质 的量浓度 2=pHHAc(HA)(HB)
开始与金属 反应的速率 HA>HB HA=HB
体积相同时与 过量的碱反应 消耗碱的量 HA=HB HA
体积相同时与过 量活泼金属反应 产生H2的量 HA=HB HA
c(A-)与 c(B-)大小 c(A-)>c(B-) c(A-)=c(B-)
分别加入固体NaA、 NaB后pH变化 HA:不变 HB:变大 HA:不变 HB:变大 加水稀释10倍后 3=pHHApHHB>2 溶液的导电性 HA>HB HA=HB 水的电离程度 HA2.判断弱酸的三种方法 方法一:根据弱酸的定义判断,弱酸在水溶液中不能完全电离,如测0.1 mol·L-1的CH3COOH溶液的pH>1。 方法二:根据弱酸在水溶液中存在电离平衡判断,条件改变,平衡发生移动,如pH=1的CH3COOH加水稀释10倍后,1方法三:根据弱酸的正盐能发生水解判断,如判断CH3COOH为弱酸可做以下实验: (1)向一定浓度的醋酸钠溶液中,加入几滴酚酞溶液,溶液变为浅红色。 (2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH>7。 3、强弱电解质的图像分析 盐酸、醋酸图像题的分析方法 (1)相同体积、相同浓度的盐酸、醋酸 ①加水稀释相同的倍数,醋酸的pH大。 ②加水稀释到相同的pH,盐酸加入的水多。
(2)相同体积、相同pH的盐酸、醋酸 ①加水稀释相同的倍数,盐酸的pH大。 ②加水稀释到相同的pH,醋酸加入的水多。 (3)不论怎样稀释,酸溶液的pH不能等于或大于7,碱溶液的pH不能等于或小于7,都只能趋近于7。
考向分析: 考向一、强酸和弱酸(碱)的判断 典例1、下列事实一定能说明HNO2为弱电解质的是( ) ①常温下,NaNO2溶液的pH>7 ②用HNO2溶液做导电实验灯泡很暗 ③HNO2不能与NaCl反应 ④常温下0.1 mol·L-1的HNO2溶液pH=2 ⑤1 L pH=1的HNO2溶液加水稀释至100 L后溶液的pH=2.2 ⑥1 L pH=1的HNO2和1 L pH=1的盐酸与足量的NaOH溶液完全反应,最终HNO2消耗的NaOH溶液多 ⑦HNO2溶液中加入一定量NaNO2晶体,溶液中[OH-]增大 ⑧HNO2溶液中加水稀释,溶液中[OH-]增大 A.①②③⑦ B.①③④⑤ C.①④⑤⑥⑦ D.②④⑥⑧ 解析:②如果盐酸(强酸)的浓度很小灯泡也很暗;④如果是强酸,pH=1;⑤如果是强酸,加水稀释至100 L后溶液的pH=3,实际pH=2.2,这说明HNO2溶液中存在HNO2H++NO-2,加水平衡右移,使pH<3;⑥依据HNO2+NaOH===NaNO2+H2O、HCl+NaOH===NaCl+H2O可知,[HNO2]大于[HCl],而溶液中[H+]相同,所以HNO2没有全部电离;⑦加入NaNO2,溶液中[OH-]增大,说明化学平衡移动;⑧不论是强酸;还是弱酸,加水稀释,溶液中[H+]均减小,而[OH-]增大。 答案:C 方法指导::弱电解质形成的盐类能水解,如判断CH3COOH为弱酸可根据下面两个现象: (1)配制某浓度的醋酸钠溶液,向其中加入几滴酚酞试液。现象:溶液变为浅红色。 (2)用玻璃棒蘸取一定浓度的醋酸钠溶液滴在pH试纸上,测其pH。现象:pH>7。 考向二、弱酸(碱)或弱碱(酸)的比较及应用 现有浓度均为0.1 mol·L-1的盐酸、硫酸、醋酸三种溶液,回答下列问题: (1)若三种溶液中[H+]分别为a1 mol·L-1、a2 mol·L-1、a3 mol·L-1,则它们的大小关系为 。 (2)等体积的以上三种酸分别与过量的NaOH溶液反应,若生成盐的物质的量依次为b1 mol、b2 mol、b3 mol,则它们的大小关系为 。
(3)分别用以上三种酸中和等物质的量的NaOH溶液生成正盐,则需要体积最少的酸为 (填化学式)。 (4)分别与Zn反应,开始时生成H2的速率为v1、v2、v3,其大小关系为 。 解析:(1)硫酸和盐酸是强酸,醋酸是弱酸,则[H+]1=[HCl]=0.1 mol·L-1,[H+]2=2[H2SO4]=0.2 mol·L-1,[H+]3<[CH3COOH]=0.1 mol·L-1,所以它们的大小关系是a2>a1>a3。 (2)等体积、等浓度的盐酸、硫酸和醋酸,它们的物质的量相等,分别与过量的NaOH溶液反应,生成盐的物质的量相等,则它们的大小关系为b1=b2=b3。 (3)三种酸的浓度相等,盐酸和醋酸都是一元酸,硫酸是二元酸,硫酸中氢离子浓度是盐酸中的2倍,则完全中和物质的量均相同的三份NaOH溶液时,需要盐酸和醋酸的体积相等,需要硫酸的体积是盐酸的一半,所以需要体积最少的酸为硫酸。 (4)三种溶液中[H+]的大小关系为a2>a1>a3,分别与Zn反应,开始时生成H2的速率为v2>v1>v3。 答案:(1)a2>a1>a3 (2)b1=b2=b3 (3)H2SO4 (4)v2>v1>v3 技法指导:强酸弱酸比较 以一元强酸(HCl)与一元弱酸(CH3COOH)的比较为例。 (1)相同物质的量浓度、相同体积的盐酸与醋酸溶液的比较 比较项目
酸 [H+] pH 中和碱的能力
与活泼金属反应产生H2的量 开始与金属反
应的速率
盐酸 大 小 相同 相同 大 醋酸溶液 小 大 小 (2)相同pH、相同体积的盐酸与醋酸溶液的比较 比较项目
酸 [H+] 酸的浓度 中和碱的能力 与足量活泼金属反应产生H2的量
开始与金属
反应的速率
盐酸 相同 小 小 少 相同 醋酸溶液 大 大 多
对点演练 1.能证明乙酸是弱酸的实验事实是( ) A.CH3COOH溶液与Zn反应放出H2 B.0.1 mol·L-1 CH3COONa溶液的pH大于7 C.CH3COOH溶液与Na2CO3反应生成CO2 D.0.1 mol·L-1 CH3COOH溶液可使紫色石蕊变红 解析:选B A项,只能证明乙酸具有酸性,不能证明其酸性强弱,错误;B项,该盐水溶液显碱性,可以证明乙酸是弱酸,正确;C项,可以证明乙酸的酸性比碳酸强,但不能证明其为弱酸,错误;D项,可以证明乙酸具有酸性,但不能证明其酸性强弱,错误。 2、下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( ) 解析:选B A这两种物质都是弱电解质,在温度不变、浓度相等时,电离程度CH3COOH选项是B。 3. 浓度均为0.10 mol·L-1、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,
pH随lgVV0的变化如图所示。下列叙述错误的是( )
A.MOH的碱性强于ROH的碱性 B.ROH的电离程度:b点大于a点 C.若两溶液无限稀释,则它们的c(OH-)相等
D.当lgVV0=2时,若两溶液同时升高温度,则cM+cR+增大 解析:选D 由图像知,浓度为0.10 mol·L-1的MOH溶液,在稀释前pH为13,说明MOH完全电离,MOH为强碱,而ROH的pH<13,说明ROH没有完全电离,ROH为弱碱。A项,
MOH的碱性强于ROH的碱性,正确;B项,曲线的横坐标lgVV0越大,表示加水稀释体积越大,由曲线可以看出b点的稀释程度大于a点,弱碱ROH存在电离平衡:ROHR++OH-,溶液浓度越小,弱电解质电离程度越大,故ROH的电离程度:b点大于a点,正确;C项,
若两溶液无限稀释,则溶液的pH接近于7,故两溶液的c(OH-)相等,正确;D项,当lgVV0=2时,溶液V=100V0,溶液稀释100倍,由于MOH发生完全电离,升高温度,c(M+)不变;ROH存在电离平衡:ROHR++OH-,升高温度,促进电离平衡正向移动,c(R+)增大,cM+cR+减小,错误。
4、在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则如图所示符合客观事实的是( )
解析:选C 因盐酸为强酸、醋酸为弱酸,故pH都等于2的盐酸和醋酸溶液中,c(HCl)=0.01 mol·L-1,而c(CH3COOH)>0.01 mol·L-1,1 L溶液中n(HCl)=0.01 mol,n(CH3COOH)>0.01 mol。A项,相同时间内pH变化较大的应为HCl,错误;B项,产生H2的
速率大的应为CH3COOH,错误;D项,相同时间内c(H+)变化较大的为HCl,错误。 5、25 ℃时,相同pH的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
A.同浓度的NaA与NaB溶液中,c(A-)小于c(B-) B.a点溶液的导电性大于b点溶液 C.a点的c(HA)大于b点的c(HB) D.HA的酸性强于HB 解析:选D 由于稀释过程中HA的pH变化较大,故HA的酸性强于HB,D项正确;酸的
