九年级化学第五单元第一节质量守恒定律练习和答案
【推荐】新人教版九年级化学上册例题精讲:第5单元 课题1质量守恒定律
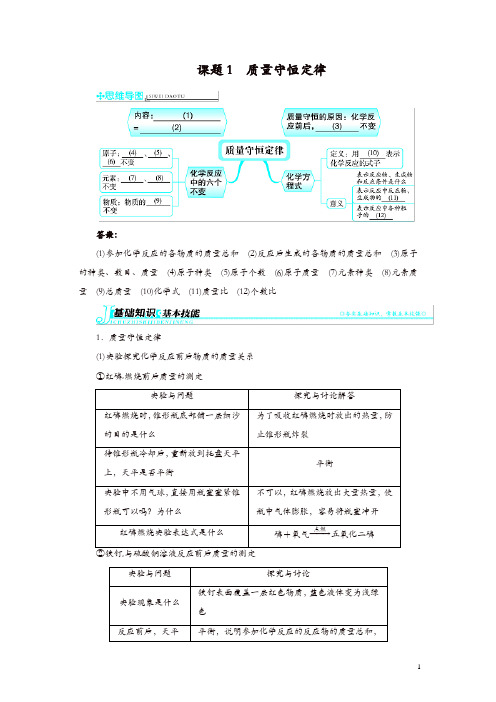
课题1 质量守恒定律答案:(1)参加化学反应的各物质的质量总和(2)反应后生成的各物质的质量总和(3)原子的种类、数目、质量(4)原子种类(5)原子个数(6)原子质量(7)元素种类(8)元素质量(9)总质量(10)化学式(11)质量比(12)个数比1.质量守恒定律(1)实验探究化学反应前后物质的质量关系①红磷燃烧前后质量的测定与硫酸铜溶液反应前后质量的测定质的质量总和(2)①内容参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,这个规律叫做质量守恒定律。
②探究反应前后质量是否守恒应注意的问题是否有外界物质进入。
辨误区验证质量守恒定律应注意什么凡有气体参加或生成的反应,在设计实验验证反应前后遵循质量守恒时,应该在密闭容器中进行。
【例1—1】下列叙述正确的是( )A.因为质量守恒,所以煤燃烧后产生煤渣的质量一定与所用煤的质量相等B.镁带在空气中燃烧后,生成物的质量比镁带的质量增加了C.100 g酒精和100 g水混合在一起,质量等于200 g,符合质量守恒定律D.氢气和氧气形成的混合物的质量等于其反应后生成水的质量解析:(3)质量守恒的微观解释 ①化学反应的实质化学反应过程是参加反应的各物质(反应物)的原子,重新组合成其他物质(生成物)的过程。
由分子构成的物质在化学反应中的变化过程可表示为:分子――→分裂原子――→重新组合分子――→聚集成新物质 ②质量守恒的原因在化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子本身的质量也没有改变。
所以,反应前后的质量总和必然相等。
【例1—2】化学反应前后可能发生变化的是( ) A .物质的总质量 B .元素种类 C .原子数目 D .分子数目解析:化学反应实质是原子的重新组合,反应前后原子数目不变,元素种类不变,物质的总质量不变;反应后分子种类一定改变,分子数目可能改变,也可能不变。
答案:D 2.化学方程式 (1)概念用化学式表示化学反应的式子,叫化学方程式。
九年级化学暑假预习《质量守恒定律》实验题练习

。
(2)小明采用图甲实验方案,测量酒精和水混合前后质量是否相等来验证质量守恒定
律。老师看到后直接否定该方案,理由是
。
(3)小明决定用如图乙装置模拟拉瓦锡实验,测定反应前
氧化汞的质量和反应后生成物的总质量是否相等来验证质
量守恒定律。小明记录了以下几组数据:(已知:氧气的
密度为p克/毫升,氧化汞分解的化学方程式:
(3)[实验探究]将收集的产物中的黄色固体放人试管中,加入适量的水,在试管口放置湿润的红
色石蕊试纸;有刺激性气味的气体生成,试纸由红色变蓝色;得到结论:黄色固体是Mg3N2。
[反思与交流]①化合物各元素化合价的代数和为零。②氮气化学性质不如氧气活泼。③燃烧不一
定需要有氧气参加。
3、质量守恒定律的发现,凝聚了不少科学家的心血。
有刺
激性气味的气体生成,试纸由红色变蓝色;黄色固体是
Mg3N2
-3
有氧气参加
氮气化学性质不如氧气活泼
燃烧不一定需要
【解析】
点燃
=== 2MgO
(1)镁条燃烧的化学方程式为:2Mg+O2====
(2)镁条燃烧后收集到的产物质量小于镁条的质量,出现这样实验结果的原因可能是:大量的
白烟弥漫到空气中,使得生成物收集不全。
实验操作
实验现象及结论
_______________________
_______________________
(反思与交流)①氮化镁中氮元素的化合价是
_______________________;
②空气中N2的含量远大于O2的含量,可是镁条在空气中燃
烧产物MgO却远多于Mg3N2,合理的解释是:
(用上述字母
【答案】(1)在化学反应中参加反应的金属和氧气的质量
初三化学质量守恒定律知识点含答案

初三化学质量守恒定律知识点含答案一、初中化学质量守恒定律选择题1.某化学反应的微观示意图如图所示,则下列说法正确的是( )A.反应前后分子种类、数目均不变B.该反应属于置换反应C.该反应中,反应物的质量比是1:2D.该反应的生成物均为氧化物2.浓盐酸跟二氧化锰混合加热会产生一种黄绿色的有毒气体,该气体可能是A.Cl2B.H2C.NH3D.HCl3.氯气是一种有毒的气体,实验室制取氯气时,可以用氢氧化钠溶液来吸收尾气,其反应原理为Cl2 + 2NaOH = X + NaClO + H2O, 则X 的化学式为A.H2B.NaCl C.HCl D.HClO4.“绿色化学”的特点之一是“零排放”.在一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物.其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,该产物化学式是()A.CH4O B.CH2O2C.C2H6O D.C2H4O25.以下是某化学反应的微观示意图(、)分别表示不同元素的原子,下列对图示反应的理解中,正确的是 ( )A.反应物和生成物中共含有三种元素B.该反应属于化合反应C.反应物和生成物中只有一种单质D.参加反应的物质分子个数之比为1:1 6.在一密闭容器内有M、N、Q、R四种物质,在一定条件下充分反应,反应前后各物质质量如表,则下列说法正确的是()物质M N Q R反应前质量(g)2155111反应后质量(g)11待测850A.该反应属于化合反应B.待测物质N的质量为22gC.该反应属于分解反应D.反应中M、N、Q、R四种物质质量比为9:37:80:1117.下列物质由离子直接构成的是A.H2O B.He C.O2D.NaCl8.三位科学家因“分子合成器”分享2016诺贝尔化学奖,下列关于分子的说法正确的是()A.物质都是由分子构成的B.同种原子可以构成不同的分子C.化学变化中分子的个数一定发生改变D.分子的质量一定大于原子的质量9.某反应前后分子变化的微观示意图如下。
汉台区第八中学九年级化学上册第五单元化学方程式课题1质量守恒定律第2课时化学方程式课时作业新版新人教

第2课时化学方程式知识要点基础练知识点1 化学方程式的意义1.镁条在氧气中燃烧的化学反应可用“2Mg+O22MgO”来表示。
现有以下信息:①反应条件;②反应速率;③反应物、生成物间的质量关系;④反应的微观过程;⑤反应过程中的能量变化;⑥反应体系中微观粒子间的数量关系。
能从上述化学方程式中获得的是(C)A.①③④B.②③⑤C.①③⑥D.②④⑥2.(北京中考)下列关于S+O2SO2的理解不正确的是(B)A.表示硫与氧气在点燃条件下反应生成二氧化硫B.参加反应的硫与氧气的质量比是2∶1C.反应前后硫原子、氧原子的数目均不变D.参加反应的氧气与生成的二氧化硫的分子个数比为1∶13.化学方程式可以提供很多信息,如2H2O2H2↑+O2↑,提供的信息有:(1)水通电后可以生成氢气和氧气的事实。
(2)可以获得的粒子数信息:每2个水分子通电分解生成2个氢分子和1个氧分子;对应的分子数之比为2∶2∶1 。
(3)可以获得的质量信息:每36份质量的水通电分解生成4份质量的氢气和32份质量的氧气;参加反应的水与生成的氢气、氧气的质量比为9∶1∶8 。
(4)用原子、分子的观点解释质量守恒定律:反应前后氢原子数和氧原子数不变,且氢原子和氧原子的质量不变,故参加反应的水的质量等于反应后生成的氢气和氧气的质量之和。
(5)你还可获得的信息有该反应是分解反应(或化学反应中分子可以分成原子,原子可重新组合成新分子,合理即可) (写一条即可)。
知识点2 化学方程式的读法4.关于化学方程式CH4+2O2CO2+2H2O的描述正确的是(C)A.甲烷加氧气在点燃条件下反应,生成二氧化碳和水B.1体积甲烷和2体积氧气在点燃条件下完全反应,生成1体积二氧化碳和2体积水C.1个甲烷分子和2个氧气分子在点燃条件下完全反应,生成1个二氧化碳分子和2个水分子D.在点燃的条件下,每1份质量的甲烷和2份质量的氧气完全反应,生成1份质量的二氧化碳和2份质量的水综合能力提升练5.图中四位同学正在讨论某一个化学方程式表示的意义,他们所描述的化学方程式是(A)A.S+O2SO2B.C+O2CO2C.2H2+O22H2OD.CH4+2O2CO2+2H2O6.从以下两个化学方程式中获取的信息,错误的是(C)反应①:Na2CO3+2HCl2NaCl+H2O+CO2↑反应②:2KMnO4K2MnO4+MnO2+O2↑A.反应①和反应②都有气体生成B.反应①和反应②是在不同条件下进行的C.反应①和反应②的反应类型相同D.反应①中有两种氧化物,反应②中只有一种氧化物7.我国古代典籍中有“银针验毒”的记载,“银针验毒”的反应原理之一是4Ag+n H2S+O22Ag2S+2H2O。
质量守恒定律

质量守恒定律
铁丝在空气中燃烧,生成的黑 色固体比铁丝还重,这一反应不符 合质量守恒定律,对吗?
不对. Fe + O2 点燃 Fe3O4
的质量之和
,反应后生成的
四氧化三铁的质量等于参加反应的铁丝和氧气
质量守恒定律
质量守恒定律
注意事项
1.质量守恒,而体积不守恒。 2.适用于一切化学反应。(不针对物理变化)
3. ①“参加反应”,没有参加反应的物质不包括在内;
②“生成的各物质的质量总和”,应当包括生成的 各种物质,如沉淀、气体等。
质量守恒定律
宏观
元素种类 不 元素质量 变 物质的总质量
微观
原子种类 原子质量 原子数目
则生成氧化镁 的质量为 40 克 ____
质量守恒定律
6克碳与一定量的氧气恰好完全反应, 16 克氧气参加了 生成二氧化碳22克,有___ 反应。
在反应A+B=C+D中,已知2克A和5克 3 克 B参加了反应,生成了4克C,则有____ D生成。
质量守恒定律
蜡烛在空气中燃烧后,生成二氧化碳 氢 元素, 和水,试推断蜡烛中一定含有碳 _____ 氧 元素。 可能含有___ 某纯净物A受热分解能生成氧化铜、 水和二氧化碳,试推断纯净物A中一定含 有 氧、铜、氢、碳 元素。
原子种类没有改变。 原子个数没有增减。 原子质量没有变化。
质量守恒定律
反思与评:
质量守恒定律是否对所有的化学 反应都适应呢?
质量守恒定律
【问】质量守恒定律是否真的适用于一切化学反应呢?
分组实验
实验一 稀盐酸与碳酸钠粉末反应前后质量的测定(在烧杯 中进行、敞口)。
质量守恒定律
实验二 稀盐酸与碳酸钠粉末反应前后质量 的测定(在密闭体系中进行)
质量守恒和化学方程式及计算专题(含答案)

质量守恒和化学方程式及计算专题姓名_______【知识点1】质量守恒定律1、涵义:参加的各物质质量总和等于反应后生成的各物质质量的总和,这个规律叫做质量守恒定律。
2、适用范围:化学变化(物理变化与质量守恒定律无关)。
3、守恒实质:化学反应前后,各种、、都不改变.4、化学反应过程中的变与不变——五不变,二改变,一可能变①不改变:从宏观来看反应物和生成物的质量总和不变以及元素种类不变。
从微观来看有三不变,即原子种类不变、原子数目不变、原子质量不变。
②改变:从宏观来看物质种类一定改变从微观来看分子种类一定改变③可能改变:分子总数可能改变5、应用:①利用质量守恒定律推断物质的组成②利用质量守恒定律推断反应物或生成物的化学式③利用质量守恒定律进行有关计算④质量守恒定律中的守恒对象是物质质量6、注意:①质量守恒,不是体积守恒。
②参加反应的各物质的质量总和并不是反应物的任意质量之和,未参加反应的物质质量不能计算在内。
质量守恒定律应用的试题归类1.解释化学反应前后质量变化原因【例】纸在空气中燃烧后化为灰烬,为什么灰烬的质量比纸的质量小?2.推断物质的组成【例】某化合物完全燃烧,需要4.8 g氧气,同时只生成4.4 g二氧化碳和2.7 g 水,则该化合物中()A.只含有碳、氢两种元素B.只含有碳、氧两种元素C.含有碳、氢、氧三种元素D.无法确定【例2】4。
6克某有机物在氧气中充分燃烧可生成二氧化碳8.8克、水5.4克,则该有机物含有元素,它们的质量比是。
3.确定物质的化学式【例】某发电厂烟气处理的新工艺:CH4十2NO2= N2+X+2H2O,则X的化学式为()A. CO B.CO2C. O2 D. C4。
配平化学方程式【例】2008年奥运会“祥云”火炬中燃料燃烧后不会对环境造成污染,体现了“绿色奥运”的理念.反应的化学方程式为C3H8+5O2xCO2+4H2O,则x的数值是( ) A. 1 B.2 C. 3 D .45。
化学质量守恒定律(讲义及答案)附解析
化学质量守恒定律(讲义及答案)附解析一、选择题1.下列关于反应C+2H 2SO 4(浓)===∆CO 2↑+2X↑+2H 2O 的分析,正确的是 A .X 的化学式为SO 3B .X 的水溶液能使酚酞溶液变红C .CO 2和X 的质量比为11:16D .碳元素的化合价在反应前后由0价变为+4价 解析:D 【解析】 【详解】根据反应C+2H 2SO 4(浓)===∆CO 2↑+2X↑+2H 2O 和质量守恒定律的元素守恒和原子个数不变,则可知:反应前C 原子个数为1、H 原子个数为4、S 原子个数为2、O 原子个数为8;反应后C 原子个数为1、H 原子个数为4、O 原子个数为4;可以推测X 气体为SO 2;因此: A 、根据分析,X 气体为SO 2;说法不正确;故不符合题意;B 、SO 2的水溶液呈酸性,不能使酚酞溶液变红,说法不正确;故不符合题意;C 、CO 2和SO 2的质量比为44:128=11:32;说法不正确;故不符合题意;D 、碳单质中碳元素化合价为0,CO 2中碳元素的化合价为+4价,碳元素的化合价在反应前后由0价变为+4价,说法正确;故符合题意; 故选D2.如图是某化学反应的微观模型,“”、“”分别表示不同元素的原子,下列各项中对图示模型理解正确的是( )A .该反应属于分解反应B .反应中共有两种元素参加C .反应物和生成物中只有一种单质D .参加反应的两种物质分子个数之比为2:3 解析:B 【解析】试题分析:A 、由图示可知,该反应的反应物是两种、生成物是一种,该反应是化合反应,不属于分解反应,故A 错误;B 、由反应中原子的种类可知,该反应中共有两种元素,故B 正确;C 、单质的分子由一种原子构成,化合物的分子由多种原子构成,由图示可知看出反应物是两种单质,而生成物是一种化合物,故C 错误;D 、由反应的图示结合质量守恒定律可知,参加反应的两种物质分子个数之比为1:3,故D 错误。
初三化学质量守恒定律单元复习测试题附答案
初三化学质量守恒定律单元复习测试题附答案一、初中化学质量守恒定律选择题1.“神舟七号“太空舱利用NiFe2O4将航天员呼出的CO2转化为O2,而NiFe2O4的质量和化学性质在化学反应前后都不发生变化。
该过程中NiFe2O4是()A.生成物B.反应物C.催化剂D.氧化剂2.在一个密闭容器中放入X、Y、Z、W四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表。
则关于此反应的认识正确的是()物质X Y Z W反应前的质量(g)211616反应后的质量(g)18m611A.该反应为分解反应B.该反应为化合反应C.m=1 D.反应后容器中Z与Y的质量比为1:6 3.某有机物在空气中完全燃烧,测得生成物中含有二氧化碳、水蒸气、二氧化硫,下列对该有机物的组成推断正确的是()A.一定含碳、氢、硫元素B.一定含有碳、氢、氧元素C.只含碳、氢元素D.一定含碳、氢、氧元素,可能含有硫元素4.如图是微信热传的“苯宝宝表情包”,苯(化学式C6H6)、六氯苯(化学式C6Cl6)都是重要的化工原料,下列有关说法正确的是()A.苯分子由碳、氢两种元素组成B.苯中氢元素的质量分数小于10%C.六氯苯中碳氯两种元素的质量比为1:1D.六氯苯有6个碳原子和6个氯原子构成5.在一个密闭容器内有四种物质,一定条件下充分反应后,测得反应前后各物质的质量如表,下列推理正确的是物质X Y Z Q反应前质量/g410121反应后质量/g01215待测A.反应物是X和Y,成物是Q和ZB.参加反应的Y和Q的质量比是1∶1C.参加反应的X与Q的质量比是1∶3D.反应后生成15 g Z6.用下列装置来验证质量守恒定律(托盘天平未画出),能达到目的是()A.B.C.D.7.“绿色化学”的特点之一是“零排放”.在一定条件下,二氧化碳和氢气可以按照不同比例反应,生成下列有机物.其中二氧化碳和氢气反应,只生成一种产物就能实现“零排放”,该产物化学式是()A.CH4O B.CH2O2C.C2H6O D.C2H4O28.如图为某化学反应的微观模拟示意图,下列说法中,正确的是A.反应前后氢元素的化合价没有改变B.n=3C.反应过程中原子种类发生了变化D.该反应生成了两种单质9.元素观是化学的重要观念之一。
人教版2021届初三化学上册同步练习:质量守恒定律【含答案】
人教版2021届初三化学上册同步练习:质量守恒定律【含答案】1、下列说法中,符合质量守恒定律的是( )A.蜡烛完全燃烧后,生成水和二氧化碳的质量之和等于蜡烛的质量B.镁带在空气中燃烧后,生成物的质量比镁带的质量增加了C.高锰酸钾受热分解后,剩余固体的质量与反应物的质量相等D.100水与100g酒精混合后总质量为200g【答案】B【解析】应用质量守恒定律分析问题时,要注意的是参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
蜡烛、镁带等固体在空气中燃烧,参加反应的物质除了蜡烛、镁带外,还有氧气;高锰酸钾分解有氧气生成。
2、在化学变化中,下列说法正确的是()①原子的种类、元素的种类、分子的种类均不变;②原子的数目、分子的数目均不变③原子的质量、元素的质量、物质的总质量均不变;④原子核的种类、数量、质量均不变A. ①②B. ①③C. ③④D. ②④【答案】C【解析】①原子的种类、元素的种类均不变,分子的种类改变,错误;②原子的数目不变,分子的数目不能确定,错误;③原子的质量、元素的质量、物质的总质量均不变,正确;④原子核的种类、数量、质量均不变,正确。
故选C。
3、在密闭容器中加热蔗糖可产生碳和水,由此可以说明( )A.蔗糖是由碳和水组成的纯净物 B.蔗糖是由碳和水组成的混合物C.蔗糖分子是由碳元素和水分子构成的 D.蔗糖是由碳元素、氢元素和氧元素组成的【答案】D【解析】注意蔗糖是反应产生了“碳和水”,根据质量守恒定律,可判定蔗糖是由碳、氢、氧三种元素组成的。
4、某种燃料是目前使用较多的“绿色可再生能源”,其在空气中完全燃烧的化学反应方程式:X+3O22CO2+3H2O.则X物质的化学式为()A.CH3COOH B.C2H5OH C.C2H4D.C2H6【答案】B【解析】根据质量守恒定律和化学方程式可得,X的化学式中应含有C的个数为:2,应含有O的个数为:2×2+3﹣3×2=1,应含有H的个数为:2×3=6.故可推断X的化学式为:C2H6O,即C2H5OH。
九年级化学化学质量守恒定律的专项培优 易错 难题练习题(含答案)含答案
学变化中元素的种类不发生改变,正确。故选 B。
11.在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前 后各物质的质量变化见下表。下列说法错误的是( )
物质
甲
乙
丙
丁
反应前物质的质量(g) 8
32
5
4
反应后物质的质量(g) 16
X
5
24
A.该反应为分解反应 B.丙可能是该反应的催化剂 C.甲、丁两物质反应前后质量变化之比为 2:5 D.X 值为 28 【答案】D 【解析】 【分析】 根据质量守恒定律,在化学反应中,反应前参加反应的各物质的质量总和等于生成物的各 质量总和,反应后增加的是反应物,减少的是生成物。 【详解】
A、反应后甲增加了16g-8g=8g ,则甲是生成物,丁增加了 24g-4g=20g ,则丁是生成
物,丙反应前后质量没变,丙可能没参加反应或是催化剂,根据质量守恒定律,则有
8g+32g+5g+4g=16g+X+5g+24g ,则 X=4g ,则反应表达式是乙 甲+丙,属于分解
反应,故 A 正确; B、丙反应前后质量没变,可能是该反应的催化剂或者没参加反应,故 B 正确;
7.图反映了某个化学反应各物质质量与时间的关系。下列描述正确的是
A.该反应是化合反应 B.甲的相对分子质量大于乙 C.丙是反应物,甲和乙是生成物 D.t1 时,丙的质量一定等于甲、乙的质量之和 【答案】C 【解析】 【分析】 【详解】 A、由图知从 0 到 t1 时间内丙物质逐渐减少,甲乙两物质逐渐增加。所以,丙为反应物, 甲、乙为生成物,该反应分解反应,描述错误; B、甲的生成量比乙多,但分子个数不知,相对分子质量甲不一定比乙大,描述错误; C、 丙是反应物,甲和乙是生成物,描述正确; D、t1 时,参加反应的丙质量一定等于甲、乙的质量之和,描述错误。 故选 C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1页(共7页) 九年级化学第五单元第一节质量守恒定律练习和答案 一.选择题(共30小题) 1.(2015•通辽)在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如下表所示,下列说法不正确的是( ) 物质 X Y Z W 反应前质量/g 10 3 90 0 反应后质量/g 3.2 3 待测 3.2 A.W可能是单质 B.Y可能是催化剂 C.该反应是分解反应 D.反应后Z物质的质量为86.4g
2.(2015•湘潭)古代“银针验毒”的原理是:4Ag+2H2S+O2═2X+2H2O,X的化学式为( ) A.AgS B.Ag2O C.Ag2S D.Ag2O2
3.(2015•北京)已知:2KClO32KCl+3O2↑,如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是( )
A.固体中氧元素的质量 B.生成O2的质量 C.固体中MnO2的质量 D.固体中钾元素的质量
4.(2015•沈阳)火箭推进器中盛有N2H4和H2O2,发生反应的化学方程式:N2H4+2H2O2=R+4H2O,其中R的化学式为( ) A.N2 B.N2O4 C.NH3 D.NO2
5.(2015•宜昌)在炼铁工业中,常用石灰石将铁矿石中的杂质二氧化硅转化为炉渣除去,发生反应的化学方程式为:CaCO3+SiO2X+CO2↑,其中X的化学式是( ) A.CaSiO4 B.Ca2SiO3 C.CaSi2O3 D.CaSiO3
6.(2015•佛冈县模拟)在一密闭容器里放入四种物质,使其在一定条件下充分反应,测得数据如下: 四种物质 甲 乙 丙 丁 反应前质量(g) 25 15 1 5 反应后质量(g) 11 a 1 22 第2页(共7页)
则下列表述正确的是( ) A.a值为3g B.甲与乙反应的质量比为14:3 C.乙全部发生了反应 D.丙一定是催化剂
7.(2015•仪征市一模)在由CH4和H2组成的混合气体中,测知碳元素的质量分数为60%,则混合气体充分燃烧生成二氧化碳和水的质量比为( ) A.22:9 B.11:18 C.3:2 D.11:27
8.(2015•石峰区模拟)氯气(Cl2)是一种重要的化工原料.在实验室,利用高锰酸钾固体与X的溶液反应可制得氯气,反应的化学方程式为:2KMnO4+□X═2KCl+2MnCl2+5C12↑+8H2O,关于该实验,下列有关说法正确的是( ) A.该反应的化学方程式中,X的化学计量数是12 B.X由三种元素组成,其中一定含有氯元素 C.X中所含元素的质量比为l:35.5 D.该实验发生装置与实验室用高锰酸钾制氧气的发生装置相同
9.(2015•郑州模拟)关于反映3Cu+8HNO3(稀)═3Cu(NO3)2+2X↑+4H2O,下列说法不正确的是( ) A.X的化学式为H2 B.铜的化合价由0升至+2 C.可采用与制取CO2相同的发生装置制取X D.该反应涉及的物质中,构成粒子有原子、分子、离子
10.(2015•重庆校级模拟)在一密闭容器中,有甲、乙、丙、丁四种物质,反应前,他们的质量如白色条形图所示.反应结束后,他们的质量如黑色条形图所示.下列说法正确的是( )
A.丙一定是该反应的催化剂 B.该反应为化合反应 C.甲、乙的相对分子质量之比一定为2:3 D.反应过程中甲和丁变化的质量比为2:1
11.(2015•会东县校级模拟)在一个密闭容器中加入四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表: 物质 甲 乙 丙 丁 反应前质量/g 3 5 20 7 第3页(共7页)
反应后质量/g 10 5 8 待测 通过分析,判断下列说法正确的是( ) A.测得反应后丁物质的质量为12g B.乙物质一定是催化剂 C.该反应是化合反应 D.该反应是置换反应
12.(2015•宁阳县模拟)将一定量的苯(化学式为C6H6,相对分子质量为78)在有限量的空气中快速不完全燃烧,产生大量的黑烟,得到碳、一氧化碳、二氧化碳和水的总质量为19g,没有其他生成物.4种生成物中水为5.4g,固态的碳为3.6g.则上述过程中产生的一氧化碳的质量为( ) A.2.8g B.5.6g C.11.2g D.1.4g
13.(2015•南通校级二模)以下应用守恒思想解决相关问题,推论正确的是( ) A.2g氢气与18g氧气反应,根据质量守恒推出生成的水的质量为20g B.丙烷燃烧生成二氧化碳和水,根据元素守恒推出丙烷由碳、氢、氧元素组成 C.100mL36%的浓盐酸用300 mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为9% D.相同分子数的CO和O2混合,在一定条件下充分反应,根据原子守恒推出反应后气体中C、O原子数比为1:3
14.(2015•罗平县三模)一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如表所示,下列说法错误的是( ) 物质 W X Y Z 反应前质量(g) 3 22 32 0 反应后质量(g) 3 40 待测 14 A.W在反应中可能是催化剂 B.该反应中生成X的质量为40g C.该反应属于分解反应 D.该反应中Y全部参加反应
15.(2015•孝感一模)某密闭容器中有X,氧气和二氧化碳三种物质,在一定条件下充分反应,测得反应前后各物质的质量如表,根据表中信息,判断下列说法正确的是( ) 物质 X O2 CO2 H2O
反应前质量g 2.3 10 1 0 反应后质量/g 0 待测 5.4 2.7 A.X中一定含有碳、氢两种元素 B.反应生成的CO2和H2O的质量比为54:27 C.该反应为置换反应 D.X中碳元素和氢元素的质量比为4:1
16.(2015•聊城校级模拟)在一个密闭容器中有X、Y、Z、Q四种物质,一定条件下充分反应,测得反应前后各物质的质量如表所示:下列说法中不正确的是( ) 物质 X Y Z Q 反应前质量/g 4 10 1 25 反应后质量/g 未测 21 10 9 第4页(共7页)
A.该反应为分解反应 B.X中未测值为0 C.若Q为氧气,则该反应为氧化反应 D.该反应遵循质量守恒定律
17.(2015•吴兴区模拟)下列各项中两个量的关系不能用如图所示的图象来表示的是( )
A.浓硫酸的质量与体积的关系 B.草原生态系统中,狼与羊的数量关系 C.通过定值电阻的电流与其两端电压的关系 D.分解反应中,一种生成物的质量与反应物的质量关系
18.(2015•珠海校级一模)下列四个图象分别对应四种操作过程,其中不正确的是( )
A. 一定质量的镁在密闭的容器内燃烧
B. 向盐酸和氯化钙的混合溶液中滴加碳酸钠溶液
C. 在室温下,向一定量的食盐饱和溶液中不断加入氯化钾晶体
D. 第5页(共7页)
向等质量、等质量分数的稀硫酸中分别加入镁和铝 19.(2015•长顺县校级模拟)根据质量守恒定律判断:X+2O2=CO2+2H2O中,X的化学式为( ) A.CH3OH B.CH3COOH C.C2H5OH D.CH4
20.(2015秋•仁寿县校级期中)化学反应前后,下列各项中,一定没有发生变化的是( ) ①原子数目 ②原子种类 ③分子数目 ④分子种类 ⑤元素种类 ⑥物质种类. A.①②⑤ B.①③⑤ C.②④⑥ D.①③④
21.(2015秋•南京校级期中)化学知识中有很多的“等于”和“不等于”.下列说法错误的是( ) A.参加化学反应的物质的元素种类等于反应后生成的物质的元素种类 B.5g氧气和50g碳完全反应后,所得CO2的质量一定等于55g C.原子中,原子核内的质子数一定等于核外电子数 D.常温下,50mL水和50mL酒精混合后的体积一定不等于100mL
22.(2015秋•江门校级期中)在一密闭容器中,有甲、乙、丙、丁四种物质,在一定的条件下,充分反应,测得反应前后各物质质量如下表关于此反应,下列认识正确的是( ) 物 质 甲 乙 丙 丁 反应前质量(g) 4 1 42 10 反应后质量(g) 0 20 6 31 A.甲是反应物 丙是生成物 B.丙是反应物 乙是生成物 C.丁是反应物 丙是生成物 D.甲乙丙丁都是生成物
23.(2015春•文登市校级期中)下列有关质量守恒定律的认识,不正确的是( ) A.质量守恒定律为定量揭示化学变化的规律,提供了理论依据 B.通过化学变化,只能改变世界上物质的种类,不能改变物质的总质量 C.随着科技的发展,精密仪器为我们定量研究化学变化创造了条件 D.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关
24.(2015春•临淄区校级期中)下列不能用质量守恒定律解释的是( ) A.鲜牛奶变质 B.粮食酿成酒 C.钢丝球刷碗 D.煤炭的燃烧
25.(2015春•宁夏校级期中)水蒸气通过红热的铁粉,发生的反应为:3Fe+4H2O═X+4H2,则X为( ) A.FeO B.Fe2O3 C.Fe3O4 D.Fe(OH)2
26.(2014•武汉校级模拟)实验时可以用铜与浓硫酸反应制取二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓)CuSO4+2X+SO2↑,其中X的化学式为( ) A.H2O B.H2S C.S D.O2
