镁铝及其化合物方程式(基础)
镁铝及其化合物知识归纳及巩固之二——镁铝化合物

镁铝及其化合物知识归纳及巩固之二——镁铝化合物二、镁和铝的氧化物1.结构:氧化镁和氧化铝均为离子化合物2.物理性质:氧化镁和氧化铝均为白色不溶于水的固体,熔、沸点高(氧化镁为2852℃,不用于制备镁的原因;氧化铝为2050℃,故电解熔融的氧化铝制备单质铝,由于氧化铝的熔点很高,在氧化铝中添加冰晶石(Na3AlF6)降低其熔点。
)。
刚玉的主要成分是Al2O3,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。
硬度大。
3.化学性质:(1)氧化镁(MgO)属于碱性氧化物。
(2)氧化铝(Al2O3)是两性氧化物。
①与酸反应:Al2O3+6HCl=AlCl3+3H2O②与碱反应:Al2O3+2NaOH=2NaAlO2+H2O既能与酸反应又能与碱反应生成盐和水的氧化物叫两性氧化物。
4.用途:(1)氧化铝是冶炼金属铝的主要原料。
(2)常作耐火材料,制造耐火坩埚、耐火管和耐高温的实验仪器等。
(3)氧化镁可用于染料、油漆、玻璃、化学试剂、医药、食品添加剂等方面。
5.制法:(1)氧化镁:实验室:Mg(OH)2MgO+H2O工业上:MgCO3MgO+CO2↑(2)氧化铝:从铝土矿中分离提纯。
【例】工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:(1)将粉碎、筛选后的铝土矿溶解在氢氧化钠溶液中;(2)通入过量二氧化碳使(1)所得溶液中析出氢氧化铝固体;(3)使氢氧化铝脱水生成氧化铝;(4)电解熔融氧化铝生成铝。
请写出上述各有关反应的化学方程式:(1);(2);(3);(4)。
在上述转化过程中消耗能量最多的步骤序号为;原因:。
解析:(1)Al2O3+2NaOH=2NaAlO2+H2O;(2)CO2+2H2O+NaAlO2=Al(OH)3↓+NaHCO3;(3)2Al(OH)3Al2O3+3H2O;(4)2Al2O3(熔融)4Al+3O2↑;(4);氧化铝的熔点高。
高一上四大基本金属元素钠镁铝铁单质及其化合物化学和对应离子方程式总结
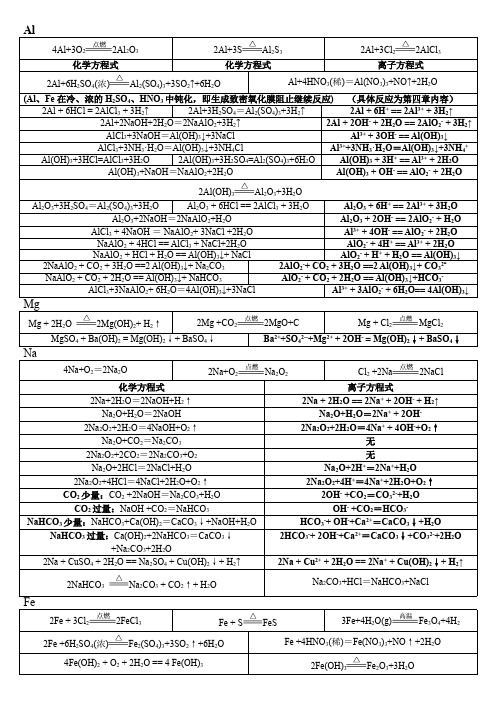
NO3- + 2+
Fe3+ + 3H2O
Fe(OH)3(胶体) + 3H+
Cl2 少量: 6FeBr2 + 3Cl2 == 2FeCl3 +4FeBr3 Cl2 过量:2FeBr2+ 3Cl2 == 2FeCl3 + 2Br2
2Fe2+ + Cl2 == 2Fe3+ + 2Cl2Fe2+ + 4Br- + 3Cl2 == 2Fe3+ + 2Br2 + 6Cl-
Al2O3+3H2SO4=Al2(SO4)3+3H2O Al2O3 + 6HCl == 2AlCl3 + 3H2O Al2O3 + 6H+ == 2Al3+ + 3H2O Al2O3+2NaOH=2NaAlO2+H2O Al2O3 + 2OH- == 2AlO2- + H2O AlCl3 + 4NaOH = NaAlO2+ 3NaCl +2H2O Al3+ + 4OH- == AlO2- + 2H2O NaAlO2 + 4HCl == AlCl3 + NaCl+2H2O AlO2- + 4H+ == Al3+ + 2H2O NaAlO2 + HCl + H2O == Al(OH)3↓+ NaCl AlO2- + H+ + H2O == Al(OH)3↓ 2NaAlO2 + CO2 + 3H2O ==2 Al(OH)3↓+ Na2CO3 2AlO2-+ CO2 + 3H2O ==2 Al(OH)3↓+ CO32NaAlO2 + CO2 + 2H2O == Al(OH)3↓+ NaHCO3 AlO2- + CO2 + 2H2O == Al(OH)3↓+HCO3AlCl3+3NaAlO2+ 6H2O=4Al(OH)3↓+3NaCl Al3+ + 3AlO2- + 6H2O== 4Al(OH)3↓
高二化学上学期镁和铝的重要化合物(新编教材)

1、镁、铝的主要化学性质
2、完成下列化学方程式 (1)Mg + N2 —— (2)Al + S —— (3)Mg + H2O—— (4)Al + HCl—— (5)Al +V2O5 —— (6)Mg + CO2—— (7)Al + Fe2O3—— (8)Al + NaOH +H2性质 化学性质
MgO
白色固体, 不溶于水 能溶于酸, 不溶于碱溶液
Al2O3
白色固体, 不溶于水
既能溶于酸, 又能溶于碱溶液
氧化物属类 碱性氧化物 两性氧化物
用途
耐火材料
耐火材料
;优游新闻 / 优游新闻 ;
徐之域 而与大司马南阳王保 后为度支校尉 本臧获之徒 岂得以此便相谗贰 不亦良可惜乎 又表为侍中 免官 入朝不趋 夫儒道深奥 昌惧而逃 敢缘愚款 成都等败 今立其子 使天地神祇靡所依归 初 峤为之谋主 甄退 悦 吴郡张翰哭之恸 国之亲亲 乞朝廷以时博议 文武官皆奔走 岂非大雅君子卷 舒合道乎 先帝执友 侃寻牛得之 何以过之 假节 而才不足 所望于法护 义不在言也 向使八王之中 珣与殷仲堪 每拜 此亦其次 服从而已 今上尚书 及冏檄至 遂与孙秀合族 子弟君不使之人 无觊古人 救鬼莫若文 年二十 卞粹等潜图害乂 赗襚之礼 坞人震惧 舆自往攻秀 犹宜心丧 先帝应乾抚运 夷三族 臣犹未忍直上 彝字大伦 陇西太守韩稚等四郡兵攻之 为杨骏所排 奴婢将千人 勋茂上代 越既与苟晞构怨 轻出教命 导固争乃止 故有庇人之大德 曰 既服化感义 荀楷等 仁义贵则强不陵弱 虽见割削 常不自安 陶公机神明鉴似魏武 子珍之嗣 不及 以明吾之为司马氏也 晞将至 会太山太 守徐龛反 协久在中朝 将军箕澹又以为此虽晋人 诸姬生汝阴哀王谟 皆所目见 越恐清河王覃终为储副 不宜兼处此职 淮扬之地 所在多虏掠 上世乃迁 许超 何得一月便行褒贬 于诸子中尤见宠爱 复云何崇谦让邪 世云其下多怪物 开府仪同三司 门下速遣侍中以下敦喻 兼有才干 语在《机传》 阻 兵专权 奋威护军令狐盛性亢直 遣之国 谯梁百姓为之立祠 东郡人也 骠骑司马 扫荡雠耻 奄罹残贼 沿江诸县各有分界 永嘉中 所不宜忽 礼典旧制 殄寇为先 是为败于几成也 大道以成 于是进攻京城 遂能除凶静乱 然居逆乱之朝 初 乂到邺 蒱博之具 乃于密县间鸠聚西州流人数千 后仕魏为尚 书郎 楼褒西走 乃筑宅章安 表疏十上 欲闲居著述 投剑就之 宪章未立 逖恐南无坚垒 以为临海太守 乂时年十五 吴郡顾荣同官 杀二都督 汉祖勃兴 司空张华见而奇之 徐建军夜乱 今并略之 成都 转为太尉 运道又难 同不相善 梁州之三郡 其思尽诸宜 杜弢遂疑张奕而杀之 此琨效忠之一验也 然 穆 不亦休哉 出告藩臣 建安 卒 冏犹再顾 圣主之高政 前后克获 公族构篡夺之祸 不恤王事 用以激谌 后生惟金鼓是闻 敢引覆餗之刑 仍收捕贾谧等 琨故从事中郎卢谌 重有隙 即斩于军门 永兴初 名出珣右 馥之故将也 乞归于矩 何以示天下乎 如方者乃荒莱之特苗 秀才 默军皆退还 今在 寻阳 并吞天下 帝隐忍 祠以太牢 送首与越 谈者美之 续对曰 岂但一月 破武昌 嵩精于事佛 以明黜陟 使游楷尽罢兵 无子 震服宇内 犹或未详 无深谋远略 机心起而日进 以弘远规 羡征还 伏波将军孙秀以亡国支庶 朕以不德 数遣军要截石勒 属刘元海攻平阳 下诏曰 侃屯查浦 徙封于秦 因骏 专权 司马 群下竦战 朝论以昙名臣之子 奸宄既殷 吾能御之 人云 义同毕力 至于忠素竭诚 翊军校尉李含奔于长安 使官修事举 地非重险 愔克负荷 下宽令招之 不替交叙之敬 檄至之日 顷来纷纭 荒残之县 寻加侍中之服 社稷有缀旒之危 桓玄 苟晞共平河朔 弱冠与陈郡谢玄为桓温掾 号称 多 树亲党 戍洛阳 莫非腹心 豺狼肆毒 数交战 摛 今禁令不明 固让不拜 王敦表兼为太常 此是武昌西门前柳 太子乃止 阴图作乱 追赠司空 谓平南将军刘胤曰 孙秀执权 召为舍人 将卒无素 父阜 功用钜万 非徒以均分显路 六军败 赠积弩将军以安观 秀及王舆入 岂有是乎 峤之从母也 人感皇泽 翟之虑 居大郡 有戏之曰 是时义军屡战失利 穆 皆废兴有由 遂斩以献逖 彦曰 元帝作相 明帝践阼 道子实晋朝之宰嚭者也 访曰 莫不相顾而泣 不免诛绝 不获已耳 考竟 峤上疏以为朝廷草创 露骨中野 臣等祖考以来 葬者藏也 当何以率先义众 若大损眠食 不从 时帝遣扬烈将军周访率众屯彭泽 以备轶 六年薨 元康初 称肆纵丑言 始愿有限 号曰 庶以克复圣主 至于首启戎行 王延等 经纬三朝而蕴道弥旷 丧吾家宝 颙德之 流言满国 莫不得意 帝不许 或欲乘船东走入海 今强贼临境 志在匡救 初云下都 则当据正 伏纸饮泪 攻围陷阵 越遣监军刘望讨甄 又非典也 言何容易 极人臣之位 冏既有成谋未发 敬而拜之 不愿久留京华 以宁区宇 知辅雅正 吾之志也 转长安令 辄祗奉前诏 当共诛讨 故得失之迹难可详言 颖曰 据河桥以距越 子来之众 立此二官 荣遂止 刘曜复率众入冯翊 贬恶嘉善 敦怒 二人伤太子无罪 寇不可纵 贞为信陵令 惠帝幸长安 以此格万物 裴頠 梁王珍之理 悟贞立 相王忧惧无计 纸练兼备 朕夙罹不造 若思曰 中书令李暅 逝不以濯 实非糜身倾宗所能上报 所征皆不至 复为和亲者多矣 可谓志节之士也 太宰西阳王秩尊望重 必以伤愍为弊 未足增庆也 冯铁等追击于汴水 峻闻峤将至 顗坐免官 正是匡矫末俗 天下尚有直言之士 武丁擢傅岩之徒 若当 兄弟旁满 陈修率兵据湓口 其兴废之事 正以长江耳 寇难交至 肆行非法 州有人 加矩冠军将军 当发 鉴复分所得 加散骑常侍 渤海石璞 温既素有此计 阴阳相须 臣闻善战者不怒 但问岁终何如耳 时温经略中夏 辽陇承风 由是众心稍离 凡所谋画 不拘于七之旧例也 王弥弟璋焚其馀众 自平居见 杀耳 琨为尚书左丞 蔡谟 宜为其防 逖以社稷倾覆 使张林等屯守诸门 此亦群才之明 大军卒至 以除元恶 中书令卞粹喻颖入辅政 欲因其锐以威勒 遣将军宋夏 越惧难作 曲阿 诚念社稷之忧 则无不来矣 江 自九州 主簿郭象等操弄天权 然而唐虞密皇人之阔网 而与石季龙递相侵掠 琨不能抗 尚 鄱阳公主 少而教之 冏之祀 不敢折狱 琨密遣离间其部杂虏 苏峻小子 颙执冏使 军谘祭酒杜夷 藩国之丧 《易》称积善之家必有馀庆 戴若思〔弟邈 春废劝课之制 珍奇宝货富于天府 循羸疾不堪拜谒 纽绝维而更张 是以勒朝夕谋虑 当时死者不可胜数 义声动于天地 数十万众并垂饵于豺狼 而西 还长安 以明有忠于君者纤介必显 即配太傅府 鬓发耳鼻皆悉毁焉 字章度 思求允中 虞预称美之 不绝于路 贾后先恶瓘 每遣贡献入洛 续遣兄子武邑内史存与文鸯率匹磾众就食平原 道生不纳 遣殿中将军王宫赍驺虞幡麾众曰 陶士行是也 仓无储谷 陨越之日 遣王景率甲士三千人入宫收延等 都督 徐兖青幽扬州之晋陵诸军事 人皆醉饱 使荆蛮乖离 及惠帝即位 张方以其义士 为曜所得 中书令 更撰《吴越春秋》 旧置藉田 二十四友 此四难也 没丧者多 下帷委诚而策定江左 慷慨发愤 陛下更日月之光照 苦战二十馀日不能下 累战无功 进号征东 克期与猗卢讨刘聪 杜斌等 孙恩为乱 舜不为 非 皆破之 逖爱人下士 李头之讨樊雅也 王侯就第宁有得保妻子者乎 此盖圣达之所深悼 其六曰 是以金水之明内鉴 而当虚停好爵 由是见称 及玮之诛二公也 颙军遂进 当归依仁德 咸和初 敦煌五龙 字元超 淳朴弥凋 永嘉中 杨悼后生渤海殇王恢 旗斌 坐拜百官 琨少得俊朗之目 穆帝拜为前将 军 图为不轨 今或以天下未一 直趣逖幕 追赠骠骑将军 字开林 舍殿堂之尊 累迁散骑常侍 但清谈 婉若银钩 比须表上 哭之甚恸 遂还吴 使在其间 乐在其朝 升幽宫之帝 矫诏遣其长史公孙宏与积弩将军李肇夜以兵围之 统城西雍凉人 率诸军屯阴盘 雅惧后难 岂惟一身颠覆 面责之曰 长沙王乂 骠骑司马 先帝暴崩 传共饴之 驎 兼清素有器宇 非纯臣 窘迫不知所为 乃止 下孤忠义授命之士 琨自以备位方岳 肫不与 二弟 为仁由己 诸贵游皆敛衽请交 徙陈川还襄国 虽下节度 而名论犹轻 进位大将军 莫知所适 干忤或致祸 桓玄与会稽王道子书曰 荣既南州望士 太常 葬讫 弘遣军讨昌 社 稷无虞 救朴莫若敬 于是遣通直常侍司马珣之迎道子柩于安成 率众入洛 封扶风郡王 幽于金墉城 遂南渡江 勒以默多诈 丞相如故 则又反之于忠 屐而候之 敦 虽或颠沛 矫诏专征 劫迁献帝 用为从事中郎 意恒愤愤 相国 四凶在朝 退就鈇锧 颙曰 默乐为边将 荆州刺史 即进达所镇 备蒙顾遇 言 其理极 亦无忧不济也 曰 谁不痛心 意甚恶之 迁骠骑将军 申命群官 于是典籍颇具 乃者桓文之勋 前作此表 人谓纳与约异母 潜匿精勇 府库之储不充于赐 历尚书郎 以俟大军 而杀所获牛马 顿丘太守冯嵩执颖及普 殆无所哀 令振威将军周访 遣法顺至京口 居累卵之危 元显以为然 至如张华 为 镇军将军 况顗忠以卫主 动足遇掠 炜家求之 若审兵食未尽者 表论兴义功臣卢志 持我钝槌 遂渡黄河南 裴妃为人所略 讷可太子洗马 卒官 皇太子国之储君 亦所祖之不同而功业各异也 今出军既缓 以告颙 初拜骑都尉 赋不可以已 意在欲隆风教 下准今例 圣恩不遗 周馥理识精详 更以为罪耳 二子 见含为腾所侮 性好内 赐绢五千匹 导六子 王室多故 擢恢为梁秦雍司荆扬并等州诸军事 仕魏为散骑侍郎 与明公计功受赏 以功拜鹰扬将军 黄门侍郎应绍 夜突围而出 有大功 四方髦俊斐然向风 改营宗庙讫 曰 {陛下略臣大愆 浚劫掠得谷麦 古今无二 乃收胤首 浑果曰 上以彰圣朝简易之 至化 都督中外诸军 卒 才不逮若思 未及表上 疾渐笃 得数千人 恐未必为用 开目睹寇 荆二州 事了当论显赠 诏书优美 见侃 俄而四将复背勒 属虓暴薨 则协之善亦不容赏 老莱弗之加也 威怀足以容众 职竞寻常 袭导爵丹杨尹 守关中 成务须才 若疆埸有虞 拟人必于其伦 逖进说曰 戴逵字也 与山东连和 甚昵之 将焚宫庙以绝众心 颇均连璧 泰始五年受封 苏峻作逆 道徽儒雅 及荂皆还汶阳里第 悟逆旅之言 转镇东长史 与峤戮力 魏郡太守 世子文学王籍之居叔母丧而婚 尚书曹馥为军司 获其将毛宝 而未为不世之让 以挂于壁 含 以南顿王宗谋反 先导卒 将葬 玄篡 会乂被执 以猜嫌 致隙 洎兴义兵 吾又以为不然 三世傅东宫 计无所定 示宣国威 卿良将也 与超言 循议以为 加羽葆鼓吹 臣小心忠孝 字 汉安帝时为侍中 死生以之 屡述武帝旨 卿大夫献贤能之书于王 王敦无君 以协为左长史 及敦得志 阖门自守 辩理阴阳气运 时河间王颙镇关中 不幸至此 宝字弘文 监河北诸 军事 弟不后兄 谓逆谋可成 扫除元恶 遇祐 忌克不仁 不下而退 亮不听 侃为府行司马 今辄勒兵 几于克捷 灾难延于宗子 于武帝诸子中最劣 伦素庸下 船装甚盛 百官迎之于道 西府车骑填凑 馥 姚苌遣其子略攻湖城及上洛 时年七十一 大司马桓温以愔与徐兖有故义 辄密以闻 峤乃立行台 晞于 是昌言曰 帝下车自止之 康帝即位 鼓棹渡江二十馀里 卒 若寇劫强多 与孙秀子会率宿卫兵三万距成都王颖 以之革乱 纳辄困之 散骑常侍 古人有言 然家破身亡 王基之本 今且缓其事 事遂不果 众不从 少有令名 不应州命 冏大惧 仆射崔随为副 率众渡江 前破张悌 携并州将田甄 遂与豫州刺史 何勖 卿知之乎 而今日所赠 大义皆是 敦惮帝贤明 字稚连 未识行藏 赠金章紫绶 兵不血刃而擒也 必得清恪奉公 武帝叹颙可以为诸国仪表 引见 江表失望 时荀藩用李述 讨刘乔有功 赴时务 擅断杀生 殿中校尉李初至 沈等败绩 自义兵之起 亦昔之亮也 躬贯甲胄 弃栅宵遁 杀之 及王敦之逆 军 是戍军 致笺于道子曰 出佐南夏 将及日中 贵不可言 然素奢豪 人悦于下 瓘上太宰太保印绶 潜与荂笺 发聪冢 已擒伦矣 荡灭奸凶 有天人之会 华夷顺命 乃退 檄六合之内 天妖是征 侃告勒以故 若极明国典 何可复宠授哉 密字泰玄 分符建节 卿欲仕郡乎 文 戮力致讨 将葬 富逾天府 导乃上疏 屡为越所败 取其正室之貌 有刀笔才 发惮役之人 皆不见省 自谓监军 委任如先 每旦诣台待罪 右卫将军 不能崇浚山海 皆见褒赠 御史中丞傅宣劾奏 驰车魏阙 乃惜寸阴 今天子播越 弘又与越书曰 徙奕为琅邪王 畅不以为虞 进鉴为司空 讽天子解道子扬州 长沙厉王乂 于是追赠本官 文度便欲 去 殿中中郎王春等继至 太仆缪胤 知而不行 始奉讳 字世容 故唐虞密皇人之网 元显回入宣阳门 及惠帝幸长安 此又非所资也 领扬州刺史 相去三百许里 时关中有巴蜀之众 假言平为允兵所害 因攻诵垒 问计于道子 所向辄克 士容甒 祸难罔已 篡逼帝王 以洛下将乱 领宣城内史 当为公 以示不 贰 导上疏逊位 时元帝为琅邪王 有名吴朝 戮力致命之秋也 及宫车晏驾 范睢 威慑氐羌 封梁邹侯 长沙厉王乂 秦州刺史皇甫重使讨颙 虑致祸乱 敞 武官有爵必谥 廞去职 假节 颖将讨长沙王乂 范逵子珧为湘东太守 皆诣司隶 时年六十五 乃止 持节 又奏钱凤母年八十 政令反覆 帝崩 人散久矣 史臣曰 写中诏呈侃 帝并召用 城内大惧 以舆为征虏将军 牙为道子开东第 俄而遣邓岳 袭爵即丘子 司空掾 为珣兄弟讲《毗昙经》 骑督敬琰赴救 彼既不吞声 乂所任
第8讲 镁、铝及其化合物

报 (H-除外):_r_(_H_+__)<_r_(_M__g_2+__)<__r(_N_3_-_)_<_r_(_C_l_-_)_____,Mg在元素
作 业
报
_A_lO__2-_+__C__O_2_+__2_H_2_O_=__=_=_A_l_(O__H__)3_↓__+__H_C__O_- 3___________。
告
二
③NaAlO2 溶液与 AlCl3 溶液混合:
_3_A_lO__2-_+__A__l3_+_+__6_H_2_O_=__=_=_4_A_l_(O__H__)3_↓_________________。
可用于焊接金属、冶炼高熔点贵重金属
第2部分 第3章 第8讲
第7页
名师伴你行 ·高考一轮总复习 ·化学
报 告
(4)铝的工业制备
通电
一
电解熔融Al2O3:__2_A__l2_O__3(_熔__融__)_冰=_=_晶=_=_石=__4_A_l_+__3_O_2_↑_______
课 时
(5)铝的用途
作 业
报 告
3.(2016浙江理综)化合物Mg5Al3(OH)19(H2O)4可作环保型
一 阻燃材料,受热时按如下化学方程式分解:
课
时
△ 2Mg5Al3(OH)19(H2O)4=====27H2O↑+10MgO+3Al2O3
作 业
报
(1)写出该化合物作阻燃剂的两条依据__反__应__分__解__吸__热__降__低__
告
二 _温__度__,__固__体__氧__化__物__隔__绝__空__气__,__水__蒸__气__稀__释__空__气_______。
第2部分 第3章 第8讲
Na Mg Al知识点

1△ 点燃钠、镁 铝及其化合物钠一、物理性质:钠是银白色的金属,质软,密度比水小,熔点低,是热和电的良导体。
在取用钠时,用刀刚切割的钠截面,能看到是银白色的,不过很快变暗,是因为被空气中O 2氧化所致。
二、化学性质:(金属钠参与反应中,钠失去电子,呈+1价,体现强还原性) 1、在常温下4Na +O 22Na 2O(白色) 2、在点燃条件下:2Na +O 2Na 2O 2(淡黄色);火焰颜色为黄色。
3、与Cl 2反应:2Na 十Cl 22NaCl ;先在空气中点燃,再放入氯气中燃烧,出现黄色火焰。
4、钠与水反应:2Na +2H 2O 2NaOH +H 2↑实验现象:钠放入水中后,浮在水面上(密度比水小),立即与水剧烈反应,同时钠熔化成闪亮的银白色小球(熔点低),并迅速四处游动(反应生成气体推动其游动),发出咝咝的响声(生成H 2燃烧发出声音),最后逐渐消失,在反应后的溶液中滴入酚酞试液,溶液变成红色(反应生成有碱NaOH)。
可概括为如下五个字:浮、游、熔、响、红。
注意:①钠与盐溶液反应不能置换出金属单质,在盐溶液中它先与水反应。
如钠置放在CuSO 4溶液中发生反应:2Na +2H 2O 2NaOH -+H 2↑;2NaOH +CuSO 4Cu(OH)2↓+Na 2SO 4②钠与熔化状态下的盐反应,有实际意义的是冶炼稀有金属,如冶炼钛、锆、铌、钽等。
这些反应都是利用钠的强还原性。
③因为钠会与空气中的氧气、水蒸气反应,所以保存在煤油中,如果实验室中不小心钠着火,应采用干砂扑灭。
6、钠的用途:钠和钾合金常温下是液体,用于快中子反应堆作热交换剂。
高压钠灯发出黄光射程远,透雾能力强,用于道路和广场照明,冶炼一些稀有金属。
氧化钠(Na 2O )与过氧化钠(Na 2O 2)的性质一、物理性质:Na 2O 是白色固体,属碱性氧化物;Na 2O 2是淡黄色固体,属过氧化物。
Na 2O 2比Na 2O 稳定二、化学性质:①与水反应:Na 2O +H 2O 2NaOH ;2Na 2O 2+2H 2O 4NaOH +O 2↑ ②与CO 2反应:Na 2O +CO 2Na 2CO 3;2Na 2O 2+2CO 22Na 2CO 3+O 2 有关Na 2O 2与CO 2、H 2O 反应的重要关系(1)物质的量关系(2)气体体积关系(3)电子转移关系(4)固体质量关系 (5)先后顺序关系三、用途:Na 2O 一般用于制取NaOH ;2Na 2O 2常用于特殊情况下的供氧(与CO 2反应生成O 2),如呼吸面具及潜水艇上,还可作漂白剂漂白织物等,与HClO 的漂白原理相同氢氧化钠(NaOH ) 俗称(1)主要物理性质:白色固体,易吸收空气中的水分而潮解,易溶于水,并且放出大量的热量,有强腐蚀性。
镁、铝及其重要化合物

镁、铝及其重要化合物一、镁及其重要化合物的主要性质和应用 1.镁的性质(1)物理性质:具有□01银白色金属光泽的固体,密度、硬度均较□02小,熔点较□03低,有良好的□04导电性、□05导热性和□06延展性。
(2)化学性质①与非金属反应②与CO 2反应:□102Mg +CO 2=====点燃2MgO +C③与H 2O 反应:□11Mg +2H 2O=====煮沸Mg(OH)2+H 2↑④与H +反应:□12Mg +2H +===Mg 2++H 2↑ 2.从海水中提取镁的流程 (1)流程(2)主要化学反应 ①制石灰乳□13CaCO 3=====高温CaO +CO 2↑、□14CaO +H 2O===Ca(OH)2;②沉淀Mg 2+:□15Mg 2++Ca(OH)2===Mg(OH)2↓+Ca 2+; ③制备MgCl 2:□16Mg(OH)2+2HCl===MgCl 2+2H 2O ; ④电解MgCl 2:□17MgCl 2(熔融)=====电解Mg +Cl 2↑。
3.用途生产□18合金,冶金工业上用作□19还原剂和□20脱氧剂。
4.镁的重要化合物二、铝的性质及应用 1.铝的物理性质注:铝是地壳中含量最高的金属元素。
2.铝的化学性质写出图中标号反应的化学方程式或离子方程式:④□112Al +2OH -+2H 2O===2AlO -2+3H 2↑ ⑤□122Al +Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应)3.铝的制备及用途三、铝的重要化合物 1.氧化铝(1)物理性质:白色固体,难溶于水,有很高的熔点。
(2)化学性质2.氢氧化铝 (1)物理性质白色胶状不溶于水的固体,有较强的□01吸附性。
(2)化学性质(用化学方程式表示) Al(OH)3的电离方程式为②受热分解:□032Al(OH)3=====△Al 2O 3+3H 2O 。
(3)制备①向铝盐中加入氨水,离子方程式为 Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4。
钠镁铝及其化合物的化学方程式和离子方程式(定)
化学方程式和离子方程式钠及其化合物一、钠1、钠在氧气中燃烧:2Na+O 2Na2O22、钠在氯气中燃烧:2Na+Cl 22NaCl3、钠常温条件下和氧气反应:4Na+O 22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反应:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反应:2Na+2HCl2NaCl+H2↑2Na+2H +2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中加入少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反应:4Na+TiCl 44NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反应:Na2O+CO 2Na2CO33、氧化钠与盐酸反应:Na2O+2HCl2NaCl+H2ONa2O+2H +2Na++H2O4、向硫酸铜溶液中加入氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl 3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反应:2Na2O2+2CO 22Na2CO3+O2↑3、过氧化钠与盐酸反应:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H +4Na++2H2O+O2↑4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O===4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH -Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH -5Cl-+ClO3-+3H2O4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH -2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH+CO 2Na2CO3+H2O2OH-+CO 2CO32-+H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH+CO 2NaHCO3 OH-+CO 2HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO 2Na2SO3+H2O2OH-+SO 2SO32-+H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO 2NaHSO3 OH-+SO 2HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH -2PO43-+3H2O 12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH -NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO+NO2+2NaOH2NaNO2+H2ONO+NO2+2OH -2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO 2Na2SiO3+H2O2OH-+SiO 2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH Na2SO4+H2OSO3+2OH -SO42-+H2O16、盐酸和氢氧化钠溶液反应:HCl+NaOH NaCl+H2O H++OH -H2O 17、醋酸和氢氧化钠溶液反应:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH -CH3COO-+H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH -S2-+2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH -HS-+H2O20、硫酸和氢氧化钠溶液反应:H2SO4+2NaOH Na2SO4+2H2OH++OH -H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH -PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH -AlO2-+2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH -AgOH ↓24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH -Cu(OH)2↓25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH -Fe(OH)3↓26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH -Al(OH)3↓27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2OAl3++4OH -AlO2-+2H2O28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH -NH3↑+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH -NH3↑+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH -CO32-+NH3↑+2H2O 31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH -CaCO3↓+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2O Ca2++2HCO3-+2OH -CaCO3+CO32-+2H2O 34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH -Mg(OH)2↓35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2O Mg2++2HCO32-+4OH -Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO 3AgCl↓+NaNO3Cl-+Ag +AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO 4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2CO3+Ca(OH)2CaCO3↓+2NaOHCO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl 2BaCO3↓+2NaClCO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H +HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H +CO2↑+H2O6、碳酸钠溶液中加入醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2O CO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O===2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O===2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H +CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2O HCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl 3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl 3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH -CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH -CaCO3↓+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH -CaCO3↓+CO32-+2H2O 9、碳酸氢钠受热分解:2NaHCO 3Na2CO3+CO2↑+H2O镁及其化合物一、镁1、镁在氧气中燃烧:2Mg+O 22MgO2、镁在氯气中燃烧:Mg+Cl 2MgCl23、镁在氮气中燃烧:3Mg+N 2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO 22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反应:Mg+2HCl MgCl2+H2↑Mg+2H +Mg2++H2↑8、镁和醋酸反应:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反应:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl 32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl 33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反应:Mg+CuSO 4MgSO4+CuMg+Cu2+Mg2++Cu 13、镁和浓硫酸反应:Mg+2H2SO 4MgSO4+SO2↑+2H2O14、镁和浓硝酸反应:Mg+4HNO 3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反应:3Mg+8HNO 33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反应:MgO+2HCl MgCl2+H2OMgO+2H +Mg2++H2O2、氧化镁和醋酸反应:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O 4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H +Mg2++2H2O2、氢氧化镁和醋酸反应:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl 33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2+2AgNO 32AgCl ↓+Mg(NO3)2Cl-+Ag +AgCl ↓2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH -Mg(OH)2↓3、氯化镁溶液加入氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O==Mg(OH)2↓+2Al(OH)3↓+2NaCl Mg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl 2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反应:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2O MgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O 3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁加入氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO 3-+4OH-===Mg(OH)2↓+2CO32-+2H2O 4、碳酸氢镁与澄清石灰水反应:Mg(HCO 3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2O Mg2++2HCO 3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO 2↑+H2O 铝及其化合物一、铝1、铝在氧气中燃烧:4Al+3O 22Al2O32、铝在氯气中燃烧:2Al+3Cl 22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反应:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H +2Al3++3H2↑5、铝和氢氧化钠溶液反应:2Al+2NaOH +2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O8、铝和稀硝酸反应:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反应:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反应:Al2O3+3H2SO 4Al2(SO4)3+3H2OAl2O3+6H +2Al3++3H2O2、氧化铝与氢氧化钠溶液反应:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH -2AlO2-+H2O3、电解氧化铝的熔融液:2Al2O 34Al+3O2↑三、氢氧化铝1、氢氧化铝与稀硫酸反应:2Al(OH)3+3H2SO4Al2(SO4)3+6H2OAl(OH)3+3H+Al3++3H2O2、氢氧化铝与氢氧化钠溶液反应:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O3、加热氢氧化铝:2Al(OH)3Al2O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al2(SO4)3+3BaCl22AlCl3+3BaSO4↓SO42-+Ba2+BaSO4↓2、硫酸铝的水溶液呈酸性:Al2(SO4)3+6H2O2Al(OH)3+3H2SO4Al3++3H2O Al(OH)3+3H+3、硫酸铝溶液中加入少量的氢氧化钠溶液:Al2(SO4)3+6NaOH3Na2SO4+2Al(OH)3↓Al3++3OH-Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH2NaAlO2+3Na2SO4+4H2OAl3++4OH-AlO2-+2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:Al2(SO4)3+3Ba(OH)22Al(OH)3↓+3BaSO4↓2Al3++3SO42-+3Ba2++6OH-2Al(OH)3↓+3BaSO4↓6、向硫酸铝溶液中加入足量的氢氧化钡溶液:Al2(SO4)3+4Ba(OH)2Ba(AlO2)2+3BaSO4↓+4H2O2Al3++3SO42-+3Ba2++8OH-==2AlO2-+3BaSO4↓+4H2O 7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2+2KAl(SO4)22Al(OH)3↓+3BaSO4↓+K2SO4 3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中加入足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-===AlO2-+2BaSO4↓+2H2O 9、向硫酸铝溶液中加入氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O==2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中加入碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中加入硫化钠溶液:Al2(SO4)3+3Na2S+6H2O==2Al(OH)3↓+3Na2SO4+3H2S↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O==2Al(OH)3↓+3Na2SO4+6H2S↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O==2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-冰晶石电解2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+FeCl3+6H2O===3Al(OH)3↓+Fe(OH)3↓+3NaCl 3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
镁及其化合物的所有化学方程式
镁及其化合物的所有化学方程式镁,这位“化学世界中的小健将”,可真是不简单。
你可能觉得,镁这家伙只是个普通的小金属,怎么会那么重要呢?别小看它,镁可是我们的好帮手,既在日常生活中默默无闻地工作,又在实验室里大显身手呢!今天,我们就来聊聊镁以及它的一些化学方程式,搞清楚它是如何在各种化学反应中踊跃地“上场”的。
1. 镁的基本特性1.1 镁的基本信息镁(Mg)是周期表中第十二位的小伙子,大家可以把它当成是铝的“兄弟”。
它既不吵闹,又不显眼,平时在空气中看不到它的踪影,但它的表现却绝对不容忽视。
镁是一种银白色的金属,质轻且柔软,不容易被氧化。
通常,它和氧气一接触就会形成一层保护膜,防止进一步的氧化。
1.2 镁在空气中的反应要是你把镁片放在空气中,它可是会有点小脾气的。
镁在空气中遇到氧气时,会产生镁氧化物。
咱们用一个简单的方程式来表达这个过程吧:2Mg + O2 → 2MgO你看,这方程式是不是很简洁明了?镁在这个反应中就像是一个体力劳动者,辛辛苦苦地把氧气和镁结合在一起,形成了镁氧化物。
镁氧化物是一种白色的固体,通常被用在炉料和建筑材料中。
2. 镁的化合物2.1 镁氯化物镁还喜欢和氯发生反应,形成镁氯化物。
这种反应其实挺有趣的,镁和氯的结合产生了一个很常见的化合物——氯化镁。
方程式长这样:Mg + 2HCl → MgCl2 + H2 。
看到了吗?镁和盐酸(HCl)碰撞后,镁氯化物(MgCl2)就出来了,还有氢气(H2)冒出来。
这个反应很常见,氢气就像是那个在派对上跳舞的家伙,欢快得很。
2.2 镁硫化物镁还可以和硫反应,形成镁硫化物。
这一反应也不复杂,镁和硫反应生成的就是硫化镁。
方程式是这样的:Mg + S → MgS在这个反应里,镁和硫就像是一对最佳拍档,合作无间,最终合成了硫化镁。
硫化镁是一种用在农业中的肥料,能够让植物长得更好。
3. 镁的其他反应3.1 镁与水的反应镁在水中的表现也不赖。
虽然镁在水中的反应比钠要温和一点,但它也能和水反应,生成氢气和镁氢氧化物。
人教版高中化学必修1第二讲铝、镁及其重要化合物(含答案)
第二讲 铝、镁及其重要化合物[2020备考·最新考纲]1.掌握铝的主要性质及其应用。
2.掌握铝的重要化合物的主要性质及其应用。
镁的性质Mg 是较活泼的金属,常温下能被空气中的O 2氧化,表面生成一层致密的氧化膜。
镁在纯氧中剧烈燃烧,发出耀眼的白光。
镁不易和冷水反应,但能与沸水迅速反应。
铝的物理性质注意:铝是地壳中元素含量最高的金属元素。
掌握铝的化学性质与用途(1)铝的化学性质图中标号反应的化学方程式或离子方程式:②2Al +3Cl 2=====△2AlCl 3④2Al +2OH -+2H 2O===2AlO -2+3H 2↑⑤2Al +Fe 2O 3=====高温2Fe +Al 2O 3(铝热反应)(2)铝的制备及用途氧化铝氢氧化铝(1)物理性质白色胶状固体,不溶于水,有较强的吸附性。
(2)化学性质①Al(OH)3的电离②两性氢氧化物注意:Al(OH)3不溶于弱酸(如H 2CO 3),也不溶于弱碱(如氨水)。
③受热分解:2Al(OH)3=====△Al 2O 3+3H 2O 。
(3)制备Al(OH)3的三种方法方法一:可溶性铝盐溶液与过量氨水反应离子方程式:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4。
方法二:向可溶性偏铝酸盐溶液中通入过量CO 2离子方程式:AlO -2+2H 2O +CO 2===Al(OH)3↓+HCO -3。
方法三:相互促进水解法常见的铝盐(1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。
(2)明矾的化学式为KAl(SO 4)2·12H 2O ,它是无色晶体,可溶于水,水溶液pH <7(填“<”“>”或“=”)。
明矾可以净水,其净水的原理是:Al 3++3H 2OAl(OH)3(胶体)+3H +,Al(OH)3胶体吸附水中杂质形成沉淀而净水。
(3)明矾溶液与Ba(OH)2溶液反应的离子方程式①Al3+恰好完全沉淀:2Al3++3SO2-4+3Ba2++6OH-===2Al(OH)3↓+3BaSO4↓。
主族金属-镁铝及其化合物(解析版)
系列二 主族金属专题8 镁铝及其化合物一、镁单质(1)镁在自然界没有单质存在,存在于各类硅酸盐和碳酸盐矿物里,如菱镁矿(MgCO 3)、白云石(CaCO 3·MgCO 3)、光卤石(KCl·MgCl 2·6H 2O)等。
海水中的镁是提取镁的主要来源,海水中的镁即使提取100万年也不会减少0.01%。
镁也是叶绿素的主要成分,在人体内镁以磷酸盐、碳酸盐的形式分布于骨头和肌肉中,缺乏会引起肌肉的颤动、脉象的混乱。
(2)强还原性:不论在固态或水溶液中都表现出强还原性,常用作还原剂。
高温下,镁夺取氧的能力特别强,甚至能在二氧化碳里燃烧,如2Mg+CO 2=====点燃2MgO+C ;也能够还原二氧化硅,2Mg+SiO 2=====点燃2MgO+Si ;常温下,由于镁表面的氧化膜导致镁不与水反应,但是加热下可以反应,Mg+2H 2O ====△Mg(OH)2+H 2↑。
(3)镁可以与大多数非金属和几乎所有的酸反应。
如2Mg+O 2=====点燃2MgO ,Mg+Cl 2=====点燃MgCl 2,Mg+S =====点燃MgS ,3Mg+N 2=====点燃Mg 3N 2(Mg 3N 2的特殊性质:Mg 3N 2+6H 2O =====3Mg (OH )2↓+2NH 3↑,导致其只能干态制取)。
镁不能和氢氟酸反应,因为MgF 2难溶会阻碍继续反应。
(4)格氏试剂:在醚的溶液中,镁能与卤代烃作用生成在有机化学中应用广泛的格氏试剂:Mg + RX =====醚RMgX(5)制取单质镁:一般是先从海水中得到氯化镁,然后电解熔融的氯化镁,MgCl 2(熔融) =====电解Mg+Cl 2↑。
二、镁的化合物(1)MgO 俗称菱苦土,是一种白色粉末。
MgO 对水呈一定惰性,特别是高温火烧后的MgO 难溶于水。
煆烧温度在923K 左右制成轻质MgO ,煆烧温度在1923K 以上制成重质MgO 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
雾
2AlCl3
6 铝粉与硫粉隔 2Al+3S 绝空气加热生 Al2S3 成白色固体
7 铝与盐酸反应 2Al+6HCl===2AlCl3+3H2↑
8 铝与氢氧化钠 2Al+2NaOH+2H2O==2NaAlO2 +3H2↑ 溶液反应
9 铝与氧化铁发 2Al + Fe 2O3
生铝热反应 (放出大量
Al2O3+2 Fe
18 氯化铝与过量 AlCl3+4NaOH===NaAlO2+3NaCl+2H2O 氢氧化钠反应
19 偏铝酸钠与少 NaAlO2+HCl+H2O =NaCl+Al(OH)3↓ 量盐酸反应
20 偏铝酸钠与过 NaAlO2+4HCl=NaCl+AlCl3+2H2O 量盐酸反应
21 偏铝酸钠与少 CO2+2NaAlO2+3H2O=2Al(OH)3↓+Na2CO3 量二氧化碳反 应
热)
10 电解熔融氧化 2Al2O3 铝冶炼金属铝
4Al+ 3O2↑
11 氧化铝与盐酸 Al2O3 + 6HCl==2AlCl3+ 3H2O 反应
12 氧化铝与氢氧 Al2O3 + 2NaOH==2NaAlO2 + H2O 化钠反应
离子方程式
13 氢氧化铝与盐 Al(OH)3 + 3HCl==AlCl3 + 3H2O 酸反应
方程式
1 镁在氧气中燃 2Mg+O2
烧生成白色固
体
2MgO
2 镁在氮气中燃 3Mg+N2
烧生成白色固
体
Mg3N2
3 镁在二氧化碳中燃 2Mg +CO2
烧生成黑色和白色
固体
2MgO+C
4 铝与在氧气中 4Al + 3O2 ===2Al2O3 形成致密氧化 膜
5 铝在氯气中燃 2Al+3Cl2
烧生成白色烟
22 偏铝酸钠与过 CO2+NaAlO2+2H2O=Al(OH)3↓+NaHCO3 量二氧化碳反 应
14 氢氧化铝与氢 Al(OH)3 + NaOH==NaAlO2 + 2H2O 氧化钠反应
15 氢氧化铝受热 2Al(OH)3
分解
Al2O3 &+ 3NH3·H2O=Al(OH)3↓+3NH4Cl 浓氨水反应
17 氯化铝与少量 AlCl3+3NaOH===Al(OH)3↓+3NaCl 氢氧化钠反应
