高三预科讲义- 第9讲 氮族
高三化学非金属及其化合物(二)——氮族元素和碳族元素知识精讲
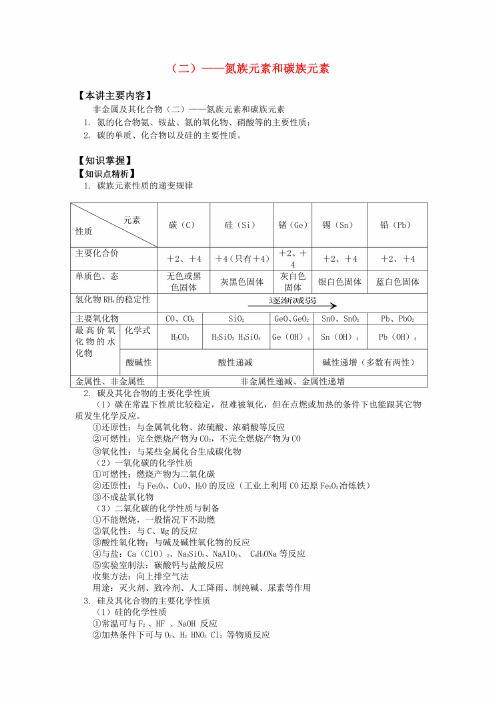
(二)氮族元素和碳族元素【本讲主要内容】非金属及其化合物(二)----氮族元素和碳族元素1. 氮的化合物氨、铉盐、氮的氧化物、硝酸等的主要性质;2. 碳的单质、化合物以及硅的主要性质。
【知识掌握】【知识点精析】1.碳族元素性质的递变规律2.碳及其化合物的主要化学性质(1)碳在常温下性质比较稳定,很难被氧化,但在点燃或加热的条件下也能跟其它物\ -素兀素性质碳(C)硅(Si)错(Ge)锡(Sn)铅(Pb)主要化合价+ 2、+4+ 4(只有+4)+ 2、+4+ 2、+4+ 2、+4单质色、态无色或黑 色固体灰黑色固体灰白色 固体银白色固体蓝白色固体氢化物rh 4的稳定性逐渐减弱 ,主要氧化物CO 、CO2SiO 2GeO> GeO2SnO> S11O2Pb 、 PbO 2最高价氧 化物的水 化物化学式H2CO3H2SM3 H4S1O4Ge (OH) 4Sn (OH) 4Pb (OH) 4酸碱性酸性递减碱性递增(多数有两性)金属性、非金属性非金属性递减、金属性递增质发生化学反应。
① 还原性:与金属氧化物、浓硫酸、浓硝酸等反应② 可燃性:完全燃烧产物为CO?,不完全燃烧产物为CO③ 氧化性:与某些金属化合生成碳化物(2) 一氧化碳的化学性质① 可燃性:燃烧产物为二氧化碳② 还原性:与Fe 304> CuO 、压0的反应(工业上利用CO 还原Fe2()3冶炼铁)③ 不成盐氧化物(3) 二氧化碳的化学性质与制备① 不能燃烧,一般情况下不助燃② 氧化性:与C 、Mg 的反应③ 酸性氧化物:与碱及碱性氧化物的反应④ 与盐:Ca (CIO ) 2、Na 2SiO 3> NaAlO?、C 6H 50Na 等反应⑤ 实验室制法:碳酸钙与盐酸反应收集方法:向上排空气法用途:灭火剂、致冷剂、人工降雨、制纯碱、尿素等作用3.硅及其化合物的主要化学性质(1)硅的化学性质① 常温可与Fz 、HF 、NaOH 反应② 加热条件下可与。
《氮族元素》PPT课件 (2)

16-2-2 氮的氢化物
氨是最重要的氮肥,是产量最大的化工产品之一 一、氨
制备
773K, 30~70MPa
N2+H2
Fe触媒
NH3
工业制法 哈伯法
哈伯获得1918年诺贝尔化学奖
《氮族元素》PPT课件 (2)
16-1、元素的基本性质
性质
原子序数
原子量
共价半径/pm 离子 M3半径 M3+ /pm M5+
第一电离势
(KJ/mol) 第一电子亲和
势(KJ/mol) 电负性
N 7 14.01 70 171 16 13
1402
-7
3.04
P 15 30.97 110 212 44 35
△
(火山爆发) (NH4)2Cr2O7
N2 ↑+ Cr2O3+4H2O
(除N2中的NH3) 2NH3+3CuO △ 3Cu+N2↑+3H2O
8NH3+3Br2(aq)△ N2↑+6NH4Br
2NaN3
△ 3N2 ↑+2Na(l)
极纯的 N2
工业制法:分馏空气。
性质
物理 性质
ห้องสมุดไป่ตู้
无色、无味的气体,难溶于水, 熔点:63K, 沸点:77K,较低, 临界温度126K,因此难 液化,只有在加压和极低温度下才能得到 液氮,作致冷剂,呈惰性.
的稀溶液均呈淡蓝色,因含有”氨合电子“,所以有顺 磁性、导电性和强还原性。
2、化学性 质
还原性
3Cl2+2NH3
N2↑+6HCl 检验Cl2管道是否漏气
高考化学专题复习精品课件 第8章 氮族元素本章小结

6~10 16
17
18
19
20
h
11
高考真题体验
1~3
4
5
名师高考预测
1~5 11~15
6~10 16
17
18
19
20
h
12
高考真题体验
1~3
4
5
名师高考预测
1~5 11~15
6~10 16
17
18
19
20
h
13
高考真题体验
1~3
4
5
名师高考预测
1~5 11~15
6~10 16
17
18
19
20
h
24
高考真题体验
1~3
4
5
名师高考预测
1~5 11~15
6~10 16
17
18
19
20
h
25
高考真题体验
1~3
4
5
名师高考预测
1~5 11~15
6~10 16
17
18
19
20
h
26
高考真题体验
1~3
4
5
名师高考预测
1~5 11~15
6~10 16
17
18
19
20
h
27
高考真题体验
1~3
4
5
6~10 16
17
18
19
20
h
4
高考真题体验
1~3
4
5
名师高考预测
1~5 11~15
6~10 16
17
18
19
20
h
盘点高考化学一轮复习氮族元素知识点

盘点高考化学一轮复习氮族元素知识点(学习版)编制人:__________________审核人:__________________审批人:__________________编制学校:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的学习资料,如英语资料、语文资料、数学资料、物理资料、化学资料、生物资料、地理资料、历史资料、政治资料、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides various types of learning materials for everyone, such as English materials, language materials, mathematics materials, physical materials, chemical materials, biological materials, geographic materials, historical materials, political materials, other materials, etc. Please pay attention to the data format and writing method!盘点高考化学一轮复习氮族元素知识点--> 2022高考各科复习资料语文数学英语政治历史地理化学物理生物2022年高三开学已经有一段时间了,高三的同学们是不是已经投入了紧张的高考一轮复习中,本店铺从高三开学季开始为大家系列准备了2022年高考复习,2022年高考一轮复习,2022年高考二轮复习,2022年高考三轮复习都将持续系统的为大家推出。
第三章氮族

2019/11/3
20
金属液氨溶液:导电(似金属) K + x NH3(l) = K+ + [e(NH3)x]稀溶液蓝色,浓溶液青铜色
金属液氨溶液,高浓度时是强的还原剂:
2NH 3 2Na 570C 2NaNH 2 H2 Na + xNH3 = Na+ + e (NH3)x碱金属的液氨溶液是产生电子的试剂:
(4) 还原性 N2H4 + AgBr → 4 Ag↓ + N2 ↑ + 4 HBr N2H4(l) + O2(g) = N2(g) + 2 H2O(l)
Lewis碱性 强
弱
2019/11/3
15
还原性
酸性介质 φ(N2/NH4+) = 0.27V φ(P/PH4+) = -0.03V φ(As/AsH4+)= - 0.54V φ(Sb/SbH4+) = -0.51V
碱性介质 φ(N2/NH3) = -0.73V φ(P/PH3) = -0.87V φ(As/AsH3)= - 1.43V φ(Sb/SbH3) = -1.34V 还原性:AsH3 > SbH3 >PH3 >NH3
2019/11/3
3
二、氮和磷的成键情况
元素 价轨道
C.N.max 杂化态
N 2s 2p
4 sp sp2 sp3
P 3s 3p 3d
6 sp3 sp3d sp3d2
键离解能 N
P
C (比较)
/ kJ.mol-1
E-E 160
209
346
E=E 400
氮族元素完整版

三、氨
1.氨分子的结构
键角:109°48’
思考:氨分子 为极性还非极 性分子? 极性分子,因 为分子内正负 电荷中心不重 合,偏移。
三角锥形 正四面体
2.氨气的物理性质
氨气是无色、有剌激性气味的气体,比空气轻,极易 溶于水和易液化。
※常见气体的溶解性:
NH3 HCl SO2 H2S Cl2 CO2 700 500 40 2.6 2 1
单 质 氧 化 性 减 弱
最 高 价 氧 化 物 对 应 水 化 物 的 酸 性 减 弱
氢 化 物 的 稳 定 性 减 弱
3、化学性质的具体表现
(1)最高价氧化物所对应的水化物的酸性 HNO3 > H3PO4 > H3AsO4 (2)气态氢化物的稳定性 NH3 > PH3 > AsH3
4、单质的性质:
一氧化氮、二氧化氮的反应
氮氧化物溶于水的有关计算
(1)NO2溶于水:
3NO2+H2O=2HNO3+NO
(2)NO2、O2的混合气体溶于水:
4NO2+O2+2H2O=4HNO3
(3)NO、O2的混合气体溶于水:
4NO+3O2+2H2O=4HNO3
(4)NO2、NO、O2的混合气体溶于水:
分子:NH3、H2O、NH3· 2O H 离子:NH4+、OH-、H+
◆氨水中的粒子
◆学会比较
物质分类 构成微粒 主要性质 存在条件
分子: H2O 、NH3 、NH3· 2O H
离子: NH4+、OH- 、H+
液氨 氨水
(既不是电解质也
纯净物 (非电解质) 混合物 不是非电解质)
NH3分子 不具有碱性 常温常压下 不能存在 (致冷剂) NH3 H2O NH3·2O H NH4+ OH- H+ 具有弱碱性 常温常压下 可存在
高三化学知识点规律大全(7)《氮族元素》
质对市爱慕阳光实验学校高中化学知识点规律大全——氮族元素1.氮和磷[氮族元素] 包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第VA族,其代表元素为氮和磷.[氮族元素的原子结构](1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价;锑、铋有+3、+5价.(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属.[氮族元素单质的物理性质]N2 P As Sb Bi颜色无色白磷:白色或黄色红磷:红棕色灰砷:灰色银白色银白色或微显状态气体固体固体固体固体密度逐渐增大熔点、沸点先按N2、P、As的顺序逐渐升高,而后按Sb、Bi的顺序逐渐降低[氮气](1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N2 78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯洁的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体.(3)氮气的分子结构:氮分子(N2)的电子式为,结构式为N≡N.由于N2分子中的N≡N键很牢固,所以通常情况下,氮气的化学性质稳、不活泼.(4)氮气的化学性质:①N2与H2化合生成NH3 N2 +3H22NH3说明该反是一个可逆反,是工业合成氨的原理.②N2与O2化合生成NO: N2 + O22NO说明在闪电或行驶的引擎中会发生以上反.(5)氮气的用途:①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化;⑧在灯泡中填充氮气以防止钨丝被氧化或挥发;④保存粮食、水果食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术;⑥利用液氮制造低温环境,使某些超导材料获得超导性能.[NO、NO2性质的比拟]氮的氧化物一氧化氮(NO) 二氧化氮(NO2)物理性质为无色、不溶于水、有毒的气体为红棕色、有刺激性气味、有毒的气体,易溶于水化学性质①极易被空气中的O2氧化:2NO + O2= 2NO2②NO中的氮为+2价,处于中间价态,既有氧化性又有复原性与H2O反:3NO2 + H2O=2HNO3 + NO(工业制HNO3原理.在此反中,NO2同时作氧化剂和复原剂)[自然界中硝酸盐的形成过程](1)电闪雷鸣时:N2+O22NO(2) 2NO + O2= 2NO2(3)下雨时:3NO2 + H2O=2HNO3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.[光化学烟雾] NO、NO2有毒,是大气的污染物.空气中的NO、NO2污染物主要来自于产品和煤燃烧的产物、尾气以及制硝酸工厂的废气.NO2在紫外线照射下,发生一光化学反,产生一种有毒的烟雾——光化学烟雾.因此,NO2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡.[磷](1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷.(2)单质磷的化学性质:①与O2反: 4P+5O22P2O5②磷在C12中燃烧: 2P+3C12(缺乏量) 2PCl3 2P+5Cl2(足量)2PCl5[磷的同素异形体——白磷与红磷]磷的同素异形体白磷红磷说明物理性质颜色、状态无色蜡状固体红棕色粉末①白磷与红磷的结构不同是物理性质存在差异的原因②由两者物理性质的不同,证明了白磷与红磷是不同的单质密度(g·cm-3)2 4溶解性不溶于水,溶于CS2 不溶于水,也不溶于CS2毒性剧毒无毒着火点40℃(白磷受到轻微的摩擦就会燃烧;常温时,白磷可被氧化而发光)240℃化学性质白磷、红磷在空气中燃烧,都生成白色的P2O5白磷与红磷燃烧都生成P2O5,证明它们都是由磷元素形成的单质相互转化白磷红磷证明白磷与红磷所含元素相同——互为同素异形体保存方法密封保存,少量白磷保存在水中密封保存,防止吸湿切削白磷在水中进行用途制造高纯度磷酸;制造燃烧弹、烟幕弹制造高纯度磷酸;制农药、平安火柴[五氧化二磷、磷酸](1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的枯燥剂).P2O5是酸性氧化物,与水反:P2O5+3H2O2H3PO4(2)磷酸的性质、用途:磷酸(H3PO4)是一种中强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织工业.[氮、磷元素及其单质、化合物性质的比拟]元素氮(N) 磷(P)自然界中存在的形式游离态和化合态只有化合态单质与O2化合的情况N2+O22NO〔易〕4P+5O22P2O5〔难〕单质与H2化合的情况N2 +3H22NH32P(蒸汽) + 3H22PH3单质的化学活泼性及原因单质活泼性:N2<P原因:N2分子中N≡N键很牢固,故N2性质稳、不活泼氢化物的稳性NH3>PH3最高价氧化物对水化物的酸性HNO3>H3PO4 非金属性N>P2.铵盐[氨](1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉);④氨对人的眼、鼻、喉粘膜有刺激作用.假设不慎接触过多的氨而出现病症,要及时吸入鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH3的电子式为,结构式为,氨分子的结构为三角锥形,N原子位于锥顶,三个H原子位于锥底,键角107°18′,是极性分子.(3)氨的化学性质:①跟水反.氨气溶于水时(氨气的水溶液叫氨水),大的NH3分子与H2O分子结合成NH3·H2O(叫一水合氨).NH3·H2O为弱电解质,只能电离成NH4+和OH -:NH3 + H2O NH3·H2O NH4+ + OH-a.氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅,使石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH3·H2O不稳,故加热氨水时有氨气逸出:NH4++ OH-NH3↑+ H2Ob.氨水的组成:氨水是混合物(液氨是纯洁物),其中含有3种分子(NH3、NH3·H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).c.氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d.有关氨水浓度的计算:氨水虽然大以NH3·H2O形式存在,但计算时仍以NH3作溶质.②跟氯化氢气体的反:NH3 + HCl = NH4C1说明 a.当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH3与盐酸挥发出来的HCl化合生成的NH4C1晶体小颗粒.b.氨气与挥发性酸(浓盐酸、浓硝酸)相遇,因反生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c.氨气与不挥发性酸(如H2SO4、H3PO4)反时,无白烟生成.③跟氧气反: 4NH3 + 5O2 4NO + 6H2O说明这一反叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反原理之一.(4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素的常用原料;③用作冰机中的致冷剂.[铵盐]铵盐是由铵离子(NH4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水.(1)铵盐的化学性质:①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对的酸的性质的不同,铵盐分解时有以下三种情况:a.组成铵盐的酸根阴离子对的酸是非氧化性的挥发性酸时,那么加热时酸与氨气同时挥发,冷却时又重合生成铵盐。
高考第一轮复习氮族元素
高考第一轮复习氮族元素高考第一轮复习——氮族元素第三节硝酸一.复习目标1.硝酸的性质:强氧化性,挥发性和不稳定性,强酸性2.硝酸的工业制备3.有关计算二.基本知识1.硝酸化学性质:①强酸性:稀硝酸+石蕊试液先变红后褪色a.硝酸浓度越大越易分解,致使浓硝酸呈黄色;②不稳定性:注意 b.区别浓硝酸与浓盐酸呈黄色的不同原因; c.硝酸挥发性和不稳定性的区别HNO3a.大多数金属(除Au.Pt外)+ HNO3(无论浓稀)=高价态金属硝酸盐+氮氧化合物_b.常温下使Fe.Al钝化;③强氧化性c.与非金属(S.C.P等)反应d.与其他还原性物质反应:H2S.FeS.SO2.Na2SO3.KI.HBr.HI e.王水:V(浓HNO3)∶V(浓HCl)=1∶3_金属与硝酸反应的一般规律:(硝酸既做氧化剂,又做酸)NO2(浓HNO3)氢以后的金属+ HNO3 = 硝酸盐+NO(稀HNO3)硝酸NO2(浓HNO3)NO(稀HNO3)活泼金属(氢以前)+ HNO3 = 硝酸盐+ NH4 NO3(极稀HNO3) H2(极稀HNO3)稀硝酸与变价金属铁反应的情况(产物与量有关):3Fe+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2OFe+4HNO3(稀)= Fe(NO3)3+NO↑+2H2On(Fe):n(HNO3)≥3:8时产物为Fe2+n(Fe):n(HNO3)≤2:8时产物为2:8_lt;n(Fe):n(HNO3)_lt;3:8时产物为Fe2+与Fe3+;2.硝酸的工业制备:原理:4NH3+5O24NO+6H2O;2NO+ O2= 2NO2;3NO2+ H2O=2 HNO3 +NO尾气吸收:NO2和NO NO2+NO+2NaOH=2NaNO2+H2O消除对大气的污染当V(NO2)∶V(NO)≥1∶1时,尾气可全部被吸收;当NO过量时,应先补充适量的O2;三.题型与变式硝酸的性质1.计算(1)电子守恒法确定还原产物1.某单质跟浓硝酸反应时,每有0.25mol单质反应就消耗1molHNO3,则单质元素氧化后的化合价可能是( )A.+1B.+2C.+3D.+42.某金属单质跟一定浓度的HNO3反应,假定只有单一还原产物,当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是( )A.NO2B.NOC.N2OD.N2(2)不活泼金属与HNO3.H2SO4混酸反应的分析与计算1.在某100mL混合液中,HNO3和H2SO4的物质的量浓度分别为0.4mol/L和0.1mol/L.向该混合液中加入1.92gCu粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度(mol/L)是( )A.0.15B.0.225C.0.35D.0.452.在某稀溶液中含有1molKNO3和4mol H2SO4,向其中加入1.5mol Cu粉,充分反应后产生的气体在标准状况下的体积为( )A.11.2LB.22.4LC.33.6LD.22.4L_33.6L之间(3)Cu和浓HNO3反应的计算1.38.4mgCu与适量浓HNO3反应,Cu全部作用后,共收集到22.4mL(标况)气体,反应消耗HNO3的物质的量可能是( )A.1.0_10—3 mol B.1.6_10—3 mol C.2.2_10—3 mol D.2.4_10—3 mol问:气体的平均摩尔质量为g/mol?NO3—减少的物质的量为 mol?H+减少的物质的量为mol?2.0.03molCu完全溶于HNO3,产生氮的氧化物(NO.NO2.N2O4)混合气体共0.05mol,求混合气体的平均摩尔质量( )A.30B.46C.50D.663.25.6mgCu能恰好与含1.4_10—3 molHNO3的浓硝酸完全反应,使生成的气体溶于水,最终得到的气体在标况下的体积为L4.将agCu投入一定浓度的硝酸溶液中,反应中消耗HNO3为bg,若a:b=8:21,则反应中起酸作用的HNO3质量为( )A.b/2gB.2bgC.3a/4gD.3b/4g(_年高考天津卷29)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L.请回答:⑴NO的体积为5.8L,NO2的体积为5.4L.⑵待产生的气体全部释放后,向溶液中加入VmLamol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为(aV__8226;10—3+0.5)/0.14mol/L.⑶欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水57.8g.(4)Fe与稀HNO3反应的分析与计算1.将8.4gFe溶于一定量稀硝酸中,完全反应后,n(Fe2+)=n(Fe3+),则稀硝酸中含HNO3( )A.0.125mol B.0.25molC.0.375mol D.0.5mol2.铁在热的稀硝酸中反应,其主要还原产物为N2O,而在冷的稀硝酸中反应,其主要还原产物为NO,当溶液更稀时,其主要还原产物是NH4+.请分析下图,回答有关问题:(5)硝酸工业制备中的多步计算1.氨氧化制硝酸时,如果由氨制成NO的产率96%,由NO制成硝酸的产率是93%.10t 氨可制备多少吨50%的硝酸?(答案:65.46吨)2.如果化肥厂用NH3制NH4NO3,已知由氨制成NO的产率96%,由NO制成硝酸的产率是92%,利用反应NH3+HNO3=NH4NO3.则制HNO3所用去的NH3质量占总消耗NH3的质量分数为53.1%3.某化肥厂用NH3制HNO3再进一步制NH4NO3.已知:由NH3制HNO3的产率88%; 由NH3与HNO3反应制NH4NO3时的产率为98%;若用100tNH3制NH4NO3时,用于制HNO3的氨为53.2 t,可制出NH4NO3 215.9 t.实验1.用如下图所示的简易装置可以进行气体的发生和收集.⑴实验前应如何检查装置的气密性?⑵拔开试管a的橡皮塞,加入10mL6mol/L稀硝酸和1g薄铜片,立即将带有导管的橡皮塞塞紧试管口.反应开始时速率缓慢,逐渐加快.请写出在试管a中发生的所有反应的化学方程式.2.下图所示装置是某种气体_的发生装置和收集装置(必要时可加热).所用的试剂从下列试剂中选取2_3种:硫化亚铁.二氧化锰.铜屑.氯化铵.稀硝酸.浓盐酸.蒸馏水.请回答下列问题:⑴气体_的化学式是⑵所选药品a是,b是,装置B的作用是.⑶用所选药品发生反应生成_时,离子方程式是.⑷在反应刚开始时A中的主要现象是.3.如图(图中有部分仪器未画出),有一容积为300mL的注射器,与蒸馏烧瓶(500mL)相连,烧瓶中有0.384gCu片,现向烧瓶中加入18mL2.5mol/L的稀硝酸溶液,并立即用锡箔包住的橡皮塞封住瓶口.⑴欲提高Cu和稀HNO3的反应速率,可采取多种不同的措施: ①若采用加入化学试剂的方法,可加入A.水B.无水醋酸钠C.铂丝D.硝酸锌②若用升高温度的方法,还需用到的仪器有⑵橡皮塞用锡箔包住的原因是⑶反应开始后,烧瓶中可观察到的现象主要有①②③.⑷停止反应后,轻轻推拉注射器活塞,使气体与气体.气体与液体皆充分反应.若忽略液体体积的变化,最终溶液中NO3—的物质的量浓度与开始时相比A.不变B.变大C.变小D.无法确定4.(_天津一摸)为了验证铜与稀硝酸反应生成的气体为一氧化氮.某学生实验小组利用下图所示装置(加热及固定装置均已略去),设计了两个实验方案.其中E是用于鼓入空气的双连打气瓶.方案一:A为H2的气体发生装置⑴实验仪器连接完毕,关闭活塞K,如何检查 B C装置的气密性?⑵实验开始时,首先要在试管C处检查H2的纯度,其目的是:⑶为验证铜与稀硝酸反应生成的气体为一氧化氮,反应一段时间后,由E向试管D 中鼓入空气,可观察到的现象是,产生上述现象的原因是(用化学方程式表示).⑷试管C中盛有的是NaOH溶液,作用是.方案二:A为CO2的气体发生装置⑴装置A中发生反应的化学方程式为.⑵实验开始时,要使整个装置充满二氧化碳气体,图中需进行改进的装置是(填序号)若无其他任何可选仪器,你认为合理的改进措施是.⑶若试管C中盛有的是澄清石灰水,反应过程中在该溶液中观察到的现象是.5.(_第七次全国大联考)某教师用如图所示装置做有关〝稀HNO3的氧化性及NO 的性质〞的课堂实验.其操作步骤如下:①检查装置的气密性;②在试管Ⅰ.Ⅱ的隔板上放置铜丝,撤去洗耳球,打开止水夹2.3,从1处漏斗加入稀硝酸,直至液面没及铜丝并与试管Ⅰ胶塞处相平;③关闭止水夹2.3,用酒精灯微热试管Ⅰ,当铜丝表面有气泡产生时,立即撤去酒精灯;④随着反应的进行,可以在试管Ⅰ上方观察到无色的NO,溶液渐显蓝色,生成的NO气体产生的压强促使硝酸沿着导管流入试管Ⅱ,当试管Ⅰ中的液面脱离铜丝时,反应停止;⑤稀硝酸流入试管Ⅱ,没及铜丝,微热试管Ⅱ,当铜丝表面有气泡产生时,立即撤去酒精灯;⑥当试管Ⅱ中有红棕色气体充满时,连接洗耳球,打开止水夹2;⑦实验结束后进行废气处理.试回答下列问题:⑴检查装置气密性的方法及现象是.⑵步骤②中硝酸液面与试管Ⅰ胶塞处相平的目的是.⑶步骤③中发生反应的化学方程式为.⑷步骤⑥中红棕色气体产生的化学方程式为;连接洗耳球产生的结果是,其原因是.。
2017高三化学一轮复习学案:第9章+氮族元素
第九章氮族元素第一课时氮与磷(1)元素X的符号是(2)写出b反应的化学方程式。
(3)写出c反应的化学方程式。
解题思路:。
易错点: 。
【巩固练习】课堂反馈1.第二次世界大战期间,某国有支侦察小分队发现了一座十分隐蔽且又戒备森严的军火厂。
上级要求小分队在三天内必须炸毁它,结果他们用十多只涂有化学药剂的老鼠完成了任务,据你推测这种药剂是 ( ) A.TNT B. KMnO4和H2SO4C. 黑火药和甘油D. 白磷和CS2溶液2.只含有一种元素的物质 ( ) A.可能是纯净物也可能是混合物B. 可能是单质也可能是化合物C.一定是纯净物D. 一定是一种单质3.Na3N是离子化合物,它和水作用可产生NH3。
下列叙述正确的是 ( )A.Na3N与盐酸反应生成的都是盐B.Na+和N3-的电子层结构不相同C.Na+的半径大于N3-的半径D.在Na3N与水的反应中,Na3N做还原剂4.已知亚磷酸(H3PO3)只能生成两种钠盐(NaH2PO3和Na2HPO3),由此可知下列说法正确的是 ( ) A.亚磷酸中的磷呈+5价 B. 亚磷酸是二元酸C.亚磷酸有氧化性和还原性 D. 亚磷酸盐无正盐5.安全火柴在摩擦起火的过程中,起化学反应的是( )A.氯酸钾和二氧化锰 B. 氯酸钾和白磷C.氯酸钾和红磷 D. MnO2和Sb2S36.为了确定某样品是否被氧化,所选试剂(括号内物质)不正确的是 ( )A.FeCl2(NH4SCN溶液) B. KI(淀粉溶液)C.白磷(紫色石蕊溶液) D. Na2SO3(BaCl2溶液)7.六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是 ( ) A.10 B. 12 C. 24 D. 288.等体积等物质量浓度的NH4H2PO4、(NH4)2HPO4、(NH4)3PO4分别与等物质量浓度的NaOH溶液反应,恰好作用完全生成正盐,则消耗NaOH溶液的体积比为 ( )A.1:2:3 B. 3:2:1 C. 1:1:1 D. 6:3:2课外作业1.某硝酸盐受热分解生成金属氧化物、二氧化氮和氧气。
高考第一轮复习 《氮族元素》
高考第一轮复习 《氮族元素》课题一 氮和磷考点一 氮族元素的性质递变规律及应用4 教材解读P122《全线突破》基础热身『例1』铋(Bi)试氮族元素中原子序数最大的元素,试推断铋单质及其化合物具有的性质是()A.铋能形成很稳定的气态氢化物B.铋的最高价氧化物对应水化物的酸性比磷酸强C.铋单质可能具有良好的导电性并具有较大的密度D.铋的两种常见氧化物Bi2O3、Bi2O5一定都是碱性氧化物牛刀小试以下说法中错误的是()A.N2不易和其他物质发生化学反应,是因为N2分子中两个原子间形成的共价键键能很大B.N2是可用于制氮肥和硝酸的原料C.利用N2的不活泼性,工业上用来代替稀有气体.做焊接金属时的保护气D.氮元素的非金属性比磷强,所以氮气比白磷活泼, 易燃烧2.现有X、Y两种VA族元素,下列事实不能说明X的非金属性比Y强的是()A.两元素所形成的最高价氧化物的水化物的酸性强弱:H3XO4>H3YO4B.两种元素所形成气态氢化物的稳定性强弱:XH3>YH3C.两种元素所形成的最高价氧化物的稳定性:X2O5>Y2O5D.两种元素形成的气态氢化物的还愿性:YH3>XH33.(2007年高考理综上海卷,氮族-固氮)将空气中氮气转化为氮的化合物的过程称为固氮。
下面能实现人工固氮的是( )(A)闪电 (B)电解饱和食盐水车间(C)根瘤 (D)合成氨车间该知识点对应题目:《全》P124-125成功体验1、3、9考点二 氮的氧化物溶于水的计算教材解读P122《全线突破》基础热身和要点突破『例2』将盛有12mlNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2ml无色气体,则原混合气体中O2的体积是( )A.1.2MLB.2.4MLC.3.6MLD.4ML牛刀小试1.常温下,在VL密闭容器中有amolNO气体,压强为bkPa,若再充入amolO2,保持温度不变,反应后容器内的压强( )A.等于1.5bkPaB.等于2bkPaC.小于1.5bkPaD.大于1.5bkPa2.NO、NO2均可与NH3反应转化为无害的N2和H2O,现在有3.0LNO、NO2的混合气体,当耗用3.0LNH3时,可全部转化为N2和H2O,则NO与NO2的体积之比为( )A.1:1B.1:2C.1:3D.任意比该知识点对应题目:《全》P124-125成功体验2、5、6、7、8、11、12、P137 3、43、下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。
