物化实验-分光光度法测BPB电力平衡常数
分光光度法测定络合物的稳定常数实验报告

分光光度法测定络合物的稳定常数一、实验目的:1、掌握用分光光度法测定络合物组成及稳定常数的基本原理和方法;2、学会使用721(722)型分光光度计。
二、实验原理溶液中金属离子M 和配位体L 形成络合物MLn ,其反应式为:M + nL === MLn当达到络合平衡时,其络合稳定常数为: n LM MLn C C C K ⋅= (4-1) 式中:K 为稳定常数;C M 为络合平衡时金属离子的浓度; C L 为络合平衡时配位体浓度; C MLn 为络合平衡时络合物的浓度;n 为络合物的配位数。
在维持金属离子及配位体总摩尔数不变的条件下,改变金属离子和配位体摩尔分数的比值,并测定不同摩尔分数比值时的某一物理化学参量,在本实验中测定吸光度A ,作摩尔分数~吸光度曲线,如图4-1所示。
图4-1 摩尔分数与吸光度图 图4-2 吸光度与溶液组成图从曲线上吸光度的最大值所对应的摩尔分数值可求出n 值。
为了配制溶液的方便,通常取相同摩尔浓度的金属离子M 溶液和配位体L 溶液,维持总体积不变,按不同体积比配制一系列混合溶液,则它们的体积比亦为摩尔比,若X V 为A max 时所取L 溶液的体积分数,即:ML L V V V V X += (4-2) VV X X n -=1 (4-3) 络合物在可见光某个波长区域有强烈吸收,而金属离子和配位体几乎不被吸收,那么就可以用分光光度法测定其组成和稳定常数,本实验就是用的这种方法。
根据比耳定律,入射光I 0和透射光强I 之间有下列关系:)ex p(0kcd I I -= (4-4)即 kcd II =0ln 令 kcd II A ==0lg 式中:A 为吸光度;k 为吸收系数,对于一定溶剂、溶质及一定波长的入射光k 为常数;d 为溶液层厚度;c 为样品浓度;I 0/I 为透射比。
在维持总体积不变的条件下,配制一系列体积比不同的溶液,用V L /V M 为7/3的溶液测其最大吸收峰,找出络合物ML n 有最大吸收,而M 和L 几乎不吸收的波长数值。
化学反应中的平衡常数测定方法

化学反应中的平衡常数测定方法化学反应平衡常数是描述反应在平衡态时物质浓度的数值。
它是理解反应物质转化程度和反应条件对反应平衡的影响的重要参数。
本文将介绍几种常用的化学反应平衡常数测定方法。
一、液相平衡常数测定方法1. 酸碱滴定法酸碱滴定法适用于酸碱中和反应。
首先,将酸或碱溶液与一定量的指示剂混合,然后滴加对应的酸或碱溶液,直到指示剂颜色发生变化,记录滴加的酸或碱溶液的体积。
通过体积比例可以确定酸碱反应平衡时的物质浓度比例,从而计算平衡常数。
2. 比色法比色法适用于反应物和产物在反应溶液中有明显的颜色差异的反应。
通过光谱仪或分光光度计测定反应溶液在特定波长下的吸光度,利用反射率与溶液中物质浓度之间的定量关系,可以计算出平衡常数。
二、气相平衡常数测定方法1. 压力法压力法适用于气体反应。
在恒定温度下,将反应物加入容器,测量容器内的压力。
反应达到平衡后,根据部分压力与摩尔比例之间的关系,可以计算出平衡常数。
2. 体积法体积法通常用于液体蒸气压上涨反应。
将反应物和辅助剂加入封闭的容器中,反应平衡后测量体积。
根据反应物与产物之间的摩尔比例,可以计算出平衡常数。
三、计算机模拟方法计算机模拟方法是利用计算机技术和物理化学理论模型对化学反应进行模拟和计算。
通过建立化学反应的动力学方程和平衡常数方程,采用数值计算方法求解,可以得到平衡常数的数值。
四、温度法可以利用温度对平衡常数的影响进行测定。
在不同的温度下进行反应,通过测量平衡时物质浓度或压力的变化,推导出平衡常数随温度的变化关系,从而得到真实的平衡常数。
总结:化学反应中的平衡常数测定方法有液相平衡常数测定方法、气相平衡常数测定方法、计算机模拟方法和温度法。
不同的反应系统和实验条件下,可以选择适合的方法进行测定。
这些方法提供了测定平衡常数的有效手段,可以帮助我们更好地理解化学反应平衡,并为相关工业过程和实验研究提供指导。
对于化学工作者来说,掌握和应用这些测定方法是十分重要的。
液相反应平衡常数的测定(华南师范大学物化实验)
行。本实验为离子平衡反应,离子强度必然对平衡常数有很大影响。所以,在各
被测溶液中离子强度 I = 1 2
mi
Z
2 i
应保持一致。
(4)测定消光度时,为什么需空白对比液?怎么选择空白对比液?
除了 Fe[CNS]2+在溶液中显色具有一定的吸光度外,其他试剂也是具有一定
的吸光度的,因此在没有设置空白对比液的情况下,所得的吸光度会比准确值偏
华南师范大学实验报告 液相反应平衡常数的测定
一、实验目的
(1)利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁络离子 液相反应的平衡常数。 (2)通过实验了解热力学平衡常数与反应物的起始浓度无关。
二、实验原理
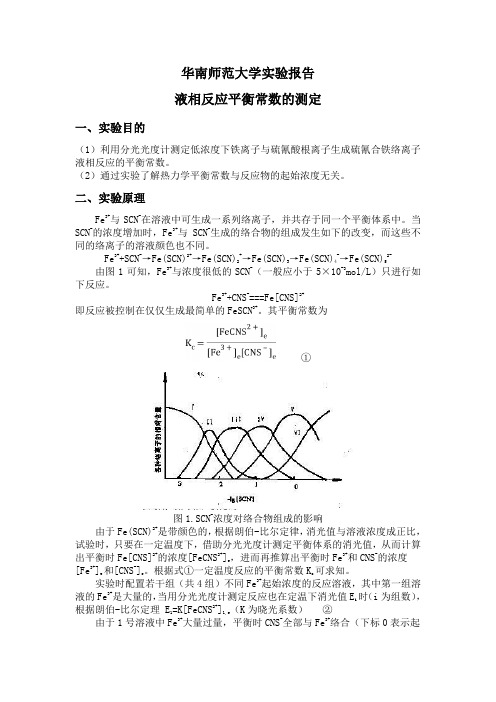
Fe3+与 SCN-在溶液中可生成一系列络离子,并共存于同一个平衡体系中。当 SCN-的浓度增加时,Fe3+与 SCN-生成的络合物的组成发生如下的改变,而这些不 同的络离子的溶液颜色也不同。
Fe3++SCN-→Fe(SCN)2+→Fe(SCN)2+→Fe(SCN)3→Fe(SCN)4-→Fe(SCN)52由图 1 可知,Fe3+与浓度很低的 SCN-(一般应小于 5×10-3mol/L)只进行如 下反应。
Fe3++CNS-===Fe[CNS]2+ 即反应被控制在仅仅生成最简单的 FeSCN3+。其平衡常数为
mi
Z
2 i
应保持一致。
由于 Fe3+离子可与多种阴离子发生络合,所以应考虑到对 Fe3+离子试剂的选
择。当溶液中有
Cl
、
PO
3 4
等阴离子存在时,会明显地降低
FeSCN2+络离子浓度,
分光光度法测定酚酞电离平衡常数实验改进

分光光度法测定酚酞电离平衡常数实验改进
1. 温控
酚酞电离平衡常数的测量需要保持恒定的反应温度,因此在实验中应该进行温控,可以使用恒温水浴或者恒温槽等设备对反应体系进行温度控制。
2. 选择合适的波长
在分光光度法中,选择合适的波长对于测定结果的准确性和精度有着决定性的影响。
对于酚酞,可以选择波长为536nm的单色光进行测量,可以获得较好的测量结果。
3. 确定反应物浓度
在进行酚酞电离平衡常数测定实验之前,需要先确定反应物的初始浓度。
可以使用比色法、重量法等方法对反应物浓度进行测定,以保证实验结果的准确性。
4. 加入缓冲剂
由于酚酞在不同酸碱条件下电离状态不同,因此加入缓冲剂可以调节反应体系的酸碱性,使得反应体系处于较为稳定的环境中,提高实验结果的准确性和重现性。
5. 注意操作技巧
在实验过程中,需要注意操作技巧,如仔细清洗或更换实验仪器和试剂,注意反应体系的混合和搅拌等,以保证实验结果的可重复性和准确性。
实验一 分光光度法测 液相反应的化学平衡常数
实验一 分光光度计法测溶液化学反应的K一、实验目的1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。
2.通过实验了解K与反应物起始浓度无关。
3.掌握分光光度计的正确使用方法。
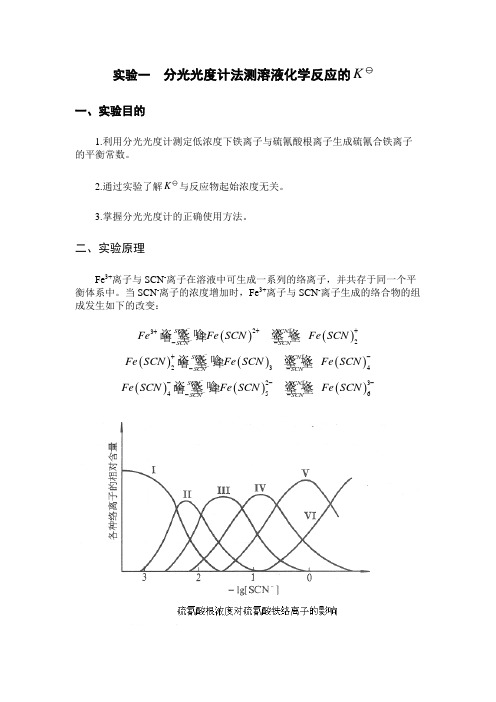
二、实验原理Fe 3+离子与SCN -离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。
当SCN -离子的浓度增加时,Fe 3+离子与SCN -离子生成的络合物的组成发生如下的改变:()()232SC NSC NSC NSC NFeFe SC N Fe SC N ----+++-- ()()()234SC NSC NSC NSC N Fe SC N Fe SC N Fe SC N ----+--- ()()()23456SC NSC NSC NSC NFe SC NFe SC N Fe SC N ---------而这些不同的络离子颜色也不同。
由图可知,当Fe 3+离子与浓度很低的SCN -离子(一般应小于5×10-3mol·dm -3)时,只进行如下反应:()23FeSCN Fe SCN++-+即反应被控制在仅仅生成最简单的Fe(SCN)2+络离子。
其标准平衡常数23()///Fe SC N C K Fe C SC N C ++-⎡⎤⎣⎦=⎡⎤⎡⎤⎣⎦⎣⎦根据朗伯-比尔定律,吸光度与溶液中Fe(SCN)2+络离子浓度成正比。
()20lgI A K L Fe SC NI+⎡⎤==⎣⎦(A 为吸光度,K 为常数, L 为液层厚度)。
借助于分光光度计测定溶液的吸光度,可计算出平衡时Fe(SCN)2+络离子的浓度以及Fe 3+离子和SCN -离子的浓度,从而求出该反应的平衡常数K。
由于:(1) Fe 3+离子在水溶液中存在下列水解平衡11232322kkK Fe SC N FeSC N FeH O FeO H H-+-+++++++ 快334222kkK FeO HSC N FeO H SC N FeO H SC NHFeSC N H O-+-+++++++ 快达平衡时22331134()/[][]//Fe SC N C K k k k k K H K H Fe C SC N C +--+++-⎡⎤⎛⎫⎛⎫⎣⎦=+÷+= ⎪ ⎪⎡⎤⎡⎤⎝⎭⎝⎭⎣⎦⎣⎦平平K与酸度有关。
分光光度法测的络合物的稳定常数

实验六 分光光度法测的配合物的稳定常数一、目的与要求1.掌握连续法测定配合物组成及稳定常数的方法; 2.掌握分光光度计的使用方法; 3.用分光光度法中的连续变化法测的Fe +3与钛铁试剂形成配合物的组成及稳定常数。
二、预习与思考1.了解连续法测的配合物组成及稳定常数的基本原理; 2.预习7200型分光光度计的构造原理和使用方法; 3.思考(1) 怎样求配位数n ?如何计算配合物稳定常数?(2) 测定λmax 的目的是什么?如何决定配合物最大吸收波长? (3) 使用分光光度计时应注意什么?比色皿大小如何选择? 三、实验原理溶液中金属离子M 和配位体L 形成配合物,其反应式为:n ML nL M −→←+当达到络合平衡时:n ML n M LC K C C=(6.1)式中:K 为配合物稳定常数;C M 为络合平衡时金属离子的浓度(严格应为活度);C L 为络合平衡时的配位体浓度;C MLn 为络合平衡时的配合物浓度;n 为配合物的配位数。
配合物稳定常数不仅反映了它在溶液中的热力学稳定性,而且对配合物的实际应用,特别是在分析化学方法中具有重要的参考价值。
显然,如能通过实验测得公式(6.1)中右边各项浓度及n 值,则就能算得K 值。
本实验采用分光光度来测定上列这些参数。
1. 分光光度法的实验原理:让可见光中各种波长单色光分别、依次透过有机物或无机物的溶液,其中某些波长的光即被吸收,使得透过的光形成吸收谱带。
如图П-6-1所示,这种吸收谱带对于结构不同的物质具有不同的特性,因而就可以对不同产物进行鉴定分析。
根据比尔定律,一定波长的入射光强I 0 与透射光强I 之间的关系:kcd e I I -=0 (6.2)式中:K 为吸收系数,对于一定溶质、溶剂及一定波长的入射光K 为常数,C 为溶液浓度,d 为盛样溶液的液槽的透光厚度。
由(6.2)式可得:kcd II =0ln(6.3) cd k A I I A I I 303.2,lg ,00==则得:令称透射比。
测定平衡常数的实验方法
测定平衡常数的实验方法引言平衡常数是化学反应中重要的参数之一,它描述了反应物到生成物之间的相对浓度关系。
测定平衡常数的准确值对于理解和控制化学反应至关重要。
本文将介绍几种常用的实验方法来测定平衡常数。
一、容器法容器法是最常用的实验方法之一,它基于反应物在平衡状态下的浓度与平衡常数之间的关系。
实验步骤如下:1. 准备两个容器A和B,分别加入适量的反应物和产物。
2. 通过控制温度和压力,使反应处于平衡状态。
3. 在平衡状态下,测量容器A中反应物的浓度,以及容器B中产物的浓度。
4. 根据浓度值计算平衡常数。
二、电动势法电动势法是通过测量电池电动势变化来确定平衡常数的方法。
实验步骤如下:1. 准备一个电池,包含两个半电池,分别连接阳极和阴极。
2. 在阳极和阴极之间加入反应物,并通过搅拌保持反应均匀。
3. 测量电池的电动势变化,并记录与时间的关系。
4. 根据电动势的变化曲线,计算平衡常数。
三、溶液法溶液法是通过测量溶液中某种物质的浓度变化来测定平衡常数的方法。
实验步骤如下:1. 准备两个溶液,分别含有反应物和产物。
2. 混合两个溶液,并通过控制温度和pH值使反应处于平衡状态。
3. 定期取样,测量溶液中某种物质的浓度,并记录与时间的关系。
4. 根据浓度变化曲线,计算平衡常数。
结论测定平衡常数的实验方法有容器法、电动势法和溶液法等。
选择合适的方法取决于实验条件、反应类型和目标。
这些实验方法为我们提供了测定平衡常数的有效工具,为化学反应的研究和工业应用提供了重要依据。
总结本文介绍了测定平衡常数的实验方法,包括容器法、电动势法和溶液法。
这些方法能够准确地测定平衡常数,为化学反应研究和应用提供了基础数据。
通过选择合适的实验方法,并合理设计实验条件,我们能够更好地理解和控制化学反应的平衡过程。
这些实验方法的应用将促进化学领域的发展和进步。
参考文献[1] 李明,刘强,张三. 平衡常数测定方法的比较与分析[J].化学实验室,2019,36(2):65-72.[2] Smith J, Johnson R. Experimental Methods for Determining Equilibrium Constants[M]. New York: Academic Press, 2018.。
中国科大物理化学实验分光光度法测溴酚蓝的电离平衡常数(仅供参考)
分光光度法测溴酚蓝的电离平衡常数The Measurement of Dissociation Constant ofBromphenalblue by Spectrophotometry化学系中国科学技术大学中国安徽合肥230041 关键词:溴酚蓝、电离常数、分光光度法、朗伯比尔定律摘要:在本次试验中,我们使用分光光度法测得不同pH溶液中的溴酚蓝的吸收光谱,并运用朗伯比尔定律求得溴酚蓝的电离平衡常数。
Key Words:Bromophenalblue,Dissociation Constant,Spectrophotometry,Beer-Lambert LawAbstract:In this experiment, we measured the absorption spectrum of the bromphrnalblue under different pH conditions with spectrophotometer. We derived the dissociation constant by applying the Beer-Lambert Law.一、实验简介波长为λ的单色光通过任何均匀而透明的介质时,由于物质对光的吸收作用而使透射光的强度(I)比入射光的强度(I0)要弱,其减弱的程度与所用的波长(λ)有关。
又因分子结构不相同的物质,对光的吸收有选择性,因此不同的物质在吸收光谱上所出现的吸收峰的位置及其形状,以及在某一波长范围内的吸收峰的数目和峰高都与物质的特性有关。
分光光度法是根据物质对光的选择性吸收的特性而建立的,这一特性不仅是研究物质内部结构的基础,也是定性分性、定量分析的基础。
—郎比定律,溶液对于单色光的吸收,遵守下列关系式:DIIK l C==⋅⋅lg0(1-1)式中,D-消光(或光密度);I/I0-透光率;K-摩尔消光系数,它是溶液的特性常数;l -被测溶液的厚度(即吸收槽的长度); C -溶液浓度。
实验一 分光光度法测 液相反应的化学平衡常数
实验一 分光光度计法测溶液化学反应的K一、实验目的1.利用分光光度计测定低浓度下铁离子与硫氰酸根离子生成硫氰合铁离子的平衡常数。
2.通过实验了解K 与反应物起始浓度无关。
3.掌握分光光度计的正确使用方法。
二、实验原理Fe 3+离子与SCN -离子在溶液中可生成一系列的络离子,并共存于同一个平衡体系中。
当SCN -离子的浓度增加时,Fe 3+离子与SCN -离子生成的络合物的组成发生如下的改变:()()232SCN SCN SCN SCN FeFe SCN Fe SCN ----+++--()()()234SCN SCN SCN SCN Fe SCN Fe SCN Fe SCN ----+---()()()23456SCN SCN SCN SCN Fe SCN Fe SCN Fe SCN ---------而这些不同的络离子颜色也不同。
由图可知,当Fe 3+离子与浓度很低的SCN -离子(一般应小于5×10-3mol·dm -3)时,只进行如下反应:()23Fe SCN Fe SCN ++-+即反应被控制在仅仅生成最简单的Fe(SCN)2+络离子。
其标准平衡常数23()///Fe SCN C K Fe C SCN C++-⎡⎤⎣⎦=⎡⎤⎡⎤⎣⎦⎣⎦ 根据朗伯-比尔定律,吸光度与溶液中Fe(SCN)2+络离子浓度成正比。
()20lg I A KL Fe SCN I+⎡⎤==⎣⎦(A 为吸光度,K 为常数, L 为液层厚度)。
借助于分光光度计测定溶液的吸光度,可计算出平衡时Fe(SCN)2+络离子的浓度以及Fe 3+离子和SCN -离子的浓度,从而求出该反应的平衡常数K 。
由于:(1) Fe 3+离子在水溶液中存在下列水解平衡11232322k k K Fe SCN FeSCN Fe H OFeOHH-+-+++++++快334222k k K FeOH SCN FeOHSCN FeOHSCN HFeSCNH O-+-+++++++快达平衡时22331134()/[][]//Fe SCN CK k k k k K H K H Fe C SCN C+--+++-⎡⎤⎛⎫⎛⎫⎣⎦=+÷+= ⎪ ⎪⎡⎤⎡⎤⎝⎭⎝⎭⎣⎦⎣⎦平平 K 与酸度有关。
2017级化学工程物理化学实验资料-测定弱电解质的电离常数---分光光度法
(2)吸光度的测定
1.用7200分光光度计由波长360nm至620nm间隔20nm分别测定溶液A和溶液B的吸光度,再根据所得的数据使A液在430nm至535nm间隔5nm测定一组吸光度,再在B液在410nm至435nm间隔5nm测定一组折光率。
对于固定长度吸收槽,在对应最大吸收峰的波长( )下测定不同浓度c的吸光度,就可作出线性的 线,这就是光度法的定量分析基础。
以上讨论是对单组分溶液的情况,对两种以上组分的溶液,情况就要复杂一些。
(1)若两种被测定组分的吸收曲线彼此不相重合,这种情况很简单,就等于分别测定两种单组分溶液。
(2)若两种被测定组分的吸收曲线相重合,且遵守朗伯-比尔定律,则可在两波长 和 时测定其总吸光度,然后换算成被测定的浓度。
根据朗伯-比尔定律,假定吸收槽的波长一定,则
设 、 分别代表 和 时混合溶液的总吸光度,则
此处 分别代表 和 时组分A和B的吸光度。由 可知:
将上式代入 得到:
这些不同的K值均可由单组分溶液求得。也就是说,在单组分溶液的最大吸收峰的波长 处,测定吸光度A和浓度C的关系。如果在该波长处符合朗伯-比尔定律,那么 为直线,直线的斜率即为K值, 、 是会和溶液在 和 处测定的总的吸收度,因此根据 式和 式即可计算混合溶液中组分A和组分B的浓度。
(2)用分光光度法进行测定时,为什么要用空白溶液校正零点?理论上应该用什么溶液校正?在本实验中用的是什么?为什么?
九.实验小结
五.实验步骤
(1)配制溶液
取12mol/L的盐酸分别配制250ml的0.1mol/L和0.01mol/L的盐酸溶液;
