《物质的制备》教学设计(云南省市级优课)
2021人教版选修6《物质的制备》word教案1

2021人教版选修6《物质的制备》word教案1复习内容:重要物质的制备一、气体的制备:1、常见气体的制备原理:写出下列制备么反应的化学方程式:H2: NH3:O2: NO2:或:NO:Cl2: CO2:HCl: CH4:H2S: C2H4:或:C2H2:SO2:或:2、气体发生装置:(1)固、固加热:即:固+固△气如制取等。
装置如右图:(2)液固或液、液加热:即:液+固△气液+液△气如制取等。
装置如右图:(3)液固不加热:即:液+固气如制取等。
装置如下图:另外,气体发生装置还有启普发生器。
它用于固—液常温下反应制取大量气体。
其优点是能够随时反鹫在,随时停止。
使用时应注意装置是否漏气;液体不能添加太满;固体试剂应是块状。
启普发生器由、、三部分组成。
3、气体的收集:(1)排水集气法:此法可收集气体有等(2)向上排空气法:气此法可收集气体有等(3)向下排空气法:此法可收集气体有等气注意:所制气体如难溶于水又不要求干燥时,应该用排水集气法;如气体溶于水则只能用排空气法收集。
排气集气时,应使气体导管伸到瓶底。
2乙酸乙酯的制取:(1)乙醇、乙酸和浓硫酸混和时应如何样操作,什么缘故?(2)在那个反应中,浓H2SO4起什么作用?(3)什么缘故要把导管通到饱和Na2CO3溶液的液面上?[练习题]1.实验室制取气体时,吸取尾气的方案,正确的是()①向KMnO4晶体中加入浓盐酸,产生的气体进行漂白实验后的尾气用NaOH溶液吸取;②向Na2SO3晶体中滴入浓H2SO4,尾气用氨水吸取;③向FeS固体中滴入稀盐酸,最后的尾气用CuSO4溶液吸取;④浓H2SO4与食盐晶体共热,将余外的气体用水吸取;A.①④B.②③C.①③④D.①②③④2.实验室用电石和水反应制取的乙炔中常常含有少量H2S、CO2和水蒸气,为了得到干燥纯洁的乙炔气,简便易行的方案是()A.通过NaOH溶液后再通过浓H2SO4B. 通过CuSO4溶液后再通过石灰水C.通过碱石灰D.通过P2O5后,再通过固体氢氧化钠3.在玻璃、肥皂、造纸和纺织工业上广泛使用的原料是()A.纯碱B.生石灰C.烧碱D.石灰石4.下列制备方法和现象都正确的是()A.取新配制的FeSO4溶液注入试管,再向试管里滴加烧碱溶液,赶忙有白色沉淀生成B.往苯酚溶液中滴入几滴浓溴水时有白色沉淀析出C.向盛有0.01mol/LKI溶液的试管中滴加相同浓度的AgNO3溶液,边滴加边振荡,可得到浅黄色的碘化银胶体D.淀粉与稀H2SO4共煮后,加入新制Cu(OH)2后再加热,有红色沉淀生成5. 在实验室里加热到熔化状态仍不能制得CO2的是()A.NaHCO3B.NH4HCO3C.K2CO3D.Cu2(OH)2CO36.在石油加工过程中,得到石蜡产品的加工方法是()A.常压分馏B.减压分馏C.裂化D.裂解7.工业上常用如下三种方法制备磷肥,试用化学方程式表示其过程。
《物质的制备》 学历案

《物质的制备》学历案一、学习目标1、了解常见物质制备的基本原理和方法。
2、掌握物质制备实验中的仪器选择、操作步骤和注意事项。
3、培养实验设计和问题解决的能力,提高科学探究的素养。
二、学习重难点1、重点(1)常见气体(如氧气、二氧化碳、氢气)的制备原理和方法。
(2)重要化合物(如硫酸铜、氢氧化钠)的制备流程。
2、难点(1)实验装置的改进与创新。
(2)制备过程中的杂质去除和产物提纯。
三、学习过程(一)常见气体的制备1、氧气的制备(1)原理:实验室常用加热高锰酸钾、分解过氧化氢溶液或加热氯酸钾和二氧化锰的混合物来制取氧气。
加热高锰酸钾:2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑分解过氧化氢溶液:2H₂O₂二氧化锰 2H₂O + O₂↑加热氯酸钾和二氧化锰的混合物:2KClO₃二氧化锰、加热 2KCl + 3O₂↑(2)实验装置发生装置:根据反应物的状态和反应条件选择。
加热高锰酸钾或氯酸钾和二氧化锰的混合物时,选择“固固加热型”装置;用过氧化氢溶液制取氧气时,选择“固液不加热型”装置。
收集装置:氧气不易溶于水,可用排水法收集;氧气的密度比空气略大,也可用向上排空气法收集。
(3)操作步骤检查装置的气密性。
装入药品。
固定装置。
加热(如果是加热高锰酸钾,需要在试管口塞一团棉花,防止高锰酸钾粉末进入导管)。
收集气体。
实验结束,先将导管移出水面,再熄灭酒精灯,防止水槽中的水倒吸进入试管,使试管炸裂。
(4)注意事项长颈漏斗的下端要伸入液面以下,防止生成的气体从长颈漏斗逸出。
用排水法收集氧气时,当气泡连续均匀冒出时再开始收集,否则收集的氧气不纯。
2、二氧化碳的制备(1)原理:实验室常用大理石(或石灰石)与稀盐酸反应制取二氧化碳,化学方程式为:CaCO₃+ 2HCl = CaCl₂+ H₂O + CO₂↑(2)实验装置发生装置:“固液不加热型”装置。
收集装置:二氧化碳能溶于水,且密度比空气大,通常采用向上排空气法收集。
最新人教版选修6《物质的制备》教案2
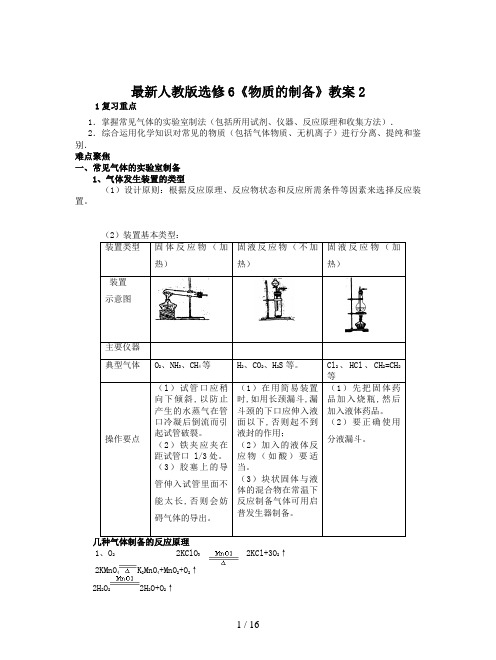
最新人教版选修6《物质的制备》教案21复习重点1.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法).2.综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别.难点聚焦一、常见气体的实验室制备1、气体发生装置的类型(1)设计原则:根据反应原理、反应物状态和反应所需条件等因素来选择反应装置。
1、O 2 2KClO 32KCl+3O 2↑2KMnO 4K 2MnO 4+MnO 2+O 2↑ 2H 2O 22H 2O+O 2↑2、NH3 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2ONH3·H2O NH3↑+H2O3、CH4 CH3COONa+NaOH Na2CO3+CH4↑4、H2 Zn+H2SO4(稀)=ZnSO4+H2↑5、CO2 CaCO3+2HCl=CaCl2+CO2↑+H2O6、H2S FeS+H2SO4(稀)=FeSO4+H2S↑7、SO2 Na2SO4+H2SO4(浓)=Na2SO4+SO2↑+H2O8、NO2 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O9、NO 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O10、C2H2 CaC2+2H2O→Ca(OH)2+CH≡CH↑11、Cl2 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O12、HCl NaCl(固)+H2SO4(浓)NaHSO4+HCl↑NaCl(固)+NaHSO4Na2SO4+HCl↑2NaCl(固)+H2SO4(浓)Na2SO4+2HCl↑13、C2H4 C2H5OH CH2=CH2↑+H2O14、N2 NaNO2+NH4Cl NaCl+N2↑+2H2O2、收集装置(1)设计原则:根据氧化的溶解性或密度(1)设计原则:根据净化药品的状态及条件(3)气体的净化剂的选择选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。
人教版选修6《物质的制备》教案2

人教版选修6《物质的制备》教案2 1复习重点1.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法).2.综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别.难点聚焦一、常见气体的实验室制备1、气体发生装置的类型(1)设计原则:根据反应原理、反应物状态和反应所需条件等因素来选择反应装置。
装置类型固体反应物(加热)固液反应物(不加热)固液反应物(加热)装置示意图主要仪器典型气体O2、NH3、CH4等H2、CO2、H2S等。
Cl2、HCl、CH2=CH2等操作要点(l)试管口应稍向下倾斜,以防止产生的水蒸气在管口冷凝后倒流而引起试管破裂。
(2)铁夹应夹在距试管口 l/3处。
(3)胶塞上的导管伸入试管里面不能太长,否则会妨碍气体的导出。
(1)在用简易装置时,如用长颈漏斗,漏斗颈的下口应伸入液面以下,否则起不到液封的作用;(2)加入的液体反应物(如酸)要适当。
(3)块状固体与液体的混合物在常温下反应制备气体可用启普发生器制备。
(1)先把固体药品加入烧瓶,然后加入液体药品。
(2)要正确使用分液漏斗。
1、O2 2KClO3 2KCl+3O2↑2KMnO4K2MnO4+MnO2+O2↑2H2O22H2O+O2↑2、NH3 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2ONH3·H2O NH3↑+H2O3、CH4 CH3COONa+NaOH Na2CO3+CH4↑4、H2 Zn+H2SO4(稀)=ZnSO4+H2↑5、CO2 CaCO3+2HCl=CaCl2+CO2↑+H2O6、H2S FeS+H2SO4(稀)=FeSO4+H2S↑7、SO2 Na2SO4+H2SO4(浓)=Na2SO4+SO2↑+H2O8、NO2 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O9、NO 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O10、C2H2 CaC2+2H2O→Ca(OH)2+CH≡CH↑11、Cl2 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O12、HCl NaCl(固)+H2SO4(浓)NaHSO4+HCl↑NaCl(固)+NaHSO4Na2SO4+HCl↑2NaCl(固)+H2SO4(浓)Na2SO4+2HCl↑13、C2H4 C2H5OH CH2=CH2↑+H2O14、N2 NaNO2+NH4Cl NaCl+N2↑+2H2O2、收集装置(1)设计原则:根据氧化的溶解性或密度装置类型排水(液)集气法向上排空气集气法向下排空气集气法装置示意图适用范围不溶于水(液)的气体密度大于空气的气体密度小于空气的气体Cl2、HCl、CO2、SO2、H2S H2、NH3、CH4典型气体H2、O2、NO、CO、CH4、CH2=CH2、CH≡CH(1)设计原则:根据净化药品的状态及条件装置类型液体除杂剂(不加热)固体除杂剂(不加热)固体除杂剂(加热)适用范围装置示意图选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。
人教版选修6《物质的制备》教案(重点资料).doc

实验方案的设计和气体的制备(建议2课时完成)[考试目标]1.掌握见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
2.设计、评价或改进实验方案。
3.了解控制实验条件的方法。
4.分析或处理实验数据,得出合理结论。
5.绘制和识别典型的实验仪器装置图。
6.以上各部分知识与技能的综合应用。
[要点精析]一、气体的制备1.气体发生装置的类型(1)设计原则:根据反应原理、反应物状态和反应所需条件等因素来选择反应装置。
(2)装置基本类型:2.几种气体制备的反应原理 (1)O 22KClO 3 2KCl+3O 2↑2KMnO 4K 2MnO 4+MnO 2+O 2↑ 2H 2O 22H 2O+O 2↑ (2)NH 3 2NH 4Cl+Ca(OH)2CaCl 2+2NH 3↑+2H 2ONH 3·H 2O NH 3↑+H 2O (3)CH 4 CH 3COONa+NaOHNa 2CO 3+CH 4↑(4)H 2 Zn+H 2SO 4(稀)=ZnSO 4+H 2↑ (5)CO 2 CaCO 3+2HCl=CaCl 2+CO 2↑+H 2O (6)SO 2 Na 2SO 4+H 2SO 4(浓)=Na 2SO 4+SO 2↑+H 2O (7)NO 2 Cu+4HNO 3(浓)=Cu(NO 3)2+2NO 2↑+2H 2O(8)NO 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O(9)C2H2 CaC2+2H2O→Ca(OH)2+CH≡CH↑(10)Cl2 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(11)C2H4 C2H5OH CH2=CH2↑+H2O(12)H2 S FeS+H+=H2S↑+Fe2+3.收集装置(1)设计原则:根据氧化的溶解性或密度(2)装置基本类型:4.净化与干燥装置(1)设计原则:根据净化药品的状态及条件(2)装置基本类型:(3)气体的净化剂的选择选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。
人教版高中化学选修6第二单元课题二《物质的制备》优秀教案6(重点资料).doc

物质的制备和检验1复习重点1.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法).2.综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别.难点聚焦一、常见气体的实验室制备1、气体发生装置的类型(1)设计原则:根据反应原理、反应物状态和反应所需条件等因素来选择反应装置。
(2)装置基本类型:几种气体制备的反应原理 1、O 2 2KClO 3 2KCl+3O 2↑2KMnO 4K 2MnO 4+MnO 2+O 2↑ 2H 2O 22H 2O+O 2↑2、NH3 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2ONH3·H2O NH3↑+H2O3、CH4 CH3COONa+NaOH Na2CO3+CH4↑4、H2 Zn+H2SO4(稀)=ZnSO4+H2↑5、CO2 CaCO3+2HCl=CaCl2+CO2↑+H2O6、H2S FeS+H2SO4(稀)=FeSO4+H2S↑7、SO2 Na2SO4+H2SO4(浓)=Na2SO4+SO2↑+H2O8、NO2 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O9、NO 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O10、C2H2 CaC2+2H2O→Ca(OH)2+CH≡CH↑11、Cl2 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O12、HCl NaCl(固)+H2SO4(浓)NaHSO4+HCl↑NaCl(固)+NaHSO 4Na2SO4+HCl↑2NaCl(固)+H2SO4(浓)Na2SO4+2HCl↑13、C2H4 C2H5OH CH2=CH2↑+H2O14、N2 NaNO2+NH4Cl NaCl+N2↑+2H2O2、收集装置(1)设计原则:根据氧化的溶解性或密度(2)装置基本类型:3、净化与干燥装置(1)设计原则:根据净化药品的状态及条件(2)装置基本类型:(3)气体的净化剂的选择选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。
人教版高中化学选修6第二单元课题二《物质的制备》教案4

人教版高中化学选修6第二单元课题二《物质的制备》教案41复习重点1.掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法).2.综合运用化学知识对常见的物质(包括气体物质、无机离子)进行分离、提纯和鉴别.难点聚焦一、常见气体的实验室制备1、气体发生装置的类型(1)设计原则:根据反应原理、反应物状态和反应所需条件等因素来选择反应装置。
1、O 2 2KClO 32KCl+3O 2↑2KMnO 4K 2MnO 4+MnO 2+O 2↑ 2H 2O 22H 2O+O 2↑2、NH3 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2ONH3·H2O NH3↑+H2O3、CH4 CH3COONa+NaOH Na2CO3+CH4↑4、H2 Zn+H2SO4(稀)=ZnSO4+H2↑5、CO2 CaCO3+2HCl=CaCl2+CO2↑+H2O6、H2S FeS+H2SO4(稀)=FeSO4+H2S↑7、SO2 Na2SO4+H2SO4(浓)=Na2SO4+SO2↑+H2O8、NO2 Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O9、NO 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O10、C2H2 CaC2+2H2O→Ca(OH)2+CH≡CH↑11、Cl2 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O12、HCl NaCl(固)+H2SO4(浓)NaHSO4+HCl↑NaCl(固)+NaHSO4Na2SO4+HCl↑2NaCl(固)+H2SO4(浓)Na2SO4+2HCl↑13、C2H4 C2H5OH CH2=CH2↑+H2O14、N2 NaNO2+NH4Cl NaCl+N2↑+2H2O2、收集装置(1)设计原则:根据氧化的溶解性或密度(1)设计原则:根据净化药品的状态及条件(3)气体的净化剂的选择选择气体吸收剂应根据气体的性质和杂质的性质而确定,所选用的吸收剂只能吸收气体中的杂质,而不能与被提纯的气体反应。
【高中化学】人教版选修6 第二单元课题二 物质的制备(第一课时) 教案1

课题二物质的制备(第一课时)一、教学目标知识与技能目标:能说出物质制备的一般方法;会根据所制备的物质选择所需要的原料;能根据所选用的原料及反应原理设计反应路径,选择合理的仪器和装置,最后分离提纯目标产品。
过程与方法目标:通过回顾总结制取二氧化碳的方法,得出制备物质的一般方法。
情感态度价值观目标:通过对物质制备的一般方法的归纳整理,激发学生的学习兴趣,使学生学会多方面、综合考虑问题解决问题,养成勤于思考总结的习惯。
二、教学重点物质制备的一般方法三、教学难点如何确定制备目标产品的反应路径四、教学方法回忆学过的制备二氧化碳的方法,总结得出制备物质的一般方法,由旧知识引入新知识并加以拓展。
五、教学过程【引入】俗话说“天有不测风云,人有旦夕祸福”,我们在日常生活中说不定哪天就会有头痛发热的现象是吧,所以要常备一些常见的药物在身边来预防。
大家都知道在西方风靡一时的降血压的药是什么吗?【生】阿司匹林【师】我们暂且不研究这种药要多么好的疗效,又有什么副作用,我们关注的是阿司匹林是如何制备的。
科学研究、工业生产和日常生活都离不开物质的制备,入新药物的合成、炼钢炼铁、氨的合成等。
在实验室中,我们也有制备物质的经验,例如氧气、二氧化碳和乙酸乙酯等物质的制取。
【分组讨论】请大家回忆初中化学课程中制取二氧化碳的实验,六人一组讨论一下问题:(1)能够产生二氧化碳气体的物质有哪些?(2)制取二氧化碳的实验中,以什么物质为反应物(原料)?为什么?(3)反应的装置是如何选择的?(4)如果欲得干燥、纯净的气体产物,应如何设计装置?【生】小组讨论分析。
【师】下面我来逐个解决上面所提到的问题。
能够产生二氧化碳气体的物质有哪些?【生】碳酸盐及其酸式盐、木炭、有机物等物质。
【师】第二个问题给第二个小组来回答。
制取二氧化碳的实验中,以什么物质为反应物(原料)?为什么?【生】制取二氧化碳的实验中,以大理石或石灰石和稀盐酸为原料。
选用大理石或石灰石的原因是原料价格低廉,容易得到,反应也容易控制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯气的制法
一、教学目标
1.初步了解Cl
2
的实验室制法。
2.培养学生严谨求实、勇于探索的科学作风。
3.对学生进行安全教育和环境教育。
二、教学重点与难点
1、除杂试剂的选择
2、氯气的收集装置的搭建
三、教学过程:
投影:1915年4月22日,在第一次世界大战的比利时伊珀尔战场。
趁着顺风,德军一声令下开启了大约6000只预先埋伏的装满氯气压缩钢瓶。
刹那间在68千米宽的正面形成2米高的黄绿色气体幕墙滚滚向前推进,对手毫无防范,致使5千多人死亡,一万五千多人中毒致伤。
一位战地记者进行了如此描述:“他们已经死亡,两手伸展着好像要挥去上方的死神。
尸体遍野,他们极度痛苦的肺在喘息,满嘴都是黄色液体。
”这就是战争史上的第一次化学战。
从此,化学战作为最邪恶的战争被写入了人类战争的史册。
但是,氯气是一种重要的化工原料,广泛用于制造各种含氯化合物、造纸、印染及自来水消毒等工业。
极大的推动了人类文明的发展和社会的进步,为我们的生活带来很多便利。
学习化学是为了应用化学,造福人类.
投影:舍勒发现氯气的方法(二氧化锰与浓盐酸共热)至今还是实验室制取氯气的主要方法之一。
请写出舍勒发现氯气的化学反应方程式:
板书:1.实验室制法
(1)制取原理 MnO
2 +4HCl(浓) MnCl
2
+Cl
2
↑+2H
2
O
思考:①将该反应的离子反应方程式,指出氧化剂、还原剂、氧化产物和还原产物?浓盐酸在反应中表现了几个作用?(学生上台书写离子方程式)
②能否用其他氧化剂代替MnO2
过渡:想一想:实验室如何安全制取纯净干燥的Cl
2
?
温故知新:实验室制备干燥纯净的CO
2
提示:①制取较多气体选择什么样的发生装置?
②制取的Cl
2
中含有哪些杂质气体?用什么方法除去这些杂质气体?
③如何收集干燥纯净的Cl
2
?
④Cl
2有毒,我们能不能将Cl
2
直接排放到空气,如果不能,我们应该怎么做?
讲述:在制取物质时,我们还需要知道反应物和生成物的状态,反应的条件等。
浓盐酸是无色液体,二氧化锰是黑色固体。
提问:你认为应该选哪个装置作为发生装置呢?
讲述:很好,这是一个固液加热反应装置。
这是烧瓶,烧瓶下面垫有石棉网,用酒精灯加热。
这是分液漏斗。
提问:你知道分液漏斗有什么作用呢?讲述:很好,分液漏斗可以使发生装置处于密封状态,还可以控制滴入烧瓶的浓盐酸的量,方便控制反应。
提问:产生的氯气中,会有哪些杂质?怎样除去?讲述:氯化氢和水具有挥发性,依据物质分离提纯原则“不增,不减,好分,复原”,氯化氢气体用饱和食盐水溶液吸收,水蒸气用干燥剂浓硫酸或无水氯化钙吸收。
讲述:现在我们可以收集氯气了。
收集气体一般有排气法和排水法,排气法又分为向上排空气法和向下排空气法。
提问:你选择哪个装置收集氯气呢?追问:为什么?
讲述:因为氯气有毒,不能直接用向上排空气法。
这样会使氯气散发到大气中,污染环境。
我们要用改进型的向上排气法收集,集气瓶上有双孔塞,气体可以从一个空进入另一个孔出,防止污染大气。
提问:气体应该从哪个孔进入呢?追问:为什么?
讲述:很好,长进短出。
因为氯气比空气重,从长孔进,更容易将大气排的彻底。
收集的氯气较纯。
设问:根据学过的氯气的性质,应该选用什么溶液来吸收?
答:易溶于水的NaOH溶液吸收原理:Cl
2+2NaOH==NaCl+NaClO+ H
2
O
学生活动:设计一套制取干燥纯净氯气的实验装置
展示学生活动成果
评价:
板书:(2)制取装置
发生装置固体与液体加热制气体
除杂装置先用饱和食盐水除去混有的HCl气体,再用浓硫酸或无水氯化钙除去水蒸气
收集装置向上排空气法收集
尾气处理装置氯气有毒,用NaOH溶液吸收。
课堂小结 1.任何事物都有两面性,正确使用化学物质和化学技术至关重要。
2.制备实验的二意识、三原理、四过程
二意识:安全意识与环保意识
三原理:反应原理、装置原理、操作原理
四过程:气体发生过程、净化过程、收集过程、尾气处理过程。
