2019版高中化学专题复习 (1)
高中2019版化学新教材必修一必修一复习要点

1、氢氧化铝、氯气、氨气的制备原理(方程式及装置、除杂、干燥、收集)、注意事项
2、写方程式:催化氧化(2个)、可逆反应(2个)、氨气与酸反应生成盐(3个)、制取漂白液,漂白粉、制硅酸(2个)、制单质硅(3个)、体现二氧化硫氧化性(1个)、工业制硝酸、氢氧化铁,氢氧化铝受热分解
3、遇水显碱性的气体是;可溶于氢氟酸(HF)的酸性氧化物是;跟强碱溶液反应生成氢气的单质是(2个);
4、特殊物质的物理性质:(抄写记忆)
①有色气体:氟气(淡黄绿色)、氯气(黄绿色)、二氧化氮气体(红棕色)等。
②无色但在空气中显红综色的气体:一氧化氮气体。
③有刺激性气味的气体:氨气、二氧化硫气体、氯气。
④有臭鸡蛋气味的气体:硫化氢气体。
⑤在水中溶解度最大的气体:氨气。
⑥最轻的气体:氢气。
⑦深红棕色液态纯净物:单质溴。
5、新制氯水的成分(7种)、雷雨发庄稼的原理、工业制硝酸
6、卤素的性质(与氢气反应,与水反应,置换反应,特性)
7、氨气、氯气、二氧化硫、铵根离子、氯离子、铁离子、亚铁离子的检验。
高中化学专题:物质的分类及计量-高一化学上学期单元复习知识清单(苏教版2019必修第一册)
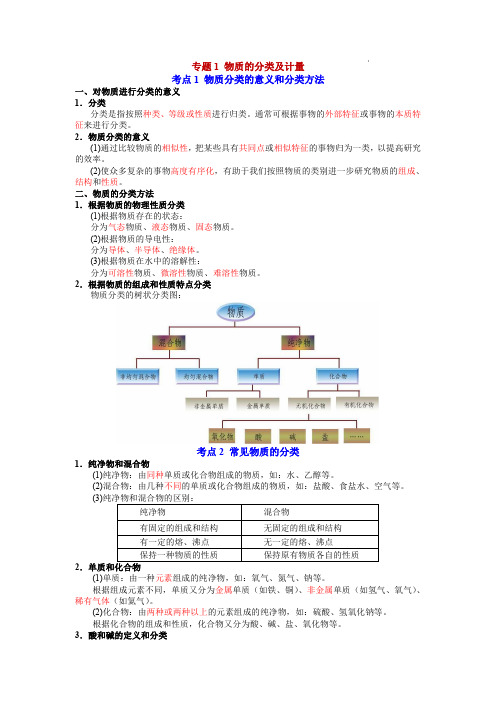
专题1物质的分类及计量考点1物质分类的意义和分类方法一、对物质进行分类的意义1.分类分类是指按照种类、等级或性质进行归类。
通常可根据事物的外部特征或事物的本质特征来进行分类。
2.物质分类的意义(1)通过比较物质的相似性,把某些具有共同点或相似特征的事物归为一类,以提高研究的效率。
(2)使众多复杂的事物高度有序化,有助于我们按照物质的类别进一步研究物质的组成、结构和性质。
二、物质的分类方法1.根据物质的物理性质分类(1)根据物质存在的状态:分为气态物质、液态物质、固态物质。
(2)根据物质的导电性:分为导体、半导体、绝缘体。
(3)根据物质在水中的溶解性:分为可溶性物质、微溶性物质、难溶性物质。
2.根据物质的组成和性质特点分类物质分类的树状分类图:考点2常见物质的分类1.纯净物和混合物(1)纯净物:由同种单质或化合物组成的物质,如:水、乙醇等。
(2)混合物:由几种不同的单质或化合物组成的物质,如:盐酸、食盐水、空气等。
(3)纯净物和混合物的区别:纯净物混合物有固定的组成和结构无固定的组成和结构有一定的熔、沸点无一定的熔、沸点保持一种物质的性质保持原有物质各自的性质2.单质和化合物(1)单质:由一种元素组成的纯净物,如:氧气、氮气、钠等。
根据组成元素不同,单质又分为金属单质(如铁、铜)、非金属单质(如氢气、氧气)、稀有气体(如氦气)。
(2)化合物:由两种或两种以上的元素组成的纯净物,如:硫酸、氢氧化钠等。
根据化合物的组成和性质,化合物又分为酸、碱、盐、氧化物等。
3.酸和碱的定义和分类(1)酸和碱的定义酸是指电离出来的阳离子全部是氢离子的化合物,如硫酸、HCl、硝酸等碱是指离出来的阴离子全部是氢氧根离子的化合物,如氢氧化钾、氢氧化钙等。
(2)酸的分类①根据组成,将酸分为无氧酸和含氧酸无氧酸:不含氧元素的酸,如HCl等。
含氧酸:含氧元素的酸,如H2SO4、HNO3等。
②根据在水溶液中电离出的H+个数,分为一元酸(如HCl、HNO3)、二元酸(如H2SO4、H2CO3)和三元酸(如H3PO4)。
高中化学苏教版(2019)必修第一册专题1第一单元物质及其反应的分类

第一单元 物质及其反应的分类
自主预习·新知导学 合作探究·释疑解惑
课堂小结
课标定位素养阐释
1.从宏观和微观的角度认识物质的多样性,根据物质的组成 和性质可以对物质进行分类。 2.认识分类对化学研究的重要性,形成学习化学的分类观。 3.从物质类别的角度认识同类物质具有相似性,一定条件下 物质可以相互转化。通过研究各类物质之间的反应关系, 初步认识研究物质通性的思路和方法。
⑥CaCl2(熔融) Ca+Cl2↑ ⑦Ca(OH)2+2HCl CaCl2+2H2O
2.物质转化的条件。
物质的转化 光合作用
转化的条件 光照
Fe2O3+3CO 3CO2+2Fe 高温
CaCO3 CaO+CO2↑
高温
物质的转化 转化的条件 置换反应 通常活动性强的单质置换活动性较弱的单质 复分解反应 通常有沉淀析出、气体放出或有水等物质生成
物质类别 酸
化学通性
酸+指示剂:能使紫色石蕊溶液变红,无色酚酞溶液
不变色
酸(非氧化性酸)+活泼金属 酸+碱性氧化物 盐+水 酸+碱 盐+水 酸+盐 新盐+新酸
盐+H2
物质类别 碱
化学通性 碱+指示剂:能使紫色石蕊溶液变蓝,无色酚酞溶液 变红 碱+酸性氧化物 盐+水 碱+酸 盐+水 碱+盐 新盐+新碱
归纳提升
1.金属、氧化物、酸、碱和盐的化学通性。
物质类别 化学通性
金属
活泼金属+非氧化性酸 盐+H2 较活泼金属+较不活泼金属的盐 较活泼金属的盐+较不活泼金属
1.1物质的组成、性质和分类(新课标

---------------------------------------------------------------最新资料推荐------------------------------------------------------1.1物质的组成、性质和分类(新课标)2019 版高中化学二轮专题复习学案:1.1 物质的组成、性质和分类(新课标)物质的组成、性质和分类(新课标)专题一基本概念【备考策略】根据近几年高考命题特点和规律,复习本专题时,要注意一下几个方面。
1.要特别注意对国际单位制中七个基本物理量之一的物质的量的理解,不仅知道它是建立宏观与微观连接的重要物理量,更重要的是要了解它的内涵和外延,建构以物质的量为中心的知识网络体系。
比较重要的题型是有关阿伏加德罗常数的问题,涉及的概念很多。
另外,有关物质的量的计算以及物质的量应用于化学方程式的计算等。
2.对氧化还原反应概念的理解,纵观近年高考命题的发展趋势,氧化还原反应除注重考查基本概念外,出现了将氧化还原反应方程式配平和物质的分析推断相结合的趋势,特别是从生活应用入手,设计新的问题背景和思考阶梯。
3.离子反应:该类题目的主要题型有三个:一是考查离子方程式的书写,从高考试题的表现形式来看,除考查中学化学教材中所涉及的典型的离子反应方程式的书写外,越来越注重有关知识迁移应用的考查即信息给予题。
二是判断离子反程式的正误。
1 / 23三是离子共存题,离子共存的条件是:在溶液中离子之间不发生任何化学反应,如复分解反应,氧化还原反应,相互促进的水解反应,络合反应等。
在分析判断过程中,除要熟悉常见离子不能共存时所发生的离子反应外,还要注意题目的要求、限制条件,多种离子间的相互影响。
4.能源是社会生产生活中的热点问题。
复习时要理解燃烧热、中国和热、反应热到呢个概念,明确热化学方程式的书写,加强与电化学、化学平衡的联系与拓展,牢牢抓住盖斯定律的实质,并能熟练应用第 1 讲物质的组成、性质和分类【考纲点击】 1. 理解混合物和纯净物、单质和化合物、金属和非金属的概念。
人教课标版 2019版高考化学专题复习PPT1(46份) 18

1.乙烯的物理性质 乙烯在通常情况下是一种无色、略有气味的气体,密度比空气略小,① 难 溶于水。
2.乙烯的结构
栏目索引
乙烯的分子式是C2H4,结构简式是②
,电子式是③
。
乙烯分子中的碳、氢原子都位于同一平面上。
3.乙烯的化学性质 在一定条件下,乙烯可发生④ 氧化 、⑤ 加成 和⑥ 加聚 反 应。 (1)乙烯在空气中燃烧,产生明亮的火焰且伴有黑烟,反应的化学方程式 为⑦ C2H4+3O2
(
)
A.2,2-二甲基丙烷也称新戊烷 B.由乙烯生成乙醇属于加成反应 C.分子式为C5H11Cl的有机物共有8种(不含立体异构) D.所有的糖类、油脂、蛋白质都可以发生水解反应
栏目索引
解题导引 书写C5H11Cl的同分异构体时要注意方法和有序性。
解析 2,2-二甲基丙烷的结构简式为
,习惯命名法命 CH3CH2OH,属于加成反
注意 (1)以上4种分子中的H原子如果被其他原子取代,则取代后的分 子空间构型基本不变。
(2)共价单键可以自由旋转,共价双键和共价三键则不能旋转。
栏目索引
例2 (2017湖南郴州第二次质量监测,10)有机物M的结构简式如下所 示。下列说法中正确的是 ( )
A.M中不含手性碳原子
B.M中所有碳原子均可能处于同一平面 C.M可以发生加成、取代、消去等反应
CH2Br—CH2Br ;
CH3CH2OH 。
(3)在适当温度、压强和有催化剂存在的情况下,由相对分子质量小的 化合物相互结合成相对分子质量大的高分子的反应叫聚合反应。 nCH2 CH2 4.乙烯的用途 乙烯是一种重要的基本化工原料,用于制 塑料 、合成纤维、有
������
������
苏教版(2019)高中化学必修第一册专题1《物质的分类及计量》单元检测题(含答案)

《物质的分类及计量》单元检测题一、单选题1.设NA代表阿伏加德罗常数的值,下列说法正确的是( )A.KClO3+6HCl=KCl+3Cl2↑+3H2O中,生成13.44L(标准状况)Cl2转移电子数为AB.标准状况下,和2混合后,原子总数小于2NAC.足量的MnO2与一定量的浓盐酸反应得到1molCl2,若向反应后的溶液中加入足量的AgNO3,则生成AgCl的物质的量为2molD.56gFe与一定量的稀硝酸反应,转移电子数可能为A 2.下列说法正确的是A.1mol的H2的体积为含有的原子数就是阿伏伽德罗常数C.17gNH3中含有的电子数为10 D.N2和CO的摩尔质量相等,都是283.设NA为阿伏加德罗常数的数值,下列说法正确的是A.将氯化铁溶于1L水中,所得溶液含有0.1 NA个Fe3+B.1LpH=4的醋酸中有4NA个H+C.标准状况下,盐酸含有NA个HCl分子D.1mol NaHSO4溶于水,电离出的阳离子为2NA个4.在相同的温度和压强下,CO和N2的体积相同,则下列它们的()一定相同。
(1)分子数(2)原子数(3)密度(4)质量(5)物质的量A.只有(1)(5)B.只有(1)(2)(4)(5)C.只有(2)(3)(4)(5)D.(1)(2)(3)(4)(5)5.下列变化中,不能够通过两种物质之间化合反应一步实现的是()A.Fe(OH)2→Fe(OH)3B.SiO2→CaSiO3C.Na→Na2O2D.FeCl3→FeCl26.标准状况下,相同体积的某物质X与H2,前者质量是后者16倍的是( )A.CH4B.H2O C.S D.O27.下列说法中错误的是 ( )A.在沸水中滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,可制得氢氧化铁胶体B.100mL1mol/L的MgCl2溶液比溶液的导电性强C.NH3溶于水后,溶液能够导电,但NH3是非电解质D.Cu和NaOH溶液均能导电,故Cu和NaOH均为电解质8.设N A 为阿伏加德罗常数的值。
人教课标版 2019版高考化学专题复习PPT1(46份) 13
)
栏目索引
解题导引 SiO2为原子晶体;聚乙烯分子中无碳碳双键;Na2O2由Na+和
O2 2 构成。
解析
SiO2不是分子晶体,它是由Si、O两种原子按一定比例构成的
具有空间网状结构的物质,故A错误;乙烯分子中含有碳碳双键,发生加 聚反应后,双键打开变单键,形成高分子,故B错误;过氧化钠是离子化合 物,它是由钠离子和过氧根离子构成的,故C错误。
A.简单离子半径的大小:Y<X<Z B.X的简单氢化物的沸点在同族元素中最高 C.Y分别与W、Z形成的两种化合物中化学键类型相同 D.Z的氧化物对应的水化物为强酸
栏目索引
解题导引 2NaCl+2H2O 键
解析
2NaOH+H2↑+Cl2↑
水分子间有氢
HClO4为氯元素的最高价含氧酸 由题意可知,W、X、Y、Z分别为氢、氧、钠、氯,m、n分别
2.用电子式表示某物质的形成过程 通式:原子的电子式 离子化合物的电子式(或共价化合物的电子式)
栏目索引
3.结构式的书写方法
用短线“—”表示共用电子对的式子。常见物质的结构式如下表。
化学式 N2 结构式 化学式 CH4 结构式
NH3
CO2
HCl
H—Cl
HClO
H—O—Cl
栏目索引
例 (2017山西大同调研,7)下列化学符号正确的是 ( A.二氧化硅的结构式为O Si O B.聚乙烯的结构简式为 C.过氧化钠的电子式为 D.羟基的电子式为
(1)由金属元素与非金属元素形成的化学键不一定是离子键。如BeCl2、
AlCl3等都只含有共价键,它们是共价化合物。 (2)由阳离子和阴离子通过离子反应生成的化合物不一定是离子化合 物。如H++OH-
2019版高考化学专题复习ppt1(46份) 人教课标版
氯化钠溶液
性质
混合液
均一 较稳定 能 不能 有丁达尔效应 不均一、不透明 不稳定 不能 不能 静置分层
外观 稳定性 能否透过滤纸 能否透过半透膜 鉴别
均一、透明 稳定 能 能 无丁达尔效应
• • • • • • • • • • • • • • • • • • • • • • • • • • • • • • •
栏目索引
4.酸的氧化性与氧化性酸不同。酸的氧化性指H+的氧化性;氧化性酸指
中心原子具有氧化性的酸,如HClO、HNO3、浓H2SO4。
5.非金属氧化物不一定是酸性氧化物,如CO、NO等。 6.酸性氧化物不一定是非金属氧化物,如Mn2O7、CrO3。 7.金属氧化物不一定是碱性氧化物,如Al2O3、ZnO(两性氧化物),Mn2O7、 CrO3(酸性氧化物)。 8.碱性氧化物一定是金属氧化物。 9.酸酐不一定是酸性氧化物,如乙酸酐(CH3CO)2O等。 10.酸性氧化物一定是酸酐。 11.酸性氧化物不一定能与水反应生成相应的酸,如SiO2。 12.Na2O2与酸反应不仅生成盐和水,还生成O2,因而不是碱性氧化物。
栏目索引
(3)③ 固
溶胶,如烟水晶、有色玻璃。
4.性质
(1)丁达尔效应 当光束通过胶体时,可以看到一条光亮的“通路”。这是胶体粒子对光 线④ 散射 形成的,叫做丁达尔效应。 现象; ;
说明 a.丁达尔效应是⑤ 物理
b.利用丁达尔效应可区别⑥ 溶液和胶体
c.丁达尔效应能证明分散质粒子直径的大小范围; d.当光束通过胶体时,看到的光亮的“通路”是光被胶体粒子散射的现 象,并不是胶体粒子本身发光。
分散系
栏目索引
二
溶液
1.饱和溶液
在一定温度下,向一定量溶剂里加入某种溶质,当溶质不能继续溶解时, 所得到的溶液叫做这种溶质的饱和溶液。
2019版高考化学专题复习ppt1(46份) 人教课标版17
专题十三
钠、镁、铝及其化合物
栏目索引
知识清单
考点一
一 钠的性质、制取、保存及用途
钠及其化合物
<基础知识>
栏目索引
栏目索引
二
NaOH的性质
1.物理性质
俗名烧碱、火碱、苛性钠,是一种白色固体,易吸收空气中的水分而潮 解,易溶于水并放热,水溶液有涩味。
2.化学性质
NaOH来源广泛,是一种最常用的一元强碱,有强腐蚀性,具有碱的通性。
1 3
栏目索引
例 (2017湖南湘中名校联考,16)实验研究发现,硝酸发生氧化还原反应 时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定
量铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气
体放出。在反应结束后的溶液中逐滴加入2 mol· L-1的NaOH溶液,所加 NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)关系如图所示。
栏目索引
具体反应有:
Al(OH)3+OH-
Al(OH)3+3H+ Al3++3OH- Al +4H+ O 2 Al3++4OH-
+ Al O 2 +H +H2O
O Al 2 +2H2O
Al3++3H2O Al(OH)3↓ Al(OH)3↓
Al3++2H2O Al +2H2O O 2 4Al(OH)3↓
+ 2Al +H O;Al(OH) +3H 2 3 O 2
Al3++
3H2O,Al(OH)3+OH-
2019版高考化学复习第一部分专题收官篇第1讲有机化学基础课件
[说明]
命名含有多个不同官能团的化合物时,要选择优
先的官能团作为母体,官能团作为母体的优先顺序为(以“>” 符号表示优先)羧酸>酯>醛>酮>醇>卤素原子。
[典例2]
写出下列有机物名称: 2乙基1丁烯
2,3二甲基1,3丁二烯 邻甲基乙苯 3甲基2氯丁烷 3甲基2乙基1丁醇 。
2甲基丙醛
(三)有机物分子中原子共面、共线问题 的判断
酚羟基、碳碳双键、羧基 ________________________。
(2)
酯基、酚羟基、醚键、碳碳双键 : _____________________________。
氯原子、酯基、醛基
(4)
碳碳双键、醇羟基、醛基 。 :__________________________
(二)有机物的命名方法
常见有机物名称、分子式(结构简式)书写 常见反应类型、官能团、反应条件 同分异构体的判断(种类)与书写
易 易 难
有机化学方程式书写 有机物结构推断与书写 有机合成路线的设计、空间结构 新信息学习与迁移、整合与利用
较易 较易 较易 较难
二、复习策略 二轮有机复习,要注重以下 3 点:
1.以“结构决定性质,性质反映结构”为核心,强化官 能团的结构、性质、鉴别,反应方程式的书写,反应类型的判 断以及断键与成键分析能力的培养,能根据题中信息灵活迁 移,做到“变化之处模仿,不变之处保留”。
、 振氢谱为两组峰,峰面积比为 1∶1)____________________ 。
2.(2018· 全国卷Ⅲ)近来有报道,碘代化合物 E 与化合物 H 在 CrNi 催化下可以发生偶联反应,合成一种多官能团的化合物 Y,其合 成路线如图:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
题型八框图、结构分析判断型
1.(2018·日照市高三5月校际联考)前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。
其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。
下列说法正确的是()
A.简单离子半径:Z>Y
B.反应①为吸热反应
C.反应②为工业上制备漂白粉的反应原理
D.X、Y分别与Z形成的化合物中,化学键类型一定相同
答案 C
解析根据题给信息分析可知,常温下乙为液体,乙为水,W为氢元素,Y为氯元素,A为氯气;甲为钙,与水反应生成氢氧化钙,X为氧,Z为钙;化合物丁和化合物戊可能为氯化钙或次氯酸钙。
A项,核外电子排布相同的离子,核电荷数越大,离子半径越小,所以Ca2+< Cl-,错误;B项,钙与水剧烈反应,放出大量的热,反应为放热反应,错误;C项,钙与水反应生成氢氧化钙,氢氧化钙与氯气反应生成氯化钙和次氯酸钙,为工业上制备漂白粉的反应原理,正确;D项,过氧化钙中含有离子键和非极性共价键,而氯化钙只有离子键,错误。
2.(2018·聊城市高三三模)短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常作引发剂;e、f为常见气体单质。
下列有关说法正确的是()
A.简单离子的半径:Y>Z>X
B.简单氢化物的沸点:Y>X
C.最高价氧化物对应水化物的碱性:Z>Y
D.W、Y的氧化物所含化学键类型相同
答案 B
解析短周期元素W、X、Y、Z的原子序数依次增加,其中a、b、d、g为化合物,a为淡黄色固体,则a为过氧化钠;c是Z的单质,在铝热反应中常作引发剂,c为金属镁;e、f 为常见气体单质,根据框图,镁与化合物b反应生成气体单质f,则f为氢气;过氧化钠与化合物b反应生成气体单质e,则e为氧气,则b为水,d为氢氧化钠,g为氢氧化镁。
根据上述分析,a为过氧化钠,b为水,c为镁,d为氢氧化钠,e为氧气,f为氢气,g为氢氧化镁;则W为H、X为O、Y为Na、Z为Mg。
A项,X为O、Y为Na、Z为Mg,简单离子具有相同的电子层结构,离子半径:X>Y>Z,错误;B项,氢化钠是离子化合物,沸点高于水,正确;C项,元素的金属性越强,最高价氧化物对应水化物的碱性越强,碱性:Y>Z,错误;D项,水或过氧化氢都是共价化合物,只含有共价键,氧化钠或过氧化钠都属于离子化合物,含有离子键,化学键类型不同,错误。
3.(2018·新余市高三二模)元素W、X、Y、Z的原子序数依次增加,p、q、r是由这些元素组成的二元化合物;m、n分别是元素Y、Z的单质,m是常见的金属单质,n通常为深红棕色液体;0.01 mol·L-1 r溶液的pH为2,p被英国科学家法拉第称为“氢的重碳化合物”,s通常是难溶于水、比水重的油状液体。
上述物质的转化关系如图所示。
下列说法错误的是()
A.q的溶液显酸性
B.W的氧化物常温常压下为液态
C.Z的氧化物的水化物一定为强酸
D.p不能使酸性高锰酸钾溶液褪色
答案 C
解析由题中的信息可知,p为苯,n为溴,s为溴苯,q为溴化铁,m为铁,W为H,X为C,Y为Fe,Z为Br。
A项,q为溴化铁,三价铁离子水解,溶液显酸性,正确;B项,W 的氧化物是水或过氧化氢,常温常压下为液态,正确;C项,Z的氧化物的水化物若为HBrO4时为强酸,若为HBrO时则为弱酸,错误;D项,p为苯,苯分子中没有双键,不能使酸性高锰酸钾溶液褪色,正确。
4.(2018·青州市高三三模)短周期主族元素X、Y、Z、W的原子序数依次增大。
四种元素形成
的单质依次为m、n、p、q;这些元素组成的二元化合物r、t、u,其中u为形成酸雨的主要物质之一;25 ℃时,0.01 mol·L-1的v溶液中pH=12。
上述物质的转化关系如图所示。
下列说法正确的是()
A.原子半径的大小:W>Z>Y>X
B.v能抑制水的电离而u能促进水的电离
C.粘有q的试管可用酒精洗涤
D.Z分别与Y、W组成的化合物中化学键类型可能相同
答案 D
解析短周期主族元素X、Y、Z、W的原子序数依次增大,四种元素形成的单质依次为m、n、p、q,r、t、u是这些元素组成的二元化合物,其中u为形成酸雨的主要物质之一,u为SO2;25 ℃时,0.01 mol·L-1的v溶液中pH=12,则v为NaOH,结合图中转化可知,m为H2,n为O2,p为Na,r为H2O,t为Na2O2,则X、Y、Z、W分别为H、O、Na、S,q为S单质,以此解答该题。
A项,电子层越多,原子半径越大,同周期从左向右原子半径逐渐减小,则原子半径的大小:X<Y<W<Z,错误;B项,u为SO2,与水反应生成亚硫酸,溶液呈酸性,抑制水的电离,错误;C项,q为S单质,微溶于酒精,故粘有q的试管不可用酒精洗涤,应用浓的氢氧化钠溶液,错误;D项,Z分别与Y、W组成的化合物Na2O、Na2S中化学键类型均为离子键,正确。
5.(2018·茂名市五大联盟学校高三五月联考)X、Y、Z、W 为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。
X、Z、W形成的最高价氧化物分别为甲、乙、丙。
x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。
其转化关系如图所示,下列判断错误的是()
A.反应①、②、③都属于氧化还原反应
B.X、Y、Z、W四种元素中,Y的原子半径最小
C.Na 着火时,可用甲扑灭
D.一定条件下,x与甲反应生成丁
答案 C
解析 根据题中信息可判断x 为碳,丙为二氧化硅,在高温条件下碳与二氧化硅反应生成w 为硅、丁为一氧化碳;y 2为氧气,碳与氧气点燃反应生成甲为二氧化碳,z 为镁,二氧化碳在镁中点燃反应生成碳和乙,乙为氧化镁。
A 项,反应①二氧化碳与镁反应、②碳与氧气反应、③碳与二氧化硅反应都属于氧化还原反应,正确;B 项,同周期元素原子从左到右半径依次减小,同主族元素原子从上而下半径逐渐增大,故C 、O 、Mg 、Si 四种元素中,O 的原子半径最小,正确;C 项,Na 着火时,不可用二氧化碳扑灭,错误;D 项,一定条件下,碳与二氧化碳在高温条件下反应生成一氧化碳,正确。
6.(2018·安徽省皖南八校高三第三次联考)四种短周期元素X 、Y 、Z 、W 原子序数依次增大,其中Y 是构成物质种类最多的一种元素。
m 、n 、p 均为由这些元素组成的二元化合物,甲、乙、丙是其中三种元素对应的单质,m 的自述是“诞生在闪电的弧光中,强大的能量造就了我”。
n 能使湿润的红色石蕊试纸变蓝。
上述物质的转化关系如图所示(反应条件已略去)。
下列说法正确的是( )
A.常温常压下,X 与Y 组成的化合物一定为气体
B.X 、Z 、W 三种元素不能组成离子化合物
C.原子半径:X<W<Y<Z
D.图示转化关系中涉及的反应均为氧化还原反应
答案 D
解析 由框图和m 的自述,推知m 为NO ,n 能使湿润的红色石蕊试纸变蓝知n 为NH 3,知丙为N 2,甲为O 2,乙为H 2;Y 是构成物质种类最多的一种元素知Y 为C ,短周期主族元素X 、Y 、Z 、W 的原子序数依次增大知X 为H 、Z 为N 、W 为O 。
A 项,常温常压下,X 与Y 组成的化合物为烃,可以为气体、液体、固体,错误;B 项,X 、Z 、W 三种元素组成的化合物可以是NH 4NO 3,属于离子化合物,错误;C 项,原子半径:C>N>O>H ,错误;D 项,图示转化关系中涉及的反应为:N 2+O 2===2NO ;3H 2+N 2=======高温、高压
催化剂
2NH 3;6NO +4NH 3===5N 2+6H 2O 均为氧化还原反应,正确。
7.(2018·赣州市高三适应性考试)短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、
C、D、E均由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如图所示的关系。
下列说法不正确的是()
A.离子半径大小关系:Y>Z>X>W
B.YX2遇到蓝色石蕊试液先变红后褪色
C.简单阴离子的还原性:Y>Z
D.Y与Z属于同一周期,与X属于同一主族
答案 B
解析B是自然界最常见的液体,所以B为水;A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,可推断A为Cl2,C为SO2,E是三元化合物,则E为H2SO4。
因为短周期主族元素W、X、Y、Z的原子序数依次增大,所以W、X、Y、Z分别为H 、O 、S 、Cl。
A项,离子半径大小关系:S2->Cl->O2->H+,正确;B项,YX2为SO2,为酸性氧化物,遇到蓝色石蕊试液变红不会褪色,错误;C项,简单阴离子的还原性:S2->Cl-,正确;D 项,Y为S,Z为Cl属于同一周期,X为O与S属于同一主族,正确。
