4.碘化铅溶度积
光度法测定碘化铅溶度积常数的探究

光度法测定PbI2溶度积常数的探究摘要:用分光光度法探究PbI2溶度积常数。
将1.65g硝酸铅与2.15gKI混合制取PbI2沉淀,再将制得的PbI2溶解得到饱和的PbI2溶液。
配制含不同浓度的I-溶液,加入KNO2和盐酸,用分光光度计测得一定浓度的I2的吸光度,绘制出I2的浓度工作曲线。
再用KNO2在酸性条件下氧化I-得到I2,并加入KCl调节离子强度,最后用分光光度计测出I2的吸光度,根据浓度工作曲线算出I2的浓度,并计算出Pb2+的浓度,最后得到PbI2的溶度积常数为1.22×10-8。
1 实验部分1.1实验试剂Pb(NO3)2、PbI2、KNO2、KCl、KI、盐酸。
1.2实验仪器烧杯、玻璃棒、容量瓶、吸量管、比色皿、分光光度计、致密定性滤纸、漏斗、药匙、电炉、电子天平、分析天平、量筒、洗耳球、1.3试验方法将1.65gPb(NO3)2、2.15g KI分别溶解,再将两溶液混合,并不断搅拌。
约15分钟后。
静置,弃去上清液用倾滗法将所得的Pb I2洗净,以洗涤液中检测不到I-为标志。
其中I-的检验:向洗涤液中加入氯水,氯水能够使I-氧化成单质,再利用I2对淀粉极为敏感,从而检验出I-。
最后进行减压过滤,将Pb I2沉淀抽干。
反应方程式:Pb(NO3)2+2KI=2KNO3+PbI2↓2I- +Cl2 =2Cl- +I2取三个干燥的小烧杯并标好号,均加入少量(黄豆粒大小)自制的PbI2。
向PbI2的烧杯中加入24.00mL蒸馏水,并按表一加入KCl、KI溶液。
溶液总体积为25.00mL.表 1不断搅拌混合溶液约15min,静置,待溶液澄清后,用致密的定量滤纸,干燥的漏斗常压过滤,滤液用编好号的干燥的小烧杯收集,注意沉淀不要转移到滤纸上。
取10.00mL于烧杯中,加2mLNaNO2溶液和5滴6mol/L盐酸溶液。
搅拌转移到50mL容量瓶中,加蒸馏水定溶。
用分光光度法测吸光度,再读出浓度。
金属盐类溶度积表

化合物的溶度积常数表化学溶解性表常见物质溶解性CU2+蓝色(稀)绿色(浓) FE3+黄色FE2+浅绿MNO4-紫色,紫红色沉淀的颜色MG(OH)2 ,AL(OH)3 ,AGCL,BASO4,BACO3,BASO3,CASO4等均为白色沉淀CU(OH)2蓝色沉淀FE(OH)3红褐色沉淀AGBR淡蓝色AGI ,AG3PO4黄色CuO 黑Cu2OFe2O3 红棕FeO 黑Fe(OH)3红褐Cu(OH)2 蓝FeS2 黄PbS 黑FeCO3 灰Ag2CO3 黄AgBr 浅黄AgCl 白Cu2(OH)2CO3 暗绿氢氧化铜(蓝色);氢氧化铁(红棕色)氯化银(白色)碳酸钡(白色)碳酸钙(白色)2Mg+O2点燃或Δ2MgO 剧烈燃烧.耀眼白光.生成白色固体.放热.产生大量白烟白色信号弹2Hg+O2点燃或Δ2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2点燃或Δ2CuO 红色金属变为黑色固体4Al+3O2点燃或Δ2Al2O3 银白金属变为白色固体3Fe+2O2点燃Fe3O4 剧烈燃烧、火星四射、生成黑色固体、放热4Fe + 3O2高温2Fe2O3C+O2 点燃CO2 剧烈燃烧、白光、放热、使石灰水变浑浊S+O2 点燃SO2 剧烈燃烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2 点燃2H2O 淡蓝火焰、放热、生成使无水CuSO4变蓝的液体(水)高能燃料4P+5O2 点燃2P2O5 剧烈燃烧、大量白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2点燃2H2O+CO2 蓝色火焰、放热、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)甲烷和天然气的燃烧2C2H2+5O2点燃2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO2 Δ2KCl +3O2↑ 生成使带火星的木条复燃的气体实验室制备氧气2KMnO4Δ K2MnO4+MnO2+O2↑ 紫色变为黑色、生成使带火星木条复燃的气体实验室制备氧气2HgOΔ2Hg+O2↑ 红色变为银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O通电2H2↑+O2↑ 水通电分解为氢气和氧气电解水Cu2(OH)2CO3Δ2CuO+H2O+CO2↑ 绿色变黑色、试管壁有液体、使石灰水变浑浊气体铜绿加热NH4HCO3ΔNH3↑+ H2O +CO2↑ 白色固体消失、管壁有液体、使石灰水变浑浊气体碳酸氢铵长期暴露空气中会消失Zn+H2SO4=ZnSO4+H2↑ 有大量气泡产生、锌粒逐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解Mg+H2SO4 =MgSO4+H2↑ 有大量气泡产生、金属颗粒逐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2↑ 有大量气泡产生、金属颗粒逐渐溶解Fe2O3+3H2 Δ 2Fe+3H2O 红色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H2 Δ3Fe+4H2O 黑色逐渐变为银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2Δ W +3H2O 冶炼金属钨、利用氢气的还原性MoO3+3H2 ΔMo +3H2O 冶炼金属钼、利用氢气的还原性2Na+Cl2Δ或点燃2NaCl 剧烈燃烧、黄色火焰离子化合物的形成、H2+Cl2 点燃或光照2HCl 点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色沉淀生成、上部为澄清溶液质量守恒定律实验2C +O2点燃2CO 煤炉中常见反应、空气污染物之一、煤气中毒原因2C O+O2点燃2CO2 蓝色火焰煤气燃烧C + CuO 高温2Cu+ CO2↑ 黑色逐渐变为红色、产生使澄清石灰水变浑浊的气体冶炼金属2Fe2O3+3C 高温4Fe+ 3CO2↑ 冶炼金属Fe3O4+2C高温3Fe + 2CO2↑ 冶炼金属C + CO2 高温2COCO2 + H2O = H2CO3 碳酸使石蕊变红证明碳酸的酸性H2CO3 ΔCO2↑+ H2O 石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变浑浊应用CO2检验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2 白色沉淀逐渐溶解溶洞的形成,石头的风化Ca(HCO3)2Δ CaCO3↓+H2O+CO2↑ 白色沉淀、产生使澄清石灰水变浑浊的气体水垢形成.钟乳石的形成2NaHCO3ΔNa2CO3+H2O+CO2↑ 产生使澄清石灰水变浑浊的气体小苏打蒸馒头CaCO3 高温CaO+ CO2↑ 工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+ H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体逐渐溶解、有使澄清石灰水变浑浊的气体CuO +COΔ Cu + CO2 黑色逐渐变红色,产生使澄清石灰水变浑浊的气体冶炼金属Fe2O3+3CO高温2Fe+3CO2 冶炼金属原理Fe3O4+4CO高温3Fe+4CO2 冶炼金属原理WO3+3CO高温W+3CO2 冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃2CO2+4H2OC2H5OH+3O2点燃2CO2+3H2O 蓝色火焰、产生使石灰水变浑浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4 银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4 溶液由浅绿色变为无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2 红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4 青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O 白色固体溶解Na2O+2HCl=2NaCl+H2O 白色固体溶解CuO+2HCl=CuCl2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O 白色固体溶解MgO+2HCl=MgCl2+ H2O 白色固体溶解CaO+2HCl=CaCl2+ H2O 白色固体溶解NaOH+HCl=NaCl+ H2O 白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O 蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O 白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O 白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O 红褐色沉淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl↓+HNO3 生成白色沉淀、不溶解于稀硝酸检验Cl—的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O 铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O 白色固体溶解CuO+H2SO4=CuSO4+H2O 黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O 白色固体溶解MgO+H2SO4=MgSO4+H2O 白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O 蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O 白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O 白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O 红褐色沉淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理BaCl2+ H2SO4=BaSO4↓+2HCl 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3 生成白色沉淀、不溶解于稀硝酸检验SO42—的原理Na2O+2HNO3=2NaNO3+H2O 白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O 黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O 白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O 白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O 白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O 蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O 白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O 白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O 红褐色沉淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO43NH3+H3PO4=(NH4)3PO42NaOH+CO2=Na2CO3+ H2O 吸收CO、O2、H2中的CO2、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O 处理硫酸工厂的尾气(SO2)FeCl3+3NaOH=Fe(OH)3↓+3NaCl 溶液黄色褪去、有红褐色沉淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl 有白色沉淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl 溶液蓝色褪去、有蓝色沉淀生成CaO+ H2O = Ca(OH)2 白色块状固体变为粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O 有白色沉淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 有白色沉淀生成工业制烧碱、实验室制少量烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH 有白色沉淀生成Ca(OH)2+K2CO3=CaCO3↓ +2KOH 有白色沉淀生成CuSO4+5H2O= CuSO4•H2O 蓝色晶体变为白色粉末CuSO4•H2OΔ CuSO4+5H2O 白色粉末变为蓝色检验物质中是否含有水AgNO3+NaCl = AgCl↓+Na NO3 白色不溶解于稀硝酸的沉淀(其他氯化物类似反应)应用于检验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl 白色不溶解于稀硝酸的沉淀(其他硫酸盐类似反应)应用于检验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl 有白色沉淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓ 有白色沉淀生成CaCO3+2HCl=CaCl2+H2O+CO2 ↑MgCO3+2HCl= MgCl2+H2O+ CO2 ↑NH4NO3+NaOH=NaNO3+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体应用于检验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O 生成使湿润石蕊试纸变蓝色的气体合成氨工业和硝酸的生产密切相关,氨和空气混合后,通过铂铑合金网(催化剂)便被氧化为一氧化氮。
荧光探针法测定碘化铅溶度积常数

的 配合物 D M A B T S — H g ( Ⅱ) , 阻 断 了 电子 转 移 。 D M A B T S —H g ( Ⅱ) 的配 位常数 为 7 . 4 8 x t 0 , 除I 一 外, D M A B T S对 H g 的识 别不受 其它 阳 、 阴离子 干扰 。 [ 4 1 I 一 干扰识别是 因为 I 一 会 取代 D M A B T S 一
降低 ;当 D M A B T S和 H g 的质 量 比 为 1 : 1 . 5
时. 荧 光 完 全 猝 灭 。 这 是 因为 两 者 形 成 了 稳 定
报道 。荧光 探针法是一 种测定难溶 电解质溶度 积 的全新 方法 。用它 测定 P b I : 的溶度 积 常数 ,
可 以直 接 检 测 P b I 饱 和溶 液 中 I 一 浓度 , 不 必象 用 分光光度 法那样 必须先将 I 一 氧 化成 I ,也 不
作者简介 : 俞芸 , 女, 福建长汀人 , 龙岩学院化 学与材料 学院教授 , 主要研 究方向: 有机发 光化合物 的合成 、 荧光分析 。
基金 项 目: 2 0 1 2年福建省级大学生创新创业训练计划项 目( 6 8 2 ) 。
1 4
ቤተ መጻሕፍቲ ባይዱ光探针法测定碘化铅溶度积 常数
a = [ P b ] ( 过量) + 要
当P b I 饱 和溶 液 中 I -  ̄
Ks p a xb
H g z + 储 备 液 , 以 水 稀 释 至 刻 度 ,摇 匀 , 得 D M A B T S — H g ( I I ) 配合 物标准溶 液 ( p H = 5 , 浓度
C= 1 . 0 0 ×1 0 — 5 m o l / L ) 。 在 h e x = 3 2 0 n m、激 发 /
碘化铅是什么

碘化铅(PbI2)是什么?碘化铅:黄色重质(指密度大)六方晶系粉末或晶体。
碘化铅的结构:晶体结构是(IPbI)n六角密堆积结构。
纯净的PbI2 为2H晶型,除此之外,还有12R和4H两种晶型。
2H晶型的六角晶胞常数为a=0.4557nm和c=0.6979nm。
碘化铅的性质:(1)密度:6.16g/cm3。
(2)熔点:402℃。
(3)沸点:954℃。
(4)溶度积:7.1*10-9(20℃)(5)溶解性:微溶于水,在水中的溶解度较小,为0.063克/100克水(20℃),易溶于硫代硫酸钠溶液,不溶于醇和冷盐酸。
(6)无气味,有毒。
(7)二碘化铅有感光性,在潮湿空气中能被光逐渐分解,生成一氧化铅和碘。
(8)热时先变砖红后呈棕色,冷却饱和液时析出闪亮的黄色小片状结晶。
(9)二碘化铅以单分子形式存在,分子呈∨形结构。
(11)禁带宽度:2.3~2.5 eV。
(12)电阻率:~10Ω·cm。
碘化铅的用途:(1)PbI2晶体是一种性能优异的室温核辐射探测器和x射线成像器件材料。
PbI2的平均原子序数较大,对高能射线具有较强的阻止本领。
PbI2晶体的禁带宽度较大,室温下电阻率较高制作成探测器后体漏电流(PN结在截止时流过的很微小的电流。
)较低,且PbI2晶体的载流子迁移率寿命积较大。
PbI2制作成的探测器具有较高的能量分辨率和探测效率。
(2)用于镀青铜金属的着色,嵌镶黄金,制药,印染和照相。
六方晶系:六方晶系六方晶系晶轴在唯一具有高次轴的c轴主轴方向存在六重轴或六重反轴特征对称元素的晶体归属六方晶系。
六次轴六方晶系特征对称性决定了六方晶系晶胞对应的基向量特点是:副轴和均与主轴垂直,二个副轴基向量的大小相等,副轴间的夹角为120°,即其晶胞参数具有a=b≠c,α=β=90°,γ=120°的关系。
六方晶系,有一个6次对称轴或者6次倒转轴,该轴是晶体的直立结晶轴C轴。
另外三个水平结晶轴正端互成120°夹角。
碘化铅(ii),99%标准

碘化铅(ii),99%标准碘化铅(II),99%标准碘化铅(II)是一种重要的无机化合物,广泛应用于化学、制药、材料科学等领域。
本文将详细介绍碘化铅(II)的性质、制备方法、应用及相关的安全注意事项,旨在为读者提供全面的了解。
1、性质碘化铅(II)的化学式为PbI2,是一种无色晶体。
在常温下它为指标形状的结晶,但在高温下会转变为单斜晶系。
其溶解度不高,可溶于氢碘酸、氨溶液等。
碘化铅(II)的密度为6.16 g/cm³,熔点为402°C,沸点超过1000°C。
2、制备方法碘化铅(II)可以通过多种方法制备。
一种常用的方法是将碘与金属铅直接反应。
反应产物可以是蓝色的自由碘,但在适当的条件下也可得到无色的碘化铅(II)。
Pb + I2 -> PbI2另一种制备方式是通过将碘化银与硫酸铅反应而得到:Pb(NO3)2 + 2KI -> PbI2 + 2KNO33、应用碘化铅(II)在化学领域具有广泛的应用。
它可用于制备其他铅化合物,例如碘化亚铅和碘化三铅。
碘化铅(II)也可以用作光学材料的原料,例如晶体和玻璃。
此外,碘化铅(II)在制药领域中也有一定的应用,例如用于合成某些药物和药剂。
4、安全注意事项在使用碘化铅(II)时,需要注意一些安全事项。
首先,碘化铅(II)应当避免直接接触皮肤和眼睛,以免引发刺激和伤害。
其次,避免吸入其粉尘或蒸汽,因为它们可能对呼吸系统造成损害。
在操作过程中,应采取适当的通风措施,并佩戴防护手套和眼镜等个人防护装备。
此外,应妥善储存和处理碘化铅(II),避免与其它化学物品混合,以防意外事故发生。
综上所述,碘化铅(II)作为一种重要的无机化合物,具有广泛的应用前景。
通过了解其性质、制备方法、应用及安全注意事项,读者可以更好地了解和应用碘化铅(II),同时在使用时保证安全。
碘化铅(ii),99%标准

碘化铅(II)分子式为PbI2,是一种黄色针状结晶的物质,是常用的无机化合物之一。
99%纯度的碘化铅(II)的技术要求和标准可能包括以下内容:
1. 外观:99%纯度的碘化铅(II)为黄色或棕色的针状结晶固体,无异物和杂质。
2. 含量:该物质的纯度至少为99%或以上。
3. 溶解度:该物质的溶解度在水中较差,但在浓盐酸和过氧化氢中易溶。
4. 杂质:碘化铅(II)的杂质含量需要控制在一定范围内,例如一些金属元素和氧化物等离子体。
5. 包装:99%纯度的碘化铅(II)一般以密封包装的形式存在,并应标明成分和纯度等信息。
此外,为了确保产品质量和性能,包装材料应耐气候、防潮、防晒。
需要注意的是,具体的技术要求和标准可能会因生产和应用领域而有所不同,建议在使用该物质时参考相关的标准和技术规范。
对于该物质的处理和使用,应当按照相关的安全操
作规程来进行,以确保人员安全和环境保护。
化学纯碘化铅

化学纯碘化铅碘化铅是一种重要的无机化合物,化学式为PbI2。
它是由铅离子和碘离子通过离子键结合而成的晶体。
碘化铅在化学、材料科学等领域具有广泛的应用,特别是在光电器件和光伏领域中有着重要的地位。
本文将从碘化铅的结构、性质以及应用等方面进行介绍。
一、碘化铅的结构碘化铅的晶体结构属于正交晶系,晶胞中包含了两个碘离子和一个铅离子。
每个碘离子被六个铅离子包围,而每个铅离子则被三个碘离子包围。
这种结构使得碘化铅具有较好的稳定性和晶体性能。
二、碘化铅的性质1. 物理性质:碘化铅是一种淡黄色的固体,具有金属光泽。
它的熔点较高,约为402℃,热稳定性较好。
碘化铅在常温下呈半导体性质,能够导电。
2. 化学性质:碘化铅在水中溶解度较低,溶解度随温度的升高而增加。
它与氟化物、氯化物等其他卤化物反应活泼,能够发生置换反应,生成相应的卤化物。
三、碘化铅的应用1. 光电器件:碘化铅具有优异的光电性能,可以用于制备光电器件,如太阳能电池、光电探测器等。
碘化铅光电器件具有高效率、稳定性好的特点,有望在新能源领域得到广泛应用。
2. 光伏材料:碘化铅作为一种半导体材料,具有较好的光伏特性。
它能够吸收可见光和近红外光,将光能转化为电能。
因此,碘化铅被广泛应用于光伏材料的研究和开发,为提高光伏电池的效率做出了重要贡献。
3. 其他应用:碘化铅还可用于光学镀膜、电子材料等方面。
由于碘化铅具有较好的光学性能和电学性能,因此在光学镀膜和电子材料制备中有着广泛的应用前景。
化学纯碘化铅是一种重要的无机化合物,具有良好的结构稳定性和优异的光电性能。
它在光电器件和光伏领域中具有重要的应用价值,有助于推动新能源技术的发展。
随着科学技术的不断进步,碘化铅的应用前景将会更加广阔。
我们对碘化铅的研究和开发仍然有很多探索和挑战,相信在不久的将来,碘化铅会在更多领域展现出其巨大的潜力和价值。
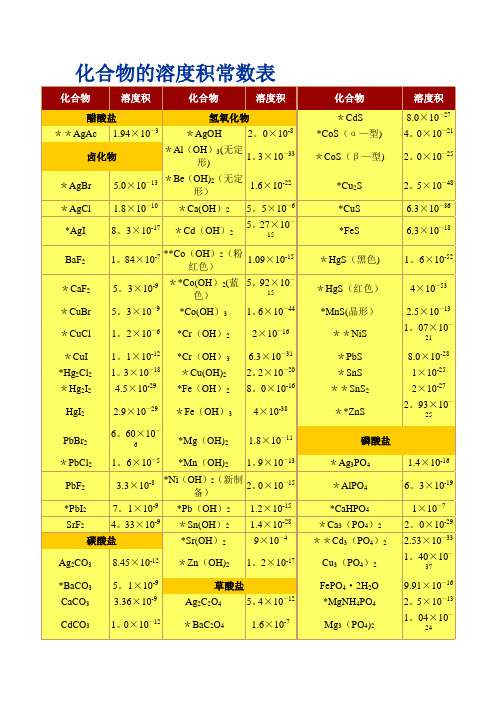
化合物的溶度积常数表
9.7
Mn(OH)2
7。8—8。8
9。8-10.4
14
4×10-14
Mg(OH)2
9。3-10。4
10.8—12.4
5×10-12
Fe(OH)3
1。5-2。3
4。1
14
1.1×10—36
Al(OH)3
3.3—4
5。2
7.8
108
12
15
7×10-31
*CaSO4
9。1×10—6
**Al(8—羟基喹啉)3
5×10-33
*CaCrO4
7。1×10—4
Hg2SO4
6。5×10—7
*K2Na[Co(NO2)6]·H2O
2.2×10—11
*CuCrO4
3。6×10—6
*PbSO4
1。6×10—8
*Na(NH4)2[Co(NO2)6]
4×10—12
*Hg2CrO4
0。5
C5H7O4N Cu·2。5H2O
3
0。03
(C5H8O4N)2Ba
1.72
C5H8O4N·NH4
76.3
谷氨酸钠
谷氨酸钴
Zn(OH)2
5.4-6。4
8
10。5
13—13
1。0×10—17
Fe(OH)2
6.5—7.5
9。7
13。5
1。6×10—14
Co(OH)2
6。8-7.6
8。7-9。2
14.1
2。6×10-16
Ni(OH)2
6。7—7。7
8.9-9。5
4。8×10—16
Pb(OH)2
7。2
8。7
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、实验原理
采用阳离子交换树脂与碘化铅饱和溶液中的铅 离子进行交换 2R-H + Pb2+ = R-Pb -R+ 2H+
将一定体积的碘化铅饱和溶液通入阳离子交换 树脂,铅离子与氢离子换后,氢离子流出液的 氢离子浓度进行测定,从而计算出通过离子交 换树脂的饱和碘化铅溶液中铅离子的浓度,进 而求得碘化铅的溶度积。
Chemistry
四、实验步骤
3. 交换
(1)用温度计测量饱和碘化铅溶液温度并记录; (2)用移液管准确量取20.00 mL饱和碘化铅上层清液,放 入50 mL烧杯中; (3)分三次将烧杯中的饱和碘化铅溶液转移至交换柱内, 控制流出液的速率,用250 mL容量瓶收集流出液,待碘化铅 饱和溶液流出后,继续向离子交换柱中持续加入蒸馏水,保 持柱内液面高于树脂; (4)交换过程中利用pH试纸检测流出液pH值,观察试纸颜 色变化,当流出液呈中性,关闭活塞。
四、实验步骤
1. 碘化铅饱和溶液的配置
称取约1 g碘化铅固体,倒入500 mL锥形瓶中,加入约200 mL煮沸过的蒸馏水,摇动锥形瓶,使药品充分溶解。
Chemistry
四、实验步骤
2. 装柱
(1)清洗离子交换柱; (2)底部填少量玻璃棉,加入约40g左右强酸型离子 交换树脂,用自来水冲洗树脂至无色,将交换柱固定在 铁架台上,关闭活塞; (3)向离子交换柱中加入蒸馏水至没过树脂约2 cm, 用蒸馏水浸泡4 ~ 8 h,将其中蒸馏水放入烧杯中,向 交换柱中倒入盐酸溶液至没过树脂约2 cm,用盐酸溶 液浸泡4 h,将交换柱中的酸倾倒入废液瓶中; (4)用蒸馏水洗树脂一段时间,利用pH试纸检测流出 液pH值,直至流出液呈中性;
碘化铅溶度积的测定
一、实验目的
了解离子交换法的基本原理 掌握用离子交换法测定溶度积的原理 练习pH计操作
Chemistry
二Hale Waihona Puke 实验原理离子交换树脂是含有能够与其他物质进行离子 交换的活性基团的高分子化合物。阳离子交换 树脂是含有酸性基团而能与其他物质交换阳离 子的树脂。
Chemistry
Chemistry
Chemistry
四、实验步骤
4. 滴定
将容量瓶中的流出液用水稀释至刻线,摇匀。取50ml 小烧杯盛取约30ml流出液,用pH计测定其pH值,记 录数据。平行测定三次,取平均值。
Chemistry
五、数据处理
NaOH溶液浓度 mol/L
温度/℃ V(交换的饱和碘化铅)/mL
I
II
c(NaOH)/(mol/L)
Chemistry
思考题
1. 装柱时,离子交换柱中出现气泡怎么办? 2. 离子交换树脂有几种类型?
Chemistry
三、实验用品
仪器:移液管(20 mL),吸耳球,离子交换柱,镊 子,药勺,温度计,玻璃棒,电子天平,玻璃棉, pH计
试剂:碘化铅固体,阳离子交换树脂,盐酸(5%)
Chemistry
V初/mL V末/mL V(NaOH)/mL 流出液中H+的量/mol 饱和碘化铅溶液中Pb2+的浓度/(mol/L) 碘化铅的溶度积Kspθ 碘化铅的溶度积Kspθ平均值
与理论值比较,计算相对误差,分析误差原因
Chemistry
六、习题
1. 离子交换过程中,为什么液体的流速不宜太快?为 什么要始终保持液面高于离子交换树脂层? 2.碘化铅饱和溶液的体积不准确对实验结果有什么影 响?
