2.1以食盐为原料的化工产品(共3课时) 第1课时 海水晒盐doc
21以食盐为原料的化工产品.
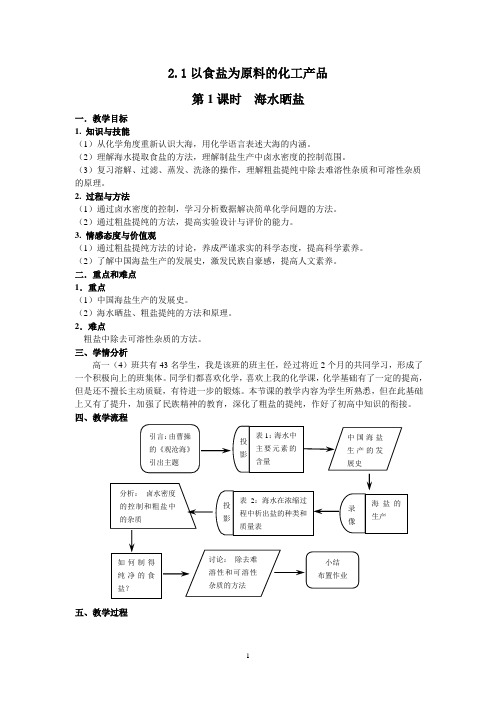
2.1以食盐为原料的化工产品第1课时海水晒盐一.教学目标1. 知识与技能(1)从化学角度重新认识大海,用化学语言表述大海的内涵。
(2)理解海水提取食盐的方法,理解制盐生产中卤水密度的控制范围。
(3)复习溶解、过滤、蒸发、洗涤的操作,理解粗盐提纯中除去难溶性杂质和可溶性杂质的原理。
2. 过程与方法(1)通过卤水密度的控制,学习分析数据解决简单化学问题的方法。
(2)通过粗盐提纯的方法,提高实验设计与评价的能力。
3. 情感态度与价值观(1)通过粗盐提纯方法的讨论,养成严谨求实的科学态度,提高科学素养。
(2)了解中国海盐生产的发展史,激发民族自豪感,提高人文素养。
二.重点和难点1.重点(1)中国海盐生产的发展史。
(2)海水晒盐、粗盐提纯的方法和原理。
2.难点粗盐中除去可溶性杂质的方法。
三、学情分析高一(4)班共有43名学生,我是该班的班主任,经过将近2个月的共同学习,形成了一个积极向上的班集体。
同学们都喜欢化学,喜欢上我的化学课,化学基础有了一定的提高,但是还不擅长主动质疑,有待进一步的锻炼。
本节课的教学内容为学生所熟悉,但在此基础上又有了提升,加强了民族精神的教育,深化了粗盐的提纯,作好了初高中知识的衔接。
四、教学流程五、教学过程六、教学反思《以食盐为原料的化工产品》第一课时,我将这节课的教学内容定为海水晒盐以及粗盐提纯两大主要内容。
结合上海市二期课改的理念,注重对学生化学素养和人文素养的培养,落实两纲教育。
我将本节课的教学重点定为:(1)中国海盐生产的发展史(2)海水晒盐、和粗盐提纯的方法和原理,在教学中力求做到“情知互促”。
一、课堂教学方法多种多样在教学中我采用多种教学手段,以此吸引学生的注意力,达到良好的教学效果。
课的导入以我们金山石化海边的图片以及曹操的《观沧海》引出主题,新颖别致。
充分利用数据表格,让学生通过相关数据的对比分析,然后得出结论。
图像和视频的使用大大节约了时间,提高课堂效率。
二、注重情感态度价值观的落实利用课本中我国海水晒盐的历史,并将之充分挖掘,将我国海盐生产的三个阶段(即煮海为盐、淋卤煎盐、海水晒盐)讲得生动活泼,引起了学生浓厚的学习兴趣。
2.1以食盐为原料的化工产品(共3课时) 第1课时 海水晒盐doc

2.1以食盐为原料的化工产品(共3课时)第1课时海水晒盐一.教学目标1.知识与技能(1)知道海洋是人类可利用的最大资源库及海洋资源的特点,理解从海水中得到卤素资源的一般方法。
(2)理解海水提取食盐的方法,理解制盐生产中卤水密度的控制范围。
(3)知道粗盐中含有的杂质。
(4)理解粗盐提纯的一般方法。
2.过程与方法(1)通过数据表格分析制盐生产中卤水密度的控制,提高分析问题的能力。
(2)通过初中所学离子沉淀的方法,描述粗盐提纯的实验方案。
3.情感态度与价值观通过海洋资源的学习,领略海洋资源的丰富及意义。
二.教学重点和难点1.重点粗盐提纯的一般方法。
2.难点通过数据表格分析制盐生产中卤水密度的控制。
三.教学用品实物投影仪、多媒体电脑。
四.教学流程1.设计思想创设问题情境,激发学习动机,架设探求桥梁,组织问题解决,知能创新应用。
2.流程图(1)海洋中的化学资源(2)海水晒盐(3)粗盐提纯3.流程图说明(1)投影表一,即书本上27页【资料库】,要求学生看书。
引导启发学生回答问题:卤素在海水中的存在形态(离子形态)和特点(浓度小)。
从而引出从海水中提取卤素资源一般方法。
(2)由上一步的分析学生自然会回答出如何从海水中获取食盐,通过录像或多媒体文件的播放讲解介绍盐田法(太阳能蒸发法)。
投影表二,即书本上26页【表2.1】,要求学生看书并分析晒盐中卤水密度的控制和所含的主要杂质。
实际生产中卤水的密度应控制在1.21g/L ~1.26 g/L 的范围,并注意分析为什么。
通过数据表格的分析得出:粗盐中主要含有CaSO 4 、MgCl 2 、MgSO 4 及泥沙等杂质;如果学生的基础较好,再从离子的角度来分析主要含有Ca2+、Mg2+、SO42―等杂质离子(有利于下一步除杂的讨论)。
(3)依次讨论①粗盐提纯的方法②去除杂质所对应加入的试剂、用量③加入试剂的顺序④最后过量的试剂如何解决。
(4)作业①请同学们到图书馆或上网收集有关海水资源的资料,完成一个有关的专题报告,如海水淡化、海水的综合利用、海水“淘”金、海水中的核燃料等。
以食盐为原料的化工产品

六、盐酸、氢氧化钠常见的化学反应:
2HCl + Fe → FeCl2+ H2↑ ; HCl + AgNO3 → AgCl↓+ HNO3 ; HCl + NaOH → NaCl + H2O; 2HCl+ CaCO3 → CaCl2 + H2O + CO2↑ ; 2HCl+ Na2CO3 → 2NaCl + H2O + CO2↑; 2NaOH + CuSO4 → Cu(OH)2↓+ Na2SO4
③粗盐中食盐(NaCl)约占78%,还含有其他一些盐类(如MgCl2、 MgSO4、KCl、MgBr2等)和难溶性物质。可用过滤的方法除去这 些难溶性物质。 3次用到玻璃棒: ④粗盐的提纯 ①溶解→搅拌溶解 (1)步骤:称量→溶解→过滤→蒸发→洗涤 ②过滤→引流 (2)过滤:一贴、两低、三靠。 ③蒸发→搅拌散热 (3)问题: 1)10g粗盐需加30mL左右的水——根据食盐在常温下的溶解度约 为36g/100g水进行计算,可得出要溶解10g食盐至少需水约28mL, 水太少则不能溶解食盐,水太多则使蒸发时间过长。 2)当有大量固体出现时要停止加热,用余热蒸干—防止固体飞溅。 3)用少量水洗涤——因可溶性杂质量小,故能溶解,而食盐量大, 只损失很少量。 4)玻璃棒的使用——溶解(加速溶解);过滤(引流);蒸发(使 受热均匀);转移(转移食盐)。 (4)除杂:粗盐中含有(MgCl2、MgSO4、CaSO4)杂质,如何除 去这些杂质?
步骤及化学方程式 : ①加入稍过量的BaCl2溶液: Na2SO4+ BaCl2→BaSO4↓+ 2NaCl ②加入稍过量的NaOH溶液: MgCl2+ 2NaOH→Mg(OH)2↓+ 2NaCl ③加入稍过量的Na2CO3溶液: Na2CO3+ CaCl2→CaCO3↓+ 2NaCl , Na2CO3+ BaCl2→BaCO3↓+ 2NaCl ④过滤; ⑤在滤液中加入适量盐酸: NaOH + HCl→NaCl + H2O, Na2CO3+ 2HCl→2NaCl+H2O+CO2↑
2.1以食盐为原料的化工产品

2Al +3SO4 Mg
+ 2+
3+
H2CO3 HCO3
H +HCO3
-
+2Cl
-
-
H + CO2 3
+
Na +OH
2+
NaHCO3
-
Na + HCO3
+
Ba +2OH
HCO3
H + CO2 3
+
【本课要点】 • 氯化氢的性质 • 氯化氢气体的工业及实验室制法 • 实验室制、取氯化氢气体的装置 • 实验室制、取气体的装置 • 气体的净化装置及吸收装置 • 检验极易溶于水的气体的装置
探究与实践
实验室制氯化氢气体
• Байду номын сангаас应原理
NaCl + H2SO4 (浓) ( NaCl + NaHSO4
微热 强热
NaHSO4 + HCl Na2SO4 + HCl )
( 工业上制氯化氢的化学方程式
H2+CI2
点燃
2HCI )
设计实验室制氯化氢的装置
反应物状态 实验室制氧气 实验室制二氧化碳 实验室制氯化氢 反应条件
固+固 固+液 固+液 提供装置见后
加热 常温 加热
固+固 加热型
固+液 常温型
固+液 或 液+液 加热型
气体收集装置
气体的净化装置
气体的吸收装置
• 氢氧化钠 一元强碱,在水中全部电离成钠离 子和氢氧根离子 NaOH→Na++OH-
氢氧化钠的用途
沪科版高一第一学期2.1 以食盐为原料的化工产品—教师版

12.1以食盐为原料的化工产品一、海水晒盐1.食盐在自然界的存在形式1)食盐主要分布在海水、盐湖、盐井和盐矿中。
2)海水中含量最多的矿物质是食盐,是人类最早从海水中提取的物质。
3)我国是海水晒盐产量最多的国家。
世界原盐产量中,海盐只占20%多一点,80%左右是用工业化工方法生产的矿盐。
2.海水晒盐的原理1)从海水中提取食盐的方法很多,主要使用太阳能蒸发法。
2)太阳能蒸发法:即盐田法,原理是蒸发结晶,随着海水的蒸发,溶解在海水中食盐逐渐析出。
(盐田法首先要在宽平的海滩上修筑盐池,在涨潮时把海水放进来,即“纳潮”。
然后让海水经多级盐池进行太阳照晒,使海水蒸发、食盐浓缩,这个过程叫“制卤”。
在制卤的流程中,铁、钙、硫等杂质会最先从盐池中析出。
当海水蒸发掉90%时,卤水盐度达到26%,即达到“盐点”,便把卤水导入结晶池使其结晶。
当85%的盐析出后,再从尾液中提取镁盐和钾盐等其他矿物质。
)3)海水晒盐得到的食盐是粗盐,含有较多的杂质(如氯化钙、氯化镁等)。
粗盐经过提纯,得到精盐。
4)海水晒盐整个流程如下:①海水引入盐田②利用日光、风力蒸发、浓缩海水,使其达到饱和③继续蒸发海水,使食盐结晶析出,得到粗盐④粗盐提纯,得到精盐3.食盐的用途食盐对于人类的生活有着极其重要的作用。
人和哺乳动物血清中含盐量高达0.9%,目前医学上使用的生理盐水就是浓度为0.9%的食盐溶液。
人必须吃盐才能进行正常的新城代谢。
在工业中,食盐是一种重要的化工原料。
常用来生产烧碱、纯碱、液氯、漂白粉等多种化工产品。
【例1】从海水中提取食盐,下列叙述中不利于食盐制取的是(D)A.气温高,水挥发速度很快B.用降温来降低食盐溶解度C.天旱,久未下雨D.盐池用塑料布罩住,防止尘土进入二、粗盐提纯1.粗盐中含有难溶性的泥沙及可溶性的其他盐等杂质。
可溶性的杂质有:MgCl2、MgSO4、CaCl2、CaSO4、Na2SO4等杂质,怎样除去这些杂质而得到较为纯净的食盐。
以食盐为原料的化工产品(一)

粗盐提纯实验中,在溶解、过滤、蒸发和转 移等操作中都使用玻璃棒,共四次用到璃棒。 溶解时搅拌加速溶解;过滤时引流;蒸发时搅 拌使受热均匀;转移时转移晶体。 粗盐提纯实验步骤: 称量→溶解→过滤→蒸发→过滤→洗涤→烘干
海水中除了提取食盐外,还可以开发的卤素资源主 要有溴和碘。 经提纯后的食盐还含有:SO42-、Ca2+、Mg2+等杂 质。若用于深加工还需把这些杂质除去。 思考: 用BaCl2、NaOH、Na2CO3和HCl等溶液如何除去 食盐中的SO42-、Ca2+、Mg2+等杂质?
10 g 36 g xg 100 g
x 27.8g
27.8mL
根据食盐在常温下的溶解度约为36g/100g水,可得 出要溶解10g食盐需要约28mL水。所以量取30 mL水…
过滤操作要注意“一贴二低三靠”:滤纸紧 贴漏斗内壁。滤纸边缘低于漏斗口;滤液液面低 于滤纸边缘。烧杯口紧靠玻璃棒;玻璃棒的一端 紧靠三层滤纸处;漏斗颈紧靠烧杯内壁。 将要蒸干时用小火加热,利用余热使食盐蒸 干。如果将要蒸干时仍用大火加热,食盐晶体很 容易飞溅出来。 用少量水洗涤食盐晶体。结晶得到的精盐晶 体表面可能含有如KCl等易溶于水的杂质,用少 量水洗涤,因可溶性杂质少,溶解了;而食盐只 损失一点。
方法4: Ba(OH)2 → Na2CO3 → 过滤 → HCl
粗盐提纯实验步骤: 小结 称量→溶解→过滤→蒸发→过滤→洗涤→烘干(→称量) 过滤操作要注意“一贴二低三靠”。 食盐精制:第一步加入稍过量的BaCl2溶液; 第二步加入稍过量的Na2CO3溶液; 第三步加入稍过量的NaOH溶液; 第四步是过滤; 第五步是再在滤液中加入稍过量HCl。 食盐精制具体操作: 方法1: BaCl2 → Na2CO3 → NaOH → 过滤 → HCl 方法2: BaCl2 → NaOH → Na2CO3 → 过滤 → HCl 方法3: NaOH → BaCl2 → Na2CO3 → 过滤 → HCl 方法4: Ba(OH)2 → Na2CO3 → 过滤 → HCl 作业:化学-练习部分 ⒈P9/一页 ⒉P23/实验报告(预习)
21以食盐为原料的化工产品

氯化氢
盐酸
化学式
HCl
物质类别 纯净物 组成微粒 HCl分子
导电性 不导电
混合物 H2O分子 H+,Cl能导电
化学性质 不使干燥
使干燥
石蕊试纸变红 石蕊试纸变红
3.HCl的制备
(1)工业 Cl2在H2中燃烧
点燃
Cl2+H22HCl
Cl2有毒,价格贵
化工生产盐酸的过程
H2 Cl2
大海也是人类智慧的来源和情感的寄托之一……
海洋资源的分类:
海底矿产资源: (蕴藏着大量的煤矿, 石油,天然气)
海洋生物资源: (20多万种生物) 海洋再生能源: (潮汐,波浪蕴藏着巨
大的能量) 海洋空间资源: (拥有辽阔空间,建造
人工岛) 海洋旅游资源: 海洋化学资源: (80多种元素)
图一:盐 田
粗盐中除氯化钠外,还含有其他一些盐类和难溶性物质,必 须经过粗盐提纯
大部分食盐用于化工生产,中国现代化工之母——氯碱工业
粗盐中含有一些杂质,远不能达到电解要求,必须制备化工用 的纯食盐 H2O Na+ Cl- H+ OH粗盐中的成分:
Na+ Cl- Mg2+
SO42-
Ca2+
NaOH
BaCl2
Na2CO3
剂需稍过量,新引入杂质需在后面加入试剂中除去。
剩余杂质
剩余杂质
} } } Mg2+
SO42Ca2+
加入试剂1 Mg2+ Ca2+
(稍过量BaCl2 )Ba2+
加入试剂2
Ca2+ Ba2+
(稍过量NaOH) OH-
高中化学《2开发海水中的卤素资源2.1以食盐为原料的化工产品海水晒盐》350沪科课标教案教学设计

第一节:以食盐为原料的化工产品知识与技能:理解粗盐提纯中除去难溶性和可溶性杂质的原理,学会对应实验操作过程与方法:通过卤水的密度控制,学习分析数据解决简单化学问题的方法情感态度与价值观:增强学生对化学知识在社会生产和日常生活中的重要作用的认识[教学过程]【查阅资料】课本P25[资料库]【分析】[资料库]海水中主要元素的含量一、食盐用途食盐对于人类的生活有着极其重要的作用。
人必须吃盐才能进行正常的新陈代谢。
在工业上,食盐是一种重要的化工原料。
常用来生产烧碱、纯碱、液氯、盐酸、漂白粉等多种化工产品。
【思考】(1)如何获得食盐?(2)物质结晶的常用方法?二、海水晒盐将海水引入盐田,利用日光、风力蒸发浓缩海水,使其饱和,并进一步使食盐结晶出来。
【思考】为什么还要留下母液,能否干脆把海水晒干来得到食盐?【思考】随着水分的蒸发,海水的密度不断增大,为了使得到的粗盐中除氯化钠外含杂质较少,实际生产中卤水(析出了盐类的海水称为卤水)的密度应控制在什么范围?【思考】粗盐中食盐约占78%,还含有泥沙等难溶性物质。
如何除去难溶性杂质来提纯粗盐?三、粗盐提纯1、除去不溶性杂质【回顾】粗盐提纯的步骤?【思考】常温下,10g粗盐要量取多少毫升的水来溶解?【思考】水为什么不能太少也不能太多?【思考】1.过滤操作需要哪些玻璃仪器?同时要注意些什么?2.蒸发到即将干时,为什么要停止加热或用小火加热?3.为何要用少量水洗涤晶体?4.玻璃棒共用了几次?作用分别是什么?5.为什么粗盐容易潮解?【思考】粗盐中还含有其它一些盐类(如:MgCl2、Na2SO4、CaCl2等)可溶性杂质,如何除去来提纯粗盐?2、除去可溶性杂质【思考】除去下列物质中的少量杂质,各应加适量的什么试剂?①NaCl溶液中含少量MgCl2②NaCl溶液中含少量CaCl2③NaCl溶液中含少量Na2SO4④NaCl溶液中含少量Na2CO3⑤NaCl溶液中含少量NaOH除杂三原则——不增、不减、易分,即不引入新的杂质、不减少被提纯的物质,杂质转化为沉淀、气体等,易分离出去。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.1以食盐为原料的化工产品(共3课时)
第1课时海水晒盐
一.教学目标
1.知识与技能
(1)知道海洋是人类可利用的最大资源库及海洋资源的特点,理解从海水中得到卤素资源的一般方法。
(2)理解海水提取食盐的方法,理解制盐生产中卤水密度的控制范围。
(3)知道粗盐中含有的杂质。
(4)理解粗盐提纯的一般方法。
2.过程与方法
(1)通过数据表格分析制盐生产中卤水密度的控制,提高分析问题的能力。
(2)通过初中所学离子沉淀的方法,描述粗盐提纯的实验方案。
3.情感态度与价值观
通过海洋资源的学习,领略海洋资源的丰富及意义。
二.教学重点和难点
1.重点
粗盐提纯的一般方法。
2.难点
通过数据表格分析制盐生产中卤水密度的控制。
三.教学用品
实物投影仪、多媒体电脑。
四.教学流程
1.设计思想
创设问题情境,激发学习动机,架设探求桥梁,组织问题解决,知能创新应用。
2.流程图
(1)海洋中的化学资源
(2)海水晒盐
(3)粗盐提纯
3.流程图说明
(1)投影表一,即书本上27页【资料库】,要求学生看书。
引导启发学生回答问题:卤素在海水中的存在形态(离子形态)和特点(浓度小)。
从而引出从海水中提取卤素资源一般方法。
(2)由上一步的分析学生自然会回答出如何从海水中获取食盐,通过录像或多媒体文件的播放讲解介绍盐田法(太阳能蒸发法)。
投影表二,即书本上26页【表2.1】,要求学生看书并分析晒盐中卤水密度的控制和所含的主要杂质。
实际生产中卤水的密度应控制在1.21g/L ~1.26 g/L 的范围,并注意分析为什么。
通过数据表格的分析得出:粗盐中主要含有CaSO 4 、MgCl 2 、MgSO 4 及泥沙等杂质;
如果学生的基础较好,再从离子的角度来分析主要含有Ca2+、Mg2+、SO42―等杂质离子(有利于下一步除杂的讨论)。
(3)依次讨论①粗盐提纯的方法②去除杂质所对应加入的试剂、用量③加入试剂的顺序④最后过量的试剂如何解决。
(4)作业
①请同学们到图书馆或上网收集有关海水资源的资料,完成一个有关的专题报告,如海水淡化、海水的综合利用、海水“淘”金、海水中的核燃料等。
于下星期全班交流。
②请同学们设计一份名为“粗盐提纯”的实验报告,做好下一节实验课的准备。
五.案例示例
1.情景引入
由当前人类所面临的能源问题、资源问题引入课题。
我们生活的地球上海洋多于陆地,目前人类在陆地上已经面临了能源、资源问题,为了更好地利用海洋资源,所以我们要学习和了解元素在海洋中的存在形态和特点。
2.难点突破
如何引导学生分析书本上26页【表2.1】,得到生产中卤水的密度应控制在1.21g/L~1.26 g/L的范围是本节课的难点。
在分析时应从以下两方面入手:(1)析出NaCl的最小卤水密度是多少?表中可以轻易地看出是1.21g/L,且小于1.21g/L时有一定量的CaSO4析出。
(2)为什么不是卤水密度越大越好,让NaCl尽可能多析出?最大应该控制在多少?为什么?要引导学生从表中看出随着密度的增大NaCl析出量的变化,由于在密度1.21g/L~1.26 g/L之间NaCl已经大部分析出,当近一步浓缩时NaCl的析出量已经不多,而此时其他盐类的析出量在明显增加,这样会使食盐中杂质含量升高;所以控制在1.26 g/L以内。
这样学生也能得到一下结论:粗盐中主要含有CaSO4、MgCl2、MgSO4及泥沙等杂质;如果学生的基础较好,再从离子的角度来分析主要含有Ca2+、Mg2+、SO42―等杂质离子(有利于下一步除杂的讨论)。
3.重点突出
对于本节课的重点——粗盐提纯的方法,教师应该注意按以下步骤引导学生分析讨论:(1)粗盐提纯的方法:将含有的杂质转化为沉淀过滤出去。
(2)去除杂质所对应加入的试剂、用量:除去Ca2+应选用Na2CO3,Mg2+应选用NaOH,SO42―应选用BaCl2,若有学生回答其他不合理试剂如K2CO3等,教师则应注意分析除杂时不应引入新的杂质。
从除杂的效果上,为了确保将杂质除净,所加入的试剂应稍过量。
(3)由试剂稍过量引出加入试剂的先后顺序:既然加入的试剂是稍过量的,那过量的试剂就会引入新的杂质离子,那么如何解决呢?利用所加入的试剂,可以解决一部分问题,由此得到加入Na2CO3必须在BaCl2之后,这样可以除去过量的Ba2+;那么如何解决由于加入Na2CO3、NaOH所引入的过量的CO32―和OH―呢?
(4)最后过量的试剂如何解决:发现CO32―和OH―都可以用盐酸除去,那么如何控制所加入的盐酸的量?利用pH值来控制调节所加入的盐酸的量。
(5)加盐酸之前还应注意过滤除去沉淀。
六.教学反思
本节课亮点有两处:
(1)如何由数据表格分析出实际生产中卤水的密度控制范围,并得到粗盐中主要含有的杂质。
教师可以先分析为什么不低于1.21 g/L,然后分析在海水密度变大的过程中NaCl析出量的变化以及其他盐类析出量的变化,再分析为什么不控制到1.31 g/L或更大,最后由数据表格得出粗盐中的主要杂质。
(2)讨论得出粗盐提纯的步骤
教学过程中应该依次讨论:①粗盐提纯的方法→②去除杂质所对应加入的试剂、用量→③由试剂稍过量引出加入试剂的先后顺序→④最后过量的试剂如何解决→⑤加盐酸之前还应注意过滤除去沉淀。
从而得出粗盐提纯的步骤。
这是本节课的重点,教师应仔细分析,耐心引导,要根据学生的思路逐步引导,并不断纠正,最终让学生融会贯通。
由于不同层次的学生,观察能力与分析能力的差异,在实施以上两点时学生的表现可能会有不同,请教师灵活把握,耐心引导。
进才中学李之春。
