优选芳香族化合物的合成法
芳香族化合物的性质与应用实验

芳香族化合物的性质与应用实验芳香族化合物是一类具有特殊结构和性质的有机化合物,广泛存在于天然物质和人工合成物中。
它们具有独特的香气、稳定性和广泛的应用价值。
本实验旨在通过一系列实验步骤,研究芳香族化合物的性质,并探索其在生活和工业中的应用。
实验一:芳香族化合物的香气测试1. 实验目的:验证芳香族化合物具有独特的香气特征。
2. 实验步骤:选取苯、甲苯、苯酚和水作为对照物质。
将每种物质滴于不同的实验瓶中,然后嗅闻每种物质的香气,并记录感受。
3. 实验结果:a) 苯:具有独特的清香气味。
b) 甲苯:具有刺激性和特殊的香气。
c) 苯酚:具有刺激性、酚类气味。
d) 水:无香气。
实验二:芳香族化合物的溶解性测试1. 实验目的:研究芳香族化合物在水和有机溶剂中的溶解性。
2. 实验步骤:选取苯、甲苯和苯酚作为实验样品。
分别取等量的样品加入水和有机溶剂(如乙醇),轻轻摇晃瓶子,观察样品的溶解性。
3. 实验结果:a) 苯:不溶于水,溶于有机溶剂。
b) 甲苯:不溶于水,溶于有机溶剂。
c) 苯酚:可与水形成混合溶液,溶于有机溶剂。
实验三:芳香族化合物的酸碱性测试1. 实验目的:研究芳香族化合物在酸性和碱性条件下的性质。
2. 实验步骤:选取苯酚作为实验样品。
将少量苯酚分别加入盛有稀盐酸和氢氧化钠溶液的试管中,观察反应。
3. 实验结果:a) 稀盐酸中的苯酚:产生白色絮状沉淀,说明苯酚是酸性物质。
b) 氢氧化钠溶液中的苯酚:生成溶于水的盐,并放出热。
实验四:芳香族化合物的应用——香料提取1. 实验目的:利用芳香族化合物的特性,提取天然香料。
2. 实验步骤:选取柑橘皮作为实验材料。
将柑橘皮削成细丝,然后放入蒸馏瓶中,加入适量的水,进行水蒸气蒸馏,收集蒸馏液。
3. 实验结果:蒸馏液中含有柑橘的香气成分,可用于制作香水或食品调味剂。
实验五:芳香族化合物的应用——药物合成1. 实验目的:通过合成反应制备一种有机药物。
2. 实验步骤:以苯酚为原料,进行酰化反应合成水杨酸苯酯。
水杨酸-次氯酸盐法

水杨酸-次氯酸盐法水杨酸-次氯酸盐法是一种常用的有机合成方法,主要应用于芳香族化合物的合成和修饰。
本文将介绍水杨酸-次氯酸盐法的原理、适用范围、反应机理和优缺点等方面。
一、原理水杨酸-次氯酸盐法又称Reimer-Tiemann反应,是一种芳香环的卤代反应。
其中水杨酸是反应的芳香族底物,次氯酸盐则是反应的卤代试剂。
反应过程产生的亚碳基离子与芳香环上的一个羰基反应,再经脱水、脱羟等步骤,形成苯酚及其衍生物。
二、适用范围水杨酸-次氯酸盐法适用于那些在芳香环上有活泼或弱碱性取代基的化合物。
在这种情况下,用其他卤代试剂(如Br2、I2等)进行卤代反应会很难控制,甚至是不可行的。
三、反应机理反应的机理如下:1.次氯酸盐产生亚碳基离子次氯酸盐在碱性条件下,可通过还原反应生成亚碳基离子:ClO^- + OH^- → H2O + Cl^- + O·2.亚碳基离子与水杨酸反应3.苯酚根离子的进一步反应苯酚根离子进一步发生脱水、脱羟等反应,形成苯酚及其衍生物:C6H5CH(OH)^- →C6H5OH + CO2四、优缺点优点:1. 反应操作简单,适用于多种卤代试剂。
2. 适用于芳香环上有活泼或弱碱性取代基的化合物。
1. 产物分离和纯化较为困难,需要使用多种色谱技术。
2. 在反应过程中,亚碳基离子是一种活泼的中间体,易发生二聚反应或复杂反应,产率不稳定。
五、总结水杨酸-次氯酸盐法是一种常用的芳香族化合物合成和修饰方法。
该方法适用于芳香基上有活泼或弱碱性取代基的化合物,并且操作简单。
但是,产物纯度难以控制,产率不稳定,需要熟练的实验操作技能以及复杂的纯化技术。
有机化学基础知识点芳香族化合物的性质与合成

有机化学基础知识点芳香族化合物的性质与合成有机化学基础知识点芳香族化合物的性质与合成有机化学是研究碳原子及其化合物的科学,而芳香族化合物是有机化学中的一个重要分支。
本文将介绍芳香族化合物的性质和合成方法。
一、芳香族化合物的性质1. 六元环结构:芳香族化合物的特征是具有由六个碳原子组成的芳香环结构。
这些环上的碳原子交替单双键排列,形成了一个稳定的共轭体系。
芳香环带有稳定的π电子系统,使得芳香族化合物具有独特的性质。
2. 稳定性和低反应性:芳香族化合物由于共轭体系的存在,具有较高的稳定性和低活性。
这使得它们在常温下不易发生化学反应,相对较稳定。
3. 强吸光性和颜色:芳香族化合物通常显示出强吸光性,能够吸收紫外线和可见光的较长波长部分。
这些化合物吸收特定波长的光,对应于它们的分子结构,因此表现出不同的颜色。
4. 臭味和香味:芳香族化合物中的某些物质常具有特殊的臭味和香味。
例如,苯环化合物具有独特的芳香气味,而芳香酮则具有香味。
5. 不饱和性:由于芳香族化合物中存在共轭体系,使得它们具有一定的不饱和性。
这意味着它们可以参与一些特定的反应,如亲电取代反应和电子亲和性反应等。
二、芳香族化合物的合成方法芳香族化合物可以通过多种合成方法制备。
以下是其中一些常见的合成方法:1. 烷基苯的烷基化:通过将烷基卤化物和苯反应,可以在苯环上引入烷基基团。
2. 醛酮的芳烃化:通过将醛酮与氨或其它含氮化合物反应,可以得到芳香族酮类化合物。
3. 吲哚合成:通过吲哚合成反应可以合成吲哚类化合物。
4. 醚类化合物的芳烃化:通过醚类化合物与强碱反应可得到芳香族化合物。
5. 芳香烃的重排和脱氢:通过烷基苯的重排反应和脱氢反应来合成芳香族化合物。
三、实例:苯的合成苯是最简单的芳香族化合物,具有六个碳原子和六个氢原子构成的芳香环结构。
苯的合成方法有许多种,以下以Friedel-Crafts反应为例。
Friedel-Crafts反应是一种通过芳基烷化合成苯的方法,它是典型的电子亲和性取代反应。
芳香族化合物原来指的是由树脂或香精油中取得的一些

E2
E3
E
H
E+
E + H+
反应进程
第九章 第十章 第十一章 第十二章 第十三章 第十四章
第一章 第二章 第三章 第四章 第五章 第六章 第七章 第八章
ⅰ 硝化反应: 以浓硝酸和浓硫酸(或称混 酸)与苯共热,苯环上的氢原子能被硝基 (-NO2)取代,生成硝基苯。如果增加硝 酸的浓度,并提高反应温度,则可得间二 硝基苯。
S
O
第九章 第十章 第十一章 第十二章 第十三章 第十四章
第一章 第二章 第三章 第四章 第五章 第六章 第七章 第八章
芳香性: 1)具有稳定的环系; 2)易于亲电取代,难于亲电加成, 即有“饱和”性。
在这一节中,将主要讨论含有苯环的碳 氢化合物。
第九章 第十章 第十一章 第十二章 第十三章 第十四章
CH2 CH CH CH2
(3) CH2 CH CH CH2
(5) CH2 CH CH CH2
(7)
CH2 CH CH CH2 (2)
CH2 CH CH CH2
(4) CH2 CH CH CH2
(6)
苯的共振式:⑴、⑵的贡献 大, ⑶、⑷、⑸贡献小。Why?
第九章 第十章 第十一章 第十二章 第十三章 第十四章
第一章 第二章 第三章 第四章 第五章 第六章 第七章 第八章
⑵当苯环上连有不饱和基团或多个碳原子 的烷基时,则将苯环作为取代基,如苯乙 烯及2-苯基庚烷。
CH=CH2 H3C CHCH2CH2CH2CH2CH3
苯乙烯
2-苯基庚烷
第九章 第十章 第十一章 第十二章 第十三章 第十四章
第一章 第二章 第三章 第四章 第五章 第六章 第七章 第八章
芳香族化合物重氮化和偶合简介

重氮化重氮化和偶合反应是重要的有机合成反应,在精细化工中有很重要的地位,该类反应在染料合成中应用很广,是两个主要的工序。
可合成酸性、冰染、直接、分散、活性、阳离子等类型的染料,还可合成各类黄色、红色偶氮型有机颜料。
一.重氮化和重氮化合物1.重氮化反应及影响因素芳香族伯胺和亚硝酸作用生成重氮盐的反应称为重氮化。
重氮化反应要在强酸中进行,实际上是亚硝酸作用于铵离子。
由于亚硝酸不稳定,通常使用亚硝酸钠和盐酸或硫酸,使反应生成的亚硝酸立刻与芳伯胺反应,避免亚硝酸的分解。
为了使反应能顺利进行,必须首先把芳伯胺转化为铵正离子。
芳胺的碱性较弱,因此重氮化要在较强的酸中进行。
有些芳胺碱性非常弱,要用特殊的方法才能进行重氮化。
重氮化是放热反应,重氮盐对热不稳定,因此要在冷却的情况下进行,一般都用冰盐浴冷却,并调节亚硝酸钠的加入速度,维持反应温度在0℃附近,由于重氮盐不稳定,一般就用它们的溶液,随做随用。
固体重氮盐遇热或震动、摩擦,都将发生爆炸,必需应用某些稳定性好的固体重氮盐时,也需谨慎小心。
自重氮化反应发现以来,人们为了弄清楚其反应的影响因素,对重氮化反应的机理进行了反复研究,已普遍接受了重氮化反应的亚硝化学说即重氮化反应是由亚硝酸产生的亲电质点对游离芳伯胺基进行亲电取代反应的机理,其反应的主要影响因素如下。
(1).酸的影响酸的影响主要考虑酸的种类、用量及浓度的影响。
重氮化所用的酸,从反应速度来说,以盐酸或氢溴酸等最快,硫酸与硝酸较次。
由反应式可以看出酸的理论用量为2摩尔,在反应中无机酸的作用是:首先是使芳胺溶解,其次可和亚硝酸钠生成亚硝酸,最后是生成稳定的重氮盐。
重氮盐一般来讲是容易分解的,只有在过量的酸液中才稳定,所以重氮化时实际上酸用量过量很多,常达3~4摩尔。
反应完毕时介质应呈强酸性,PH值为3,对刚果红试剂呈蓝色,重氮化过程经常检查介质的PH值是十分重要的。
反应时若酸量不足,生成的重氮盐容易和未反应的芳胺偶合,生成重氮胺基化合物。
芳香族烃类化合物

酰基化反应
将苯与酰氯或酸酐在酸性催化剂作用下进行酰基化反应,生 成芳香酮或酸。
稠环芳烃的合成
氧化偶联反应
将芳香族化合物在氧化剂作用下进行 偶联反应,生成稠环芳烃。
分子内的环化反应
某些芳香族化合物在加热或加压条件 下发生分 和化学性质
物理性质
溶解性
芳香族烃类化合物通常不溶于水,但可溶于有机 溶剂。
沸点
由于其相对较高的分子量和稳定性,芳香族烃类 化合物的沸点通常较高。
密度
芳香烃的密度通常比水大,且随着分子量的增加 而增大。
化学性质
稳定性
芳香族烃类化合物相对稳定,不易发生氧化或还原反应。
总结词
随着环保意识的提高,对芳香族烃类化合物对环境和安全性的影响将有更深入的研究,以减少其对环 境的负面影响。
详细描述
目前,芳香族烃类化合物在生产和使用过程中可能对环境和人类健康产生一定影响。因此,对其在环 境中的迁移、转化和降解行为,以及对人体健康的潜在影响进行深入研究,是未来研究的重点方向。 同时,开发低毒、环保的替代品或寻找循环利用的方法也是未来的研究重点之一。
在医药工业中的应用
药物合成
芳香族烃类化合物是许多药物合成的关键原料,如抗癌药物、抗 生素等。
诊断试剂
芳香族烃类化合物可以用于制备诊断试剂,如用于检测癌症、传 染病等的试剂盒。
生物活性分子
某些芳香族烃类化合物具有生物活性,可以作为药物或其他生物 活性分子的先导化合物。
在农业中的应用
农药
某些芳香族烃类化合物可以作为农药使用,如除草剂、杀虫剂等。
进而发生取代反应。
加成反应
03
硝基合成芳胺一种有效的有机化学

硝基合成芳胺一种有效的有机化学芳胺是芳香族有机化合物的重要成员,具有广泛的生物活性和应用。
因此,它们的合成方法一直是化学领域研究的热点。
其中,硝基还原法是一种常用的制备芳胺的方法,尤其适用于合成复杂和多样化的芳香族化合物。
本文将详细介绍硝基还原法的反应机理、实验条件与应用范围。
一、反应机理硝基还原法的基本原理是利用还原剂将硝基化合物还原为胺。
在实验室中,通常使用不同的还原剂如催化氢化、活泼金属还原、氢化锂铝/硼氢化钠还原或其他还原方法如Na2S、NaHS、保险粉等来实现这一过程。
1.催化氢化:在这种方法中,硝基化合物与氢化催化剂如Pd/C 或Raney Ni在一定温度和压力下进行反应,被还原为胺。
这种方法对于分子内存在对加氢敏感基团(如Cl、Br、I、双键、三键)的硝基化合物可能不适用。
2.活泼金属还原:Fe粉、Zn粉和氯化亚锡等活泼金属在酸性或弱酸性条件下可将硝基化合物还原为胺。
这种方法一般在特定的酸性条件下进行。
3.氢化锂铝/硼氢化钠还原:这种方法对于常规的硝基化合物通常不适用,因为LiAlH4的还原作用不彻底,往往得到的是混合物。
4.其他还原方法:除了上述方法,还可以使用Na2S、NaHS、保险粉等其他还原剂进行硝基还原。
二、实验操作与注意事项在进行硝基还原反应时,需要注意以下关键因素:1.反应温度和压力:不同的还原剂需要不同的温度和压力条件。
在实验过程中,应根据所选用的还原剂调整温度和压力。
2.催化剂或溶剂的选择:对于催化氢化反应,可能需要使用特定的催化剂和溶剂。
而在使用活泼金属进行还原时,可能需要选择合适的酸性环境。
3.反应时间:反应时间也是影响还原反应成功与否的关键因素。
通常,反应时间需要根据具体的反应条件进行调整。
4.纯化和分离:完成还原反应后,需要对产物进行纯化和分离。
这一步骤对于获得高纯度的芳胺至关重要。
在进行硝基还原实验时,还需要特别注意安全。
由于涉及使用活泼金属、酸性和加氢等反应条件,存在一定的安全隐患。
专题1 有机化合物的合成
例1、设计的合成路线。
例2、设计的合成路线
例3、设计的合成路线
例5、设计 的合成路线。
例6、由苯酚合成
例7、设计 的合成路线
例8、用C3化合物合成
例9、由苯合成对溴乙苯
例10、由苯合成对硝基苯甲酸。
例11、由苯合成间硝基苯乙酮。
例12、由C2化合物合成叶醇
练习题
1、由指定原料及其他必要的无机及有机试剂合成下列化合物:
CH3(CH2)5CH2C≡CCH2OHCH3(CH2)5CH2C≡CCH2C≡CCH2OH
B C
CH3(CH2)11CH2OH
D E
(1)用反应式表示由电石和甲醛以及必要的无机试剂为原料制备A的各步反应,并注明必要的反应条件。
(2)用系统命名法命名化合物B,C,D。
(3)以乙烯、丙烯、乙炔、化合物A以及必要的无机试剂为原料合成B和C,以反应式表示。
(2)引入一种基团,这种基团具有一定的定位作用,待第二基团引入后,再除去这种基团,例如由苯合成间二溴苯。
(3)当用取代苯作为起始物时,可通过改变起始物取代基转化的先后顺序来决定最终产物分子中基团的相对位置,例如由甲苯合成硝基苯甲酸。
在将两个基团引入到苯环上时,应考虑以下两个问题:
(1)在有选择余地时,首先引入最强的致活基团或最弱的致钝基团进入苯环。
专题一有机化合物的合成
一、有机合成的一般原则
1、反应步骤较少,总产率高。2、每步的主要产物易于分离提纯。3、原料易得价格便宜。
二、有机物的合成方法(包括碳架的建立、各种官能团引进等)
(一)芳香族化合物的合成
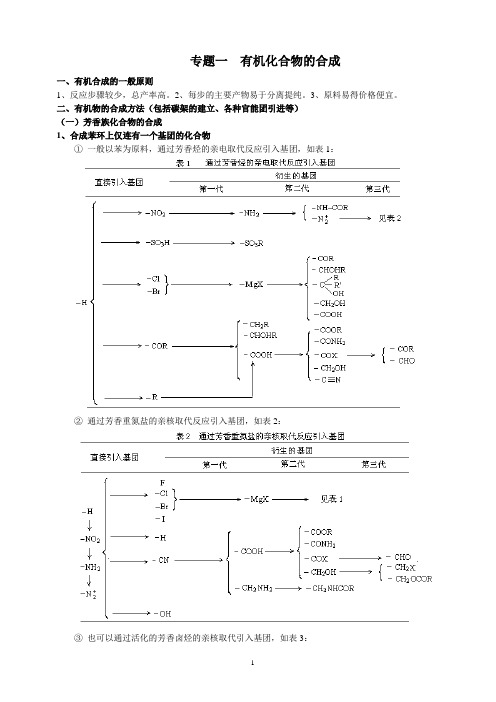
1、合成苯环上仅连有一个基团的化合物
①一般以苯为原料,通过芳香烃的亲电取代反应引入基团,如表1:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(8)
8
实际合成时NH2这一步氯代时要用酰基保护一 下,以防止多氯代:
HNO3 H2SO4
NO2
i. H2/Pd/C ii. Ac2O
NHAc
i. Cl2 ii. HCl(aq)
NH2 Cl
i. NaNO2/HCl ii. CuCN
CN Cl
NaOH(aq)
COOH Cl
TM(8)
9
卤代甲苯的合成是十分常见的。以邻溴甲苯(9) 的合成为例加以说明。
化合物(14)是用作抗疟疾药试验的化合物。 最好的做法是以苯乙醚为起始物。分析如下:
OEt
OEt
OEt
OEt
OEt
Cl a
b Cl b
a NO2 (14)
NO2
17
合成如下:
OEt HNO3
OEt HCHO/HCl ZnCl2
NO2
OEt
Cl TM(14) 75%
NO2
再如由苯合成1-(4-氯苯基)丙烯(15)。
SH
11
萘在进行卤代(及硝化)时,几乎完全进入α位,若让它进入β-位就必须采用间接的过程。 例如(10)的合成如下:
H2SO4(C) 160°C
SO3H i. NaHSO3 ii. NaOH(s)/
OH(NH4)2SO3(aq) 150°C 加压
NH2 i. HNO2 ii. CuBr
Br TM(10)
萘氯代时用苯为溶剂,I2作催化剂;如果进行 溴代,一般用CCl4作溶剂,不需催化剂。
4
准则3 如在合成中需要进行FGI,那么它很 可能会改变原基团的定位效应,因此,另一 个取代基可能应在FGI之前或之后引入。
常见的例子有: 邻、对位定位的Me→间位定位的COOH 邻、对位定位的Me→间位定位的CCl3/CF3 间位定位的NO2→邻、对位定位的NH2
CHO i. HNO3,H2SO4
ii. Fe/HCl
CHO
iii. HNO2
KI
I
CHO
CHO
CHO
i. NaBF4 ii. SchiemFann CHO CuX
N2+ CuCN
CHO
PhH HO-
S KSCOEt Gomberg
-Bachmann CHO
X(Br, Cl) CN Sandmeyer
OH
CO2H 水杨酸(水杨醛)
NH2
CO2H 邻氨基苯甲酸
CH3
H3C
CH3
均三甲苯
O
OH
CH3
O
联苯
O 邻苯二甲酸酐
OH 二苯酚
OH 甲酚混合物
15
选择常用的试剂完成(13)的合成:
O
O
NH
O
合成如下:
O O+ O
O
AlCl3
(13)
O CO2H
Zn-Hg HCl
CO2H
16
准则7 要注意试剂的选择性或使用范围。例如 苯甲醛硝化时只生成50%的间硝基苯甲醛,因 为硝基会将CHO氧化成COOH。这类问题可 采用迂回的方式:用苯甲酸进行硝化,而后再 将羧基还原为醛基。
14COOH H3PO2
N2+ NO2
14COOH TM(3)
NO2
2
准则2 如有选择余地时,可以最先切断吸电子 性最强的基团(也就是说这个基团将最后引 入)。这种基团有致钝性,它的存在将影响其 它基团的引入。 如合成麝香(4)的合成 :
O2N
NO2 OMe
(4)
OMe
OMe
3
再如由萘合成1-氯-4-硝基萘(5),关键是两 个取代基的引入先后顺序。过程如下:
CH3 i. 硝化 ii. 分离
CH3 NO2 i. Fe/HCl ii. HNO2
CH3N2+ i. CuBr ii. HCHO
CH3 Br
TM(9)
问题:i. 邻位体还可以怎样合成? ii. 对位体如何合成? iii. 氯化物也可仿照如上的过程合成。
10
通过重氮盐可以合成多种化合物,如下所示:
CH3 i. HNO3/H2SO4 ii. Fe/HCl
iii. Ac2O
CH3 HNO3(e)
CH3
NHAc
O2N
NO2
NHAc
i. HO-
CH3
COCl
ii. HNO2
i. KMnO4
iii.HCHO O2N
NO2 ii. SOCl2 O2N
NO2
TM(12)
14
准则6 找出难引入的取代基。这时选择含有这 种取代基的原料为起始物,这往往是上策。 OH和OR便是实例。这类可供选择的原料包括:
CH3 Br H2O(g)
SO3H
SO3H
再如由苯酚合成2,6-二氯苯酚(16):
CH3 Br
OH
H2SO4 100°C
OH
OH
OH
Cl2/H2O Cl
Cl H2O(g) Cl
CH2CH2CH3
Cl2 Fe
CH2CH2CH3 NBS
Cl
CHBrCH2CH3 KOH EtOH
Cl
CH=CHCH3 TM(15)
Cl
18
准则8 若涉及邻、对位取代时(如甲苯的溴 代),一个可采用的避免分离(分离增加了步 骤,是要损失产率的!)的策略就是占位:
CH3
H2SO4
CH3 Br2/Fe
5
化合物(6)的合成涉及到甲基的氯代和环上 的氯代,这就有先后顺序和官能团转化的问题:
Cl
Cl3C (6)
H3C
Cl H3C
文献报道的合成产率还很不错,但一般却不能 这样引入甲基邻、对位的氯或溴,因为二者的 沸点相近难以分离,需采用后面的苯(7)。
注意两点:一是溴的引入方式;二是三个 碳以上直链的引入方法,即酰基化后经 Clemmensen还原。合成过程如下:
12
准则5 万不得已时,“卸磨杀驴”的做法可用
于某些诸如引入两个互处间位的邻、对位基的
问题。做法是先引入一个“作幌子的”氨基以
建立起所需要的关系,随后再用重氮化、还原
来除去氨基:
R
R
R
NO2
NH2
R
R
i. HNO2
R' ii. H3PO2
R'
NH2
13
再如由甲苯合成3,5-二硝基苯甲酰氯(12)(以 及3,5-二卤代苯甲酸、酯等羧酸衍生物)。
丙酰氯 AlCl3
COCH2CH3 Br2/Fe
COCH2CH3
Zn-Hg
Br
HCl
CH2CH2CH3 Br TM(7)
7
准则4 许多基团可通过重氮盐引入。在胺阶段引 入其它可能的基团是有好处的,因为它是强活化 的邻、对位定位基。再如化合物(8)的合成。
COOH CN
NH2
NH2
NO2
Cl
Cl
Cl
优选芳香族化合物的合成法
再一个例子是由标记的苯甲酸合成标记的对硝基 苯甲酸(TM3)。
14COOH
HNO3 H2SO4
14COOH Fe
NO2 HCl
14COOH Ac2O
NH2
14COOH NHAc
14COOH
NaOH NHAc H2O NO2
14COOH
NaNO2/HCl NH2 0-5°C NO2
