Oxprenolol-hydrochloride抑制剂COA-M2907
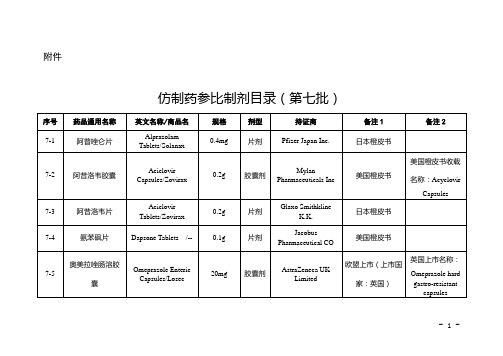
仿制药参比制剂目录(第七批)
片剂(肠溶片)
AstraZeneca K.K.
日本橙皮书
7-8
奥美拉唑肠溶片
Omeprazole Enteric-coated Tablets/Omepral
10mg
片剂(肠溶片)
AstraZeneca K.K.
日本橙皮书
7-9
苯巴比妥片
Phenobarbital Tablets/
Luminaletten
7-20
茶碱缓释片
Theophylline Sustained-release Tablets/THEOPHYLLINE
0.1g(按C7H8N4O2计)
片剂(缓释片)
PLIVA INC
美国橙皮书
美国橙皮书收载名称:Theophylline Extended-release Tablets
7-21
地红霉素肠溶片
0.1g
片剂
DESITIN Arzneimittel GmbH
欧盟上市(上市国家:德国;产地:德国)
7-12
苯妥英钠片
Phenytoin Sodium Tablets
50mg
片剂
Aurobindo Pharma - Milpharm Ltd.
欧盟上市(上市国家:英国;产地:英国)
7-13
苯妥英钠片
Phenytoin Sodium Tablets
0.5mg
片剂
HOFFMANN LA ROCHE INC
美国橙皮书
7-47
马来酸氯苯那敏片
Chlorphenamine Maleate Tablets/Chlor-Tripolon
4mg
片剂
BAYER INC CONSUMER CARE
安进公司研发的PCSK9抑制剂Repatha喜获欧盟批准

安进公司研发的PCSK9抑制剂Repatha喜获欧盟批准佚名
【期刊名称】《临床合理用药杂志》
【年(卷),期】2015(8)23
【摘要】生物技术巨头安进(Amgen)近日在监管方面收获重大里程碑,该公司研发的PCSK9抑制剂Repatha(evolocumab)喜获欧盟批准,标志着全球首个新一代PCSK9抑制剂类降脂药成功诞生!PCSK9抑制剂是一类单抗药物,靶标是一种名为前蛋白转化酶枯草溶菌素9(PCSK9)的蛋白,该蛋白会增加低密度脂蛋白胆固醇(LDL-C)的生成率,而LDL-C可阻塞血管,被公认为心血管疾病(CVD)的主要风险因子,也是心脏病的罪魁祸首。
【总页数】1页(P87-87)
【正文语种】中文
【中图分类】R972.4
【相关文献】
1.诺华公司第二代酪氨酸激酶抑制剂尼洛替尼在欧盟获得批准
2.欧盟批准安进公司denosumab上市
3.欧盟率先批准赛诺菲-安特公司减肥药利莫那班上市
4.欧盟批准安进公司panitumumab用于转移性结直肠癌治疗
5.FDA批准安进公司的新药Amjevita上市
因版权原因,仅展示原文概要,查看原文内容请购买。
科莱恩重点推荐产品

科莱恩重点推荐产品HLB EPA 组成活性物质含量浊点脂肪醇乙氧基化合物(calc.) (%);外观 (?)ca.80.5 11 910,930 液体乳化剂,增效剂带有8个EO的油醇聚乙二醇醚100;液体糊状 ?Genapol O 080ca.50.0 12 910,930 液体乳化剂,增效剂带有10个EO的油醇聚乙二醇醚100;糊状类似蜡 ?Genapol O 100ca.65.5 11 910,930 液体乳化剂,润湿剂带有6个EO的异13醇聚乙二醇醚100;液体 ?Genapol X 060ca.75.5 13 910,930 液体乳化剂,润湿剂带有8个EO的异13醇聚乙二醇醚100;液体 ?Genapol X 080脂肪醇乙氧基化合物ca.67.0 9 910,930 矿物油乳化剂油醇聚乙二醇醚 ca.100;液体 ?Emulsogen M(低倾点(ca.0?),在低至ca.12?时仍能保持均一性)三苯乙烯苯酚乙氧基化合物(600#)ca.60.0 13 920 乳化剂带有16个EO的2,4,6-三(1-苯乙基)100;液体 ?Emulsogen TS 160-酚聚乙二醇醚ca.57.5 13.5 920 乳化剂带有20个EO的2,4,6-三(1-苯乙基)100;液体糊状 ?Emulsogen TS 200-酚聚乙二醇醚蓖麻油乙氧基化合物64.0-69.0 13.5 960 乳化剂带有36个EO的蓖麻油乙氧基化合物 100;液体 ?Emulsogen EL360EO/PO 嵌段共聚物ca.56.8 14 960 液体分散剂,乳化剂含有20%EO的EO/PO嵌段共聚物 100;液体 ?Genapol PF 20ca.85.0 11 960 液体分散剂,乳化剂正丁醇烷氧物 100;类似蜡 ?Emulsogen 3510ca.67.8 16 960 液体分散剂,乳化剂含有40%EO的EO/PO嵌段共聚物 100;液体 ?Genapol PF 40ca.40.5 12 920 液体分散剂,乳化剂脂肪醇烷氧化物 100;液体 ?Genapol EP 2584ca.72.9 6 960 液体分散剂,乳化剂 EO/PO嵌段共聚物 100;糊状 ?Emulsogen V1816三丁基苯酚乙氧基化合物ca.67.0 11 液体乳化剂, 润湿剂带有8个EO的三仲丁基酚聚乙二醇醚 100;液体未豁免 ?Sapogenat T 080ca.43.0 13 液体乳化剂, 润湿剂带有11个EO的三仲丁基酚聚乙二醇醚 100;液体未豁免 ?Sapogenat T 110EPA 组成活性物质含量种类水溶性分散剂 (100%);外观固体分散剂甲酚-甲醛钠盐的浓缩产品 ca.80;粉末阴离子溶未豁免 ?Dispersogen 1494SC,WDG,WP 固体分散剂脂肪酸甲基牛磺酸钠盐 ca.60-65;粉末阴离子溶910,?Hostapon TPHCWDG 920,(950)萘磺酸盐分散剂 Coralon OTWP,WDG固体润湿剂WP,WDG Hostapur OSB非离子液体梳状共聚聚丙烯酸酯接枝共聚物 ca.100;糊状非离子溶未豁免 ?Dispersogen PSL 100物 SC阴离子液体梳状共聚Dispersogen ACP 120物 SC磷酸酯酸 Dispersogen LFHSC磷酸酯盐 Dispersogen LFSSC磷酸酯盐 Dispersogen Agent 3618SC钙盐支链钙盐70% Phenylsulfonat CA直链钙盐70% Phenylsulfonat CAL草甘膦助剂牛脂胺 Genamin 267绿色性 Synergen GL 5两性离子 Synergen G2D 溶剂绿色溶剂 Genagen 4166 绿色溶剂 Genagen 4296。
一种新型海洋抗癌药物__Halaven介绍

四、临床研究
步骤
1.临床前 研究
2. Ⅰ期 临床
3. Ⅱ期 临床
4. Ⅲ期 临床
4.1 临床前研究
给大鼠单剂量静脉注射eribulin(910 mg/m2 ) 后, 其α和β相半衰期短(分别为0.03和0.36 h) ,γ相半衰期长( 1.14 h) 。该药的稳态分布 容积为109.7 L /m2 。给犬单剂量静脉滴注 eribulin,其体内药物的 AUC 和 Cmax以与 剂量成比例的方式增加。
Uemura D, Takahashi K, et al. 1985. J Am Chem Soc, 107: 4796-4789
1986年,从这种海绵中又分离得到其它 7 种 halichondrin 族化合物
Halicondrin B 对接种 B16 黑色素瘤细胞及 P388 白血病 的小鼠,能延长寿命分别为 244%和236% 。
【适应证和用途】
HALAVEN 是一种微管抑制剂, 适用于转移乳癌患者的治疗,应已包 括一种蒽环类和一种紫杉烷类或 者辅助或转移情况 。
【剂量和给药方法 】
(1)给予1.4 mg/m2 静脉历时2至5分钟在21天疗程的第1天 和第8 天(2.1)。 (2)在有肝受损和中度肾受损患者中减低剂量(2.1)。 (3)不要与其它药物混合或与含葡萄糖溶液给药(2.3) 。
Axinella cf. carteri Denty 1993年 西印度洋海绵
1993年,化合物 halichondrin B 在美国 国家癌症研究所(NCI) 进行了体外抗肿瘤活性 测试
2.2 Halichondrin 族化合物的结构特征
Purdue制药公司的处方止痛药OxyContin的标签上将添加黑框警告

Purdue制药公司的处方止痛药OxyContin的标签上将添加黑框警告华盛顿,7月26日(路透社医学新闻)Purdue制药公司的OxyContin(氧可酮)的标签上将印上很明显的警示语,旨在帮助防止不适当的处方、滥用和转向使用问题。
OxyContin是一种被广泛滥用的止痛处方药。
OxyContin的滥用者通常会压碎药丸用鼻吸入或溶解后注射,以避开药物的控释给药系统。
今年早些时候公布的一项报告显示,司法部门认定至少有37例OxyContin滥用死亡事件。
为了突出与OxyContin滥用相关的危险性,FDA周三说,他们已和Purdue制药公司合作在药品的标签上作了不少修改,其中包括添加黑框的警示语,这是处方药中最有力的一种警示。
Purdue制药公司还将向药剂师、医生和其他医务人员发送一封“致亲爱的医务人员”的信,以强调与该药相关的滥用和转向使用问题,并解释标签的变化。
FDA说:“新的警告旨在减少OxyContin被不恰当地用于比许可应用的程度轻的疼痛或其它不该用II级麻醉药的疾病的机会。
在开处方时一定要认真地考虑疼痛是否严重到需治疗的程度,而不仅是引起疼痛症状的疾病本身。
”OxyContin是一种阿片样物质激动剂,和它的“近亲”吗啡一样有成瘾性。
该药被批准用于需较长时间用药物控制的中至重度疼痛的患者。
由于所有的阿片样物质类药物都有滥用、误用和转向使用的问题,所以FDA还鼓励其它生产该类产品的厂商检查他们的药品标签,可能的话也进行修改。
FDA强调还要给那些真正需要止痛药治疗的患者的合理使用留有余地。
Purdue制药公司发言人告诉路透社医学新闻。
“公司很高兴能成为第一个在产品标签上作出这些修改的止痛药生产商。
阿片样物质激动剂的其它生产商还包括强生公司和葛兰素史克公司。
”发言人认为,OxyContin标签修改的范围不大,称这次修改“很大程度上是一次图形设计的改动”,而不是大幅度修改内容。
Purdue制药公司官员过去曾指出,在超过6,000名患者的临床试验中,并没有一人发生OxyContin成瘾。
盐酸帕洛诺司琼说明书

临床研究表明,帕洛诺司琼能安全地与皮质类固醇类、镇痛药、止吐药、解痉药和抗胆碱 能药物一起使用。
鼠肿瘤模型研究表明,帕洛诺司琼不会抑制所研究的五种化疗药物(顺铂、环磷酰胺、阿 糖胞苷、阿霉素和丝裂霉素 C)的抗肿瘤活性。 【药物过量】
盐酸帕洛诺司琼注射液不能跟其他药物混合,故使用帕洛诺司琼注射液前、后均需应用生
理盐水冲洗输注管路。
【孕妇及哺乳期妇女用药】 尚未在妊娠期妇女中进行充分的随机对照临床试验,也没有妊娠期或分娩期妇女使用过帕
洛诺司琼,因此对其对母亲及胎儿的影响并不清楚,故怀孕期间应慎用本品。 帕洛诺司琼是否通过乳汁分泌尚不明确。鉴于多数药物均经人体乳汁排泄,对乳儿有潜在
琼或多拉司琼相似。发生率≥2%的临床不良反应列表如下:
表 1 预防化疗诱发恶心和呕吐研究中各治疗组发生率≥2%的不良反应
不良反应 帕洛诺司琼
昂丹司琼
多拉司琼
( = ) ( = ) ( = ) 0.25mg N 633
32mg iv N 410
100mg iv N 194
头痛 60(9%)
34(8%)
试验,结果表明,帕洛诺司琼组的不良反应发生率和严重程度与对照组昂丹司琼组的相似。结
果见表 2。
表 2 预防化疗所致恶心和呕吐研究中两组不良反应发生率
不良反应
帕洛诺司琼
昂丹司琼
头痛 便秘 腹泻 腹痛 心电图异常 头晕 全身间歇性颤抖
( = ) 0.25mg iv N 112 6(5.36%) 3(2.68%) 1(0.89%) 1(0.89%) 1(0.89%) 1(0.89%) 1(0.89%)
(中药学优秀论文)褐藻糖胶(FPS)的调脂机制探讨

袁同学摘要目前心脑虹管瘸已成为威胁我国居民生命健康的头号杀手,现代医学认为高脂血症和动脉粥样硬化与心脑血管发病有密切关系。
如何有效防治高脂血症成为现代医学研究的热点之一。
海带(LaminariajaponicaAresch)是一种营养丰富的食物,海带多糖(Laminariajaponicapolysaccharide)是海带的主要提取物,近年来研究发现海带多糖具有多方面的药理作用和生物活性功能。
其中有关褐藻糖胶的研究倍受国内外学者关注。
本课题拟在研究褐藻糖胶调节脂质代谢的可能机制,研究概要如下:目的:研究褐藻糖胶(FPS)对实验动物高脂血症的调节作用及其机理。
方法:(1)对正常小鼠血脂的影响:取健康雄性NIH小鼠50只,随机分为空白组、绞骨兰组、FPS低剂组、FPS中剂组、FPS高剂组,除空白组外,其余各组每天给药一次,共4周,末次给药后禁食12小时,眶静脉取血测其TG、TC。
(2)对高脂血症小鼠血脂的影响:取健康雄性NIH小鼠60只,随枫分为空白组、模型组、绞骨兰组、FPS低剂组、FPS中齐9组、FPS高剂组,每天上午各给药组给药,空白组和模型组给等体积蒸馏水,下午除空白组外,各组高脂乳剂灌胃以复制高脂血症模型,共4周,末次给药后蔡食12小时,眶静脉取血观察FPS对TG、TC、LD卜C、l{DL_c的影响。
(3)对高脂血症大鼠血脂的影响及机制探讨:取健康雄性SD大鼠60只,分组、造模、给药方法同(2),共持续4周。
样品处理及待测指标:①收集实验最后3天粪便,真空冷冻干燥后,粉碎混匀观察其中脂质(脂肪和胆同醇)和胆汁酸含量:②末次给药后禁食12小时,眶静脉丛取血观察FPS对TG、TC、LDL-C、皿L—C及亚组分、apoAI、apoB、LPL、HL、LcAT、SOD、MDA的影响;③取血之后恢复一天正常饮食,20%乌来糖腹腔注射麻醉大鼠,胆总管插管引流胆汁.待胆汁流稳定后开始计时,收集2小内的胆汁流量,并测其中的胆固醇和总胆汁酸含量;④胆汁引流结束后,处死大鼠,迅速取肝脏:在相同部位取lOOmg肝组织迅速置一70"C冰箱冷冻以备测其低密度脂蛋自受体(LDLR)mRNA的表达:另在相同部位取200mg用以测肝组织匀浆中的TG、Tc、LPL、HL、SOD、MI)A:最后取适量肝组织,以lo%福尔马林固定后做病理组织学观察。
仿制药参比制剂目录(第六十三批)
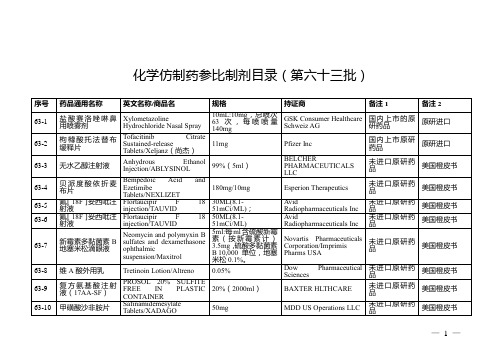
欧盟上市
63-27
匹伐他汀钙片
Pitavastatin Caical Europe GmbH
未进口原研药品
欧盟上市
63-28
匹伐他汀钙片
Pitavastatin Calcium Tablets
2mg
Kowa Pharmaceutical Europe GmbH
未进口原研药品
增加持证商Angelini Pharma Česká Republika s.r.o.
27-423
左甲状腺素钠片
Levothyroxine Sodium Tablets/Euthyrox;Levothyrox
100μg(以左甲状腺素钠计)
Merck Serono GmbH/Merck Sante/Merck GesellschaftmbH/Merck Healthcare Germany GmbH
100ml:1g(10mg/ml)
B Braunmedical Inc
未进口原研药品
美国橙皮书
63-14
钆特醇注射液
Gadoteridol Injection
/ProHance
279.3mg/mL(1.3965 g/5mL)
Bracco Diagnostics Inc
未进口原研药品
美国橙皮书
63-15
63-241
依折麦布瑞舒伐他汀锌胶囊
Ezetimibe rosuvastatin zinc hard capsule/Cholecomb
20mg/10mg
Proterapia Hungary Ltd
未进口原研药品
欧盟上市
63-251
盐酸氨酮戊酸凝胶
aminolevulinic acid hydrochloride gel/AMELUZ
