血清铁浓度检测试剂盒说明书
铁蛋白(FER)测定试剂盒(胶乳免疫比浊法)产品技术要求sainuopu
铁蛋白(FER)测定试剂盒(胶乳免疫比浊法)适用范围:用于体外定量测定人体血清中的铁蛋白的含量。
1.1试剂盒包装规格试剂1:1×20ml,试剂2:1×10ml;试剂1:2×36ml,试剂2:2×18ml;试剂1:1×400ml,试剂2:1×200ml。
校准品(可选):4×0.5ml(四水平),4×1ml(四水平)。
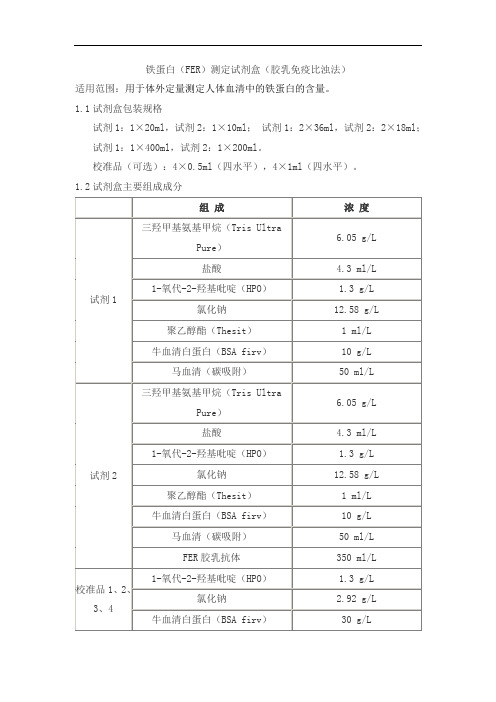
1.2试剂盒主要组成成分2.1 外观液体双试剂:试剂1无色澄清液体;试剂2 乳白色悬浊液。
校准品:浅黄至棕红色液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3 试剂空白吸光度在37℃、660nm波长、1cm光径条件下,试剂空白吸光度应不大于2.0。
2.4 分析灵敏度测定浓度为400ng/ml样本时,吸光度变化绝对值(|ΔA|)应不小于0.03。
2.5 线性范围在(6,450)ng/ml范围内,线性相关系数r不小于0.996,在(50,450)ng/ml 区间内线性相对偏差不大于±15%,(6,50]ng/ml区间内线性绝对偏差不大于±7.5ng/ml。
2.6 重复性重复测试两份高低浓度的样本,所得结果的变异系数(CV%)应不大于8%。
2.7 批间差不同批号试剂测试同一份样本,测定结果的批间相对极差应不大于10%。
2.8 准确度相对偏差:相对偏差应不超过±10%。
2.9 校准品溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求,校准品溯源至NIBSC生产的有证参考物质(WHO 94/572)。
2.10 稳定性效期稳定性:试剂盒在2℃~8℃下有效期为12个月。
取失效期的试剂盒进行检测试验结果满足2.3、2.4、2.5、2.6、2.8的要求。
Fe说明书

铁(Fe)测定试剂盒(亚铁嗪比色法)使用说明书【产品名称】通用名称:铁(Fe)测定试剂盒(亚铁嗪比色法)商品名称:英文名称:Reagent Kit for Iron (Fe) Test (Ferrozine Colorimetry) 【包装规格】SI7967 R1 7 × 50 ml R2 2 × 42 mlSI7753 R1 2 × 64 ml R2 2 × 16 mlSI7754 R1 8 × 60 ml R2 2 × 60 mlSI7553 R1 4 × 50 ml R2 1 × 50 mlSI7554 R1 6 × 100 ml R2 2 × 60 mlSI7253 R1 3 × 20 ml R2 3 × 5 mlSI7254 R1 4 × 50 ml R2 2 × 20 mlSI5054 R1 2 × 100 ml R2 2 × 20 mlSI0054 R1 4 × 100 ml R2 1 × 100 mlSI0001 R1 1 × 64 ml R2 1 × 16 ml朗道校准血清CAL2350 1 × 5ml【预期用途】本试剂盒用于检测人体样本中铁离子的含量,临床上主要用于贫血的辅助诊断。
【检验原理】血清样本中与转铁蛋白结合的铁,在酸性介质中从转铁蛋白中解离出来,再被还原剂抗坏血酸等还原为二价铁,后者与亚铁嗪络合成紫红色复合物,在562nm处该复合物有特定吸收峰,其吸光度与血【主要组成成分】氯化胍 4.5mol/L硫脲100mmol/L R2:亚铁嗪 1.7mmol/L 抗坏血酸40mmol/L不同批号试剂盒各组分不能互换。
【储存条件及有效期】未开封的试剂2~8℃密闭避光保存(勿冷冻),有效期为18个月。
铁离子(Fe)测定试剂盒(Ferene法)产品技术要求

铁离子(Fe)测定试剂盒(Ferene法)组成:试剂盒由试剂1(R1)、试剂2(R2)和校准品(选配)组成:试剂1(R1):醋酸缓冲液:200mmol/L,硫脲:42mmol/L, Trion X-100:0.50%;试剂2(R2):呋喃三嗪二钠盐:2mmol/L,盐酸羟胺:200mmol/L。
校准品(选配):单水平的液态校准品,在盐酸缓冲液中添加Fe离子,稳定剂<0.1%。
定值范围:(80.0~120.0)μmol/L。
校准品具有批特异性,详见瓶签。
预期用途:本产品用于体外定量测定人体血清或血浆中铁离子的含量。
2.1 外观液体双试剂:R1:无色透明液体; R2:黄绿色澄清液体。
校准品:无色至淡黄色澄清液体。
2.2 净含量液体试剂的净含量不得低于标示体积。
2.3溯源性根据GB/T 21415及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品可溯源至国家标准物质GBW08616。
2.4 试剂空白吸光度在37℃、600 nm波长、1cm光径条件下,试剂空白吸光度(A)应<0.3。
2.5 分析灵敏度测定浓度为50μmol/L时,吸光度差值(△A)应在(0.085~0.180) 范围之间。
2.6 线性范围在[2,120]μmol/L线性范围内,线性相关系数r2≥0.996。
在(50,120]μmol/L范围内的相对偏差≤10%;测定结果[2,50]μmol/L时绝对偏差≤5.0μmol/L。
2.7 重复性试剂盒测试项目重复性 CV< 6%。
2.8 批间差不同批号之间测定结果的相对极差应< 6%。
2.9 准确度相对偏差:用参考物质作为样本进行检测,测量结果与参考物质靶值的相对偏差应不超过±10%。
2.10稳定性2.10.1效期稳定性原包装试剂(含校准品)在(2~8)℃下有效期为18个月,取失效期的试剂盒检测其试剂空白、分析灵敏度、线性范围、重复性、准确度应分别符合2.4、2.5、2.6、2.7、2.9的要求。
铁蛋白(Fer)测定试剂盒(化学发光免疫分析法)产品技术要求huaketai

铁蛋白(Fer)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人血清中铁蛋白(Fer)的含量。
1.1规格
包装规格为96人份/盒。
主要组成成分见表1:
表1 组成
2.1物理性能
试剂盒的各液体组分应澄明,无沉淀或絮状物;
包被抗体微孔板的铝箔袋,应无破损现象。
2.2 准确度
回收率应在90%—110%之间。
2.3 线性
在企业线性范围内[5,800]ng/mL,线性相关系数应不低于0.9900。
2.4 重复性
分别检测高值和低值两个样本,重复性(CV%)应不高于10.0%.
2.5 批间差
在多个不同批次产品之间,样本测定结果的变异系数(CV)应不高于15.0%。
2.6 空白检测限
试剂盒的空白检测限应不高于3 ng/mL。
2.7 特异性
表2 与AFP、CEA的交叉反应
2.8 稳定性
2℃-8℃保存,有效期12个月,效期后分别检测2.1~2.4、2.6项,其结果应符合各项要求。
2.9溯源性
应根据GB/T 21415-2008提供所用Fer校准品溯源性资料,并溯源到国家标准品铁蛋白(Fer),编号:150540。
铁测定试剂盒(Ferene法)产品技术要求senmeixikema

铁测定试剂盒(Ferene法)适用范围:用于体外定量测定人血清中铁的含量。
1.1规格a)试剂1:2×60ml,试剂2:2×12ml;b)试剂1:4×50ml,试剂2:1×40ml;c)试剂1:2×40ml,试剂2:1×16ml;d)试剂1:2×40ml,试剂2:2×8ml;e)试剂1:2×80ml,试剂2:2×16ml;f)试剂1:1×40ml,试剂2:1×8ml;g)试剂1:1×25ml,试剂2:1×5ml。
1.2 组成试剂主要组分见表1:表1 试剂主要组分2.1 净含量应不低于试剂瓶标示装量。
2.2 外观试剂1:无色或淡黄色透明溶液,试剂2:淡黄色透明溶液。
2.3 试剂空白在600nm处测定试剂空白吸光度,应不超过1.2。
2.4 分析灵敏度测试 100μmol/L的被测物时,吸光度变化(ΔA)应不低于0.05。
2.5 准确度用国家标准物质对试剂盒进行测试,测定值与标准物质标示值的相对偏差应不超过±15%。
2.6 重复性变异系数(CV)应不超过5%。
2.7 线性2.7.1在[2,120]μmol/L范围内,线性回归的相关系数应不低于0.990;2.7.2测试浓度(20,120]μmol/L的样品,相对偏差应不超过±15%;测试浓度[2,20]μmol/L的样品,绝对偏差应不超过±6μmol/L。
2.8 批间差相对极差应小于10%。
2.9 稳定性取在2℃~8℃条件下贮存达到18个月后的试剂进行检测,应符合本技术要求2.2、2.3、2.4、2.5、2.6、2.7之规定。
试剂盒使用说明书

人抗乙型肝炎病毒表面抗体(HBsAb)酶联免疫分析(ELISA)试剂盒使用说明书本试剂仅供研究使用目的:本试剂盒用于测定人血清,血浆及相关液体样本中抗乙型肝炎病毒表面抗体(HBsAb)的含量。
实验原理:本试剂盒应用双抗原夹心法测定标本中人抗乙型肝炎病毒表面抗体(HBsAb)水平。
用纯化的抗原包被微孔板,制成固相抗原,往包被的微孔中依次加入抗乙型肝炎病毒表面抗体(HBsAb),再与HRP标记的抗原结合,形成抗原-抗体-酶标抗原复合物,经过彻底洗涤后加底物TMB显色。
TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的抗乙型肝炎病毒表面抗体(HBsAb)呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中人抗乙型肝炎病毒表面抗体(HBsAb)含量。
试剂盒组成:试剂盒组成48孔配置96孔配置保存说明书1份1份封板膜2片(48)2片(96)密封袋1个1个酶标包被板1×48 1×96 2-8℃保存标准品:270IU/L 0.5ml×1瓶0.5ml×1瓶2-8℃保存标准品稀释液 1.5ml×1瓶 1.5ml×1瓶2-8℃保存酶标试剂 3 ml×1瓶 6 ml×1瓶2-8℃保存样品稀释液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂A液 3 ml×1瓶 6 ml×1瓶2-8℃保存显色剂B液 3 ml×1瓶 6 ml×1瓶2-8℃保存终止液3ml×1瓶6ml×1瓶2-8℃保存浓缩洗涤液(20ml×20倍)×1瓶(20ml×30倍)×1瓶2-8℃保存样本处理及要求:1. 血清:室温血液自然凝固10-20分钟,离心20分钟左右(2000-3000转/分)。
铁蛋白(FER)检测试剂盒(胶体金免疫层析法)产品技术要求注册

医疗器械产品技术要求编号:铁蛋白(FER)检测试剂盒(胶体金免疫层析法)1.产品型号/规格及划分说明1.1型号/规格:检测条1人份/袋,检测卡1人份/袋。
1.2主要组成成分:1.检测试剂:由胶体金垫(胶体金标记羊抗鼠FER单克隆抗体)、硝酸纤维素膜(C 线包被羊抗鼠多克隆抗体,T线包被羊抗鼠FER单克隆抗体)、纤维膜、吸水纸、PVC 板、纤维膜、吸水纸、PVC板;2.干燥剂1个;3.铝箔袋1个;4.滴管1个(选配);5.稀释液1瓶;6.比色卡1张。
1.3适用范围用于体外半定量检测人血清、血浆、全血(静脉全血、末梢血)中的铁蛋白。
1.4产品储存条件及有效期(体外诊断试剂适用)4℃~30℃,密封避光保存,有效期24个月。
2.性能指标2.1物理性状2.1.1外观:检测试纸整洁完整、无毛刺、无破损、无污染。
2.1.2宽度:检测试纸宽度≥2.5mm。
2.1.3移行速度:液体移行速度应不低于10mm/min。
2.2阳性参考品符合率用铁蛋白企业内部阳性参考品进行检测,结果符合以下标准:80ng/ml显色强度强于50ng/ml参考线;30ng/ml显色强度强于20ng/ml参考线,弱于50ng/ml参考线;15ng/ml显色强度强于10ng/ml,弱于20ng/ml参考线。
2.3阴性参考品符合率分别检测参考溶液、胆红素250ng/ml、胆固醇2.5ug/ml、血红蛋白1.5ug/ml,结果均为阴性。
2.4最低检出量最低检出量为10ng/ml。
2.5批内精密性取一批的检测试剂盒10人份,用铁蛋白企业内部精密性参考品CV(10ng/ml)平行检测(n=10),显色强度与10ng/ml参考线相当,反应结果一致。
2.6批间精密性连续三批的检测试剂盒各取10人份,用铁蛋白企业内部精密性参考品CV(10ng/ml)平行检测(n=10),显色强度与10ng/ml参考线相当,反应结果一致。
2.7稳定性4℃~30℃,密封避光保存,放置24个月,分别检测2.1-2.5项,结果应符合各项目的要求。
铁蛋白(Fer)测定试剂盒(荧光免疫层析法)产品技术要求华科泰

铁蛋白(Fer)测定试剂盒(荧光免疫层析法)适用范围:本试剂盒用于体外定量测定人血清、血浆或全血中铁蛋白的含量。
1.1 包装规格10人份/盒、20人份/盒、50人份/盒。
1.2 主要组成成分每盒含10/20/50人份检测卡(每人份包装中含1袋干燥剂)、1个校准信息卡。
主要组成成分见表1:表12.1 物理性能2.1.1 外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固。
2.1.2 膜条宽度膜条的宽度≥3mm。
2.1.3 移行速度液体移行速度应不低于10 mm/min。
2.2 空白检测限空白检测限应不高于10 ng/mL。
2.3 准确度用世界卫生组织提供的标准品(NIBSC code:94/572)作为样本进行检测,其测量结果的相对偏差应在±15%范围内。
2.4 线性在企业线性范围内[10,500]ng/mL,相关系数(r)应不低于0.99。
2.5 重复性用浓度为(40±4) ng/mL、(100±10) ng/mL和(450±45)ng/mL的样本各重复检测10次,其变异系数(CV%)应不高于15.0%。
2.6 批间差用3个批号的检测卡检测浓度为(100±10)ng/mL和(450±45) ng/mL的样本,则批间相对极差(R%)应不高于15.0%。
2.7 特异性表22.8 溯源性根据GB/T 21415-2008的有关规定,校准信息卡溯源至世界卫生组织提供的标准品(NIBSC code:94/572)。
2.9 稳定性10℃~30℃保存,有效期12个月,效期后2个月内分别检测2.1~2.5、2.7项,其结果应符合各项要求。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
货号:MS2802 规格:100管/96样
血清铁浓度检测试剂盒说明书
微量法
注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:
血清铁是指血液中转铁蛋白所结合的铁,该指标常用于鉴别缺铁性与非缺铁性贫血。
测定原理:
亚硫酸钠还原血清Fe3+生成成Fe2+,Fe2+进一步与2, 2’- 联吡啶显色,在520nm处有吸收峰,测定该波长光吸收值即可计算血清铁含量。
自备实验用品及仪器:
离心机、可调式移液枪、可见分光光度计/酶标仪、微量石英比色皿/96 孔板、冰醋酸、氯仿和蒸馏水。
试剂组成和配置:
试剂一:粉剂×1 瓶,4℃保存。
临用前配制,加入15mL蒸馏水充分溶解。
试剂二:粉剂×1 瓶,4℃保存。
临用前配制,加入469μL冰醋酸,加入15mL蒸馏水充分溶解。
标准液:液体×1 支(EP管),100μmol/L Fe3+标准液,4℃保存。
测定:
1. 分光光度计/酶标仪预热30min,调节波长到520nm,蒸馏水调零。
2. 标准液解冻:提前取出标准液,置于室温下充分解冻后混匀。
3. 空白管:取EP管,依次加入125μL蒸馏水,125μL试剂一,125μL试剂二,混匀后盖紧,
置于沸水浴5min,自来水冷却。
加入62μL氯仿(自备),充分震荡混匀;室温10000rpm,离心10min,小心吸取上层液210μL,加入微量石英比色皿/96孔板,于520nm 测定吸光度,记为A空白管。
4. 标准管:取EP管,依次加入125μL标准液,125μL试剂一,125μL试剂二,混匀后盖紧,
置于沸水浴5min,自来水冷却。
加入62μL氯仿,充分震荡混匀;室温10000rpm,离心10min,小心吸取上层液210μL,加入微量石英比色皿/96孔板,于520nm测定吸光度,记为A标准管。
5. 测定管:取EP管,依次加入125μL血清,125μL试剂一,125μL试剂二,混匀后盖紧,置
于沸水浴5min,自来水冷却。
加入62μL氯仿,充分震荡混匀;室温10000rpm,离心10min,小心吸取上层液210μL,加入微量石英比色皿/96孔板,于520nm测定吸光度,记为A测定管。
注意:空白管和标准管只需测定一次。
血清铁浓度计算公式:
血清铁含量(μmol/dL)=[C 标准液×(A 测定管-A 空白管)÷(A 标准管-A 空白管)]×V 总=10× (A 测定管-A 空白管)÷(A 标准管-A 空白管)
C 标准液:100 μmol/L Fe 3+ 标准液;V 总:1 dL=0.1 L。
注意事项:
1、血清铁含量少,所用器皿(EP 管)需要注意,避免被铁污染。
2、试剂一和试剂二溶液不稳定,需现配现用,新配制的试剂只能当天使用。
3. 最低检出限为1μmol/L。
第1页,共1页。
