芳环的亲电取代亲核取代反应芳环取代基的反应
芳环的取代反应
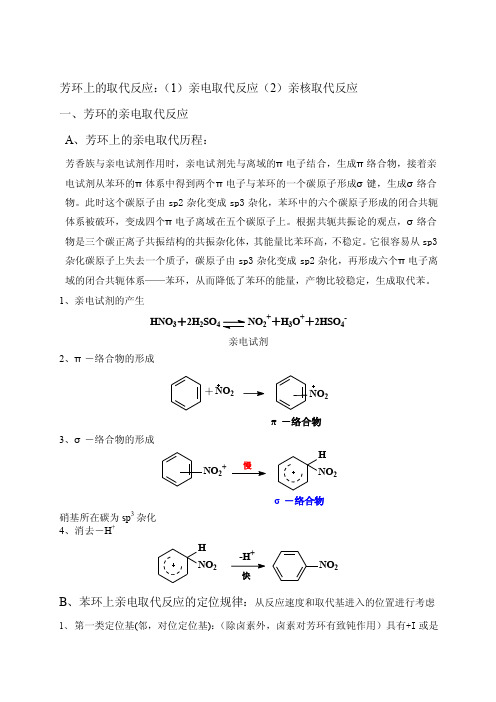
芳环上的取代反应:(1)亲电取代反应(2)亲核取代反应 一、芳环的亲电取代反应 A 、芳环上的亲电取代历程:芳香族与亲电试剂作用时,亲电试剂先与离域的π电子结合,生成π络合物,接着亲电试剂从苯环的π体系中得到两个π电子与苯环的一个碳原子形成σ键,生成σ络合物。
此时这个碳原子由sp2杂化变成sp3杂化,苯环中的六个碳原子形成的闭合共轭体系被破环,变成四个π电子离域在五个碳原子上。
根据共轭共振论的观点,σ络合物是三个碳正离子共振结构的共振杂化体,其能量比苯环高,不稳定。
它很容易从sp3杂化碳原子上失去一个质子,碳原子由sp3杂化变成sp2杂化,再形成六个π电子离域的闭合共轭体系——苯环,从而降低了苯环的能量,产物比较稳定,生成取代苯。
1、亲电试剂的产生HNO 3+2H 2SO4NO 2++H 3O ++2HSO 4-亲电试剂2、π-络合物的形成+NO 2π-络合物23、σ-络合物的形成NO 2+HNO2σ-络合物硝基所在碳为sp 3杂化 4、消去-H ++NO 2H NO 2快B 、苯环上亲电取代反应的定位规律:从反应速度和取代基进入的位置进行考虑1、 第一类定位基(邻,对位定位基):(除卤素外,卤素对芳环有致钝作用)具有+I 或是+C 效应,其作用是增大芳环的电子云密度。
致活基NH 2NHR2OHORNHCROPhR致钝基F Cl BrI2、 第二类定位基(间位定位基):具有-I 或-C 效应,使芳环上的电子云密度降低,均为致钝基NO 2NR 3COOHCOORSO 3HCNCHOCROCCl 3C 、影响亲电取代的因素:(1)芳环上取代基对于E +进入芳环位置的影响第一类定位基-邻对位定位基第二类定位基-间位定位基共振式越多, 正电荷分散程度越大,芳正离子越稳定。
(2) 动力学控制与热力学控制: α位取代-动力学控制产物; β位取代-热力学控制产物。
(3) 邻位和对位定向比:a 亲电试剂的活性越高,选择性越低。
高等有机第七章+芳环上的取代反应.

7.1.3 π-络合物
HE
E+Nu- fast
E+ slow
p-络合物
HE
E
fast
+ H+
决定反应 速度步骤
动力学同位素效应可以证明此步反应速度较快
7.1.4 动力学同位素效应
用氘或氚标记苯环进行亲电取代,kH/kD或kH/kT的数值
接近1,说明C——H键断裂的步骤不是决定反应速率的
步骤。 例如:
-CF3具有强烈的-I
使苯环钝化
进攻邻位
CNFO32
H E
CNFO32
H E
CNOF23
H E
CNFO32
+ E+
对位
NCOF23
NCOF23
不稳定
CNOF32
间位
HE
CNFO32
HE
NCOF23
HE 不稳定
CNOF23
H
H
H
E
E
E
进攻邻位
NH2 H E
NH2 + E+
对位 间位
NH2 HE
NH2
加成-消除机理(Ar-SE)进行的:
HE
E
E+Nu-
k1 k-1
k2
σ-络合物
芳正离子,Wheland络合物
一般地,k2>k1,k-1,所以, σ-络合物生成步骤是决定反应 速度步骤。
7.1.1 σ-络合物存在的证明
一、分离鉴定
Me
Me Et
EtF, BF 3
- 80 oC
H
BF4
Me
Me
Me
Me
NO2+ 本位进攻生成的σ-络合物可以发生几种反应:
芳环的亲电取代亲核取代反应芳环取代基的反应

二、取代基对芳环亲电取代反应的影响
4. 定位效应与定位规律的分析与解释 从实验事实提出的问题:
—— 为什么致活基都是邻对位取代基? —— 为什么大多数致钝基都是间位定位基? —— 为什么卤素既是弱的致钝基,又是邻对位定位基?
以下从三个方面进行分析讨论: —— 电子效应对苯环上电子云密度分布的影响 —— 苯环上电子云密度分布的理论计算结果 —— 反应中活泼中间体的结构与稳定性
CH3和烷基:弱致活基,邻对位定位基。
ortho-
CH 3 E H
CH 3 E H
CH 3 E H
parameta-
particularly stable CH 3
SO3
2 中等强度亲电试剂,能取代致活、不能取代致钝 的芳环:
—— R+ (obtained by R-Cl + AlCl3)
—— RC+=O (obtained by RCOCl + AlCl3)
———R2C=O+H(obtained by R2C=O + H+)
3 弱亲电试剂,只能取代高活化的芳环:
一、芳环的亲电取代反应及机制
(1) Halogenation
一、芳环的亲电取代反应及机制
(1) Halogenation
一、芳环的亲电取代反应及机制
(2) Nitration
一、芳环的亲电取代反应及机制
(3) Sulfonation —— reversible reaction
磺化反应是可逆的,存在动力学和热力学控制的竞争
二、取代基对芳环亲电取代反应的影响
1. Experimental Facts:
CH 3 HNO 3
CH 3 NO 2
第九章 芳环上的取代反应

以Cl+形式存在,故不易离去。
CH 3 HNO3 / H2 SO4 O2N + I NO 2 CH 3 CH 3
I
CH 3 H 3 O+ CH3 SO3H
CH 3 + CH 3 H H2SO4
实验结果表明,在原位取代中,离去基团的离去能 力由大到小的次序为: H+ >> I+ > Br+ > NO2+ > Cl+
中间体的稳定性-共振论
CH
CH
CH2 + E
邻对位
CH2 H E
CH
CH2 H E
CH
CH2 H E
CH
CH2 H E
间位
CH
CH2 CH H E
CH2 H E
CH
CH2 H E
共振式越多,正电荷分散程度越大,芳正离子越稳定。
Cl
Cl
Cl H E H E
Cl H E
Cl H E
进攻邻位
Cl + E+
Z E
邻
Z + E+
Z
对
E Z 间 E
定位基:苯环上原有取代基能指定新导入基团的位置, 则原有取代基成为定位基。这种效应叫定位基效应。
2、定位基分类
Z= 硝 化 产 物
o (%) p(%) m (%)
OH 40 60 <1
CH3 56 40 4
>1
Cl 30 70 <1
NO2 6 <1 >93
<1
H
SO3 H
H
SO3 H
a-位取代-动力学控制产物; b-位取代-热力学控制产物。
第八章芳环上的取代反应

Cl
OCH3
0.03
2.3X104
0.0009 0.14
0.25 5.5X104
对于不同的反应物进行相同的反应(即亲 核试剂相同),分速度因数的值不同,说 明不同的反应物对同一试剂的选择性不同, 这种选择性叫反应物选择性,它表明环上 原有的取代基对某一种亲电试剂使苯环活 化或钝化的程度。
反应物的选择性高时,通常间位和对位的 产率相差比较大,反之,反应物的选择性 差时,其差值比较小。
由于取代基的σ值与苯环上第二个官能团无关, 因此,σ值不随反应而变,它是取代基静电效应 的反映。
Hammett发现,邻位和对位取代苯甲酸酯 和苯甲酸酯水解常数之比的对数与σ值有很 好的直线关系,即Hammett方程:
lg(Kh/K0h) = ρlg(Ka/K0a) =ρσ 或:lg(K/K0) = ρσ
fo 、fm、 fp分别为邻、间、对位上的分速度因 数,k取代苯为取代苯的反应总速率,k苯为苯的总 反应速度(为1),邻位有两个,间位有两个, 对位有一个,苯上有六个,因此分别有除2,2, 1和6。
如甲苯和苯在乙酸中45℃时用硝酸硝化, 甲苯比苯快24.5倍,而得到的异构体比为: o 为57%,m为3.2%,p为40%,据此可计 算出:
当环上有吸电子基时,尤其是在离去基团 的邻位和对位,使亲核取代反应加速,有 供电子基时则反应受阻。
下列化合物进行亲核取代由易到难的次序 是:
当离去基团的邻位和对位有供电子基时,不仅按 加成-消除历程进行的亲核取代反应较难进行,且 有相当部分将按消除-加成(苯炔机理)历程进行, 但随着离去基团不同,两种历程的比例不同。越 是容易离去的基团,按加成-消除历程进行的量也
σ是一个常数,它只与取代基的性质及其在苯环 上的位置有关,称为取代基常数(或取代基特性 参数)。
芳环上的取代反应

+ N2
,
CuBr HBr
N CuCl
+ N2
①历程
N2
+ N
+ CuCl
Cl-
+ CuCl2 +N2
Cl
+ CuCl2
N2Cl-
+ CuCl
②举例
CuCN KCN
CN
+ N2
2. Gattermann(加特曼反应)
N2ClCl
N2Br-
Br
Cu HCl
Cu HBr
注:Cu代替CuCl或CuBr
N2ClNO2
+E+ +H+
中间体碳正离子 σ-络 合 物
2.典型亲电取代反应历程举例: 硝化反应:
HNO3+2H2SO4
H
每摩尔 HNO3在浓 H2SO4中 形成四个质点 (冰点降低实验证实)
H3O+2HSO4+NO2
NO2
H NO2
拉曼光谱中 NO2在 1400cm-1 处有吸收带
NO2
+ NO2
慢
+HSO4 -
COOH C H C C
N2+ COOH
Cu -N2
H COOH
-H
△ 菲
三.苯炔历程(消除-加成历程) Cl 1. 反应历程: NH
2
Cl
-Cl-
NH2
H NH2
NH2
NH3
+ NH2
苯炔历程证明: ①红外光谱证明
(8 K时可观察到它的光谱)
②碘苯与NaNH2反应时,加入1,3-环己二烯或呋喃可生成D-A产物。
N2Cl
芳香族化合物的取代反应

(D)H (D)H NO2 H(D) HNO3/H2SO4 H(D) H(D) kH/kD = 1.05 (D)H (D)H NO2 H(D) NO2 H(D)
容易观察到较小的同位素效应 (kH/kD = 1-3,而非正常的6-7): 第一步具有可逆性及由此引起 的分配效应所产生的。
:
:
:
:OMe
+
H
E
H
E :
H
E : :OMe H E
H
E
:OMe
+
:
:OMe
+
H E
H E
+
化学
-I > +C ,钝化苯环:X
Cl
Cl E H H E
B间位定位基 的定位能力次序大致为(从强到弱) 2.
-NR3, -NO2, -CF3, -CCl3, -CN, -SO3H, -CHO, -COR,-COOH, -CONH2。
反 应 进 程
化学
2. 同位素效应 当一个反应进行时,在决定反应速率的步骤中发生 了反应物分子的同位素键的断裂,将显示初级动力 学同位素效应。最常见的是,反应物分子中的氢被 氘取代后,反应时有速率上的不同,这种变化称为 氘同位素效应,用kH/kD表示。 例如下列反应有 动力学同位素效 应,说明质子是 在决速步的失去 的:
CH2CH3 H
CH3CH2 + [AlCl3Br]
CH2CH3
H+
+
HBr AlCl3
化学
特点: 1°常用的催化剂是无水AlCl3,此外 FeCl3、BF3、 无水HF、SnCl4、ZnCl2、H3PO4、H2SO4等都有催 化作用。
第四章_芳环上的取代反应

6)原位取代 (Ipso取代):
在亲电取代反应中,亲电试剂取代苯环上原有的取代 基,称为原位取代。
CH3 NO2 +
CH3
NO2OAc Ac2O
CH3
CH3
CH(CH3)2
CH(CH3)2 82%
+ NO2 CH(CH3)2 NO2 8% 10%
苯环上原有取代基被取代的难易,取决于离去基团
带有正电荷的稳定性或形成产物的难易程度。
_
因为一级正丙基正离子重排为 更稳定的二级异丙基正离子: CH3CHCH2 H 正丙基正离子 重排 CH3CHCH3 异丙基正离子
B). 酰基化
O AlCl3 O CR + HCl 烷基 苯 基 酮
+ R CC l O O
( RCOOH)
(or RCOCR)
酰基化反应不会发生重排
酰基化历程
O RCC l + A lC l 3 O + O CR H RC AlCl 4 O RC AlCl4 O CR H + A lC l 4
fa st
E
+ s lo w σ-络合物芳正离子
E
fa st
p-络合物
芳正离子生成的一 + + H 步是决定反应速率 的一步
实验已经证实芳正离子的存在:
CH3 C2H5F/BF3 H3C CH3
-80℃
H C2H5 CH3 H3C BF4CH3 m. p: -15℃
苯环亲电取代反应进程-位能变化曲线图
+
5)螯合效应:当环上的取代基与亲电试剂发 生配位时,通常发生邻位取代。
H2 C HNO3 / H2 SO4 H2 C H2 C O CH 3 H2 C + NO 2 59% H2 C H2 C O CH 3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
亲电试剂的分类
1. 强亲电试剂,能取代致活和致钝的芳环:
—— Cl-Cl+ - -AlCl3 —— Br-Br+ - -FeBr3 —— I+ (obtained by I2 + HNO3) —— +NO2 (obtained by HNO3 + H2SO4) —— +SO3H (from H2SO4) or SO3
二、取代基对芳环亲电取代反应的影响
4. 定位效应与定位规律的分析与解释
—— 电子效应对苯环上电子云密度分布的影响
O N O O N O O N O O N O
O
δ +
N
O
δ
δ
-CHO、-COR、-COOR、-CONHR、-SO3H、-NO2 、 、 、 、 、 等基团均具有吸电子共轭和吸电子诱导作用, 等基团均具有吸电子共轭和吸电子诱导作用,从而使 得苯环上的电子云密度降低,亲电反应速率降低。 得苯环上的电子云密度降低,亲电反应速率降低。 从上述共振结构可以看出吸电子共轭作用使得邻对位 电子云密度降低得更多,因此反应发生在间位。 电子云密度降低得更多,因此反应发生在间位。
二、取代基对芳环亲电取代反应的影响
3. The effect of substituents on orientation
邻对位定位基) ① ortho/para directors (邻对位定位基 邻对位定位基 —— all activating substituents are ortho/para directors. —— the weakly deactivating halogens are ortho/para directors. 间位定位基) ② meta directors (间位定位基 间位定位基 —— all deactivating substituents (except the halogens) are meta directors.
取代反应中发生 δ 络合物的证据有好几个方面,用标 记同位素方法研究取代速度是其中之一。如果质子的 离去关系到亲电取代速度,则环上速度显示第一级的 同位素效应。对硝化和一些快速取代反应看不出这种 同位素效应。例如苯上有五个氘的硝基苯在硝化时与 普通硝基苯的硝化没有什么差别。缺乏同位素效应说 明退减质子是一步快步骤。但并非都是如此某些芳香 取代反应显示kH/kD比值在1—2之间,说明存在着同 位素效应,这是与。络合物机理一致酌,因为这种络 合物退减质子较慢,成为决定速度的步骤.从而证明 了δ 络合物中间体。
取决于取代基电子效应对苯环电子云密度影响的大小 Weakly Activating Substituents
致钝基
Moderately activating Substituents Strongly activating substituents
邻、对位定位
***
只具有 吸电子 诱导作用
间位定位 -CF3
第七讲
芳环的亲电取代 亲核取代反应 芳环取代基的反应
Electrophilic and Ncleophilic Substitutions at Aromatic Rings, Reactions of Substituents of Aromatic Rings
本章主要内容
一、苯的亲电取代反应及机制 二、取代基对苯环亲电取代反应的影响 三、稠环芳烃的亲电取代反应 四、芳香杂环的亲电取代反应 五、芳环和芳香杂环的亲核取代反应 六、芳环取代基的反应 ——芳香重氮盐的形成及其在合成中的应用 芳香重氮盐的形成及其在合成中的应用
10
10
一、芳环的亲电取代反应及机制
(5) Friedel-Crafts Acylation (傅氏酰基化 傅氏酰基化) 傅氏酰基化
O - AlCl4 R C Cl: + AlCl3 R C O: R C O:
没有重排问题 acylium ion 注意使用不同的酰化试剂时, 注意使用不同的酰化试剂时,催化剂的用量是不同的 >1.0eq.
二、取代基对芳环亲电取代反应的影响
2. The effect of substituents on reactivity
致活基) ① Activating substituents (致活基 致活基 —— Electron-donating substituents ( 给 电 子 基 ) increase the reactivity of the benzene ring toward electrophilic aromatic substitution. 致钝基) ② Deactivating substituents (致钝基 致钝基 —— Electron-withdrawing substituents (吸电子基 吸电子基) 吸电子基 decrease the reactivity of the benzene ring toward electrophilic aromatic substitution.
二、取代基对芳环亲电取代反应的影响
1. Experimental Facts:
CH3 HNO3 CH3 NO2 CH3 Faster than nitration of bezene orthoBr HNO3 Br NO2 NO2 paraBr Slower than nitration of bezene orthoNO2 HNO3 NO2 NO2 metaNO2 paraSlower than nitration of bezene
HC N
ArN+
NH+ (obtained
by HCN+ HCl)
O+
(obtained by HNO2+ H+) N (obtained by ArNH2+ HNO2+H+)
苯环上的电子为芳香取代反应供给了电子, 很多亲电试剂能与之反应其范围远比烯、 炔加戊反应为广泛。可以用一个统一的反 应机理来解释这些取代反应,虽然反应酌 动力学、自由能—反应曲线对每一种亲电 试剂来说可以是不一样的,但若干中间步 骤基本上是相似的.
一、芳环的亲电取代反应及机制
(4) Friedel-Crafts Alkylation (傅氏烷基化 傅氏烷基化) 傅氏烷基化
Note: Rearrangement may occur in alkylation
一、芳环的亲电取代反应及机制
(4) Friedel-Crafts Alkylation (傅氏烷基化 傅氏烷基化) 傅氏烷基化
一、芳环的亲电取代反应及机制
(1) Halogenation
一、芳环的亲电取代反应及机制
(1) Halogenation
一、芳环的亲电取代反应及机制
(2) Nitration
一、芳环的亲电取代反应及机制
(3) Sulfonation —— reversible reaction
磺化反应是可逆的, 磺化反应是可逆的,存在动力学和热力学控制的竞争
O R
F-C acylation
n al ky la t io
Halogenation
na lfo Su tio
Cl
Br
I
C
Nitration
n
F-
R
NO2
SO3H
一、芳环的亲电取代反应及机制
以上几种亲电取代反应仅亲电试剂不同: 以上几种亲电取代反应仅亲电试剂不同: —— Cl-Cl+ - -AlCl3 —— Br-Br+ - -FeBr3 —— I+ (obtained by I2 + HNO3) —— +NO2 (obtained by HNO3 + H2SO4) —— +SO3H (from H2SO4) or SO3 —— R+ (obtained by R-Cl + AlCl3) —— RC+=O (obtained by RCOCl + AlCl3)
一、芳环的亲电取代反应及机制
1. Mechanism:
Step 1: 类似烯烃,亲电试剂进攻苯环的 键,形 类似烯烃,亲电试剂进攻苯环的pi-键 成碳正离子 Step 2: 这一步与烯烃不同,不是发生亲核试剂 这一步与烯烃不同, 对苯环进行加成,而是脱去一个质子, 对苯环进行加成,而是脱去一个质子,回复到稳 定的芳香性苯环结构, 定的芳香性苯环结构,结果发生取代反应。
2 中等强度亲电试剂,能取代致活、不能取代致钝 的芳环:
—— R+ (obtained by R-Cl + AlCl3) —— RC+=O (obtained by RCOCl + AlCl3) ———R2C=O+H(obtained by R2C=O + H+)
3 弱亲电试剂,只能取代高活化的芳环:
>2.0eq.
一、芳环的亲电取代反应及机制
思考题: 思考题: 如何从苯合成正丁基苯?
二、取代基对芳环亲电取代反应的影响
A study of the chemistry of aromatic compounds leads to deeper understanding of the effects of electronic and steric factors on reactivity, which will be of benefit in the further study of chemistry and biochemistry.
X
x
+ + E
X
E
X
X
E H
H Eห้องสมุดไป่ตู้E
一、芳环的亲电取代反应及机制
