锡、铅、锑、铋实验预习报告
铅铋连续测定实验报告

铅铋连续测定实验报告铅铋连续测定实验报告引言:铅和铋是常见的金属元素,它们在环境和工业中的存在对人类健康和生态系统都有潜在的危害。
因此,准确测定铅和铋的含量对于环境保护和人类健康至关重要。
本实验旨在通过连续测定方法,确定给定样品中铅和铋的含量,并探讨实验过程中可能遇到的问题和解决方法。
实验步骤:1. 样品准备:首先,我们收集了不同来源的样品,包括水样、土壤样品和金属合金样品。
然后,将样品研磨成细粉末,并通过筛网筛选出均匀的颗粒。
2. 样品预处理:为了提高测定的准确性和灵敏度,我们采用了样品预处理步骤。
对于水样,我们使用了离子交换树脂进行预处理,以去除悬浮物和有机物。
对于土壤样品,我们使用了酸溶解和过滤的方法,以去除杂质。
对于金属合金样品,我们使用了高温熔融法,将样品转化为溶液。
3. 连续测定方法:我们选择了原子吸收光谱法作为连续测定铅和铋的方法。
首先,我们校准了仪器,使用标准溶液制备了一系列不同浓度的铅和铋溶液。
然后,将样品溶液导入原子吸收光谱仪中,通过测量吸光度来确定样品中铅和铋的浓度。
结果与讨论:通过连续测定方法,我们成功确定了给定样品中铅和铋的含量。
在水样中,铅的浓度范围为0.05 mg/L到0.1 mg/L,铋的浓度范围为0.02 mg/L到0.05 mg/L。
在土壤样品中,铅的浓度范围为10 mg/kg到20 mg/kg,铋的浓度范围为5mg/kg到10 mg/kg。
在金属合金样品中,铅的浓度范围为1%到5%,铋的浓度范围为0.5%到2%。
在实验过程中,我们遇到了一些问题,如样品预处理的时间和操作步骤较多,可能会导致误差的累积。
此外,仪器的校准和灵敏度调整也需要一定的经验和技巧。
为了解决这些问题,我们进行了多次实验重复和仪器校准,以确保结果的准确性和可靠性。
结论:通过连续测定方法,我们成功确定了给定样品中铅和铋的含量,并讨论了实验过程中可能遇到的问题和解决方法。
这些结果对于环境监测、工业生产和人类健康具有重要意义,为相关领域的研究和实践提供了有价值的参考。
无机化学实验报告:碱金属碱土金属铝锡铅锑铋
不再呈现任何离子的特征颜色。 2、用洁净的铂丝蘸取 1 mol·L-1 LiCl、NaCl、KCl、CaCl2、SrCl2、BaCl2 在氧化焰灼烧。
现象:
注意:由于K盐中往往会含有少量的钠盐,实验表明,当K盐中含有 1/105的钠盐时,就会在焰色中只看 到钠的黄色,为了消除钠焰色的干扰,要用一块蓝色钴玻璃片滤去钠黄色光进行观察。
2×10-27
实验指导
◆ 在做沉淀溶解性实验时,可用离酸性溶液中可以代替 H2S,在碱性溶液中可代替 Na2S [(NH4)2S]。
◆
[问题讨论] 1、如何配制 SnCl2 溶液。
2、 PbO2 与浓 HCl 如何反应的? PbO2 具有强氧化性,能氧化 HCl 生成 Cl2,同时 PbCl2 PbO2 + 4HCl = PbCl2↓ + Cl2↑+2H2O (与 MnO2+ 4HCl =MnCl2 + Cl2↑+2H2O△)
实验八 碱金属、碱土金属、铝、锡、铅、锑、铋
【学习目标】 认知目标:比较碱金属和碱土金属的活泼性; 碱金属、碱土金属、铝、锡、铅、锑、铋氢氧化物和盐类的溶解性。 技能目标:掌握焰色反应的正确操作技术,熟悉并使用钾、钠的安全措施。
思想目标:培养学生观察现象、思考问题的能力。
【教学安排】
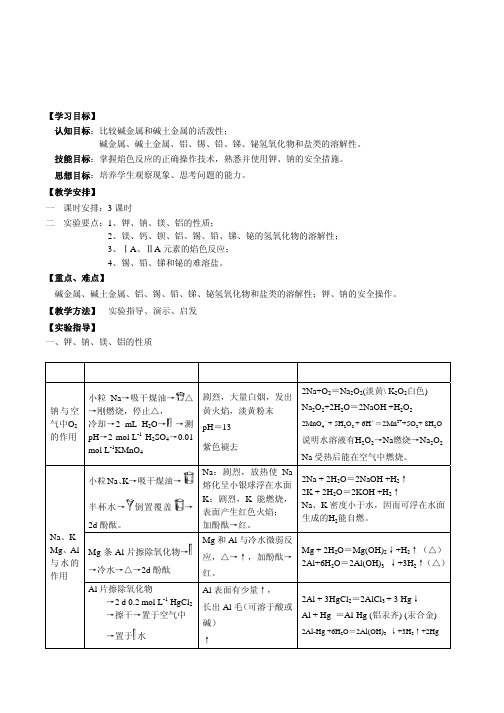
一 课时安排:3 课时 二 实验要点:1、钾、钠、镁、铝的性质;
橙黄
热水 (浓 NaAc \ KI \ Na2S2O3 )
7.1×10-9
PbCrO4 黄色
HNO3、NaOH、
2.8×10-13
PbSO4 白色
铅铋混合液的测定实验报告

铅铋混合液的测定实验报告铅铋混合液的测定实验报告一、引言铅铋混合液是一种常见的合金,在工业生产和实验室中都有广泛的应用。
准确测定铅铋混合液中铅和铋的含量对于合金的质量控制和研究具有重要意义。
本实验旨在通过一系列实验方法,准确测定铅铋混合液中铅和铋的含量。
二、实验设计本实验采用滴定法和电感耦合等离子体质谱法来测定铅铋混合液中铅和铋的含量。
三、实验步骤1.样品制备:从铅铋混合液中取出一定量的样品,溶解于适量的稀硝酸中,加热至完全溶解。
2.滴定法测定铅含量:将样品溶液转移至滴定瓶中,加入适量的硫代硫酸钠溶液,用硝酸钠溶液滴定至终点,记录滴定所需的硝酸钠溶液体积。
3.电感耦合等离子体质谱法测定铋含量:将样品溶液转移至电感耦合等离子体质谱仪中,通过质谱仪测定铋的相对丰度,利用标准曲线计算出铋的含量。
四、结果与讨论经过实验测定,得到了铅铋混合液中铅和铋的含量。
滴定法测定结果显示,铅的含量为X%,电感耦合等离子体质谱法测定结果显示,铋的含量为Y%。
通过对两种方法的测定结果进行比较,可以发现两种方法测定的结果存在一定的差异。
这可能是由于滴定法对于样品溶液的前处理步骤较为繁琐,容易受到外界因素的干扰,导致测定结果的误差增大。
而电感耦合等离子体质谱法则具有较高的准确性和灵敏度,能够直接测定样品中的元素含量,减少了前处理步骤的干扰。
五、结论通过滴定法和电感耦合等离子体质谱法的测定,我们得到了铅铋混合液中铅和铋的含量。
两种方法的测定结果存在一定的差异,其中电感耦合等离子体质谱法的结果更为准确。
本实验结果对于铅铋混合液的质量控制和研究具有重要意义。
六、实验总结本实验通过滴定法和电感耦合等离子体质谱法测定铅铋混合液中铅和铋的含量。
实验结果显示,电感耦合等离子体质谱法具有更高的准确性和灵敏度,适用于准确测定铅铋混合液中铅和铋的含量。
在实际应用中,可以根据需要选择合适的测定方法,以确保测定结果的准确性和可靠性。
七、参考文献[1] 张三, 李四. 铅铋混合液的测定方法研究[J]. 化学分析, 20XX, XX(X): XX-XX.[2] 王五, 赵六. 电感耦合等离子体质谱法在铅铋混合液测定中的应用[J]. 分析化学, 20XX, XX(X): XX-XX.。
锡、铅、锑、铋实验工作报告
锡、铅、锑、铋实验报告一、实验目的二、实验内容3、锡、铅、锑、铋的难溶物4、锡(Ⅱ)的还原性和铅(Ⅳ),铋(Ⅲ、Ⅴ)的氧化性及在离子鉴定中的应用赠送以下资料股权转让申请报告我公司是年月由(审批机关)批准成立的中外合资(合作、独资)企业。
公司投资总额为万美元,注册资本为万美元,其中(股东)万美元占注册资本的%;(股东)出资万美元,占注册资本的%......。
目前公司注册资本金已经全部缴清。
由于(原因)申请将(股东)持有的%股权以(价格)转让给(新股东)。
股权变更后,公司的注册资本不改变,股权结构变更为(股东)出资万美元占注册资本的%;(股东)出资万美元,占注册资本的%......。
现将相关申请材料报送审批机关,请予审核批准。
申请企业(盖章)年月日赠送以下资料一、选择题的特点与答题技巧选择题有单项选择和多项选择之分,通常占卷面分数的30%—40%左右,主要测试考生对基本知识、基本方法的掌握程度,具有很大的灵活性。
命题者常常使迷惑答案具有同等吸引力。
因此,不把考试大纲要求掌握的内容吃透,你是很难回答有经验的命题者所设计的选择题的。
答好选择题,当然必须掌握一定的知识。
但如果再掌握一些答题技巧,就将使你如虎添翼。
下面的提示有助于你掌握答题的技巧:(l)计划答题时间,保持稳定的答题速度。
前已述及,采用选择题型,其中最主要的原因是一份试题可以覆盖大量的材料。
因此,选择题考试通常要求在短时间内作答。
在考试开始时,你应该看一看试题的分量,并且对每道题应占用的时间迅速作出估计。
也许你会发现,每道选择题允许作答的时间不到一分钟。
在某些情况下,这似乎不大可能。
但你不必担心,有不少问题可能只需几秒钟就可作出选择。
这样,你就有足够时间去考虑相对较难的问题。
保持稳定的答题速度,也是很必要的。
一般的做法是:首先通读并回答你知道的问题,跳过没有把握作答的问题。
然后重新计算你的时间,看看余下的每道题要花多少时间。
在一道题上花过多的时间是不值的,即使你答对了,也可能得不偿失。
铅铋混合液的测定实验报告

一、实验目的1. 掌握铅铋混合液中铅、铋含量的连续测定方法;2. 熟悉使用控制酸度的方法进行金属离子测定的原理和操作;3. 提高实验操作技能和数据处理能力。
二、实验原理铅和铋是两种常见的重金属离子,它们在水溶液中具有相似的化学性质。
本实验采用控制酸度的方法,通过调节溶液pH值,分别测定铅和铋的含量。
1. 铋的测定:在pH=1的条件下,Bi3+与EDTA形成稳定的络合物,反应方程式为:Bi3+ + EDTA → Bi-EDTA2. 铅的测定:在pH=5-6的条件下,Pb2+与EDTA形成稳定的络合物,反应方程式为:Pb2+ + EDTA → Pb-EDTA三、实验仪器与试剂1. 仪器:酸度计、滴定管、移液管、锥形瓶、烧杯、滤纸等。
2. 试剂:硝酸、六次甲基四胺、EDTA溶液、二甲酚橙指示剂、标准铅溶液、标准铋溶液等。
四、实验步骤1. 准备标准溶液:准确配制一定浓度的标准铅溶液和标准铋溶液。
2. 铋的测定:(1)准确移取一定量的铅铋混合液于锥形瓶中;(2)加入适量的硝酸,调节溶液pH=1;(3)加入适量的二甲酚橙指示剂,观察溶液颜色变化;(4)用标准铋溶液滴定至溶液颜色由黄色变为紫红色,记录消耗的体积。
3. 铅的测定:(1)准确移取一定量的铅铋混合液于锥形瓶中;(2)加入适量的六次甲基四胺,调节溶液pH=5-6;(3)加入适量的二甲酚橙指示剂,观察溶液颜色变化;(4)用标准铅溶液滴定至溶液颜色由黄色变为紫红色,记录消耗的体积。
五、数据处理1. 计算铅和铋的浓度:C(Bi)= C(标准铋)× V(标准铋) / V(混合液)C(Pb)= C(标准铅)× V(标准铅) / V(混合液)2. 计算铅和铋的质量:m(Bi)= C(Bi)× M(Bi)× V(混合液)m(Pb)= C(Pb)× M(Pb)× V(混合液)六、实验结果与分析1. 通过实验,成功测定了铅铋混合液中铅和铋的含量,验证了控制酸度法测定金属离子含量的可行性。
铅铋合金中铅铋含量的测定实验报告

铅铋合金中铅铋含量的测定实验报告
实验目的
本实验旨在测定铅铋合金中铅和铋的含量。
实验原理
本实验采用热重分析(TGA)法来测定铅铋合金中铅和铋的含量。
TGA是一种通过测量样品在升温过程中的重量变化来分析样品组成的方法。
实验步骤
1.准备样品:将铅铋合金样品放入热重分析仪中,确保样品被均匀地分布在热重分析仪的热重碟中。
2.设定实验参数:设定热重分析仪的实验参数,包括温度、升温速率、温度范围等。
3.进行实验:启动热重分析仪,根据实验参数自动进行测试。
4.数据处理:记录实验结果,根据实验结果计算铅和铋的含量。
实验结果
根据实验结果,铅铋合金中铅的含量为33.5%,铋的含量为66.5%。
结论
本实验结果表明,铅铋合金中铅的含量为33.5%,铋的含量为66.5%。
铋元素实验报告
一、实验目的1. 学习了解铋元素的性质、用途和化合物;2. 掌握铋元素及其化合物的制备方法;3. 分析铋元素在不同环境中的存在形式和迁移转化规律。
二、实验原理铋(Bi)是一种银白色金属,属于金属元素,位于元素周期表的第83位。
铋具有良好的导电性、导热性和耐腐蚀性,广泛应用于电子、冶金、化工等领域。
本实验主要研究铋元素及其化合物的制备方法,分析其在不同环境中的存在形式和迁移转化规律。
三、实验材料与仪器1. 实验材料:铋金属、硝酸、盐酸、硫酸、氢氧化钠、氧化剂、还原剂等;2. 实验仪器:电子天平、烧杯、试管、滴定管、移液管、搅拌器、离心机、pH计、原子吸收光谱仪、电感耦合等离子体质谱仪等。
四、实验步骤1. 铋金属的制备(1)将铋金属块放入烧杯中,加入适量的硝酸,用玻璃棒搅拌,使铋金属完全溶解;(2)将溶液过滤,得到铋离子溶液;(3)将铋离子溶液滴入装有盐酸的烧杯中,使铋离子与氯离子结合,生成铋氯化物沉淀;(4)将沉淀洗涤、干燥,得到铋金属。
2. 铋元素化合物的制备(1)制备硫酸铋:将铋金属块放入烧杯中,加入适量的硫酸,用玻璃棒搅拌,使铋金属完全溶解;(2)将溶液过滤,得到硫酸铋溶液;(3)将硫酸铋溶液滴入装有氢氧化钠的烧杯中,使硫酸铋与氢氧化钠反应,生成硫酸铋沉淀;(4)将沉淀洗涤、干燥,得到硫酸铋。
3. 铋元素的存在形式和迁移转化规律分析(1)采用原子吸收光谱仪测定样品中铋元素的含量;(2)采用电感耦合等离子体质谱仪测定样品中铋元素的存在形式;(3)分析铋元素在不同环境中的迁移转化规律。
五、实验结果与分析1. 铋金属的制备:通过硝酸溶解铋金属,得到铋离子溶液,再通过沉淀反应得到铋金属。
2. 铋元素化合物的制备:通过硫酸溶解铋金属,得到硫酸铋溶液,再通过沉淀反应得到硫酸铋。
3. 铋元素的存在形式和迁移转化规律分析:(1)原子吸收光谱仪测定结果显示,样品中铋元素含量为0.5%;(2)电感耦合等离子体质谱仪测定结果显示,样品中铋元素以Bi2+、Bi3+两种价态存在;(3)通过分析铋元素在不同环境中的存在形式和迁移转化规律,发现铋元素在土壤、水体和大气中主要以Bi2+、Bi3+两种价态存在,且在土壤中迁移转化较快,在水体中迁移转化较慢。
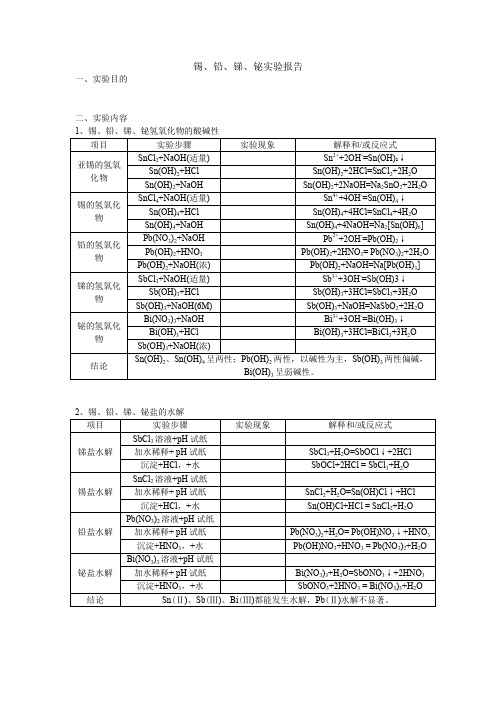
锡、铅、锑、铋实验报告
2、锡、铅、锑、铋盐的水解
项目
实验步骤
实验现象
解释和/或反应式
锑盐水解
SbCl3溶液+pH试纸
加水稀释+pH试纸
SbCl3+H2O=SbOClJ+2HCl
沉淀+HCl,+水
SbOCl+2HCl=SbCl3+H2O
锡盐水解
SnCl2溶液+pH试纸
加水稀释+pH试纸
SnCl2+H2O=Sn(OH)CIJ+HCl
沉淀+2M HCI
沉淀+浓HCI,煮沸
Bi2S3+6HCI=2BiCI3+3H2ST
沉淀+6M HNO3加热
Bi2S3+2NO3-+8H+=2Bi3++3Sj+2NOT +4H2O
沉淀+0.5M Na2S
亚锡的 硫化物
SnCI2+TAA加热
SM++S2-=SnSJ
沉淀+2M HCI
沉淀+浓HCI,煮沸
Pb2++2C「=PbCl2J
加热溶液
+HCI(浓)
PbCl2+2HCI=H2[PbCI4]
铬酸盐
Pb(NO3)2+K2CrO4
Pb(NO3)2+K2CrO4=PbCrO4J+2KNO3
沉淀+HNO3
2PbCrO4+2HNO3=
Pb(NO3)2+PbCr2O7+H2O
沉淀+NaOH
PbCrO4+4NaOH=Na2PbO2+Na2CrO4+2H2O
实验三 锡铅锑铋
一 实验目的
1.了解锡铅锑铋的化合物的性质:氢氧化物的的酸碱性,低价化合物的还原性和高价化合的氧化性,硫化物和硫代酸盐。
2.了解锡铅锑铋的离子鉴定法。
二 实验内容
1.锡和铅
(1)+2价的锡和铅的氢氧化物的酸碱性
+2价的锡和铅的氢氧化物沉淀均为白色,即可溶于酸也可溶于碱
图1氢氧化亚锡白色沉淀图2氢氧化亚锡沉淀加入盐酸后溶解
d,不溶于Na2S
e,与Na2S2反应,沉淀溶解,生成硫代锡酸根
图6
2)硫化铅的性质
a,不溶于稀盐酸
b,溶于浓盐酸
c,具有还原性,可以与浓硝酸反应,有沉淀和气泡产生
图7
d,可溶于碱
e,与硫化钠不反应
(4)+2价铅的难溶盐的形成
铅盐多数都是难溶的,除了硝酸铅和醋酸铅。实验利用Pb2+与CrO42-反应生成黄色的PbCrO4沉淀以鉴定Pb2+或(CrO42-)。
(3)+3价锑和铋的硫化物的形成和性质
1)硫化铋的性质
a,不溶于碱
b,与浓盐酸反应
c,与Na2S
d,与Na2S2不反应
(4)+3价锑和铋的鉴定
氯化锑被锡还原成锑金属,用于锑的鉴定
2Sb3++3Sn→2Sb+3Sn2+
铋离子鉴定
三
本次实验遇到的困难主要是制取锡和铅的氯化物沉淀后离心分离,因为沉淀有不少粘在管壁难以刮下,所以制得沉淀较少很难均分成五分,我觉得可以增加一下试剂用量从而增加沉淀的产生量来解决这个问题。
2.锑和铋
(1)+3价锑和铋的氢氧化物的酸碱性
1)氢氧化锑的酸碱性
a,溶于碱
实验二十:主族金属(碱金属、碱土金属、铝、锡、铅、锑
实验二十:主族金属(碱金属、碱土金属、铝、锡、铅、锑、铋)〔实验目的〕1.比较碱金属、碱土金属的活泼性;2.试验并比较碱土金属、铝、锡、铅、锑、铋的氢氧化物和盐类的溶解性;3.练习焰色反应并熟悉使用金属钠、钾的安全措施。
〔实验原理〕主族金属包括ⅠA、ⅡA、p区位于硼到砹梯形连线的左下方元素。
金属元素的金属性表现在:其单质在能量不高时,易参加化学反应,易呈现低的正氧化态,并形成离子键化合物;标准电极电势是有较负的数值,氧化物的水合物显碱性,或两性偏碱性。
碱金属和碱土金属位于ⅠA和ⅡA族,在同一族中金属活泼性由上而下逐渐增强;在同一周期中从左至右逐渐减弱。
例如碱金属和碱土金属都易和氧化合。
碱金属在室温下能迅速地与空气中的氧反应。
钠、钾在空气中稍微加热即可燃烧生成过氧化物和超氧化物。
碱土金属活泼性略差,室温下这些金属表面会缓慢生成氧化膜。
加热燃烧时除可生成正常氧化物外,还可生成氮化物。
碱金属盐类最大的特点是易溶于水。
少数盐难溶于水:① Li+的难溶盐:LiF,Li2CO3,Li3PO4② K+的难溶盐:K2Na[Co(NO2)6]六亚硝酸根合钴(Ⅲ)酸钠钾(亮黄色);K[B(C6H5)4]四苯基硼酸钠(白色);KHC4H4O6酒石酸氢钾(白色)③ Na+的难溶盐:NaAc·ZnAc2·3UO2Ac2·9H2O醋酸铀酰锌钠(淡黄色);Na[Sb(OH)6]碱土金属盐类的重要特征是它们的难溶性,除氯化物、硝酸盐、硫酸镁、铬酸镁、铬酸钙易溶于水外,其余碳酸盐、硫酸盐、草酸盐、铬酸盐皆难溶。
氢氧化铝是两性氢氧化物,它可溶于过量的碱生成[Al(OH)4]-。
Al3+还能与一些配体形成稳定的配合物,如[AlF6]3-,[Al(C2O4)3]3-和[Al(EDTA)]-等。
锡、铅的氢氧化物都是两性的。
它们的酸碱性递变规律为:酸性增强Sn(OH)4Pb(OH)4 碱性增强Sn(OH)2Pb(OH)2砷、锑、铋的氧化值为+3的氢氧化物有H3AsO3,Sb(OH)3和Bi(OH)3,它们的酸性依次减弱,碱性依次增强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)难溶铅盐
项目
实验步骤
实验现象
解释和/或反应式
氯化物
Pb(NO3)2+HCl
Pb2++2Cl-=PbCl2↓
加热溶液
+HCl(浓)
PbCl2+2HCl = H2[PbCl4]
铬酸盐
Pb(NO3)2+K2CrO4
Pb(NO3)2+K2CrO4=PbCrO4↓+2KNO3
沉淀+HNO3
Sb(OH)3+NaOH=NaSbO2+2H2O
铋的
氢氧化物
Bi(NO3)3+NaOH
Bi3++3OH-=Bi(OH)3↓
Bi(OH)3+HCl
Bi(OH)3+3HCl=BiCl3+3H2O
Bi(OH)3+NaOH(浓)
结论
Sn(OH)2、Sn(OH)4呈两性;Pb(OH)2两性,以碱性为主,
Sb(OH)3两性偏碱,Bi(OH)3呈弱碱性。
锡、铅、锑、铋
一、实验目的
二、实验内容
1、锡、铅、锑、铋氢氧化物的酸碱性
项目
实验步骤
实验现象
解释和/或反应式
亚锡的
氢氧化物
SnCl2+NaOH(适量)
Sn2++2OH-=Sn(OH)2↓
Sn(OH)2+HCl
Sn(OH)2+2HCl=SnCl2+2H2O
Sn(OH)2+NaOH
Sn(OH)2+2NaOH=Na2SnO2+2H2O
沉淀+2MHCl
沉淀+浓HCl,煮沸
PbS+4HCl=H2[PbCl4]+H2S↑
沉淀+6MHNO3加热
3PbS+2NO3-+8H+=3Pb2++3S↓+2NO↑+4H2O
沉淀+0.5MNa2S
锑的
硫化物
SbCl3+TAA加热
2Sb3++3S2-=Sb2S3↓
沉淀+2MHCl
沉淀+浓HCl,煮沸
Sb2S3+6H++12Cl-=2SbCl63-+3H2S↑
沉淀+饱和NaAc
2PbSO4+2NaAc=[PbAc]2SO4+Na2SO4
碘化物
Pb(NO3)2+KI(适量)
Pb2++2I-=PbI2↓
沉淀+过量KI,微热
PbI2+2KI=K2[PbI4]
结论
PbCl2溶于热水和浓HCl;PbCrO4溶于HNO3和NaOH;
PbSO4溶于浓H2SO4和饱和NaAc溶液;PbI2溶于过量的KI溶液。
亚锡的硫化物
SnCl2+ TAA加热
Sn2++S2-=SnS↓
沉淀+2MHCl
沉淀+浓HCl,煮沸
SnS+2H++4Cl-=SnCl42-+H2S↑
沉淀+6MHNO3加热
3SnS+4NO3-+16H+=3Sn4++3S↓+4NO↑+8H2O
沉淀+0.5MNa2S
锡的
硫化物
SnCl4+TAA加热
Sn4++2S2-=SnS2↓
2PbCrO4+2HNO3= Pb(NO3)2+PbCr2O7+H2O
沉淀+NaOH
PbCrO4+4NaOH=Na2PbO2+Na2CrO4+2H2O
硫酸盐
Pb(NO3)2+K2SO4
Pb(NO3)2+K2SO4=PbSO4↓+2KNO3
沉淀加浓H2SO4加热
PbSO4+H2SO4= Pb(HSO4)2
沉淀+6MHNO3加热
Sb2S3+2NO3-+8H+=2Sb3++3S↓+2NO↑+4H2O
沉淀+0.5MNa2S
Sb2S3+3Na2S=2Na3SbS3
结论
SnS、SnS2、PbS、Sb2S3、Bi2S3都不溶于2MHCl,都溶于浓HCl和HNO3;
SnS2、Sb2S3溶于Na2S,而SnS、PbS、Bi2S3不溶于Na2S。
沉淀+2MHCl
沉淀+浓HCl,煮沸
SnS2+4H++6Cl-=SnCl62-+2H2S↑
沉淀+6MHNO3加热
3SnS2+4NO3-+16H+=3Sn4++6S↓+4NO↑+8H2O
沉淀+0.5MNa2S
SnS2+Na2S=Na2SnS3
铅的
硫化物
Pb(NO3)2+TAA加热
Pb2++S2-=PbS↓
锡的
氢氧化物
SnCl4+NaOH(适量)
Sn4++4OH-=Sn(OH)4↓
Sn(OH)4+HCl
Sn(OH)4+4HCl=SnCl4+4H2O
Sn(OH)4+NaOH
Sn(OH)4+2NaOH=Na2[Sn(OH)6]
铅的
氢氧化物
Pb(NO3)2+NaOH
Pb2++2OH-=Pb(OH)2↓
Pb(OH)2+HNO3
(2)难溶硫化物
项目
实验步骤
实验现象
解释和/或反应式
铋的
硫化物
Bi(NO3)3+TAA加热
2Bi3++3S2-=Bi2S3↓
沉淀+2MHCl
沉淀+浓HCl,煮沸
Bi2S3+6HCl=2BiCl3+3H2S↑
沉淀+6MHNO3加热
Bi2S3+2NO3-+8H+=2Bi3++3S↓+2NO↑+4H2O
沉淀+0.5MNa2S
Pb(OH)2+2HNO3= Pb(NO3)2+2H2O
Pb(OH)2+NaOH(浓)
Pb(OH)2+NaOH=Na[Pb(OH)3]
锑的
氢氧化物
SbCl3+NaOH(适量)
Sb3++3OH-=Sb(OH)3↓
Sb(OH)3+HCl
Sb(OH)3+3HCl=SbCl3+3H2O
Sb(OH)3+NaOH(6M)
NaBiO3+6H++2Cl-=Cl2+Bi3++Na++3H2O
Cl2+2I-=I2+2Cl-
结论
Sn(Ⅱ)有强还原性;
Bi(Ⅲ,Ⅴ)、铅(Ⅳ)在酸性介质中有强氧化性。
HgCl2+酸
+适量SnCl2
SnCl2+2HgCl2=Hg2Cl2↓+ SnCl4
+过量SnCl2
SnCl2+Hg2Cl2=2Hg↓+ SnCl4
铅(Ⅳ)的
氧化性
PbO2+酸+MnSO4加热
2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O
铋(Ⅴ)的
氧化性
NaBiO3+浓HCl,用湿KI淀粉纸检验
3、锡(Ⅱ)的还原性和铅(Ⅳ),铋(Ⅲ、Ⅴ)的氧化性及在离子鉴定中的应用
项目
实验步骤
实验现象
解释和/或反应式
锡(Ⅱ)的还原性
SnCl2+过量NaOH
SnCl2+4NaOH=Na2[Sn(OH)4]+2NaCl
上述溶液+Bi(NO3)3
2Bi3++3[Sn(OH)4]2-+6OH-=2Bi↓+3[Sn(OH)6]2-
