锡、铅、锑、铋实验报告
锡、铅、锑、铋实验预习报告

(1)难溶铅盐
项目
实验步骤
实验现象
解释和/或反应式
氯化物
Pb(NO3)2+HCl
Pb2++2Cl-=PbCl2↓
加热溶液
+HCl(浓)
PbCl2+2HCl = H2[PbCl4]
铬酸盐
Pb(NO3)2+K2CrO4
Pb(NO3)2+K2CrO4=PbCrO4↓+2KNO3
沉淀+HNO3
Sb(OH)3+NaOH=NaSbO2+2H2O
铋的
氢氧化物
Bi(NO3)3+NaOH
Bi3++3OH-=Bi(OH)3↓
Bi(OH)3+HCl
Bi(OH)3+3HCl=BiCl3+3H2O
Bi(OH)3+NaOH(浓)
结论
Sn(OH)2、Sn(OH)4呈两性;Pb(OH)2两性,以碱性为主,
Sb(OH)3两性偏碱,Bi(OH)3呈弱碱性。
锡、铅、锑、铋
一、实验目的
二、实验内容
1、锡、铅、锑、铋氢氧化物的酸碱性
项目
实验步骤
实验现象
解释和/或反应式
亚锡的
氢氧化物
SnCl2+NaOH(适量)
Sn2++2OH-=Sn(OH)2↓
Sn(OH)2+HCl
Sn(OH)2+2HCl=SnCl2+2H2O
Sn(OH)2+NaOH
Sn(OH)2+2NaOH=Na2SnO2+2H2O
沉淀+2MHCl
锡铅锑铋的化学实验报告

锡铅锑铋的化学实验报告嘿,大家好,今天咱们来聊聊一个有趣又神秘的话题——锡、铅、锑和铋!听起来就像是化学课本里的魔法四人组,对吧?其实它们可都是我们生活中常见的元素,有的甚至和我们的日常生活息息相关。
别急,咱们一步步来,聊聊它们的特性和实验中发生的那些事儿。
咱们得先说说锡。
锡啊,在生活中可是个老朋友了。
想想那些闪亮亮的罐头和一些小玩意儿,嘿,没错,很多都是锡做的!它的熔点低,没事儿的时候用点锡焊,还能把各种金属牢牢地粘在一起。
这次实验里,我们准备了一些锡,真是像小孩看到糖果一样兴奋!嘿,拿着锡的时候,心里总是想着它能带来什么样的奇迹呢。
接下来是铅,哎,铅可得小心翼翼地对待。
虽然它很重,而且常常被用来制造电池,但铅也不是个好东西,大家都知道,接触太多可不好。
实验的时候,我们戴上手套,像变魔术一样,生怕碰到铅。
可别以为铅就只会让人紧张,它的特性可真不少,像是高密度、耐腐蚀,嘿,简直是个化学界的小明星!然后是锑,这个家伙就更神秘了。
锑的颜色好看得很,银白色的外表像极了贵金属。
我们在实验中仔细观察,发现它在加热的时候会变得非常活跃,冒出各种气泡,像是在跟我们玩捉迷藏。
大家伙儿都惊呼:“哇,真有趣!”我想这大概就是化学的魅力吧,它总能在不经意间给你带来惊喜。
是铋。
这小子可是个性格鲜明的家伙。
铋的密度很大,颜色也独特,像彩虹一样,五光十色。
听说它在冷却的时候会形成漂亮的晶体,那种效果简直让人惊艳。
我们在实验室中像孩子一样围着铋,纷纷拍照留念,仿佛在捕捉一瞬间的魔法。
实验的过程中,大家都很兴奋,互相开玩笑,讨论着这些金属的奇妙之处。
每当我们观察到一个新现象,哇,整个实验室都像炸了锅,兴奋的声音此起彼伏。
感觉就像在进行一场化学的探险,大家都是勇敢的探险者。
准备实验材料的时候,大家纷纷分享各自的经验,就像一场热火朝天的聚会,谁都不愿意错过任何一个精彩瞬间。
我们还试着把这些金属混合在一起,嘿,这可真是个挑战!有的同学开玩笑说,这简直是给化学配乐!每次混合的声音都像是一首乐曲,伴随着我们的欢声笑语。
无机化学实验报告:碱金属碱土金属铝锡铅锑铋
不再呈现任何离子的特征颜色。 2、用洁净的铂丝蘸取 1 mol·L-1 LiCl、NaCl、KCl、CaCl2、SrCl2、BaCl2 在氧化焰灼烧。
现象:
注意:由于K盐中往往会含有少量的钠盐,实验表明,当K盐中含有 1/105的钠盐时,就会在焰色中只看 到钠的黄色,为了消除钠焰色的干扰,要用一块蓝色钴玻璃片滤去钠黄色光进行观察。
2×10-27
实验指导
◆ 在做沉淀溶解性实验时,可用离酸性溶液中可以代替 H2S,在碱性溶液中可代替 Na2S [(NH4)2S]。
◆
[问题讨论] 1、如何配制 SnCl2 溶液。
2、 PbO2 与浓 HCl 如何反应的? PbO2 具有强氧化性,能氧化 HCl 生成 Cl2,同时 PbCl2 PbO2 + 4HCl = PbCl2↓ + Cl2↑+2H2O (与 MnO2+ 4HCl =MnCl2 + Cl2↑+2H2O△)
实验八 碱金属、碱土金属、铝、锡、铅、锑、铋
【学习目标】 认知目标:比较碱金属和碱土金属的活泼性; 碱金属、碱土金属、铝、锡、铅、锑、铋氢氧化物和盐类的溶解性。 技能目标:掌握焰色反应的正确操作技术,熟悉并使用钾、钠的安全措施。
思想目标:培养学生观察现象、思考问题的能力。
【教学安排】
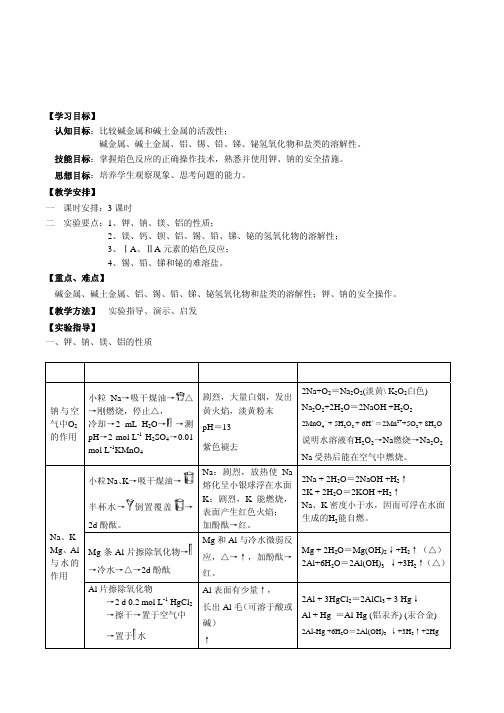
一 课时安排:3 课时 二 实验要点:1、钾、钠、镁、铝的性质;
橙黄
热水 (浓 NaAc \ KI \ Na2S2O3 )
7.1×10-9
PbCrO4 黄色
HNO3、NaOH、
2.8×10-13
PbSO4 白色
主族金属碱金属碱土金属铝锡铅锑铋实验报告

主族金属碱金属碱土金属铝锡铅锑铋实验报告名扬成语是指那些因为某种原因而名声远播的成语。
以下是一些常见的名扬成语:1. 四面楚歌:比喻处境孤立,四面受敌。
2. 狗仗人势:比喻依仗别人的势力欺压人。
3. 杯弓蛇影:比喻疑神疑鬼,心理不安。
4. 守株待兔:比喻不主动劳动而等待机会。
5. 画蛇添足:比喻做了多余无用的事情。
6. 青出于蓝:比喻学生超越老师,后来者超过前辈。
7. 指鹿为马:比喻混淆黑白、颠倒是非。
8. 狐假虎威:比喻利用别人的势力来吓唬人。
9. 虎头蛇尾:形容开始劲头很大,到后来没有坚持下去。
10. 画龙点睛:比喻在文章或事物的关键处加上一个恰当的点睛之笔。
12%虫螨腈虱螨脲是一种杀虫剂的混合配方,其中腈虱螨脲是一种常用的农药成分。
以下是该混合配方的标准:有效成分含量:12%杀虫剂类型:螨类(包括虫螨、腈虫、螨腈等)使用方法:根据不同的作物和病虫害情况,按照规定的用药剂量和方法进行喷洒或灌溉。
注意事项:使用前必须仔细阅读产品说明书,并遵循相关安全操作规程。
在使用过程中应注意保护好自己的皮肤和呼吸道,以免接触到有害成分。
主族金属、碱金属和碱土金属是元素周期表中的三个大类元素。
1. 主族金属:指周期表中第1A(Ia)到2A(IIa)族元素,如锂、钠、铜、银、铅等。
这些元素的化学性质活泼,容易失去电子形成正离子,因此在化合物中通常表现为阳离子。
2. 碱金属:指周期表中第1A(Ia)族元素,如锂、钠、钾、铷等。
这些元素的物理性质(如密度、熔点、沸点)都非常低,同时也具有非常强的还原性和反应性。
3. 碱土金属:指周期表中第2A(IIa)族元素,如镁、钙、锶、钡等。
这些元素的化学性质相对活泼,在化合物中通常表现为二价阳离子。
铝、锡、铅、锑和铋是五个不同的元素,它们都属于主族金属或其次族的元素。
以下是一份关于这些元素的实验报告:实验目的:研究铝、锡、铅、锑和铋的物理和化学性质。
实验步骤:1. 取适量的铝、锡、铅、锑和铋样品,并分别进行外观、密度、熔点和沸点等物理性质的测定。
锡、铅、锑、铋实验工作报告
锡、铅、锑、铋实验报告一、实验目的二、实验内容3、锡、铅、锑、铋的难溶物4、锡(Ⅱ)的还原性和铅(Ⅳ),铋(Ⅲ、Ⅴ)的氧化性及在离子鉴定中的应用赠送以下资料股权转让申请报告我公司是年月由(审批机关)批准成立的中外合资(合作、独资)企业。
公司投资总额为万美元,注册资本为万美元,其中(股东)万美元占注册资本的%;(股东)出资万美元,占注册资本的%......。
目前公司注册资本金已经全部缴清。
由于(原因)申请将(股东)持有的%股权以(价格)转让给(新股东)。
股权变更后,公司的注册资本不改变,股权结构变更为(股东)出资万美元占注册资本的%;(股东)出资万美元,占注册资本的%......。
现将相关申请材料报送审批机关,请予审核批准。
申请企业(盖章)年月日赠送以下资料一、选择题的特点与答题技巧选择题有单项选择和多项选择之分,通常占卷面分数的30%—40%左右,主要测试考生对基本知识、基本方法的掌握程度,具有很大的灵活性。
命题者常常使迷惑答案具有同等吸引力。
因此,不把考试大纲要求掌握的内容吃透,你是很难回答有经验的命题者所设计的选择题的。
答好选择题,当然必须掌握一定的知识。
但如果再掌握一些答题技巧,就将使你如虎添翼。
下面的提示有助于你掌握答题的技巧:(l)计划答题时间,保持稳定的答题速度。
前已述及,采用选择题型,其中最主要的原因是一份试题可以覆盖大量的材料。
因此,选择题考试通常要求在短时间内作答。
在考试开始时,你应该看一看试题的分量,并且对每道题应占用的时间迅速作出估计。
也许你会发现,每道选择题允许作答的时间不到一分钟。
在某些情况下,这似乎不大可能。
但你不必担心,有不少问题可能只需几秒钟就可作出选择。
这样,你就有足够时间去考虑相对较难的问题。
保持稳定的答题速度,也是很必要的。
一般的做法是:首先通读并回答你知道的问题,跳过没有把握作答的问题。
然后重新计算你的时间,看看余下的每道题要花多少时间。
在一道题上花过多的时间是不值的,即使你答对了,也可能得不偿失。
Sn Pb Sb Bi Cr Mn(1)

锡(Sn)、铅(Pb)、锑(Sb)、铋(Bi)一、实验目的1.掌握锡Sn 、铅Pb 、锑Sb 、铋Bi 的氢氧化物的酸碱性、氯化物的水解性和硫化物的溶解性及其变化规律。
2.掌握锡Sn(Ⅱ)的还原性和铅Pb(Ⅳ)的氧化性。
二、实验原理和主要化学反应锡和铅处于ⅣA 族,价电子层排布: 225p 5s 、226p 6s 锑和铋处于ⅤA 族,价电子层排布:325p 5s 、326p s 6因此,锡和铅的氧化数为+2、+4;锑和铋的氧化数为+3、+5。
铅和铋的电子排布式中有一对6s 2,称着“惰性电子对”。
由于“钻穿效应”,内层电子对其屏蔽系数减小,有效核电荷数大,使这对电子变得惰性,不容易失去,叫“.惰性电子对效应.......”.。
所以,它们的高价氧化数有很强的氧化性,常以固体形式存在;而它们的低价化合物,即二价铅和三价铋的化合物则相对稳定。
1. 氢氧化物的生成及其酸碱性它们的氢氧化物能溶于过量的NaOH 溶液:第五主族不溶解第四主族⎭⎬⎫→+=+⎭⎬⎫=+=+NaOH Bi(OH)]Na[Sb(OH)NaOH Sb(OH)]Na[Pb(OH)NaOH Pb(OH)][Sn(OH)Na NaOH 2Sn(OH)34332422结论:Bi(OH)3为碱性氢氧化物,其他氢氧化物都为两性氢氧化物 2. 氯化物的水解性结论: SbCl 3、BiCl 3、SnCl 2固体在水溶液中都易水解,生成相应的白色沉淀;但SnCl 2的水解不可逆,配制该溶液时应先溶解在少量的浓HCl 中然后再加水稀释。
PbCl2是沉淀。
2HCl 白色)(SbOCl +↓O H )s (SbCl 23+OH )s (BiCl 23+2HCl白色)(BiOCl +↓OH )s (SnCl 22+反应不可逆)HCl(白色)(Sn(OH)Cl +↓3. 锡、铅、锑、铋的硫化物的生成及在不同介质中的溶解性硫化物的颜色:SnSSnS 2 PbS Sb 2S 3 Bi 2S 3 暗棕黄色黑色橙色棕黑这5种硫化物都不溶于稀盐酸,但可溶于浓盐酸,其中SnS 2、Sb 2S 3还可溶于过量的Na 2S 溶液中,其溶解的主要反应是:生成的硫代酸盐在稀酸中不稳定,又变成原来的沉淀,反应式:4.氧化还原性5. Pb(Ⅱ)盐的溶解性几种难溶的铅盐并观察其颜色PbCl 2 PbSO 4 PbS PbI 2 PbCrO 4 白色 白色 黑色 黄色 黄色PbCl 2沉淀溶于热水,不溶于冷水。
锡铅锑铋实验报告
锡铅锑铋实验报告实验报告标题:锡铅锑铋实验报告摘要:本次实验旨在探究锡、铅、锑、铋四种金属的物理与化学特性,并通过实验结果分析其互相浸染产生的由此导致的物理化学改变。
实验方法:分别取锡、铅、锑、铋四种金属作为实验材料,将其按照比例混合,利用电炉在高温条件下进行冶炼,使得四种金属互相融合。
待其凝固后,取出样本进行物理化学性质的测试。
实验结果:锡铅锑铋混合后的样本产生了诸多物理化学变化。
首先,样本的颜色由原来的金属自然色变成了深灰色,这是由于不同金属混合后的颜色变化造成的。
其次,混合后的样本势能增加,自由能减小;晶格形成高度结晶,且凝固后材质硬度明显增强。
这是由于材料中不同金属原子结晶点和空穴的掺杂产生侧漏,并且由此形成复杂的原子之间的化学吸引力和化学跳跃反应导致的物理化学性质变化。
实验分析:锡、铅、锑、铋作为常见的金属元素,它们的化学性质和物理性质有所不同,这使得这四种金属在混合后会产生复杂的物理化学反应。
样本颜色的变化是由于不同金属的原子结构不同,每一种金属吸取不同颜色光线,汇聚在一起就会产生颜色的改变。
吸收不同颜色光线的金属反应产生的电子云结构和原子跳跃产生不同发光颜色,而这样的互相作用就形成了样本的颜色变化。
而材质硬度增加则是由于金属材料的化学组成和原子角度导致微小杂质和板状物质的形成,两种结构也不相同造成的硬度变化。
结论:通过本次实验,我们深入研究了锡、铅、锑、铋四种金属之间的物理化学性质变化,发现在混合后不仅会较大程度地改变样本的硬度、颜色,并且与不同金属元素原子结构相结合而形成了一种新的金属化合物。
因此,相信这些结论将有助于日后外科工作者和化学家的研究,并促进废料回收处理、金属合金研制以及材料设计的进步。
大学无机实验
反应方程式如下:
Pb2++CrO42-=PbCrO4↓ PbCrO4+2HNO3=Pb(NO3)2+H2CrO
4
2 CrO42-+2H+=Cr2O72-+H2O PbCrO4+3OH-=[Pb(OH)3]-
+CrO42-
现象:生成PbCrO4黄色沉 淀,加硝酸后,沉淀溶解, 溶液颜色变为橙红色。
通过硫化亚锡、硫化锡的实验得出 什么结论?写出有关反应方程式。
反应方程式如下:
Sn2++H2S=SnS↓+2H+ Sn4++2H2S=SnS2↓+4H+ 现 象 : 生 成 的 SnS 为 褐 色 , SnS2 为金黄色沉淀。
SnS、SnS2与HCl不反应 SnS+Sx2-=SnSx+12SnS2+S2-=[SnS3]2SnS2+2S2-=[SnS4]4-
反应方程式如下所示:
Al(OH)3+NaOH=NaAlO2+2H2O Sn(OH)2+2OH-=SnO22-+2H2O
Al(OH)3+3H+=Al3++3H2O Sn(OH)2+2H+=Sn2++2H2O Sb(OH)3+3H+=Sb3++3H2O Pb(OH)2+2H+=Pb2++2H2O Bi(OH)3+3H+=Bi3++3H2O
将所得白色沉淀连同溶液一起加 热,沉淀是否溶解?再把溶液冷却, 又有什么变化?说明氯化铅的溶解 度与温度的关系。取以上白色沉淀 少许,加入浓盐酸,观察沉淀溶解 情况。
锡铅锑铋实验报告
一、实验目的1. 掌握锡、铅、锑、铋的基本性质。
2. 了解这些元素氢氧化物的酸碱性。
3. 研究这些元素盐类的水解性。
4. 掌握锡(II)的还原性和铅(IV)的氧化性。
二、实验原理锡、铅、锑、铋是第四周期的金属元素,它们在化学性质上有一定的相似性,但也有一些差异。
本实验通过观察这些元素氢氧化物的酸碱性以及盐类的水解性,了解它们在无机化学中的性质。
三、实验内容1. 锡、铅、锑、铋氢氧化物的酸碱性(1)实验步骤:①取一定量的锡、铅、锑、铋盐溶液,分别加入适量的NaOH溶液,观察现象。
②将生成的氢氧化物用稀盐酸溶解,观察现象。
(2)实验现象:①锡、铅、锑、铋盐溶液分别加入NaOH溶液后,均生成白色沉淀。
②用稀盐酸溶解氢氧化物后,沉淀溶解。
(3)解释和/或反应式:锡:SnCl2 + 2NaOH → Sn(OH)2↓ + 2NaCl铅:Pb(NO3)2 + 2NaOH → Pb(OH)2↓ + 2NaNO3锑:SbCl3 + 3NaOH → Sb(OH)3↓ + 3NaCl铋:Bi(NO3)3 + 3NaOH → Bi(OH)3↓ + 3NaNO32. 锡(II)的还原性和铅(IV)的氧化性(1)实验步骤:①取一定量的锡、铅盐溶液,分别加入适量的稀盐酸,观察现象。
②取一定量的铅盐溶液,加入适量的NaOH溶液,观察现象。
(2)实验现象:①锡、铅盐溶液加入稀盐酸后,均无明显现象。
②铅盐溶液加入NaOH溶液后,生成白色沉淀。
(3)解释和/或反应式:锡:SnCl2 + 2HCl → SnCl2 + 2HCl铅:Pb(NO3)2 + 2NaOH → Pb(OH)2↓ + 2NaNO33. 锑盐水解实验(1)实验步骤:①取一定量的SbCl3溶液,加入适量的蒸馏水,观察现象。
②用pH试纸测定溶液的pH值。
(2)实验现象:①SbCl3溶液加水稀释后,生成白色沉淀。
②溶液的pH值随稀释程度增加而逐渐降低。
(3)解释和/或反应式:SbCl3 + H2O → Sb(OH)3↓ + 3HCl四、实验结论1. 锡、铅、锑、铋的氢氧化物均呈碱性,其中锡(II)和锑(III)的氢氧化物呈酸性,铅(II)和铋(III)的氢氧化物呈碱性。
锡铅锑铋实验报告
锡铅锑铋实验报告实验目的,通过实验,掌握锡铅锑铋的性质及其常见化合物的制备方法。
实验原理,锡铅锑铋是一组金属元素,它们在化学性质上有一些相似之处。
锡是一种具有金属光泽的银白色金属,具有较好的延展性和韧性,能够制成薄片。
铅是一种比较常见的金属元素,具有较好的延展性和韧性,可以制成管、线、板等。
锑是一种蓝白色的金属,具有较好的导电性能,可以用于制造半导体材料。
铋是一种蓝白色的金属,具有较好的导电性能,可以用于制造半导体材料。
实验步骤:1. 实验前准备,将所需的实验器材和药品准备齐全,保持实验台面整洁。
2. 制备锡的氢氧化物,将适量的锡粉加入到稀盐酸溶液中,搅拌均匀并加热至沸腾,然后加入氢氧化钠溶液,生成沉淀。
3. 制备铅的氧化物,将适量的铅粉加入到稀硝酸溶液中,搅拌均匀并加热至沸腾,然后加入氢氧化钠溶液,生成沉淀。
4. 制备锑的氧化物,将适量的锑粉加入到稀盐酸溶液中,搅拌均匀并加热至沸腾,然后加入氢氧化钠溶液,生成沉淀。
5. 制备铋的氧化物,将适量的铋粉加入到稀硝酸溶液中,搅拌均匀并加热至沸腾,然后加入氢氧化钠溶液,生成沉淀。
实验结果及分析:通过实验,我们成功地制备了锡、铅、锑、铋的氢氧化物。
在实验过程中,我们发现锡的氢氧化物呈白色沉淀,铅的氢氧化物呈黄色沉淀,锑的氢氧化物呈橙色沉淀,铋的氢氧化物呈棕色沉淀。
这些颜色的差异可以帮助我们区分这些金属元素的化合物。
实验结论:通过本次实验,我们深入了解了锡铅锑铋这一组金属元素的性质,掌握了它们的常见化合物的制备方法。
这对于我们进一步学习金属元素的化学性质和化合物的制备方法具有重要的意义。
实验注意事项:1. 在实验过程中,要注意安全,避免化学品的直接接触和吸入。
2. 实验结束后,要及时清理实验器材和台面,保持实验环境的整洁。
3. 实验中产生的废弃物要根据规定进行处理,避免对环境造成污染。
总结:本次实验使我们对锡铅锑铋这一组金属元素有了更深入的了解,通过实际操作,我们掌握了它们的性质及常见化合物的制备方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2Bi3++3[Sn(OH)4]2-+6OH-=2Bi↓+3[Sn(OH)6]2-
HgCl2+酸+适量SnCl2
SnCl2+2HgCl2=Hg2Cl2↓+ SnCl4-
+过量SnCl2
SnCl2+Hg2Cl2=2Hg↓+ SnCl4
铅(Ⅳ)的氧化性
PbO2+酸+MnSO4加热
PbI2+2KI=K2[PbI4]
结论
PbCl2溶于热水和浓HCl;PbCrO4溶于HNO3和NaOH;PbSO4溶于浓H2SO4和饱和NaAc溶液;PbI2溶于过量的KI溶液。
(2)难溶硫化物
项目
实验步骤
实验现象
解释和/或反应式
铋的硫化物
Bi(NO3)3+TAA加热
2Bi3++3S2-=Bi2S3↓
沉淀+ Na2S
SnS2+Na2S=Na2SnS3
铅的硫化物
Pb(NO3)2+TAA加热
Pb2++S2-=PbS↓
沉淀+2M HCl
沉淀+浓HCl,煮沸
PbS+4HCl=H2[PbCl4]+H2S↑
沉淀+6M HNO3加热
3PbS+2NO3-+8H+=3Pb2++3S↓+2NO↑+4H2O
沉淀+ Na2S
沉淀+HCl,+水
Sn(OH)Cl+HCl= SnCl2+H2O
铅盐水解
Pb(NO3)2溶液+pH试纸
加水稀释+ pH试纸
Pb(NO3)2+H2O= Pb(OH)NO3↓+HNO3
沉淀+HNO3,+水
Pb(OH)NO3+HNO3= Pb(NO3)2+H2O
铋盐水解
Bi(NO3)3溶液+pH试纸
加水稀释+ pH试纸
结论
SnS、SnS2、PbS、Sb2S3、Bi3S3都不溶于2MHCl,溶于浓HCl和HNO3,SnS、PbS、 Bi3S3不溶于Na2S。
4、锡(Ⅱ)的还原性和铅(Ⅳ),铋(Ⅲ、Ⅴ)的氧化性及在离子鉴定中的应用
项目
实验步骤
实验现象
解释和/或反应式
锡(Ⅱ)的还原性
SnCl2+过量NaOH
SnCl2+4NaOH=Na2[Sn(OH)4]+2NaCl
Pb2++2Cl-=PbCl2↓
加热溶液
+HCl(浓)
PbCl2+2HCl=H2[PbCl4]
铬酸盐
Pb(NO3)2+K2CrO4
Pb(NO3)2+K2CrO4=PbCrO4↓+2KNO3
沉淀+HNO3
2PbCrO4+2HNO3= Pb(NO3)2+PbCr2O7+H2O
沉淀+NaOH
PbCrO4+4NaOH=Na2PbO2+Na2CrO4+2H2O
Sb(OH)3+NaOH=NaSbO2+2H2O
铋的氢氧化物
Bi(NO3)3+NaOH
Bi3++3OH-=Bi(OH)3↓
Bi(OH)3+HCl
Bi(OH)3+3HCl=BiCl3+3H2O
Sb(OH)3+NaOH(浓)
结论
Sn(OH)2、Sn(OH)4呈两性;Pb(OH)2两性,以碱性为主,Sb(OH)3两性偏碱,Bi(OH)3呈弱碱性。
硫酸盐
Pb(NO3)2+K2SO4
Pb(NO3)2+K2SO4=PbSO4↓+2KNO3
沉淀加浓H2SO4加热
PbSO4+H2SO4= Pb(HSO4)2
沉淀+饱和NaAc
2PbSO4+2NaAc=[PbAc]2SO4+Na2SO4
碘化物
Pb(NO3)2+KI(适量)
Pb2++2I-=PbI2↓
沉淀+过量KI
锡的氢氧化物
SnCl4+NaOH(适量)
Sn4++4OH-=Sn(OH)4↓
Sn(OH)4+HCl
Sn(OH)4+4HCl=SnCl4+4H2O
Sn(OH)4+NaOH
Sn(OH)4+4NaOH=Na2[Sn(OH)6]
铅的氢氧化物
Pb(NO3)2+NaOH
Pb2++2OH-=Pb(OH)2↓
Pb(OH)2+HNO3
锡、铅、锑、铋实验报告
一、实验目的
二、实验内容
1、锡、铅、锑、铋氢氧化物的酸碱性
项目
实验步骤
实验现象
解释和/或反应式
亚锡的氢氧化物
SnCl2+NaOH(适量)
Sn2++2OH-=Sn(OH)2↓
Sn(OH)2+HCl
Sn(OH)2+2HCl=SnCl2+2H2O
Sn(OH)2+NaOH
Sn(OH)2+2NaOH=Na2SnO2+2H2O
Bi(NO3)3+H2O=SbONO3↓+2HNO3
沉淀+HNO3,+水
SbONO3+2HNO3= Bi(NO3)3+H2O
结论
Sn(Ⅱ)、Sb(Ⅲ)、Bi(Ⅲ)都能发生水解,Pb(Ⅱ)水解不显着。
3、锡、铅、锑、铋的难溶物
(1)难溶铅盐
项目
实验步骤
实验现象
解释和/或反应式
氯化物
Pb(NO3)2+HCl
沉淀+6M HNO3加热
3SnS+2NO3-+8H+=3Sn2++3S↓+2NO↑+4H2O
沉淀+ Na2S
锡的硫化物
SnCl4+TAA加热
Sn4++2S2-=SnS2↓
沉淀+2M HCl
沉淀+浓HCl,煮沸
SnS2+4H++6Cl-=2SnCl62-+2H2S↑
沉淀+6M HNO3加热
3SnS2+4NO3-+16H+=3Sn4++6S↓+4NO↑+8H2O
2、锡、铅、锑、铋盐的水解
项目
实验步骤
实验现象
解释和/或反应式
锑盐水解
SbCl3溶液+pH试纸
加水稀释+ pH试纸
SbCl3+H2O=SbOCl↓+2HCl
沉淀+HCl,+水
SbOCl+2HCl= SbCl3+H2O
锡盐水解
SnCl2溶液+pH试纸
Байду номын сангаас加水稀释+ pH试纸
SnCl2+H2O=Sn(OH)Cl↓+HCl
Pb(OH)2+2HNO3= Pb(NO3)2+2H2O
Pb(OH)2+NaOH(浓)
Pb(OH)2+NaOH=Na[Pb(OH)3]
锑的氢氧化物
SbCl3+NaOH(适量)
Sb3++3OH-=Sb(OH)3↓
Sb(OH)3+HCl
Sb(OH)3+3HCl=SbCl3+3H2O
Sb(OH)3+NaOH(6M)
沉淀+2M HCl
沉淀+浓HCl,煮沸
Bi2S3+6HCl=2BiCl3+3H2S↑
沉淀+6M HNO3加热
Bi2S3+2NO3-+8H+=2Bi3++3S↓+2NO↑+4H2O
沉淀+ Na2S
亚锡的硫化物
SnCl2+TAA加热
Sn2++S2-=SnS↓
沉淀+2M HCl
沉淀+浓HCl,煮沸
SnS+2H++4Cl-=SnCl42-+H2S↑
2Mn2++5PbO2+4H+=2MnO4-+5Pb2++2H2O
铋(Ⅴ)的氧化性
NaBiO3+浓HCl,用湿KI淀粉试纸检验
NaBiO3+6H++2Cl-=Cl2+Bi3++Na++3H2O
Cl2+2I-=I2+2Cl-
结论
Sn(Ⅱ)有强还原性,Bi(Ⅲ,Ⅴ)、铅(Ⅳ)在酸性介质中有强氧化性。
锑的硫化物
SbCl3+TAA加热
2Sb3++3S2-=Sb2S3↓
沉淀+2M HCl
沉淀+浓HCl,煮沸
Sb2S3+6H++12Cl-=2SbCl63-+3H2S↑
沉淀+6M HNO3加热
Sb2S3+2NO3-+8H+=2Sb3++3S↓+2NO↑+4H2O
沉淀+ Na2S
Sb2S3+3Na2S=2Na3SnS3
