第二章化学物质及其变化 第一节物质的分类
必修1-第二章化学物质及其变化

盐
氧化物的分类
金属氧化物 氧 化 物 从组 成元 素分 从性 质分 非金属氧化物 酸性氧化物 碱性氧化物
CuO、Fe2O3、Na2O CO、P2O5、H2O CO2、P2O5、SO3
CaO、CuO、K2O
(其它氧化物) CO、H O 2
二、分散系及其分类
往事回顾 1、把下列物质分成两类,应怎样分? ①纯水②泥水③纯H2SO4④稀H2SO4 ⑤蔗糖水⑥空气⑦铁粉 2、在初中我们能把纯净物继续分类,可表示为 单质
2、树状分类法
对同类事物进行再分类的方法,分级,递进,每 一级一个分类标准。
化合物 酸
碱
盐
氧 化 物
【讨论】O2、Cu、H2SO4、Ba(OH)2、KNO3、CO2、空气
树状分类图 物 纯净物 单质 非 金 属 O2 金 属 Gu H2SO4 Ba(OH)2 KNO3 化合物 质 混合物 空气 氧 化 物 CO2
酸 碱 化合物 盐 氧化物 而混合物还能否再进行分类呢?
纯净物
1、分散系的概念 把 一种(或多种)物质分散在另一种(或多种)物质中 所得 到的混合体系,叫做分散系。前者属于 属于被分散的物质, 称作 分散质 ,后者起 容纳分散质 的作用,称作 分散剂。其 实,初中我们学过的溶液就是一种分散系,其中溶质属 于 分散质 ,溶剂属于 分散剂 。初中我们还学过悬浊液和乳 浊液,它们也是分散系。例如泥水中的水是 分散剂,泥土 小颗粒是 分散质 。 根据分散质与分散剂的状态,它们之间可以有9种组合方 式:
思考 胶体为什么具有介稳性?
原因一 胶体粒子可以通过吸附离子而带有 电荷,同种胶粒带同种电荷,而同种电荷会 相互排斥,要使胶体聚沉,就要克服排斥力, 消除胶粒所带电荷。
人教版高一化学必修一新授课课件:第二章第一节 第一课时 物质的分类方法及其应用

Na2CO3 Na2SO4 K2CO3 K2SO4
钠盐 钾盐 硫酸盐 碳酸盐
物质所属 类别。
例:用树状分类法对HCl,CO2 ,CaO ,NaOH, Na2SO4 , CaCO3 , Ca(OH)2 ,H2SO4进行分类。
化合物
酸
HCl H2SO4
碱
盐
NaOH Ca(OH)2
Na2SO4 CaCO3
பைடு நூலகம்
氧化物
CO2 CaO
小结:
分类一般步骤: 确定分类标准
选择分类方法
得出正确的分类
分类的一般原则:行之有效,简单易行。
分类的目的和意义:对于化学研究而
言,便于了解各类物质的共性和各类反 应的本质;对于工作和生活而言,则提 供便利,实现高效。
作业:
请大家用交叉分类法对下列物质分类
Na2SO4 NaNO3 Na2CO3 K2SO4 K2CO3 KCl
第二章 化学物质及其变化
第一节 物质的分类
第一课时 物质的分类方法及其应用
学习目标
1、阅读P24第一段,认识分类法在学习科学技术中的应 用。
2、阅读思考与交流(1),能说出初中所学化学物质种类 和化学反应类型,能举例说出其它方面分类的例子, 知道分类的普遍性。
3、学生阅读P24倒数第一段及图2-2,归纳交叉分类的含 义及方法。
超市按照商品的用途将商品进行了分类。
一、简单分类法及其应用
1.分类:把某些特征相似的事物归类到 一起的方法。
试想想:没有分类的世界的模样会怎样?
分类的目的和意义: 能够提高人们工作、学习的效率,使人
们更快更便捷的达到目的。
思考与交流
1、请回顾初中学过那些有关物质类别的概念?
第二章 物质的分类 总复习

4.酸、碱、盐、氧化物 (1)酸:电离时生成的阳离子全部是氢离 子的化合物。 (2)碱:电离时生成的阴离子全部是氢氧 根离子的化合物 (3)盐:电离时生成金属阳离子(或⑰ ____铵_离__子_____)和酸根阴离子的化合物。 (4)氧化物:由⑱_两__种__元__素_____组成,其 中一种元素是氧的化合物。
第二章 化学物质及其变化
第1节 物质的分类
考点一 物质的组成
知识梳理 1.元素、物质及微粒间的关系 (1)宏观上物质是由元素组成的,微观上物 质是由①__分__子____、②__原__子____或③ ____离__子__构成的。 ①分子:保持物质_化__学__性__质___的最小微粒。 ②原子:化学变化中的最小微粒。 ③离子:带电荷的⑤__原__子____或原子团。 ④原子团:在许多化学反应里,作为一个整 体参加反应,如同⑥_一__个__原__子_____一样的原 子集团。
解析 食品干燥剂应无毒、无味、无腐蚀性, 硅胶、CaCl2以及加工后植物纤维都可用作 食品干燥剂。P2O5吸水生成磷酸,不可用。 CaCl2·6H2O无吸水性,C项错误。
高考支招 纯净物和混合物的区别
考点二 物质的分类 交叉
u 知识梳理
1.分类法 常用的两种是①__交__叉__分__类__________法 和②__树__状__分__类__________法。由于物质 分类可以有不同的标准,也就是说对某一物 质而言在不同的分类标准下可以归为不同的 类别。
(2)元素:具有⑦_相__同__核__电__荷__数_____的一 类原子的总称。
①金属元素:原子的最外层电子数目一般 ⑧___少__于__4_个_______。
②非金属元素:原子的最外层电子数目一 般⑨____多__于__或__等__于__4_个__。
(完整版)第二章化学物质及其变化必背知识点

第二章化学物质及其变化知识清单一、物质的分类1. 元素的存在形式有两种,分别是什么?游离态(单质)、化合态(化合物)2.从熔沸点角度看,纯净物和混合物有何差别?纯净物有固定的熔沸点,混合物没有3.只含一种元素的物质一定是纯净物吗?不一定;如氧气与臭氧、石墨与金刚石组成的都是混合物4.从与酸或碱反应的情况看,氧化物是如何分类的。
酸性氧化物:与碱反应生成盐和水的氧化物(如CO2、SO2、SO3、P2O5)碱性氧化物:与酸反应生成盐和水的氧化物(如Na2O、CaO)不成盐氧化物:既不与酸反应,也不与碱反应的氧化物(如CO、NO)5.酸性氧化物一定是非金属氧化物吗?不一定,如Mn2O7非金属氧化物一定是酸性氧化物吗?不一定,如CO、NO碱性氧化物一定是金属氧化物吗?是金属氧化物一定是碱性氧化物吗?不一定,如Al2O3、Mn2O76.酸碱盐是如何定义和再分类的?酸的定义:在水溶液中电离出的阳离子都是H+的化合物。
酸可以分为强酸与弱酸;或含氧酸与无氧酸;或一元酸与多元酸;或氧化性酸与非氧化性酸等;碱的定义:在水溶液中电离出的阴离子全是OH-的化合物。
碱可以分为强碱与弱碱;或一元碱与多元碱等。
盐的定义:由金属阳离子(或铵根离子)与酸根离子组成的化合物盐可以分为正盐与酸式盐;或可溶性盐与难容性盐等盐的溶解性:钾钠硝铵全都溶,盐酸不溶银亚汞;硫酸难容钡和铅,碳酸只溶钾钠铵;钙银硫酸盐微溶;亚硫酸盐似碳酸。
7. 常见物质俗名和化学式生石灰:CaO 熟石灰:Ca(OH)2 石灰石:CaCO3碱石灰:CaO+NaOH烧碱(苛性钠):NaOH 纯碱(苏打):Na2CO3小苏打:NaHCO38.分散系如何分类的?分类的标准是什么?分散系分为溶液、胶体和浊液;分类的标准是分散质粒子的直径大小:其中小于1-100nm属于溶液,1-100nm之间的属于胶体,大于100nm的属于浊液。
9.常见的胶体有哪些?云、烟、雾、牛奶、豆浆、河水、血液、有色玻璃等10.胶体有哪些性质?丁达尔效应、聚沉、电泳、渗析使胶体聚沉的方法有哪些?加热、搅拌、加入电解质溶液、加入胶粒带相反电荷的胶体。
高一必修一第二章第一节物质的分类和胶体

(1)加热;例:牛奶的加热
(2)加入电解质溶液 ;例:卤水点豆腐 (3)加入带相反电荷的胶粒 ;例:明矾净水
【学以致用—胶体聚沉的应用】
盐卤点豆腐;加入电解质溶液 钢笔用不同种墨水混合会堵塞; 加入带相反电荷的胶粒 FeCl3溶液用于伤口止血 加入电解质溶液
土壤胶体有保肥作用、土壤在入海口易形成三角洲
CuSO4
探究:如何区别溶液与胶体?胶体分散系为什么可 以产生丁达尔效应?而溶液为什么不行? 用丁达尔效应
(4)★胶体的聚沉(凝聚)P29 豆浆、土壤、牛奶都是胶体,为什么豆浆能变成豆 腐,土壤会沉积形成平原、牛奶加热会结块呢? a 胶体具有介稳性的主要原因: 胶粒带电荷,带同种电荷的胶粒会互相排斥,并且胶粒 做布朗运动,所以胶粒会互相排斥而不会聚集成沉淀。 按照以上原理,如何破坏胶体的介稳性,使胶体聚 集成沉淀。 b.胶体的聚沉:其原理是中和胶粒的电荷或增加胶粒 的结合机会以使胶粒结合在一起形成大颗粒而沉淀
树状分类法
化合物
酸
碱
盐
氧化物
HCl H2SO4
NaOH Ca(OH)2
Na2SO4 CaCO3
CO2 CaO
二、分散系及其分类
1、分散系:(即混合物体系 )
把一种或多种物质分散在另一种(或多种) 物质中所得到的体系。 1)分散质: 被分散的物质。
2)分散剂: 起容纳分散质作用的物质。
例如:河水,蔗糖水,牛奶、豆浆的
用交叉分类法对下列物质进行分类 多种分类标准 如果根据酸的分子里是否含有氧原子,可以把酸分成含 氧酸和无氧酸两类;根据酸分子电离时所能生成的氢离子 个数,可以把酸分成一元酸,二元酸和三元酸等。
H2SO4 HCl HNO3 H2SO3 含氧酸 无氧酸 一元酸 二元酸
新编人教版高中化学必修一课时作业:第二章 第一节 第1课时 Word版含解析
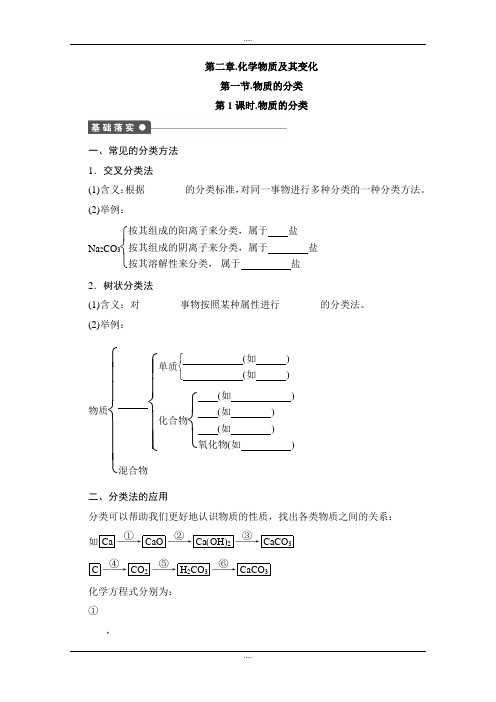
第二章.化学物质及其变化第一节.物质的分类第1课时.物质的分类一、常见的分类方法1.交叉分类法(1)含义:根据________的分类标准,对同一事物进行多种分类的一种分类方法。
(2)举例:Na 2CO 3⎩⎨⎧ 按其组成的阳离子来分类,属于 盐按其组成的阴离子来分类,属于盐按其溶解性来分类, 属于 盐2.树状分类法 (1)含义:对________事物按照某种属性进行________的分类法。
(2)举例:物质⎩⎪⎪⎨⎪⎪⎧ ⎩⎪⎪⎨⎪⎪⎧ 单质⎩⎨⎧ (如 ) (如 )化合物⎩⎨⎧ (如 ) (如 ) (如 )氧化物(如 )混合物二、分类法的应用分类可以帮助我们更好地认识物质的性质,找出各类物质之间的关系: 如Ca ――→①CaO ――→②Ca (OH )2――→③CaCO 3 C ――→④CO 2――→⑤H 2CO 3――→⑥CaCO 3化学方程式分别为:①________________________________________________________________________,②_________________________________________________________________ _______,③_________________________________________________________________ _______,④_________________________________________________________________ _______,⑤_________________________________________________________________ _______,⑥_________________________________________________________________ _______。
人教版化学必修一物质的分类

如:Na2O、CaO、CuO、Fe2O3 例: CuO + H2SO4 CuSO4 + H2O
两性氧化物 和酸、碱反应都能生成盐和水的 氧化物 如:Al2O3
例: Al2O3 + 6HCl 2AlCl3 + 3H2O Al2O3 + 2NaOH 2NaAlO2 + H2O
人 教 版 化 学 必修一 2.1物质 的分类 (共34 张PPT) 统编版 课件优 秀课件 ppt课件 部编版 课件
人 教 版 化 学 必修一 2.1物质 的分类 (共34 张PPT) 统编版 课件优 秀课件 ppt课件 部编版 课件
3、盐
(1)概念 由金属(含铵根NH4+)离子和酸根组成。 (2)分类
人 教 版 化 学 必修一 2.1物质 的分类 (共34 张PPT) 统编版 课件优 秀课件 ppt课件 部编版 课件
按 化 学 性 质 划 分
人 教 版 化 学 必修一 2.1物质 的分类 (共34 张PPT) 统编版 课件优 秀课件 ppt课件 部编版 课件
成盐氧 化物
酸性氧化物 和碱反应只生成盐和水的氧化物
第二章化学物质 及其变化
第一节 物质的分类 (第一课时)
[思考]
1、当我们进入商场时如何快速找到我 们需要的商品?
2﹑当你置身于图书馆或书店中,是怎 样找到你想要的书的?
3﹑当你去餐馆吃饭时,怎么点菜的?
商场
图书馆
餐馆菜谱
试想想,没有分类的世界的模样?
分类的目的和意义:能够提高人们工作、学 习的效率,使人们更快更便捷的达到目的。
物质的分类(A4)

第二章化学物质及其变化第一节、物质的分类一、物质的分类金属:Na、Mg、Al单质非金属:S、O2、N2酸性氧化物:SO3、SO2、P2O5等氧化物碱性氧化物:Na2O、CaO、Fe2O3两性氧化物:Al2O3等纯不成盐氧化物:CO、NO等净物金属氢化物:NaH、CaH2氢化物非金属氢化物:NH3、H2OHNO3、H2SO4等化按酸根分HCl合强酸:HNO3、H2SO4、HCl酸按强弱分物弱酸:H2CO3、HClO、CH3COOH一元酸:HCl、HNO3按电离出的H+数分二元酸:H2SO4、H2SO3多元酸:H3PO4强碱:KOH、NaOH、Ba(OH)2物按强弱分质弱碱:NH3·H2O、Fe(OH)3碱一元碱:NaOH、按电离出的HO-数分二元碱:Ba(OH)2多元碱:Fe(OH)3正盐:Na2CO3盐酸式盐:NaHCO3碱式盐:Cu2(OH)2CO3复盐:KAI(SO4)2混盐:溶液:NaCl溶液、稀H2SO4等混胶体:Fe(OH)3胶体、淀粉溶液、烟、雾、有色玻璃等合浊液:悬浊液:泥水混合物等物乳浊液:油水混合物酸电解质碱非电解质盐化合物氧化物离子化合物氢化物共价化合物二、分散系相关概念1. 分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。
2. 分散质:分散系中分散成粒子的物质。
3. 分散剂:分散质分散在其中的物质。
4、分散系的分类:按照分散质粒子的大小可以把分散系分为:溶液、胶体和浊液。
(1nm==10-9m )分散质粒子直径小于1nm 的分散系叫溶液,在1nm -100nm 之间的为胶体,大于100nm 的叫做浊液。
⎢⎢⎢⎢⎢⎢⎢⎢⎣⎡⎩⎨⎧→→⎩⎨⎧→→→→⎥⎦⎤乳浊液悬浊液浊液胶气溶胶;液溶胶;固溶粒子胶体:分子胶体胶体溶液分散系分散剂分散质三、胶体:分散质粒子直径大小在10-9~10-7m 之间的分散系。
1、分类:⑴. 根据分散质微粒组成:如:3)(OH Fe 胶体胶粒是由许多3)(OH Fe 等小分子聚集一起形成的微粒,其直径在1nm ~100nm 之间,这样的胶体叫粒子胶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章化学物质及其变化第一节物质的分类
【学习目标】
1.了解物质分类的方法和依据,学会从多种角度、依据不同标准对物质进行分类。
2.知道“交叉分类法”和“树状分类法”这两种常用的分类方法。
3.知道胶体是一种常见的分散系,知道分散系的分类。
4.知道胶体的本质特征及其性质。
【知识温习】
1.将空气、水、硫酸、矿石、石油、煤炭从物质的状态进行分类,可以将___________归为一类,将___________________归为一类,将________________归为一类。
2.初中学习中,将元素分为______元素和______元素;将化合物分为______、______、______、______。
对于化学反应,我们把它分为四种基本反应类型,分别是______反应、_______反应、________反应、__________反应。
【新知梳理】
一、物质的分类:关键是把大量事物按照事先设定的“标准”即分类依据进行分类。
常见的分类方法有以下两种。
1.交叉分类法:对某类事物按照多种标准进行再分类。
(1)例如,Na2CO3按其组成的阳离子来分类,属于______盐;按其组成的阴离子来分类,属于______盐;按其溶解性来分类,属于________盐。
(2)在不同的物质和它所属的类别之间进行连线
①强碱NaOH ②金属氧化物CO2
弱碱KOH 非金属氧化物CaO
一元碱NH3·H2O 酸性氧化物SO2
二元碱Ba(OH)2碱性氧化物Na2O
2.树状分类法:对同类事物按照某种属性进行再分类。
如:将Fe、Cu、S、H2、HCl、NaOH、H2SO4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl填入下图。
二、分散系及其分类
1.把___________分散在_____________中所得到的体系叫分散系。
其中__________的物质称为分散质;______________________的物质称为分散剂。
2.分类:以分散质或分散剂所处的状态为标准,共有
______种组合方式。
当分散剂是水或其他液体时,按
照分散质粒子的大小来分类,分散系可以分类如下:
3.胶体的制备和性质:(1)Fe(OH)3胶体的制备:将烧
杯中的_________加热至沸腾,向其中逐滴加入5~6滴________________,继续煮沸至液体呈__________色,停止加热,得到的分散系即为Fe(OH)3胶体。
反应的化学方程式为:FeCl3+3H2O(沸水)==Fe(OH)3(胶体)+3HCl
4.胶体的性质(1)介稳性:胶体的稳定性介于______和_______之间,在一定条件下可以稳定存在。
(2)丁达尔效应:当光束通过胶体时,可以看到_________________,这是由于胶体粒子对光线的________形成的。
丁达尔效应可用来区分_______________。
(3)电泳现象:胶体微粒带电荷,在电场的作用下发生定向移动。
(4)聚沉:胶体形成沉淀析出的现象。
其方法主要有_____________、__________、__________________________。
【知识巩固】
1.对下列物质的分类全部正确的是()
①纯碱②食盐水③石灰水④NaOH ⑤液态氧⑥KClO3
A.碱——①④
B.纯净物——③④⑤
C.盐——①⑥
D.混合物——②⑤
2.下列反应方程式中,有一个与其他三个在分类上不同,这个反应是()
A.Zn+H2SO4=ZnSO4+H2↑
B.Na2CO3+H2O+CO2==2NaHCO3
C.S+O 2SO2
D.H2+Cl22HCl
3.下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是()
A.石灰石
B.Ca(OH)2
C.CaCO3
D.CH4
4.依据不同的分类标准,HNO3可属于下列的哪一类?()
①酸②纯净物③氧化物④含氧酸⑤化合物⑥混合物⑦一元酸
A.①②③
B.③④⑥
C.①②④⑤⑦
D.①③④⑤⑦
5.胶体区别于其他分散系的本质特征是()
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.分散质粒子直径在1nm~100nm之间
D.胶体在一定条件下能稳定存在
6.“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质()
①是溶液②是胶体③能产生丁达尔效应④能透过滤纸
⑤不能透过滤纸⑥静置后会析出黑色沉淀
A.①④⑤
B.②③④
C.②③⑤
D.①③④⑥
7.根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞,雾属于下列分散系中的()
A.溶液
B.悬浊液
C.乳浊液
D.胶体
8. FeCl3溶液和Fe(OH)3胶体具有的共同性质是()
A.都能透过滤纸
B.都呈红褐色
C.都有丁达尔效应
D.都比浊液稳定
9.不能用胶体的知识解释的现象是()
A.豆浆中加入石膏做豆腐
B.一支钢笔使用两种不同牌号的墨水,易出现堵塞
C.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D.在海水与河水交界处,易形成三角洲
10.浊液中分散质粒子的直径______(填“>”或“<”)100nm,溶液中分散质粒子的直径______(填“>”或“<”)1nm,而胶体颗粒的直径介于________之间。
布朗运动______(“是”或“不是”)胶体的特有性质。
这三种分散系按稳定性由弱到强顺序排列的是
___________________________________。
区别FeCl3溶液和Fe(OH)3胶体的最简单的方法是_________________。
