鲁教版化学九年级下册《物质的溶解性》溶液(第1课时)
6.3物质的溶解性(第1课时)练习九年级化学(全国)下册

第3节物质的溶解性第1课时影响物质溶解性的因素一、基础巩固1.【2023·秦皇岛期末】固体物质的溶解性与下列因素无关的是( )A.温度的高低 B.溶质的性质C.压强的大小 D.溶剂的性质2.为了探究影响物质溶解性的因素,设计了如下表所示的实验方案,该实验无法探究的因素是( )A. 溶质种类B. 溶剂种类C. 溶液温度D. 颗粒粗细3.下表是同学们在学习溶液知识时实验报告中的部分内容,分析后请回答:(1)在同一条件下,物质的溶解能力与____________和____________有关。
(2)除(1)中的因素外,你认为固体物质的溶解能力还与外界条件________有关。
4.一定温度下,某物质的饱和溶液一定是( )A.不能继续溶解该物质的溶液B.浓溶液C.不能继续溶解其他任何溶质的溶液D.稀溶液5.【2022·吉林模拟】下列溶液一定是该温度下的饱和溶液的是( )A.①B.②C.③D.④6.【2023·重庆模拟】要使不饱和溶液变成饱和溶液,下面的方法中一定可行的是( ) A.加溶剂 B.加溶质C.升高温度 D.降低温度7.【2023·聊城期末改编】下列关于溶液的叙述正确的是( )A.溶液是均一、稳定的化合物B.浓溶液不一定是饱和溶液C.稀溶液一定是不饱和溶液D.饱和溶液就是不能再继续溶解任何溶质的溶液二、能力提升8.【2023·苏州】向5 mL碘的水溶液(黄色)中加入2 mL汽油(无色),振荡后静置,实验现象如图所示。
由该实验不能得出的结论是( )A.汽油的密度比水小,且难溶于水B.汽油易挥发,沸点比水低C.碘在汽油中的溶解性比在水中强D.碘在不同溶剂中形成的溶液颜色可能不同9.氢氧化钙的溶解能力随温度的升高而减小。
把一瓶接近饱和的石灰水变成饱和溶液的具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水;⑥通入少量CO2气体。
其中正确的是( )A.①②④ B.①③④ C.③⑤⑥ D.①②⑤10.【2023·郴州模拟】室温时,取一定质量的氯化钠固体放入烧杯中,按图所示加水并搅拌,使之充分溶解。
九年级化学知识点(鲁教版)第三单元 溶液

第三单元溶液第一节溶液的形成一、物质在水中的分散二、溶液溶液:一种或几种物质分散到另一种物质形成的均一、稳定的混合物。
溶质:被溶解的物质溶剂:起溶解作用的物质1.溶液的外观:澄清透明。
(溶质是以肉眼看不见的分子或离子形式分散到溶剂中的,所以溶液是澄清透明的;但是溶液不一定是无色的)2.溶液的特点:均一性、稳定性、属于混合物3.溶质、溶剂的判断:①固体、气体溶解于液体:固体、气体是溶质,液体是溶剂②液体溶解于液体:少的是溶质,多的是溶剂;如果有水,无论多少,水是溶剂。
4.溶液的命名:“xx”(溶质)的“xx”(溶剂)溶液;如果溶剂是水,可以不说溶剂水。
氯化钠溶于水所得溶液的全称为“氯化钠的水溶液”,又可以叫做“氯化钠溶液”。
5.一些常见溶液的俗称:氯化钠溶液——食盐水氢氧化钙溶液——石灰水碘的酒精溶液——碘酒三、溶解时吸热、放热现象1.溶解时溶质的分子(或离子)向水中扩散,吸收热量,溶液温度降低。
2.溶解时溶质的分子(或离子)和水分子作用,生成水合分子(或水合离子),放出热量,溶液温度升高。
3.①溶解放热,所得溶液温度升高的物质有:氢氧化钠固体、生石灰氧化钙、浓硫酸②溶解吸热,所得溶液温度降低的物质有:硝酸铵晶体③氯化钠溶于水既不吸热也不放热四、溶液的性质①常见的酸、碱、盐的水溶液具有导电性。
原因是它们溶于水要发生电离,产生能自由移动的阳离子和阴离子。
如氯化钠溶解发生电离的电离方程式为NaCl=Na++Cl-;硫酸溶解发生电离的电离方程式为H2SO4=2H++SO42-②少量溶质溶于水中,形成的稀溶液的沸点升高,凝固点降低。
③常见的有色溶液:蓝色溶液(含Cu 2+):硫酸铜溶液,氯化铜溶液,硝酸铜溶液浅绿色溶液(含Fe 2+):硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液黄色溶液(含Fe 3+):硫酸铁溶液,氯化铁溶液,硝酸铁溶液 紫红色溶液:高锰酸钾溶液 紫色溶液:石蕊溶液五、饱和溶液与不饱和溶液1. 定义:在一定温度下,一定量的溶剂里,不能再继续溶解某种溶质的溶液,就是该溶质的饱和溶液。
鲁教版化学九年级第一单元 溶液1.1溶液的形成(第1课时)学案

溶液第一节溶液的形成课标要求:认识溶解现象,知道溶液是由溶质和溶剂组成的;知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂;知道水溶液中溶质是以分子或离子存在的;了解饱和溶液的含义;能进行溶质质量分数的简单计算;认识溶质质量分数的含义,能配制一定溶质质量分数的溶液;能说出一些常见的乳化现象;了解溶液在生产、生活中的重要意义。
内容和学情分析:本单元内容主要涉及“什么是溶液?”、“溶液是怎样形成的?”、“溶液组成如何表示?”、“如何配制一定组成的溶液?”等四个问题。
学生对于溶液的知识并不陌生,他们不仅在生活中接触并使用到溶液,在实验室中也用到过溶液,如盐酸、硫酸、氢氧化钠、硫酸铜溶液等。
对溶液有一定的感性认识,从心理上和知识背景上都具备了学习本课题的条件,但他们对溶液的认识仍是感性的、不具体的,甚至还存在着“迷思概念”现象。
对溶液在化学研究中的重要性、溶液在生命活动中、在工农业生产和日常生活中的作用和用途的了解还是远远不够的。
学习建议:根据设置的情境,从自己熟悉的溶液入手,通过实验探究、讨论及观察,借助溶解动画视频,从宏观和微观两个维度认识溶解现象得出溶液的特征及概念,分析溶解过程中通常都伴随能量变化。
联系生活常识,通过实验观察,认识乳化现象。
学习目标:知识与技能:1.认识溶解现象,知道水是最重要的溶剂,酒精、汽油等也是常见的溶剂。
知道水溶液中溶质是以分子或离子存在的。
2.了解饱和溶液的含义,学会饱和和不饱和溶液之间的相互转化。
3.能说出一些常见的乳化现象。
过程与方法:1.能进行溶质质量分数的简单计算。
2.初步学会配制一定溶质质量分数的溶液。
情感态度与价值观:1.了解溶液在生产、生活中的重要意义。
知识点(重点、难点):重点是理解溶液的概念,知道溶液的基本特征;能辨别常见溶液中的溶质、溶剂。
难点是从微观角度解释溶液的形成过程及溶解过程中的能量变化。
实验准备:多媒体;烧杯(50ml)3只,试管2支,玻璃棒、温度计、药匙、胶头滴管;食盐固体、氢氧化钠、硝酸铵、汽油、植物油、洗洁精。
鲁教版(五四制)九年级化学第一单元 溶液第1节《溶液的形成》第一课时参考课件

1.溶液的定义 一种或几种物质分散到另一种物质里,形成均一的、 稳定的混合物。 2.溶液的特征
均一性:溶液形成以后,溶液任一部分的组成和性
质完全相同(指密度、浓度、性质等)。 稳定性:溶液在外界条件(包括温度、压强)不改 变的情况下,溶液中的各组成不会发生变化。
透明的混合物:凡是溶液都是透明的混合物。
化学需要的溶液
实验二:碘和高锰酸钾在水和汽油中的溶解性
问题: 1.溶质相同,溶剂不同,溶解情况是否相同?
2.溶质不同,溶剂相同,溶解情况是否相同?
3.试归纳影响溶解性的因素。
碘
碘
高锰 酸钾
高锰 酸钾
水
汽油
水
汽油
碘或高锰酸钾分别放入水或汽油中
试管编号 1
2 3 4
溶剂 水 水 汽油 汽油
溶质
碘 高锰 酸钾
把液体倒 掉后试管 是否干净 不干净
分层
乳状浑浊
不分层
干净
洗涤剂有乳化的功能,它能使植物油分 散成细小液滴,而不聚成大的油珠,
细小液滴能随水流走。
洗涤剂和汽油去除油污的原理的区别
植物油大 油滴
洗涤剂 (乳化) 汽油
分散成小油 水冲洗 随水流走 滴 (乳浊液)
植物油的汽 油溶液
植物油大 油滴
水冲洗
20℃
20℃
NaCl溶解
实验方案:将温度计插入盛水的烧杯中,观察温度并记录;向烧杯中加入
一种固体,用玻璃棒搅拌,读出温度计的刻度并记录。对另外两种固体做
同样的实验。 溶解现象:用手触摸个烧杯外壁,NaCl溶液的烧杯无明显变化,NH4NO3
溶液的烧杯较冷, NaOH溶液的烧杯壁热。
结论: NaCl溶解时温度变化不明显, NH4NO3 溶解时溶液温度降低,溶 解时吸热, NaOH溶解时溶液温度升高,溶解时放热。
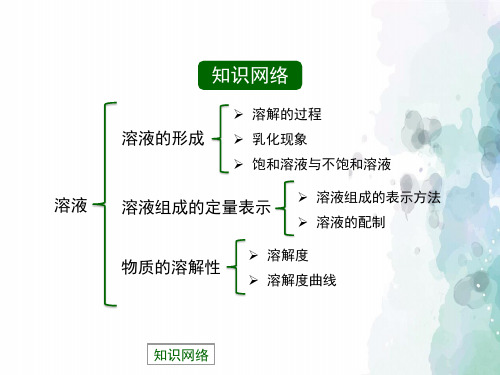
初三化学鲁教版第三单元《溶液》单元教学设计

初三化学鲁教版第三单元《溶液》单元教学设计《初三化学鲁教版第三单元《溶液》单元教学设计》这是优秀的教学设计文章,希望可以对您的学习工作中带来帮助!作业内容初三化学鲁教版第三单元《溶液》单元教学设计所需时课内共用6课时,每周三课时;课外共用2课间主题单元学习概述本单元的教学核心内容,隶属于课程标准中第五个“一级主题”------“身边的化学物质”中主要内容之一。
本单元教学意在帮助学生认识一类均匀的混合物——溶液的组成特征及其定量表示方法和配制方法,并同时体会在科学上是按照怎样的思路来认识的。
内容涉及溶液的概念、形成、表示、配制四个方面。
学生通过探究的过程中养成科学的态度、获得科学的方法、提高实验的技能。
本主题单元内容来源于鲁教版教材九年级上册课本第三单元。
该主题单元共分为以下三个专题:专题一:溶液的形成。
学生能初步认识溶液的组成及溶液的重要特征;通过亲历科学探究的过程深化对溶液知识的理解,进一步构建物质之间相互溶解的微观本质;并能初步运用科学探究的的方法解决一些化学问题。
专题二:溶液组成的定量表示。
了解表示溶液组成的几种方法;会进行有关溶液溶质质量分数的基本计算,进一步加深对概念的理解。
专题三:配制一定溶质质量分数的溶液。
学生初步学会配制溶液的实验方法,并且巩固和熟练一些基本实验操作的方法如托盘天平、量筒等使用。
本主题单元的教学重点:溶液、饱和溶液、不饱和溶液的概念理解;饱和溶液与不饱和溶液的转化方法;溶质质量分数的计算;配置一定质量分数的溶液。
主要的学习方式:实验探究、自主学习与合作学习等。
预期教学成果:探究实验报告、思维导图、课堂综合检测、溶液在工农业生产和生活中的应用调查报告、各类洗涤剂及其作用归类。
主题单元规划思维导图主题单元学习目标知识与技能:(1)知道溶质、溶剂的概念,理解溶液的概念;(2)了解物质溶解的微观实质;(3)了解影响溶解的因素;(4)理解饱和、不饱和溶液的概念。
过程与方法:(1)通过丰富的探究实验,培养学生的动手操作、比较推理、表述等能力。
九年级化学下册 第6章 溶解现象 6.3 物质的溶解性(1)课件

第五页,共十四页。
资料(zīliào)
呢绒、毛、丝绸等高级衣料用水洗会引起皱 缩、变形和损伤,或不易洗净,故常采用干洗 的方法。干洗剂(xǐ jì)是由易挥发的有机溶剂,表 面活性剂和少量水(或不加水)及乳化剂组成 的。有机溶剂的作用是溶解衣物上的油污(常用 的有轻石油烃和氯代烃),表面活性剂能防止 溶于溶剂的污垢微粒再沉积。干洗剂尽管对清 洁油性污渍非常有效,但对水溶性污渍的去污 效果却不明显。
不饱和溶液
3、检验饱和溶液方法:
取样,加入少量该溶质,观察能否继续溶解。
4、浓溶液和稀溶液: ⑴饱和溶液不一定是浓溶液,不饱和溶液也不一定是稀溶液;
⑵相同温度,同一溶质的溶液,
饱和溶液比不饱和溶液要浓一些。
第十三页,共十四页。
内容 总结 (nèiróng)
第6章 溶解现象。胡萝卜如果生吃,其中的β-胡萝卜素只有25%被吸收,如果用食用油烹调后,则 能吸收95%,你知道吸收效率高低的道理吗。β-胡萝卜素在水中溶解性小,在食用油中的溶解性大。
的溶质多。
√ (6)浓溶液一定是饱和溶液,稀溶液一定是不饱和溶液。
(7)在相同温度下,食盐的饱和溶液比它的不饱和溶液要浓。
√ (8)60℃时的硝酸钾饱和溶液,当温度降低到20℃时,其它条件不变,该
溶液还是饱和溶液 。
第十页,共十四页。
1、下列因素不会影响(yǐngxiǎng)物质溶解性的是( )
A.溶质的性质
第六页,共十四页。
干洗不是什么神秘的事,它只是用溶剂来去除油垢或 污渍。由于溶剂中几乎不含任何水分,所以称之为干洗 。干洗的溶液可以溶解及去除衣物上的油垢,例如羊毛 及丝类的天然纤维,水洗后很可能会缩水、变形及褪色 ,但是干洗就可以处理得很好。
鲁教版化学九年级《溶液》复习课件
【解析】本题考查用图像表示变化的能力,解答本题需明确 两点:(1)氢氧化钙溶解度与温度的关系;(2)生石灰放入溶 液后的变化情况。生石灰能与水反应生成氢氧化钙,溶剂质 量会减少,A错误;反应过程中放热使溶液的温度升高,致 使氢氧化钙的溶解度降低,B错误;因为饱和溶液中溶剂的 量减少,溶质的质量随之减少,温度升高溶解度降低,使得 溶质的质量也随之减少,温度恢复后,溶解度增大,溶质的 质量又会增大,但小于开始时的质量,C正确;温度不变, 溶解度不变,饱和溶液的溶质质量分数相等,D错误。 故选:C。
知识回顾
2.物质溶解时温度的变化 (1)物质溶解于水的过程中发生了两种变化:一是 溶质的分子(或离子)向水中扩散,这一过程_吸__收__ 热量;二是溶质的分子(或离子)和水分子作用,生 成水和分子(或水合离子),这一过程_放__出__热量。 (2)若吸热<放热,溶液温度__升__高___;若吸热=放 热,溶液温度不变;若吸热>放热,溶液温度 __降__低___。
例题解析
【解析】 (1)从标签中可以知道盐酸的体积为500mL,密度为 1.19g/cm3,可以据此求出盐酸的质量为: 1.19g/cm3×500mL=595g; (2)设需要这种浓盐酸的质量为x,根据稀释前后溶 质的质量不变可知: 148g×5%=x•37% 解得:x=20g;
例题解析
(3)根据题意可以知道氢氧化钠和盐酸恰好完全反应,所以盐 酸中溶质 的质量为:73g×5%=3.65g; 设氢氧化钠溶液中溶质的质量为x NaOH+HCl═NaCl+H2O 40 36.5
知识回顾
3.乳化现象: (1)含表面活性剂的物质可以使食用油等物质以 _细__小__的__液__滴___均匀分散在水中,形成不易分层、比较 稳定的混合物,这种现象叫做__乳__化__现__象___。 (2)乳化作用在生产生活中应用广泛,如利用 __洗__涤__剂____可以轻松去除衣物或餐具上的油污。
鲁教版化学九年级《物质的溶解性》教学课件

气体溶解度:气体在压强为101kPa和一定温度时溶 解在1体积水里达到饱和状态时的气体体积。
气体溶解度随温度升高而降低,随压强的增大而增大。
知能训练 打开汽水瓶盖会有大量气泡冒出,产生这一现象的 原因是二氧化碳的溶解度随( B ) A.压强增大而减小 B.压强减小而减小 C.温度升高而升高 D.温度降低而减小
/g
溶 200
解 190
度
180 170
160
150 140
130 120
110 100 90 80
70
60
50 40 30 20
10
0
二、溶解度曲线
硝酸铵 硝酸钾
1:同种物质在不 同温度下的溶解度 不同。Βιβλιοθήκη 硝酸钠氯化铵 氯化钠
2:曲线的交点表 示这两种物质在该 温度下的溶解度相 同。
3:曲线越陡,该 物质的溶解度受温 度影响越大。
溶解度曲线的应用 降温结晶
结晶:固体物质从它的饱和溶液中以晶体的形式析出
的过程。 饱和溶液
②蒸发溶剂 结晶
①冷却
氯化钠晶体
硫酸铜晶体
明矾晶体
课堂小结
溶解度 影响物质溶解性的因素 固体溶解度概念
溶解度 气体溶解度
概念 影响因素
溶解度曲线
意义及应用 结晶
Thyoaunk
End
结束
说明:物质的溶解性受温度影响。
化学上通常用溶解度来定量表示某种物质在某种溶剂 中的溶解性。
溶解度:在一定温度下,某固态物质在100克溶剂里 达到饱和状态时所溶解的质量。
溶 条件 —— 一定温度
解 度
标准 —— 100克溶剂 (水)
要 状态 —— 饱和溶液
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质的溶解性
3.收集证据:
Creativity / Innovation / Specialty / Exquisite
[实验1]探究溶质、溶剂种类对物质溶解性的影响
在试管中,分别取少量的高锰酸钾和碘,再各加入5ml 水和5ml汽油,振荡,观察现象。
加入5mL水并振荡
加入5mL汽油并振荡
高锰酸钾 高锰酸钾溶于水
饱和溶液与不饱和溶液
Creativity / Innovation / Specialty / Exquisite
上述实验证明,饱和溶液与不饱和溶液是可以相互转化的。改变温度 可以使饱和溶液与不饱和溶液相互转化。
除了视频中的方法,你还能想到什么方法使饱和溶液与不饱和溶液相 互转化?
饱和溶液与不饱和溶液
1、向一接近饱和的KNO3溶液中,逐渐加入
K量N变O3晶化体规,律下的列是图(像中)符C 合溶液中溶质的质
\ \
\ \
溶
质
溶
溶 质
溶 质
克
质
克
克
克
KNO3晶体
A
KNO3晶体
B
KNO3晶体
C
KNO3晶体
D
2、一杯20℃的NaNO3溶液,能证明它是饱和溶液的是( D )
A蒸发10克水有硝酸钠晶体析出 B降低10℃时,有硝酸钠晶体析出 C加入10克硝酸钠晶体,仍有硝酸钠晶体 D在该温度下,加入少许硝酸钠晶体,晶体质量不再减
2、不能影响物质溶解度大小的因素是( B )
A.温度高低 B.溶质、溶剂的量 C.溶剂种类 D.溶质种类 3、打开汽水瓶塞时会有大量气泡冒出,产生这一现象的原因是二
氧化碳气体的溶解度( B )
A、随压强的增大而增大 B、随压强的减小而减小 C、随温度的升高而升高 D、随温度的降低而减小
4、60℃时,50g水中溶解10.48gM恰好达到饱和,则M属于( D)
高锰酸钾不溶于汽油
碘 结论
碘不溶于水
碘溶于汽油
溶解性与溶质、溶剂的种类有关
物质的溶解性 Creativity / Innovation / Specialty / Exquisite
[实验2]探究温度对物质溶解性的影响(以KNO3为例)
思路分析:在实验中需要改变的因素是__温___度__, 需要保持不变的因素是_____溶__剂___的__质__量_____。
溶液的质量不变
2
溶解度
物质的溶解性 Creativity / Innovation / Specialty / Exquisite
1.提出问题:哪些因素影响固体物质的溶解性?
2.猜想假设:((21))溶溶剂质的的种种类类
(3)温度
小贴士
控制变量法:如果有许多因素会同时影响某一实验结 果,当我们要研究其中的一种因素时,要控制其它因 素保持不变,只研究这一个变量对实验结果的影响。
1、定义: 一定压强、一定温度下,气体在1体积水里 达到饱和状态时的所溶解的体积数。
2、影响因素: 温度和压强
在一定压强下,温度越高气体溶解度越小,温度越低溶解度越大 在一定温度下,压强越大气体溶解度越大,压强越小溶解度越小
1、要使溶解度增大采用的方法是( D)
A、增加水 B、增加溶质 C、不断搅拌 D、升高温度
A、易溶物质 B、可溶物质 C、微溶物质 D、无法确定
5、“20℃时KClO3的溶解度为7.4g”,它表示( D )
A、20℃时,100g KClO3饱和溶液中含KClO37.4g。 B、20℃时,KClO3在水中溶解7.4g,溶液达到饱和状态。 C、100g水最多溶解7.4g KClO3。 D、20℃时,100g水溶解7.4g KClO3时,溶液达到饱和状态。 6、20℃时食盐的溶解度为36g。20℃时将20g食盐放入50g水中,充分搅
实验证明,物质在水中不能无限的溶解
我们将在一定温度下,在一定量的溶剂中,不能继 续溶解某物质的溶液称为该物质的饱和溶液。
将在一定温度下,在一定量的溶剂中,能继续溶解 某物质的溶液称为该物质的不饱和溶液。
饱和溶液与不饱和溶液
Creativity / Innovation / Specialty / Exquisite
溶解度
(1)定义:
一定温度下,某固体在100g溶剂(通常为水)里 达到饱和状态时所溶解的质量。
(2)符号:S
(3)四要素:温度、100g溶剂、饱和状态、单位是克。
溶解度 Creativity / Innovation / Specialty / Exquisite
1.100g水中溶解了36g食盐刚好达到饱和, 所以食盐的溶解度是36g。一定温度 2. 20℃时,1010g水中最多溶解了3.6g氯化钠, 所以20℃时氯化钠的溶解度为3.6g。 3. 20℃时,10g食盐溶解在100g水中,所以 20℃时,食盐的溶解度是10g。饱和状态 4. 在20℃时,100g水里最多溶解了33.3g氯 化铵,则20℃时氯化铵的溶解度是33.3单。位:g
《物质的溶解性》溶液(第1 课时)
鲁教版化学九年级下册
超多互动!超多素材!总有你喜欢的。为教学插上翅膀!
目 录
CONTENTS
1 -饱和溶液与不饱和溶液 2 -溶解度
1
饱和溶液与不饱和溶液
与氯化钠一样,硝酸钾也是易 溶于水的物质。但是,易溶于 水能否代表可以无限溶解?
饱和溶液与不饱和溶液
Creativity / Innovation / Specialty / Exquisite
问题:现有一瓶接近饱和的硝酸 钾液,要
使它变为饱和溶液可有哪些方法?
饱和溶液与不饱和溶液
Creativity / Innovation / Specialty / Exquisite
小结
一定温度,一定量的溶剂
饱和溶液
增加溶剂、升高温度 不饱和溶液
增加溶质、蒸发溶剂、降低温度
饱和溶液与不饱和溶液
Creativity / Innovation / Specialty / Exquisite
拌后,所得饱和食盐溶液的质量为( C )
A、70g B、69g C、68g D、67g
谢谢观看
THANKS FOR WATCHING
溶解度与溶解性的关系 溶解度 Creativity / Innovation / Specialty / Exquisite 易溶、可溶、微溶、难溶 物质
( )( ) ( ) ( )
0.01 1
பைடு நூலகம்
10 20 ℃溶解度/克
气体溶解度 Creativity / Innovation / Specialty / Exquisite
40 ℃
方不法行三
1克氯化钠 1克硝酸钾
应该达到2饱0克水和状态
20克水能溶解1克氯化钠, 也能溶解1克硝酸钾,这 可以说明氯化钠、硝酸钾 的溶解限量相同吗?
溶解度 Creativity / Innovation / Specialty / Exquisite
为了能够量化物质的溶解性,化学家推出了溶解度的概念。
少
3. 能证明 20℃ 时原 KNO3 溶液是饱和溶液的事实是( D )
A. 降温到 10℃ 时有 KNO3 晶体析出 B. 蒸发掉 10g 水,有 KNO3 晶体析出 C. 加热到 30℃ 后,再加入 KNO3 晶体仍能继续溶解 D. 在 20℃ 时,向上述 KNO3 溶液中加入少量 KNO3 晶体,
Creativity / Innovation / Specialty / Exquisite
转化方法
饱和溶液
例外:氢氧化钙降低温度 增加溶剂、减少溶质、升高温度
增加溶质、蒸发溶剂、降低温度 例外:氢氧化钙升高温度
不饱和溶液
饱和溶液与不饱和溶液
Creativity / Innovation / Specialty / Exquisite
饱和溶液与不饱和溶液 Creativity / Innovation / Specialty / Exquisite
注:(1)要指明一定温度。 (2)要指明一定量的溶剂。 (3)对某种溶质而言。
判断溶液是否饱和
(1)在一定温度下,看是否有剩余溶质存在。 (2)加入该溶液的少量溶质,看是否能够溶解。
4.获得结论: 物质的溶解性 Creativity / Innovation / Specialty / Exquisite
影响固体物质溶解性的因素:
溶质的性质 内部因素:
溶剂的性质
外部因素: 温度
这样行吗?
不方行法一
氯化钠 硝酸钾
方不法行二 硝
酸
氯化钠
钾
应该在同一温度下
应该是一定量的溶剂
10 ℃
上述活动中,当我们在20mL水中第一次加入5g硝酸钾时,得到的是 硝酸钾的_______不___饱__和__溶__液___________(饱和溶液/不饱和溶液),第二 次加入5g硝酸钾时,得到的是硝酸钾的____饱__和___溶__液___________。
那么,如何才能让剩余的硝酸钾继续溶解?饱和溶液 与不饱和溶液如何相互转化?
实验步骤:____________________________________。 实验现象:____________________________________。 实验结论:在___溶__剂__质__量______保持不变的情况下,
当升高温度时,硝酸钾晶体在水中的最大溶解量会__变___大____; 当降低温度时,其最大溶解量会__变___小____。
