第9章 反合成分析
合成化学-逆合成

合成路线: 合成路线
NaNH2 NH3 Br Lindlar Cat. H2 OsO4 Et2O O O TsOH O H2O
HO OH
用环己烯和二个碳的简单有机原料合成下列化合物: 例九 用环己烯和二个碳的简单有机原料合成下列化合物:
O OCH3 OCH3
逆合成分析: 逆合成分析:
O OCH3 OCH3 OH O OH O CHO
金属有机化合物与卤代烷的偶联反应; 金属有机化合物与卤代烷的偶联反应; 金属有机化合物与羰基,氰基的加成反应; 金属有机化合物与羰基,氰基的加成反应; 金属有机化合物与环氧化合物的开环反应; 金属有机化合物与环氧化合物的开环反应; 各类缩合反应; 各类缩合反应; 炔烃,芳环, 二羰基化合物和β 炔烃,芳环,酮,酯,β-二羰基化合物和β-羰基 腈的烷基化和酰基化反应; 腈的烷基化和酰基化反应; 酮的双分子还原; *6 酮的双分子还原; 酯的双分子还原; *7 酯的双分子还原; 环加成反应; *8 环加成反应;
合成路线: 合成路线
O Br2 Mg Br anhydrous ether Mg anhydrous ether PhCOCl H+ CHO H+ OCOPh Ph PhCH2CH2OH
H+
用苯,苯甲酸和五个碳以下的简单有机原料合成: 例十一 用苯,苯甲酸和五个碳以下的简单有机原料合成:
Ph O O Ph
逆合成分析: 逆合成分析:
Ph O O Ph Ph CHO CH2OH + PhCH2CH2MgBr OH
Br PhCH2CH2Br + CH2O
O PhCH2CH2OH PhMgBr +
三、 逆合成原理
逆合成原理是以合成子概念和切断法为基础, 逆合成原理是以合成子概念和切断法为基础,从目标化合物 出发;通过官能团转换或键的切断; 出发;通过官能团转换或键的切断;去寻找一个又一个前体 分子(合成子),直至前体分子为最易得的原料为止,这是 分子(合成子),直至前体分子为最易得的原料为止, ),直至前体分子为最易得的原料为止 完成合成设计的一条有效途径。 完成合成设计的一条有效途径。
有机合成 逆合成分析

逆合成分析是一种 逆推法,是通过切 断(剖析)等操作, 从比较复杂的目标 分子推导出简单易 得的起始原料的过 程 LOGO
3
断裂转化和合成子 (Transforms, Synthon)
合成子
断裂转化
由产物推出起 始物的过程, 是合成反应的 逆过程
反合成分析中 进行某一转化 所必须的结构 单元或化合物
4
简化断裂分析的主要目的
1.
将TM变换成 合成上更易制 备的可替代的 目标分子 (Alternative TM) 2. 为了作逆向切 断、连接或重 排等变换,须 将TM中原来不 适用的官能团 变换成所需形 式,或暂时添 加某些必须官 能团。 3. 添加某些活化 基、保护基或 阻断基,以提 高化学区域选 择性或立体选 择性。
逆合成分析是一种逆推法是通过切断剖析等操作从比较复杂的目标分子推导出简单易得的起始原料的过断裂转化和合成子transformssynthon断裂转化由产物推出起始物的过程是合成反应的逆过程合成子反合成分析中进行某一转化所必须的结构单元或化合物添加某些活化基保护基或阻断基以提高化学区域选择性或立体选为了作逆向切断连接或重排等变换须将tm中原来不适用的官能团变换成所需形式或暂时添加某些必须官将tm变换成合成上更易制备的可替代的目标分子alternativetm1
5
合成子及其合成等效体
1.合成子 Synthon 指在逆向合成法中,通过切断化学键而拆 开TM分子后,得到的各个组成结构单元
2.合成等效体 2.合成等效体 能起合成子作用的试剂。 synthetic synthetic equivalent equivalent
6
7
设计中利用的结构因素
1 2 3 分子骨架:连接与重排 官能团:相互转化 立体化学:翻转或转移
周环反应理论解释

1
3 3,3-σ-迁移
1ˊ
3ˊ
2ˊ
2
1
3
1ˊ
3
2ˊ ˊ
周环反应的特征:
(1) 多中心的一步反应,不经过中间体如C+、C-、C•、:C 等,反应进行时
键的断裂和生成是同时进行的(协同的)。
CHO +
CHO
CH
(2) 反应的动力是加热(热能)或光照(光能),不受溶剂极性影响,不被 酸碱所催化,不受任何引发剂的引发。
分子轨道对称性守恒原理的表述:
协同反应的途径是由分子轨道对称性性质决定的—— 反应物与产物的轨道对称性相合时,反应易于发生(对称 性允许 ) ;不相合时,反应就难发生(对称性禁阻) 。
化学反应是分子轨道进行重新组合的过程,在一个协同反应 中,分子轨道的对称性是守恒的,即由原料到产物轨道的对 称性始终不变。
(3) 反应有显著的立体选择性,生成空间定向产物。
R hv
R
R
R
R
R = - COOCH3
R
(一) 分子轨道对称性守恒原理(Conservation of orbital symmetry)
1. 原理的提出:
1965年伍德沃德和霍夫曼(R . B . Woodward , R . Hoffmann)在 系统研究大量协同反应的试验事实的基础上从 量 子 化 学 的 分 子 轨 道 理 论 出 发提出了分子轨道对称性守恒原理。 1971年福井谦一 提出了完整的前线轨道(ontier orbital)理论。
前线轨道 (FMO)理论认为,在双分子光反应中,两 组分均为具有两个成单电子的激发态分子,单电子占据 的MO又称为SOMO,。故光照下的环加成方式为: 两组分能量较高的两个SOMO组合形成一个σ单键; 两组分能量较低的两个SOMO组合形成另一个σ单键。 两组分相互组合的SOMO必须具有相同的对称性且能量相 近才能重叠。若对称性不同则不能发生环加成反应
第九章 药物合成设计原理和方法 答案
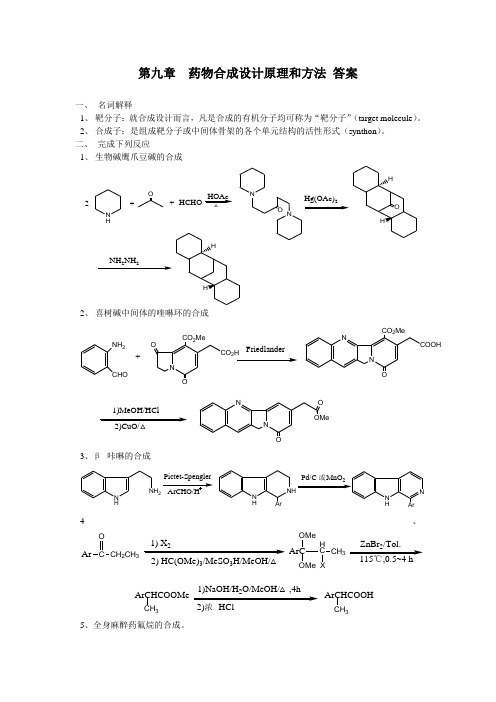
第九章 药物合成设计原理和方法 答案一、 名词解释1、 靶分子:就合成设计而言,凡是合成的有机分子均可称为“靶分子”(target molecule )。
2、 合成子:是组成靶分子或中间体骨架的各个单元结构的活性形式(synthon )。
二、 完成下列反应1、 生物碱鹰爪豆碱的合成N HOHCHOHOAcNNO 2++Hg(OAc)222、 喜树碱中间体的喹啉环的合成NH 2CHONOOCO 2MeCO 2NONO OMeNO CO 2MeCOOHN+Friedlander1)MeOH/HCl3、β- 咔啉的合成N HNH 2N HNH ArPictet-Spengler4、Ar C CH 2CH 3O22) HC(OMe)3/MeSO 3H/MeOH/△OMe OMeArCHC CH 3X2ArCHCOOMeCH 322)浓 HClCH 3ArCHCOOH5、全身麻醉药氟烷的合成。
CF2Cl CF2Zn,CH3OH40℃F2C CFCl BrF2C CHFClAlCl50℃F3C CHBrCl三、按要求完成下列化合物全合成。
1、采用逆合成分析法完成布洛芬(Ibuprofen)的逆推过程并写出合成的反应。
i-BuCOOHi-BuCOOH FGAFGIi-BuOHCNi-Bui-Bui-BuOHCNO Fci-Bu+ClOCai-BuCNEai-BuCl+NaCN i-Bu+HCHO+HCl(ZnCl2)Fb2、采用逆合成分析法完成下面化合物的逆推过程并写出合成的反应。
CHOOHCHO OH Cb CHO+HCHO(NaOH/H2O/MeOH)OHCOOH(Al(OPr)3/PhCO)(DIBAL/THF)3、采用逆合成分析法完成茉莉酮的逆推过程并写出合成的反应。
OOOC5H9OOFGA C5H9OOEtO2COCb(NaOH/H2O/EtOH)1)NaOH/H2O2)HCl/△EtO2CC5H9O+BrOX C5H9OOHC5H9O(SOCl2)NC C5H9(H2O/HCl)OH1)PBr3/Py2)NaCNCcCO2EtO+(MeONa/MaOH)4、采用逆合成分析法完成下面化合物的逆推过程并写出合成的反应。
高中化学-有机合成路线的分析与设计

有机合成路线的分析与设计一、有机合成中官能团的衍变1、官能团的引入(或转化)方法(1)引入或转化为碳碳双键的三种方法①醇的消去反应引入②卤代烃的消去反应引入③炔烃与H2、HX、X2的不完全加成反应(2)引入卤素原子的三种方法①烷烃、苯及其同系物与卤素单质发生取代反应②不饱和烃与卤素单质、卤化氢的加成反应③醇与氢卤酸的取代反应(3)引入羟基的四种方法①烯烃与水加成生成醇②卤代烃的碱性水解成醇③醛或酮与氢气加成生成醇④酯水解生成醇(4)引入醛基(或羰基)的方法①醇的催化氧化(5)引入羧基的四种方法①醛被氧化成酸②酯在酸性条件下水解③含侧链的芳香烃被强氧化剂氧化④醇被强氧化剂氧化2、官能团的保护:有机合成过程中,为了避免有些官能团发生变化,必须采取措施保护官能团,待反应完成后再使其复原。
有时在引入多官能团时,需要选择恰当的顺序保护特定官能团被保护的官能团被保护的官能团性质保护方法酚羟基易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化碳碳双键易与卤素单质加成,易被氧气、臭氧、双氧水、酸性高锰酸钾溶液氧化醛基易被氧化3、官能团的消除(1)通过加成消除不饱和键双键或三键(2)通过加成或氧化等消除醛基(—CHO)(3)通过消去、氧化、与氢卤酸取代或酯化反应等消除羟基(—OH)(4)通过水解反应消除酯基、肽键、卤素原子三、有机合成中碳骨架的衍变1、使有机物碳链增长的反应①乙炔自身加成②卤代烃与NaCN的反应③卤代烃与炔钠的反应④卤代烃和钠反应⑤醛、酮与氢氰酸的加成反应⑥醛、酮与格氏试剂反应⑦羟醛缩合反应⑧烯烃、炔烃加聚反应⑨苯环与卤代烃反应(傅克反应)⑩苯环与酰卤反应⑪缩聚反应2、使有机物碳链缩短的反应①脱羧反应②氧化反应③水解反应④烃的裂化或裂解反应3、使有机物碳链的成环的反应①二烯烃成环反应(双烯合成)②羟基酸酸的酯化成环③多元羧酸与多元醇的酯化成环④氨基酸的成环⑤二元羧酸与二氨基化合物成环⑥形成环醚4、使有机物碳链的开环的反应①环酯水解开环②环烯烃氧化开环四、有机合成路线的设计与分析1、常见有机物的转化关系2、有机合成路线设计思路3、常见的有机合成路线 (1)一元化合物合成路线:R —CH===CH 2−→−HX R —CH 2—CH 2X ∆−−−→−溶液NaOH R —CH 2—CH 2OH []−→−O R —CH 2—CHO []−→−OR —CH 2—COOH −−−−→−∆醇、浓硫酸、酯 (2)二元化合物合成路线CH 2===CH 2−→−2X CH 2X —CH 2X ∆−−−→−溶液NaOH HOH 2C —CH 2OH []−→−O OHC —CHO []−→−O HOOC —COOH −−−→−一定条件链酯、环酯、聚酯(3)芳香化合物合成路线 ①∆−−−→−溶液NaOH②光照−→−2Cl ∆−−−→−溶液NaOH −−−−→−∆醇、浓硫酸、芳香酯4、有机合成的分析方法(1)正向合成分析法: (2)逆向合成分析法: (3)正、逆合成分析:(4)逆合成分析法设计有机合成路线的思维程序(5)逆向合成分析法应用例析:利用“逆合成分析法”分析由乙烯合成草酸二乙酯的过程逆合成分析思路,概括如下 具体步骤如下5、解决有机合成题的基本步骤第一步:要正确判断合成的有机物属于何种有机物,它带有什么官能团,它和哪些知识、信息有关,它所在的位置的特点等第二步:根据现有原料、信息和有关反应规律,尽可能合理地把目标有机物解剖成若干片段,或寻找官能团的引入、转换、保护方法,或设法将各片段(小分子化合物)拼接衍变,尽快找出合成目标有机物的关键和突破点。
人教版高考化学一轮总复习精品课件 第9章 有机化学基础 作业43有机推断 有机合成路线设计

RCHClCH==CH2+HCl;
③合成反应流程图示例如下(无机试剂可任选):
A
B
C→…→H。
123456
答案
123456
解析 本题可用逆合成分析法解答,其思维过程为 ⇒……⇒中间体⇒……⇒起始原料
其逆合成分析思路为:
由此确定合成方案。
123456
4.芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一 种重要的有机化工中间体,A、B、C、D、E、F和OPA的转化关系如下所 示:
2R—C≡C—H
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是 利用Glaser反应制备化合物E的一种合成路线:
123456
写出用2-苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线。 答案
123456
解析 已知2-苯基乙醇的结构简式为
,目标产物D的结构简式为
出化合物D的4种同分异构体。
123456
本课结束
123456
(3)化合物C的结构简式是 ClCH2CH2N(CH3)2
。
(4)写出E→F的化学方程式:
+2H2
+H2O 。
123456
(5)研究小组在实验室用苯甲醛为原料合成药物N-苄基苯甲酰胺
(
)。利用以上合成线路中的相关信息,设计
该合成路线(用流程图表示,无机试剂任选)。 答案
123456
(6)写出同时符合下列条件的化合物D的同分异构体的结构简式:
NaHCO3/H2O 条件下反应得到 OHC—CHO,OHC—CHO
HOCH2—COOH,HOCH2—COOH 缩聚为
药物合成重要反应

药合名词解释和重要反应(广医药学)一、名词解释1、靶分子:(Target Molecule):就合成设计而言,凡是所需合成的有机分子均可成为“靶分子”,或者是最终产物,或者是有机合成中的某一个中间体。
2、合成子(Synthons):反合成分析时,目标分子切割成的片段(Piece)叫合成子3、逆合成分析:也称为反合成分析,即由靶分子出发,用你想切断、连接、重排和官能团互换、添加、除去等方法,将其变换成若干中间产物或原料,然后重复上述分析,直到中间体变换成所有价廉易得的和橙子等价试剂为止。
4、化学选择性:取决丁不同官能团的反应差异。
区域选择性:取决丁活性基团周围不同位置的反应性差异。
5、立体选择性:涉及产物分子的相对或绝对立体化学问题。
6、逆向切断(dis):用切断化学键的方法把靶分子骨架剖析城不同性质的合成子,成为逆向切断。
7、逆向官能团转化(con):在不改变靶分子基本骨架的前提下变换官能团的性质或所处位置的方法,包括逆向官能团转换(FGI)、逆向官能团添加(FGA)和逆向官能团除去(FGR)。
8、等价物(Equivalent):与合成子相对应的化合物。
9、切断(disconnection):目标化合物剖析的一种处理方法,想象在目标分子中有价键被打断,形成碎片,进而推出合成所需要的原料。
二、重要的化学反应(包括名解)1、卤化反应:在有机化合物分子中简历碳-卤键的反应称为卤化反应。
2、轻化反应:用轻基取代有机分子中的氢原子,包括在某些官能团或碳架上的氢原子,均称轻化反应。
3、酰化反应:在有机化合物分子中的碳、氧、氮、硫等原子上引入酰基的反应。
4、缩合反应:两个或多个有机化合物分子通过反应形成一个新的较大分子的反应或同一个分子发生分子内的反应形成新分子都可称为缩合。
5、重排反应:在同一分子内,某一原子或基团从一个原子迁移至另一个原子而形成新分子的反应。
6、氧化反应:有机物分子中氧原子的增加,氢原子的活除,或者两者兼而有之,不包括形成C-X、C-N、C-S的反应。
反合成法分析规则及基本技巧

例
例:苯基丁醇的逆合成分析:Ph-C键的切断
n Pr H C Ph OH n Pr H C+ HO 合成子 + Ph合成子
n
Pr
δ+ C Oδ-
H
PhMgBr 试剂
PhMgBr
(1)Et2O + n Pr H (2)NH4Cl
n Pr H C Ph OH
O
C-H键的切断
FGI n Pr H C Ph OH n Pr δ+ C Ph + NaBH4
基本技巧
由于切断和逆合成分析都是建立在已知反应的基础上的,因 此,必须掌握足够数量的反应,才能进行合理而有效的逆合成分 析(核心:切断) 有机分子是由碳骨架构成的,有机反应可简单分为两类:构 成碳骨架的反应和官能团转变的反应(官能团的导入、互换、和 除去) 1.构成碳骨架的反应,按成键方式和反应本质,可划分为极性 反应(亲核-亲电),自由基反应,周环反应和金属有机试剂参与 反应。 2.官能团转变:氧化反应,还原反应,取代反应,加成反应, 消除反应
逆合成分析法(反向合成法):是有机合成路线设计最简单、 最基本的方法,是产物到原料的合成分析方法。 合成路线:是从原料开始,按一定的顺序,进行一系列的反 应,最后得到指定结构产物。这一系列的反应过程通称为合成路 线。然而,在设计合成路线时,就要反其道而行之,从产物开始, 由后倒推,逐步回复,直至推出适当的原料为止(采用逆合成 法)。
R2CHO
O D-A FGA +
O
O FGA O
O CO2H FGA
O Robinson cycle O + O
CO2H
F-C
OMe O + OMe O O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
使用任何无机试剂,不必写其制法。如NaOH, HCl,KMnO4等,可直接用。 常用的简单有机化合物,如甲醛,乙醇、丙酮、 醋酸等等。若没指明要制备时,都不必写其制法。 为节省时间和篇幅,两步以上的简单反应,可合 在一个箭号上写出。但必须标明各步进行的先后 次序①,②,③等等。 若反应用到几种异构体(最好不选用此反应),应 写明分离异构体的步骤。
• (电子)接受体(Electron acceptor)[用a或A表示] • (电子)给予体(Electron donor)[缩写为d或D]
• 连接(Connection)[ 缩写为Con] • 重排(Rearrangement)[Rearr]
• 双基团均裂(Homolysis)产生自由基(free radical)[缩写r]
分子拆开的一般方法
切断技巧:
1) 从官能团处切断,以利用特殊的反应。 •2) 利用分子内在对称性或潜在的对称性切断。 •3) 利用碳杂键易于形成的特点进行切断。
•4) 在支链最多的碳原子处切断。
例1. 试设计1,3-丁二醇的合成路线
例2 试设计螺[4,5]-6-癸 酮的合成路线
例3 试设计二甲基环己基甲醇的合成路线
在醇醛缩合反应中,用碱催化,可以停留在β 羟基羰基化合物的阶段;若酸催化,就容易进一 步发生不可逆的失水反应,得到α, β-不饱和羰基 化合物。例如:
但是,碱催化下若反应条件激烈(碱太强太浓时、 温度过高等),α-碳上还有氢也会进一步失去一分 子水生成α,β-不饱和羰基化合物。
环状α,β-不饱和酮的制备反应
2. 设计合成路线的例行程序 • 认出目标分子中的官能团及其逻辑变化关系 • 依据已知的可靠方法进行切断,必要时采用 FGI使产生合适的官能团供切断。 • 必要时重复进行切断,以便获取易得的起始原 料。
• 由两种官能团结合形成的官能团,先拆为 原来的官能团。 • C-X健处,X为杂原于或官能团。 • 1,2-dis型的二基团处(n=1~6)。 • 链的分支处。 • 环内某处(因成环反应方法多)。 • 连接芳环与分子剩余部分的键。 • 邻接于羰基的键 。
例: 设计4-甲基-6-羟基-3-己烯酸甲酯的合 成路线
九、1,1-二官能团化合物的拆开
例1 试设计绿叶丁香素的合成路线
例2
设计合成路线
缩醛(酮)可用通式表示为:
例: 设计环庚酮的合成路线
十、 分子拆开法的总结
1. 应具备的基本知识 • 运用各种可靠反应的知识。 • 对各种反应机理的了解。 • 具有鉴别某些易得化合物的能力。 • 对立体化学的了解并具备立体选择性合成的必要 手段。
在甲基和羰基之间被一个或多个共扼的双键隔 开时,甲基的活性不变——“插烯规律”。例如:
多种环酮的亚甲基,也可以草酰化
甲酸酯与酮的酰化反应—脂肪酮优先发生在亚甲基上
例1 设计天然产物白屈莱酸的合成路线
例2 设计庚二酸的合成路线
例3 设计2-苯基色酮的合成路线
酯与腈缩合
(1) 乙酸乙酯与腈的缩合
2. α-羟基酮的拆开 (1) α-羟基酮的合成
(2) α-羟基酮的拆开
例1 设计2-甲基-2-羟基-5-(α-呋喃)-4-
戊烯-3-酮的合成路线
例2 设计2,5-二甲基-2,5-环氯-3-已酮的 合成路线
八、1,4-和1,6-二羰基化合物的拆开
1. 1,4-二羰基化合物的拆开 (1) 通式
例3 试设计顺-2-丁烯-1,4-二醇缩丙 酮合成路线
例4 设计1-羟基-2-炔戊基苄基醚的合成路线
四、β羟基羰基化合物和α,β-不饱和羰基 化合物的拆开 1. β-羟基羰基化合物的拆开 (1) β-羟基醛、酮的合成
乙醛碱催化的缩合反应历程
若为酮,例如丙酮
丙酮酸催化下的缩合反应历程
醛、酮的交叉缩合反应
例4 试设计4’-硝基苯基-2-甲氧基-5’-甲基苯甲 酮的合成路线
例5 试用Williamson合成法合成异丙基正丁基醚。
例6 试用四个碳以下的原料合成1,2,3,4-四氢萘合成路线
三、醇的拆开法
例1 试设计合成路线
例2 试设计3-甲基-1-苯基-2丁烯的合成路线
二、分子拆开法-“合成子法”
“分子拆开”的原理 拆开的方法
分子拆开应遵循的原则
骨架的形成 官能团的形成
• 合成子 • 合成等价物 • 反合成分析或反向合 成 • 官功能团互换 [FGI]
• 官能团加成 [FGA] • 官能团消除 [FGR]
• 切断(disconnetion)[缩 写为dis]
例3 设计β-(α-呋喃基)丙烯酸的合成路线
例4 设计的合成路线
例5 设计的合成路线
五、l,3-二羰基化合物的拆开 1. l,3-二羰基化合物的拆开
2. 1,3-二羰基化合物的合成反应
常用的也是最重要的合成方法是Claisen酯缩合 反应。反应的结果脱掉一分子醇形成β-羰基酸酯。 现在把提供酰基的化合物,如酯、酰氯、酸酐与 酯、醛酮、腈(提供α氢)的反应都称为Claisen缩合 反应。即:
合成α苯基乙酰乙酸乙酯
(2) 碳酸二乙酯与腈的缩合 这是在碱性试剂存在下,形成腈α碳 负离子进攻酯的C=O基中心,然后推 斥掉-OEt,得α羰基腈。
例: 试设计合成路线
六、1,5-二羰基化合物的拆开
1. 1,5—二羰基化合物的合成-Michael加成
若给予体中X成Y为-COOR,-COR,-CHO 或—CONH2,受体为α,β-不饱和羰基化合物,则 Michae1反应产物为1,5-二羰基化合物。例如:
例1 设计[α(1—羟基)环戊基]环戊酮的合成路线
例2 设计2-(α-环已酮)基-2-羟基二苯乙酮合成路线
例3 设计5-硝基-4-辛醇的合成路线
2. α,β-不饱和羰基化合物的拆开
(1) α,β-不饱和羰基化合物的形成 β-羟基醛酮的脱水反应: 开链α,β-不饱和羰基化合物的制备 • 易脱水的原因: ①β-羟基和羰基之间α-H受二者吸电子的影响更 为活泼。 ②脱水后形成π-π共扼体系很稳定。 • 促进脱水的原因: ①加热给以能量帮助脱水。 ②酸催化,类似醇脱水。
合成要点:
• 根据分析,写出合成计划,加上试剂和反应条件。 • 检查是否安排好一个合理的次序。 • 检查是否把化学选择性的各个方面考虑周到,避 免任何不必要的反应发生,必要时应使用保护基 或导向基。 • 根据出乎意料的失败或成功来修改计划。
(1) 臭氧化然后还原后处理
(2) 臭氧化后继续氧化处理
(3) 氧化成邻二醇及邻二醇的开裂
(4) 羟基化与二醇断裂相结合
例:设计6-苯基-6-己酮酸(6-苯基-6-氧代 已酸)的合成路线
Brich还原反应在有机合成中的应用 (1) 反应简述
• 芳环上带有卤素、硝基、醛或酮羰基等, 除了特殊要求外不能进行Birch还原。 • 酚因与金属成盐也不能进行Birch还原。 • 烷基苯、芳香羧酸、酰胺、酯、苯胺及其 衍生物、芳醚等可进行Birch还原。 • 供电子基团一般使Birch还原速度减慢,吸 电子基团一般使Birch还原加快。
Claisen—Schmidt反应
Knoevengel反应
Claisen缩合反应
Perkin反应
X=H或吸电子基,-OH,-OR、-OAc等。 所以,α,β-不饱和羰基化合物的拆开就容易理 解了。
(2) α,β-不饱和羰基化合物的拆开
例1 设计对硝基苯丙烯醛的合成路线
例2 设计合成路线
Michael反应的选择性
2-辛酮与丙烯酸乙酯的反应
2. 1,5-二碳基化合物的拆开法
例1 设计5,5-二甲基-1,3-环已二酮的合成路线
例2 设计合成路线
例3 设计9-甲基-3,5,6,7,8,9-六氢化-3 -萘酮的合成路线
例4 设计合成路线
Mannich反应及其应用
例如: 设计合成路线
先制成Mannich碱的碘化季胺盐
七、α-羟基羰基化合物的拆开
1. α-羰基酸的合成与拆开 (1) α-羰基酸的合成
(2) α-羰基酸的拆开
例1 设计2-羟基-3-异丁基丁二酸的合成路线
例2 设计1,1-二苯基-3,3-二甲基-1,2, 4—丁三醇的合成路线
例3 设计2,4,4-三甲基-6-氧代-2-派哺甲 酸的合成路线
(2) β-羟基羰基化合物的拆开法 从羰基起,将α,β-碳碳键打开,β羟基回到α碳 上,β碳恢复为原来的羰基。
在醇醛型缩合反应中,原料的一分子供给羰 基,另一分子供给活泼的α-H。但能使α-H活化 的基团,除了醛酮的碳基外,其他的强吸电子基, 如:-NO2,-CN,-CO2H,-CO2R,甚至于卤原子、不 饱和键等也有致活作用。因此,这种类型的反应, 内容很丰富,在有机合成中非常重要。例如:
第九章
有机合成设计
一、概述 1. 逆合成法的涵义及其使用
“逆合成法”简而言之就是“以退为进, 化繁为简”的合成路线设计法。
2. 合成路线的类型
骨架与官能团 骨架与官能团的类型都无变化 骨架不变,仅官能团变 骨架变而官能团不变 骨架与官能团均变
3.
原料的选择
容易得到 价格便宜 C-4以下的烷、烯、炔等链状 有机化合物 C-10以下的芳环化合物
相同酯间的Claisen酯缩合反应
若酯的碳上只有一个氢,则缩合反应不能在碱 的作用下进行。例如:
二元或多元酯的Dieckmann环化缩合反应
• Dieckmann分子内酯缩合反应是合成含五员或 六员环及其衍生物的主要方法 • Dieckmann分子内酯缩合反应实际上是在分子 内部进行的Claisen酯缩合反应 • 含有杂原子的二元羧酸酯(含α-活泼氢)也可进 行Dieckmann酯缩合反应 • 二元酸酯的α氢的活性是亚甲基大于次甲基
乙酯的合成路线
对于酮,α-H的活性为: ①α-甲基:可以被甲酸酯以外的所有酯优先酰化。 ②α-亚甲基:甲酸酯优先酰化。此外,还可以被草 酸酯、乙酸乙酯、苯甲酸乙酯和甲酯等酰化。 ③α-次甲基:很难被各种酯所酰化。
