实验五配合物的生成和性质
配合物化学-1-基础知识

第一章 基础知识
④ 配位数
配位数指中心离子所结合的配位原子的总数。
中心离子最常见的配位数一般是4和6,少数是2和8;更高配 位数的情况少见。
影响配位数的因素:
几何因素(中心离子半径、配体的大小及几何构型) 静电因素(中心离子与配体的电荷) 中心离子的价电子层结构 外界条件(浓度、温度等)
化学式
第一章 基础知识
(b)配位原子
表1-1 配位原子
C
N P As Sb
O S Se Te
H F Cl Br I
第一章 基础知识
(C)按配位原子分类的常见配体
配位原子
卤素 O
配体举例
F -,Cl - ,Br - , I H2O,OH- ,ONO-,RCOO-,C2O42-
N
C S
NH3,NO,NO2-,NH2-CH2-CH2-NH2(乙二胺)
第一章 基础知识
1 配合物的生成与发现 2 配合物的组成与结构 3 配合物的类型 4 配合物的命名
5 配位个体的立体结构
6 配合物的异构现象
第一章 基础知识
1 配合物的生成与发现
Tassaert在从事钴的重量分析的研究过程中,偶用氨水代替 氢氧化钠加入CoCl2溶液中,由于加入过量氨水后得不到他预期 的Co(0H)2沉淀,他便将所得溶液放置过夜,以待第二天继续进 行实验,在这放置过程中,有关物质间继续缓慢地反应(空气参 加了反应)。 到第二天,在该体系中出现了一种橙黄色的晶体,后来经化 学分析确定,其组成为上述的CoCl36NH3。随后又陆续制得了 CoCl35NH3(紫红色)和CoCl3· 5NH3· H2O(红色)等。这些物质在当 时被称为复杂化合物。
第一章 基础知识
【公开课课件】配合物的形成和应用

(1)下列说法正确的是 BD
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(2)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+
配离子.已知NF3与NH3的空间构型都是三角锥形,但
[AlF6]3[Fe(CN)6] 3-
[Cr(NH3)4Cl2]+的几何异构体的数目是: 2 。
Cl
+
Cl
+
H3N
NH3
H3N
Cr NH3
Cl
NH3 Cl
Cr
NH3
NH3
NH3
NH3 Pt
Cl
7. 有两种化合物,
A:CoCl3·5NH3·H2O; B:CoCl3·5NH3·H2O,根据 下面的实验结果,确定它们的络离子、中心离子和配体。
Cu2+ +4NH3 = [Cu(NH3)4]2+ 提出你的设想。
[Cu(NH3)4]2+ 的结构简式为:
NH3中的N提供孤电子 对, Cu2+提供空轨道
形成配位键。
N
2+
H3
CHu3 NH3
N N
一、配合物的形成
1、配合物: 由提供孤电子对的配位体与接受孤
电子对的中心原子以配位键结合形 成的化合物。
+
Cl
Cl Cl
Co
NH3
NH3
NH3
顺式
+ Cl
Cl H3N
Co
NH3
NH3
Cl
反式
配合物的性质
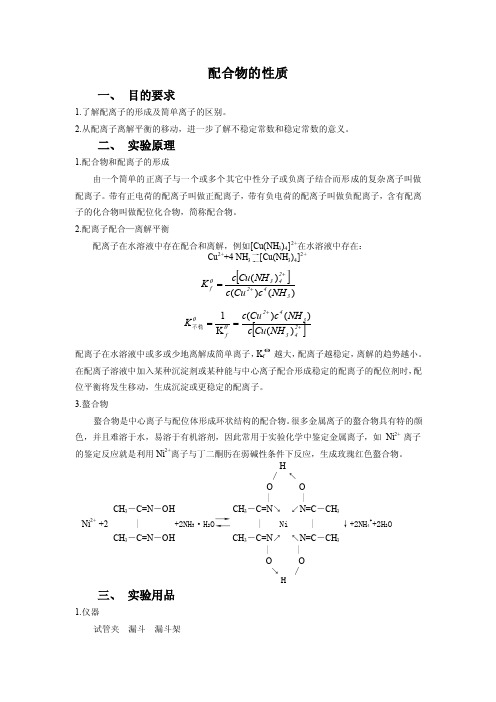
配合物的性质一、 目的要求1.了解配离子的形成及简单离子的区别。
2.从配离子离解平衡的移动,进一步了解不稳定常数和稳定常数的意义。
二、 实验原理1.配合物和配离子的形成由一个简单的正离子与一个或多个其它中性分子或负离子结合而形成的复杂离子叫做配离子。
带有正电荷的配离子叫做正配离子,带有负电荷的配离子叫做负配离子,含有配离子的化合物叫做配位化合物,简称配合物。
2.配离子配合—离解平衡配离子在水溶液中存在配合和离解,例如[Cu(NH 3)4]2+在水溶液中存在:Cu 2++4 NH 3→←[Cu(NH 3)4]2+ [])()()(342243f NH c Cu c NH Cu c K ++=θ []++==243342f NH Cu c NH c Cu c K )()()(K 1θθ不稳 配离子在水溶液中或多或少地离解成简单离子,K f θ越大,配离子越稳定,离解的趋势越小。
在配离子溶液中加入某种沉淀剂或某种能与中心离子配合形成稳定的配离子的配位剂时,配位平衡将发生移动,生成沉淀或更稳定的配离子。
3.螯合物螯合物是中心离子与配位体形成环状结构的配合物。
很多金属离子的螯合物具有特的颜色,并且难溶于水,易溶于有机溶剂,因此常用于实验化学中鉴定金属离子,如Ni 2+ 离子的鉴定反应就是利用Ni 2+离子与丁二酮肟在弱碱性条件下反应,生成玫瑰红色螯合物。
H↚ ↖O O| |CH 3-C=N -OH CH 3-C=N ↘ ↙N=C -CH 3Ni 2+ +2 | +2NH 3·H 2O →← | Ni | ↓+2NH 4++2H 2O CH 3-C=N -OH CH 3-C=N ↗ ↖N=C -CH 3| |O O↘ ↚H 三、 实验用品1.仪器试管夹 漏斗 漏斗架2.药品H2SO4 1mol·L-1,NH3·H2O 2mol·L-1、6mol·L-1,NaOH 0.1mol·L-1、2mol·L-1 ,AgNO3 0.1 mol·L-1,CuSO4 0.1 mol·L-1,HgCl2 0.1mol·L-1,KI 0.1 mol·L-1,K3[Fe(CN)6] 0.1 mol·L-1,KSCN 0.1 mol·L-1,NaF 0.1 mol·L-1,NH4F 4mol·L-1,NaCl 0.1 mol·L-1,FeCl3 0.1 mol·L-1,Na2S2O3 1 mol·L-1、饱和溶液,Ni(NO3) 2 0.1 mol·L-1,Na2S 0.1 mol·L-1,EDTA 0.1 mol·L-1,Na2CO3 0.1 mol·L-1,KBr 0.1 mol·L-1,C2H5OH 95%,CCl4,丁二酮肟试液。
实验五配合物的生成和性质

实验五配合物的生成和性质
实验五中,利用三种不同的金属离子对六碳糖醛酸进行取代反应,生成三种不同类型的配合物。
具体而言,钠离子与六碳糖醛酸作用形成了钠六碳糖醛酸,也就是“钠半乳糖”,化学式为C6H8O7Na;钙离子取代六碳糖醛酸,生成钙六碳糖醛酸,也就是“钙半乳糖”,化学式为C6H8O7Ca;镁离子取代六碳糖醛酸,生成镁六碳糖醛酸,也就是“镁半乳糖”,化学式为
C6H8O7Mg。
这三种配合物都有明显的溶解性,在水中溶解性较好,但在有机溶剂中溶解性差,而且有一定的PH敏感性,在酸性条件下便可以水解为糖原和金属离子。
实验六、配合物的生成、性质与应用

实验六、配合物的生成、性质与应用一、实验目的1、了解几种不同类型的配合物的生成,比较配合物与简单化合物和复盐的区别.2、了解影响配合平衡移动的因素。
3、了解螯和物的形成条件。
4、熟悉过滤和试管的使用等基本操作。
二、实验原理由中心离子(或原子)和一定数目的中性分子或阴离子通过形成配位共价键相结合而成的复杂结构单元称配合单元,凡是由配合单元组成的化合物称配位化合物。
在配合物中,中心离子已体现不出其游离存在时的性质。
而在简单化合物或复盐的溶液中,各种离子都能体现出游离离子的性质。
由此,可以区分出有否配合物存在。
配合物在水溶液中存在有配合平衡:M n+ + aL—→ Ml a n-a配合物的稳定性可用平衡常数KΘ稳来衡量。
根据化学平衡的知识可知,增加配体或金属离子浓度有利于配合物的形成,而降低配体或金属离子浓度有利于配合物的解离.因此,弱酸或弱碱作为配体时,溶液酸碱性的改变会导致配合物的解离。
若有沉淀剂能与中心离子形成沉淀反应,则会减少中心离子的浓度,使配合平衡朝解离的方向移动,最终导致配合物的解离。
若另加入一种配体,能与中心离子形成稳定性较好的配合物,则又可能使沉淀溶解.总之,配合平衡与沉淀平衡的关系是朝着生成更难解离或更难溶解的物质的方向移动.中心离子与配体结合形成配合物后,由于中心离子的浓度发生了改变,因此电极电势数值也改变,从而改变了中心离子的氧化还原能力。
中心离子与多基配体反应可生成具有环状结构的稳定性很好的螯和物。
很多金属螯和物具有特征颜色,且难溶于水而易溶于有机溶剂.有些特征反应长用来作为金属例子的鉴定反应.三、仪器和药品仪器:试管,试管架,离心试管,漏斗,漏斗架,白瓷点滴板,离心机,滤纸药品: 2 mol·L—1 H2SO4;2mol·L—1NH3·H2O,6mol·L—1 NH3·H2O ,0.1 mol·L-1 NaOH,2mol·L—1NaOH.0。
配合物的生成和性质 实验报告

1
实验7. 配合物的生成和性质
一、 实验目的
1. 加深理解配合物的组成和稳定性,了解配合物形成时的特性。
2. 初步学习利用配位溶解的方法分离常见混合阳离子。
3. 学习电动离心机的使用和固-液分离操作。
二、 实验原理
配位化合物与配位平衡
配位化合物的内、外层之间是靠离子键结合的,在水中是完全解离。
而配位个体在水中是部分的、分步的解离,因此就存在解离平衡。
配合物的标准平衡常数
f K ,也被称为稳定平衡常数。
f K 越大,表明配合物越稳定。
形成配合物时,常伴有溶液颜色、酸碱性、难溶电解质溶解度、中心离子氧化还原性的改变等特征。
利用配位溶解可以分离溶液中的某些离子。
三、实验内容
2
3
4
四、 注意事项
1.使用离心机时要注意安全。
2.及时记录实验过程中配合物的特征颜色。
3.节约药品,废液倒入废液缸。
五、思考题
1. 请应用“配合物的结构和性质”一章中的知识并结合实验现象,阐述实验CuSO4+NH3·H2O(过量);溶液分为2份,分别+2 mol·L-1 NaOH / 0.1mol·L-1 BaCl2的本质。
2. 如何正确使用电动离心机?
六、实验体会和建议
5。
实验五配合物的生成和性质
实验五 配合物的生成和性质一、实验目的1、了解有关配合物的生成,配离子及简单离子的区别。
2、比较配离子的稳定性,了解配位平衡与沉淀反应、氧化还原反应以及溶液酸度的关系。
二、预习提问1、 试指出硫酸铁铵和铁氰化钾哪个物质是配合物?答:铁氰化钾是配合物。
2、 Cu 2+与[Cu (NH 3)4]2+比,谁的氧化能力较强?为什么?答:Cu 2+的氧化能力较强。
因为φCu2+/Cu >φ[Cu (NH3)4]2+/Cu3、 配合物与复盐的主要区别是什么?如何判断某化合物是配合物?答:复盐是由两种或两种以上的同种晶型的简单盐类所组成的化合物,在其晶体中(或水溶液中)均只有简单的离子存在。
而配合物晶体中存在复杂的配位离子或配位分子,这些配位离子或配位分子或离子很稳定,能以独立的整体存在,根据晶体中(或水溶液中)是否含有复杂的配位离子或分子来判断某化合物是不是配合物。
三、实验原理由一个简单的正离子和几个中性分子或其它离子结合而成的复杂离子叫配离子,含有配离子的化合物叫配合物。
配离子在溶液中也能或多或少地离解成简单离子或分子。
例如:[Cu(NH 3)4]2+配离子在溶液中存在下列离解平衡:32243NH 4Cu ])NH (Cu [+⇔++)])(([)()(243342++⋅=NH Cu C NH C Cu C K d 不稳定常数K d 表示该离子离解成简单离子趋势的大小。
配离子的离解平衡也是一种化学平衡。
能向着生成更难离解或更难溶解的物质的方向进行,例如,在[Fe(SCN)]2+溶解中加入F -离子,则反应向着生成稳定常数更大的[FeF 6]3- 配离子方向进行。
螯合物是中心离子与多基配位形成的具有环状结构的配合物。
很多金属的螯合物都具有特征的颜色,并且很难溶于水而易溶于有机溶剂。
例如,丁二肟在弱碱性条件下与Ni 2+生成鲜红色难溶于水的螯合物,这一反应可作检验Ni 2+的特征反应。
四、仪器及试剂1、 仪器试管、滴定管2、 试剂HgCl 2(0.1mol ·L -1)、KI(0.1 mol ·L -1)、NiSO 4(0.2 mol ·L -1)、BaCl 2(0.1mol ·L -1)、NaOH(0.1mol ·L -1)、1:1(NH 3·H 2O)、FeCl 3(0.1mol ·L -1)、KSCN(0.1 mol ·L -1)、K 3[Fe(CN)6](0.1 mol ·L -1)、AgNO 3(0.1mol ·L -1)、NaCl(0.1 mol ·L -1)、CCl 4、FeCl 3(0.5 mol ·L -1)、NH 4F(4 mol ·L -1)、NaOH(2mol·L-1)、1:1H2SO4、HCl(浓)、NaF(0.1 mol·L-1)、CuSO4(0.1 mol·L-1)、K4P2O7(2 mol·L-1)、NiCl2(0.1 mol·L-1)、NH3·H2O(2 mol·L-1)、1%丁二肟、乙醚。
配合物的形成和应用教案(学案)
配合物的形成和应用[学习目标]1.理解配合物的概念、组成;2.掌握常见配合物的空间构型及其成因;3.掌握配合物的性质特点及应用。
[学习重、难点]配合物的空间构型、配合物的应用[课时安排]3课时[学习过程][活动及探究]:实验1:向试管中加入2mL5%的硫酸铜溶液,再逐滴加入浓氨水,振荡,观察。
现象:原理:(用离子方程式表示)实验2:取5%的氯化铜、硝酸铜进行如上实验,观察现象并分析原理。
[交流讨论] Cu2+及4 个NH3分子是如何结合生成[Cu(NH3)4]2+的?⑴ 用结构式表示出NH3及H+反应生成NH4+的过程:⑵ 试写出[Cu(NH3)4]2+的结构式:一、配位键、配合物:1、配位键:配位键是一种特殊的共价键。
成键的两个原子间的共用电子对是由一个原子单独提供的。
2、形成条件:形成配位键的条件是其中一个原子有孤电子对,另一个原子有接受孤电子对的“空轨道”。
配位键用A→B表示,A是提供孤电子对的原子,B是接受孤电子对的原子。
3、配合物:通常把金属离子或原子(称为中心原子)及某些分子或离子(称为配位体)以配位键结合形成的化合物称为配合物。
4、常见配位键的形成过程(1) NH4+ 、H3O+中配位键的形成注意:结构式中“→”表示配位键及其共用电子对的提供方式。
(2)配离子[Ag(NH3)2]+中配位键的形成在[Ag(NH3)2]+里,NH3分子中的氮原子给出孤电子对,Ag+接受电子对,以配位键形成了[Ag(NH3)2]+:[ H3N→Ag←NH3] +(3)配离子[Cu(NH3)4]2+的形成在[Cu(NH3)4]2+里,NH3分子中的氮原子给出孤电子对,Cu2+接受电子对,以配位键形成了二、配合物的组成配合物的组成包含中心原子/离子、配体和配位原子、配位数,内界和外界等。
以[Cu(NH3)4]SO4为例说明,如右图所示:配合物的内界和外界之间多以离子键结合,因而属于离子化合物、强电解质,能完全电离成内界离子和外界离子,内界离子也能电离但程度非常小,可谓“强中有弱”。
实验十一-配合物的生成、性质与应用
实验十一配合物的生成、性质和应用一、实验目的1.了解配合物的生成和组成。
2.了解配合物与简单化合物的区别。
3.了解配位平衡及其影响因素。
4.了解螯合物的形成条件及稳定性。
二、实验原理由中心离子(或原子)与配体按一定组成和空间构型以配位键结合所形成的化合物称配合物。
配位反应是分步进行的可逆反应,每一步反应都存在着配位平衡。
M+nR MR n s n [MRn] [M][R]K配合物的稳定性可由K 稳(即K s)表示,数值越大配合物越稳定。
增加配体(R)或金属离子(M)浓度有利于配合物(MRn)的形成,而降低配体和金属离子的浓度则有利于配合物的解离。
如溶液酸碱性的改变,可能引起配体的酸效应或金属离子的水解等,就会导致配合物的解离;若有沉淀剂能与中心离子形成沉淀的反应发生,引起中心离子浓度的减少,也会使配位平衡朝离解的方向移动;若加入另一种配体,能与中心离子形成稳定性更好的配合物,则同样导致配合物的稳定性降低。
若沉淀平衡中有配位反应发生,则有利于沉淀溶解。
配位平衡与沉淀平衡的关系总是朝着生成更难解离或更难溶解物质的方向移动。
配位反应应用广泛,如利用金属离子生成配离子后的颜色、溶解度、氧化还原性等一系列性质的改变,进行离子鉴定、干扰离子的掩蔽反应等。
三、仪器和试药仪器:试管、离心试管、漏斗、离心机、酒精灯、白瓷点滴板。
试药:H2SO4 (2mol·L-1)、HCl (1mol·L-1)、NH3·H2O (2, 6mol·L-1)、NaOH (0.1, 2mol·L-1) 、CuSO4 (0.1mol·L-1, 固体)、HgCl2 (0.1mol·L-1)、KI (0.1mol·L-1)、BaCl2 (0.1mol·L-1)、K3Fe (CN)6 (0.1mol·L-1)、NH4Fe (SO4)2 (0.1mol·L-1)、FeCl3 (0.1mol·L-1)、KSCN(0.1mol·L-1)、NH4F (2mol·L-1)、(NH4)2C2O4(饱和)、AgNO3 (0.1mol·L-1)、NaCl (0.1mol·L-1)、KBr (0.1mol·L-1)、Na2S2O3 (0.1mol·L-1,饱和)、Na2S (0.1mol·L-1)、FeSO4 (0.1mol·L-1)、NiSO4 (0.1mol·L-1) 、CoCl2 (0.1mol·L-1)、CrCl3 (0.1mol·L-1)、EDTA(0.1mol·L-1)、乙醇(95%)、CCl4、邻菲罗啉(0.25%)、二乙酰二肟(1%)、乙醚、丙酮。
配位化合物的生成和性质
实验七 配位化合物的生成和性质一、配离子和简单离子性质比较:1、2+-2Hg + 2OH = HgO + H O ↓黄 2+-2-2-24Hg + 2I = HgI HgI + 2I = [HgI ]↓红色沉淀 无色溶液2、硫酸亚铁铵(FeSO 4)2-22223Fe + 2OH = Fe(OH)4Fe(OH)+ O + 2H O = 4Fe(OH)+↓↓白棕3、气室法测铵离子:+-432NH + OH = NH + H O pH ↑湿润试纸变蓝(碱性)二、配位平衡的移动:1、-34n3+--43+-3n [FeCl ][FeSCN]Fe 4Cl = [FeCl ] Fe + nSCN = [FeSCN] (n = 1-6) Fe K K K n n --+3-63+-3-6稳稳稳[FeF ]蓝绿色溶液血红色 + 6F = [FeF ] 无色< <2+2-43+-3nCo + 4SCN- = [Co(SCN )] Fe + nSCN = [FeSCN] (n = 1-6) n-蓝色血红色2、 3---63[FeF ] + 3OH = Fe(OH) + 6F 褐色沉淀3++4224243243243-+3+243224Fe + 3(NH )C O +3H O = (NH )[Fe(C O )]3H O + 3NH [Fe(C O )] + 6H = Fe + 3H C O 淡黄绿色棕黄这个方程式错了,在前面加上6个氰酸根,后面加上氰酸铁(一个铁6个氰酸根)带3歌负电荷,吧3价铁离子删掉,颜色为血红色。
3、 +--+332+3232-3-232323--2-23223Ag + Cl = AgCl AgCl +NH =Cl + Ag(NH )]Ag(NH )] + Br- = AgBr + 2NH AgBr +S O = [Ag(S O )] [Ag(S O )] + I = AgI + 2S O ↓↓↓白2 [[淡黄无色溶液黄4、3+-2+2Fe Fe + 2I = 2Fe + I 3+-3-6 + 6F = [FeF ] 无色2棕黑KI 浓度高时为棕黑色,浓度低时为紫红色2+3+-24--3-266I + 2Fe = 2Fe + 2I I + 2[Fe(CN)] = 2I + 2[Fe(CN)]⨯3+2+2+4+2Fe + Sn = 2Fe + Sn 三、配合物生成:3+-242+- 2-42242+2--22433442+2-442+2-+3442+- 2-344NH H O NH + OH 2Cu + 2OH + SO = [Cu (OH)]SO [Cu (OH)]SO + 8NH = 2[Cu(NH )] + SO + 2OH Ba + SO = BaSO [Cu(NH )] + S = CuS + 4NH [Cu(NH )] + 2OH + SO ⋅↓↓↓浅蓝深蓝溶液白黑224322424= [Cu (OH)]SO + 8NH [Cu (OH)]SO 2CuO + H SO ∆↓↑−−→ 黑四、螯合物生成: 1、2+- 22+-2334Ni + 2OH = Ni(OH) Ni(OH) + 4NH = [Ni(NH )]+ 2OH ↓浅绿蓝紫丁二酮肟镍 鲜红色沉淀2、 Fe(SCN)3-63- 血红 → [FeF 6]3- 无色 → [Fe(EDTA)]- 黄五、配合物的水合异构现象略。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验五 配合物的生成和性质
一、实验目的
1、了解有关配合物的生成,配离子及简单离子的区别。
2、比较配离子的稳定性,了解配位平衡与沉淀反应、氧化还原反应以及溶液酸度的关系。
二、预习提问
1、 试指出硫酸铁铵和铁氰化钾哪个物质是配合物?
答:铁氰化钾是配合物。
2、 Cu 2+与[Cu (NH 3)4]2+比,谁的氧化能力较强?为什么?
答:Cu 2+的氧化能力较强。
因为φCu2+/Cu >φ[Cu (NH3)4]2+/Cu
3、 配合物与复盐的主要区别是什么?如何判断某化合物是配合物?
答:复盐是由两种或两种以上的同种晶型的简单盐类所组成的化合物,在其晶体中(或水溶液中)均只有简单的离子存在。
而配合物晶体中存在复杂的配位离子或配位分子,这些配位离子或配位分子或离子很稳定,能以独立的整体存在,根据晶体中(或水溶液中)是否含有复杂的配位离子或分子来判断某化合物是不是配合物。
三、实验原理
由一个简单的正离子和几个中性分子或其它离子结合而成的复杂离子叫配离子,含有配离子的化合物叫配合物。
配离子在溶液中也能或多或少地离解成简单离子或分子。
例如:
[Cu(NH 3)4]2+配离子在溶液中存在下列离解平衡:
32243NH 4Cu ])NH (Cu [+⇔++
)])(([)()(243342++⋅=NH Cu C NH C Cu C K d 不稳定常数K d 表示该离子离解成简单离子趋势的大小。
配离子的离解平衡也是一种化学平衡。
能向着生成更难离解或更难溶解的物质的方向进行,例如,在[Fe(SCN)]2+溶解中加入F -离子,则反应向着生成稳定常数更大的[FeF 6]3- 配离子方向进行。
螯合物是中心离子与多基配位形成的具有环状结构的配合物。
很多金属的螯合物都具有特征的颜色,并且很难溶于水而易溶于有机溶剂。
例如,丁二肟在弱碱性条件下与Ni 2+生成鲜红色难溶于水的螯合物,这一反应可作检验Ni 2+的特征反应。
四、仪器及试剂
1、 仪器
试管、滴定管
2、 试剂
HgCl 2(0.1mol ·L -1)、KI(0.1 mol ·L -1)、NiSO 4(0.2 mol ·L -1)、BaCl 2(0.1mol ·L -1)、NaOH(0.1mol ·L -1)、1:1(NH 3·H 2O)、FeCl 3(0.1mol ·L -1)、KSCN(0.1 mol ·L -1)、K 3[Fe(CN)6](0.1 mol ·L -1)、AgNO 3(0.1mol ·L -1)、NaCl(0.1 mol ·L -1)、CCl 4、FeCl 3(0.5 mol ·L -1)、NH 4F(4 mol ·L -1)、
NaOH(2mol·L-1)、1:1H2SO4、HCl(浓)、NaF(0.1 mol·L-1)、CuSO4(0.1 mol·L-1)、K4P2O7(2 mol·L-1)、NiCl2(0.1 mol·L-1)、NH3·H2O(2 mol·L-1)、1%丁二肟、乙醚。
五、实验内容
1、配离子的生成与配合物的组成
(1)在试管中加入0.1 mol·L-1HgCl2溶液10滴(极毒!),再逐滴加入0.1 mol·L-1KI溶液,观察红色沉淀的生成。
再继续加入KI溶液,观察沉淀的溶解。
反应式:HgCl2+2KI=HgI2↓+2KCl
HgI2+2KI=K2[HgI4]
(1)在2只试管中分别加入0.2 mol·L-1NiSO4溶液10滴,然后在这2只试管中分别加
入0.1 mol·L-1BaCl2溶液和0.1 mol·L-1NaOH溶液,
反应式:NiSO4+BaCl2= Ba SO4↓+NiCl2
NiSO4+2NaOH= Ni(OH)2↓+Na2SO4
在另一只试管中加入0.2 mol·L-1NiSO4溶液10滴,逐滴加入1:1NH3·H2O,边加边振荡,待生成的沉淀完全溶解后,再适当多加些氨水。
然后将此溶液分成两份,分别加入0.1 mol·L-1BaCl2溶液和0.1 mol·L-1溶液。
两支试管中均无现象。
反应式:NiSO4+2NH3∙H2O= (NH4)2 SO4+Ni(OH)2↓
Ni2++6NH3 = [Ni(NH3)6]2+
2、简单离子和配离子的区别
在试管中加入0.1 mol·L-1FeCl3溶液,加入少量KSCN溶液,溶液变红,
方程式为:Fe3++SCN—=[Fe(SCN)]2+
以0.1 mol·L-1K3[Fe(CN)6]溶液代替FeCl3溶液做同样实验,无任何现象,
方程式为:K3[Fe(CN)6]= 3K++Fe(CN)63—
3、配位平衡的移动
(1)配位平衡与沉淀反应:
在试管中加入0.1 mol·L-1 AgNO3溶液,滴加0.1 mol·L-1NaCl溶液,观察现象;然后加入过量的氨水,观察现象,写出反应式,并解释之。
现象:有AgCl白色沉淀,加入NH3∙H2O后沉淀溶解。
反应式:Ag++Cl-= AgCl ↓
AgCl+2NH3= Ag(NH3)2++Cl—
(2)配位平衡与氧化还原反应:
在试管中加入0.5 mol·L-1FeCl3溶液,滴加0.1 mol·L-1KI溶液,然后加入CCl4,振荡后观察CCl4层颜色。
解释现象,并写出有关反应式。
现象:CCl4层溶入碘后变红,2Fe3++2I—=2Fe2++I2
在另一支盛有0.5 mol·L-1FeCl3溶液的试管中,先逐滴加入4 mol·L-1NH4F溶液变为无色,再加入0.1 mol·L-1KI溶液和CCl4。
振荡后,观察CCl4层的颜色,解释之,并写出有关的反应式。
现象:CCl4层为无色透明溶液,无碘生成。
反应式:Fe3++6F—=FeF63—
(2) 配位平衡与介质的酸碱性 :
在试管中加入0.5 mol ·L -1 FeCl 3溶液10滴,逐滴加入0.4 mol ·L -1NH 4F 溶液,呈无色。
将此溶液分成两份,分别滴加2 mol ·L -1NaOH 溶液和1:1H 2SO 4溶液,观察现象,并写出有关化学反应方程式。
化学反应方程式:Fe 3++6F —=FeF 63—
FeF 63—加入NaOH 后有棕黄色絮状沉淀生成,反应方程式:
Fe 3++3OH —= Fe(OH)3 ↓
FeF 63—⇔
Fe 3++6F — 平衡右移。
FeF 63—加入H 2SO 4后变黄色, F —+H +=HF FeF 63—⇔
Fe 3++6F — 平衡右移。
(3) 配离子的转化
往一支试管中加入2滴0.1 mol ·L -1FeCl 3溶液,加水稀释至无色,加入1-2滴0.1 mol ·L -1KSCN 溶液,再逐滴加入0.1 mol ·L -1NaF 溶液,观察现象并解释之。
Fe 3++SCN —=[Fe (SCN )]2+
Fe 3++6F —=FeF 63— [Fe (SCN )]2+⇔Fe 3++SCN —
平衡右移,颜色褪去。
4、螯合物的形成
(1)往试管中加入约1mL 0.1 mol ·L -1CuSO 4溶液,然后逐滴加入2 mol ·L -1K 4P 2O 7溶液,先生成浅蓝色的焦磷酸铜沉淀。
继续加入K 4P 2O 7溶液,沉淀又溶解,生成深蓝色透明溶液。
2Cu 2++ P 2O 74—= Cu 2P 2O 7↓
Cu 2 P 2O 7+ P 2O 74—=2 CuP 2O 72—
(2)往试管中加入2滴0.1 mol ·L -1NiCl 2溶液及约1mL 蒸馏水,再加入1-2滴2 mol ·L -1氨水溶液,使呈碱性。
然后加入2-3滴1%丁二肟溶液,观察生成的鲜红色沉淀。
最后加入1mL 乙醚,振荡,观察现象。
现象:鲜红色沉淀溶入乙醚溶液。
六、思考题
总结本实验观察到的现象,说明配离子和简单离子的区别以及影响配位平衡的因素有哪些?。
