对生产企业采购一次性医疗器械和器具证件审核表
《医疗器械生产企业许可证》现场审查标准汇总

《医疗器械生产企业许可证》现场审查标准一、一般要求(一)根据《医疗器械监督管理条例》、《医疗器械生产监督管理办法》,结合现场审查的实际情况,特制定本标准。
(二)本标准适用于对新开办企业申办《医疗器械生产企业许可证》、《医疗器械生产企业许可证》生产地址和生产范围变更以及《医疗器械生产企业许可证》换证的现场审查。
医疗器械生产企业日常监督管理可参照执行本标准。
(三)生产企业现场审查按《〈医疗器械生产企业许可证〉现场审查评分表》进行,审查评分表分为5个部分,其中否决条款5项。
评分条款总分为300分,各部分内容和分值为:1.人员资质70分2.场地80分3.法规及质量管理文件40分4.生产能力40分5.检验能力70分(四)合格标准:“否决条款”一项不合格,即为本次审查不合格;“否决条款”全部合格且各部分的得分率均达到80%以上为合格;“否决条款”全部合格且各部分的得分率均达到60%以上,但其中一部分或几部分的得分率不足80%的,要求企业整改并对整改情况进行复查,复查仍不合格的,即为本次审查不合格;“否决条款”全部合格但有一部分或几部分的得分率不足60%的,即为本次审查不合格。
二、评分方法(一)按审查评分表中审查方法评分。
扣分时,最多至本项分数扣完为止。
(二)按评分通则评分。
评分不宜量化的条款,按评分通则打分。
实得分等于每项规定满分乘以得分系数。
得分系数及含义:1.0 全面达到规定要求;0.8 执行较好,但仍需改进;0.7 基本达到要求,部分执行较好;0.6 基本达到要求;0.5 已执行,但尚有一定差距;0.0 未开展工作。
(三)缺项(条)的处理:缺项(条)指由于产品管理类别而出现的合理缺项(条)。
缺项(条)不记分,计算得分率时,从该项(条)标准总分中减去缺项(条)应得分。
计算公式为:得分率=实得分/(该部分总和-缺项分)×100%(四)现场审查记录中的“合计”应包括总实得分及总得分率。
总实得分为各部分实得分和,总得分率=总实得分/总分三、审查结论现场审查后,应及时填写现场审查记录。
医疗器械经营企业记录表格验收用完整版
专业资料
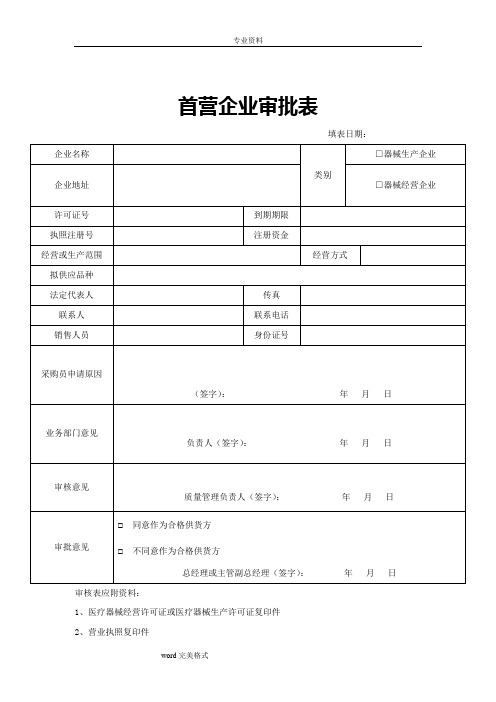
首营企业审批表
填表日期:
审核表应附资料:
1、医疗器械经营许可证或医疗器械生产许可证复印件
2、营业执照复印件
专业资料
3、委托书原件
首营品种审批表
编号:
注:附医疗器械生产/经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
验收单
日期:页次:质检部:
在库养护、检查表日期:页次:养护:
不合格品处理记录表
不合格医疗器械报损审批表
退回产品记录
日期:页次:质检部:
质量信息汇总表
质量问题追踪表
不良事件报告记录
质量事故报告记录
质量查询、投诉的报告处理记录
(反馈信息单)
方法:□信函□电话□附送样品□其他序号:年月日
质量(管理)档案
年至____ __
用户反馈质量记录
质量信息汇总表
退货记录
日期:页次:质检部:
质量事故报告记录
不良事件报告记录
质量问题跟踪表
设施和设备及定期检查、维修、保养档案
计量器具管理档案
用户档案
年度培训记录表
员工健康检查档案
质量管理制度执行情况检查和考核记录
记录表格目录
记录表格目录
医疗器械采购记录
供货单位:购进日期:年月日编号:
word完美格式
word完美格式
购货人:医疗器械召回情况记录表
word完美格式医疗器械销售记录表
word完美格式。
关于印发《一次性使用无菌医疗器械产品(注、输器具)生产实施细则》(2001年修订)的通知

关于印发《一次性使用无菌医疗器械产品(注、输器具)生产实施细则》(2001年修订)的通知各省、自治区、直辖市药品监督管理局:根据《医疗器械监督管理条例》、《医疗器械生产企业监督管理办法》和《一次性使用无菌医疗器械监督管理办法》的有关规定,我局组织制定的《一次性使用无菌医疗器械产品(注、输器具)生产实施细则》(2001年修订)已经局领导审查同意,现予印发,自2001年8月1日起施行。
2000年10月16日国家药品监督管理局印发的《一次性使用输液器系列产品生产许可证换(发)证实施细则》(国药监械[2000]483号)同时废止。
特此通知附件:一次性使用无菌医疗器械产品(注、输器具)生产实施细则(2001年修订)略国家药品监督管理局二零零一年六月二十日附件:一次性使用无菌医疗器械产品(注、输器具)生产实施细则(2001年修订)1 总则1.1根据《医疗器械监督管理条例》、《医疗器械生产企业监督管理办法》和《一次性使用无菌医疗器械监督管理办法》的有关规定,依据《无菌医疗器具生产管理规范》标准,特制定《一次性使用无菌医疗器械产品(注、输器具)生产实施细则》(以下简称《细则》)。
1.2本《细则》所指一次性使用无菌医疗器械产品(注、输器具)包括:一次性使用无菌注射器、一次性使用输液器、一次性使用输血器、一次性使用静脉输液针、一次性使用无菌注射针。
1.3本《细则》适用于上述产品的生产企业申请生产企业许可证和产品注册证,以及换证复查、监督检查、年检对企业生产条件的检查评定。
对其它实施重点管理的一次性使用无菌医疗器械生产企业,其生产条件的检查评定可参照本《细则》执行。
2 监督管理部门和检验单位2.1国家药品监督管理局负责核发《医疗器械产品注册证》,省级药品监督管理局负责核发《医疗器械生产企业许可证》,并共同实施对取证企业的监督管理工作。
各级药品监督管理局在接受企业申报时,应执行国务院经济综合管理部门制订的医疗器械产业政策。
医疗器械生产企业许可证现场审查评分表

《医疗器械生产企业许可证》现场审查评分表产12.1 厂区内生产环境应整洁、厂区周边环境不应对生产过程和产品质量造成阻碍;生产、行政、生活和辅助区布局合理。
12.2 生产、研发、检验等区域应相互分开。
13.1 仓储区要与生产规模相习惯,各个区域应划分清晰。
13.2 所有物料的名称、批号、有效期和检验状态等标识必须明确。
13.3 台帐应清晰明确,帐、卡、物应一致。
14.1 仓储区域应保持清洁、干燥和通风,并具备防昆虫、其他动物和异物混入的措施。
14.2 对各类物料的仓储环境及操纵应符合规定的储存要求,并定期监测。
冷藏条件应符合生产要求并定期监测。
15.1 %易燃、易爆、有毒、有害、具有污染性或传染性、具有生物活性或来源于生物体的物料的存放应符合国家有关规定。
15.2 以上物料应做到专区存放并有明显的识别标识,应由专门人员负责保管和发放。
16 生产过程中所涉及的化学、生物及其他危险品,企业应列出清单,并制定相应的防护规程,其环境、设施与设备应符合国家有关安全规定。
17 生产区应有与生产规模相习惯的面积和空间用以安置设备、器具、物料,并按照生产工艺流程明确划分各操作区域。
18.1 厂房应按生产工艺流程及生产所要求的空气洁净级别进行合理布局,同一厂房内及相邻厂房间的生产操作不得相互干扰。
18.2 厂房与设施不应对原材料、半成品和成品造成污染或潜在污染。
19% 部分或全部工艺环节对生产环境有空气净化要求的体外诊断试剂产品的生产应明确规定空气净化等级,生产厂房和设施应符合本细则附录A《体外诊断试剂生产用净化车间环境与操纵要求》20.1 生产环境没有空气净化要求的体外诊断试剂产品,应有防尘、通风、以及防蝇、蚊、蟑螂、鼠和防异物混入等措施;生产场地的地面应便于清洁,墙、顶部应平坦、光滑,无颗粒物脱落;操作台应光滑、平坦、无缝隙,便于清洗、消毒,不应使用木质或油漆台面。
20.2 生产环境没有空气净化要求的体外诊断试剂产品,应人流物流分开,人员进入生产车间前应有换鞋、更衣、洗手等设施;应配备适当的消毒设施,并对生产区域进行定期清洁、清洗和消毒,应对生产车间的温湿度进行操纵。
医疗器械质量体系内部审核表

1、查看担任企业质量管理及经营等上述关键岗位人 员的劳动合同、简历、学历或者职称、职业资质证明 文件和培训记录,确认企业质量管理、经营等关键岗 位人员资格是否符合上述适用要求;是□ 否□
(六)负责医疗器械质量投诉和质量事故的调查、处理及报告;
(七)组织验证、校准相关设施设备;
(八)组织医疗器械不良事件的收集与报告;
(九)负责医疗器械召回的管理;
(十)组织对受托运输的承运方运输条件和质量保障能力的审核;
(十一)组织或者协助开展质量管理培训;
(十二)其他应当由质量管理机构或者质量管理人员履行的职责。
疗器械岗位的人员至少每年进行一次健康查看,身体 条件不符合相应岗位要求的,不得从事相关工作;
医疗器械质量管理体系内部审核记录表
编号
早下
条款
内容
评审内容及方法
检查结果
整改要求
所属部门
人员 与 培训
3.15
明确口 不明确口
2、抽查相关岗位人员体检报告或健康证明,确认企 业是否按规定对相关人员进行健康检查并建立员工 健康档案。是口 否口
X2.9.2
企业应当建立并执行进货查验制度。
查看进货查验记录制度的内容,并确认是否按照规定 进行购进和验收
是口 否口
X2.9.3
从事第二类、第三类医疗器械批发业务以及第三类医疗 器械零售业务的经营企业应当建立销售记录制度。
1、查看销售记录制度的内容及规定是否齐全;
是口 否口
2、抽查经营过程的销售记录,确认是否按规定建立 并执行销售记录制度。
一次性使用医疗器械和器具的管理制度

一次性使用医疗器械和器具的管理制度1、医院所用一次性使用医疗用品必须符合国家规定的准入要求,由医院采购部门统一集中采购,任何科室和个人不得私自采购和使用。
科室开展新项目所需引进的设备、材料等,必须事先向主管部门申报,提交医院感染管理委员会审核,经分管院长或医疗机构负责人批准后由采购部门集中办理。
2、医院采购一次性使用无菌医疗用品必须从取得有关证件的单位购进,购买前必须索取相关证件.3、采购部门必须对每次购置的产品进行质量验收,订货合同、发货地点及货款汇寄账号应与生产企业(经营企业)相一致,并查验每箱产品的同批产品检验合格证、生产日期、消毒或灭菌日期及产品标识和失效期;进口的一次性导管等无菌医疗用品应有灭菌日期和失效期等中文标识。
4、采购部门有专人负责建立登记账册,记录每次订货与到货的时间、生产厂家、供货单位、产品名称、数量、规格、单价产品批号、消毒或灭菌日期、失效期、出厂日期、供需双方经办人姓名等资料,以备查验。
5、一次性使用无菌医疗用品应统一存放,专人保管。
物品存放阴凉干燥、通风良好的物架上,距地面≥20cm,距墙壁≥5cm;距屋顶≥50cm,不得将包装破损、失效、霉变的产品发放至科室。
6、科室使用前应检查小包装有无破损、失效、产品有无不洁净等。
对不合格产品或质量可疑产品应立即停止使用,及时报告采购部门和医院感染管理部门,由采购部门报告当地药监管理部门,不得作自行退货、换货处理。
7、使用中若发生热原反应、感染及其它异常情况时,必须及时留取样本送检,按规定详细记录,报告医院感染管理科、药剂科和采购部门及时处理。
8、一次性使用注射器、输液(血)器、输液针、静脉留置针等,应由供应室从消毒药械管理部门领取后全院统一发放与管理,各科室使用后按感染性、损伤性医疗废物的管理要求进行处置。
9、一次性血液透析器、介入导管等不得重复使用。
使用后按感染性、损伤性医疗废物的管理要求进行处理.10、医院感染管理部门须履行对一次性使用无菌医疗用品的采购、使用、储存和回收处理的监督检查职责,每季度检查至少一次.加强对临床、医技科室等使用中的消毒药械和器具的监督检查,确保消毒产品使用安全。
医疗器械经营企业记录表格(质量记录表格)
医疗器械质量信息反馈单编号: 反馈部门:
首营企业审批表
审核表应附资料:
1.医疗器械经营许可证或医疗器械生产许可证(复印件加盖红章)。
2.营业执照、税务登记证、组织机构代码证(复印件加盖红章)。
3.授权委托书原件。
首营品种审批表
编号:
注: 附医疗器械生产/经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
医疗器械购进记录
医疗器械退货记录表
医疗器械入库验收单
医疗器械拒收单
医疗器械养护、检查表
医疗器械养护处理记录
医疗器械质量复检通知单
医疗器械质量查询函
近效期医疗器械预警表
医疗器械客户资格审核表
医疗器械销售记录表
医疗器械产品出库复核记录
医疗器械售后服务记录
质量问题追踪表
医疗器械产品质量查询、投诉记录表
医疗器械用户访问处理意见表
质量事故报告单
质量事故确认处理记录表
可疑医疗器械不良事件报告表
医疗器械销售退回申请单
医疗器械退回验收记录
医疗器械退回记录
医疗器械召回事件报告表补救无害化处理销毁
医疗器械召回计划实施情况报告
报告单位: (盖章)负责人: (签字)报告人: (签字)报告日期: 不合格品医疗器械确认表
不合格医疗器械报损审核表
不合格医疗器械产品处理记录表
不合格医疗器械销毁记录表
医疗器械培训计划表
年度培训记录表
年度体检汇总表档案
医疗器械员工健康档案表
医疗器械设施设备一览表
质量管理制度执行情况自查考试记录。
医疗器械生产许可证现场审查标准
《医疗器械生产企业许可证》现场审查标准说明一、一般要求(一)根据《医疗器械监督管理条例》、《医疗器械生产监督管理办法》,结合现场审查的实际情况,特制定本标准。
(二)本标准适用于对新开办企业申办《医疗器械生产企业许可证》、《医疗器械生产企业许可证》生产地址和生产范围变更以及《医疗器械生产企业许可证》换证的现场审查。
医疗器械生产企业日常监督管理可参照执行本标准。
(三)生产企业现场审查按《〈医疗器械生产企业许可证〉现场审查评分表》进行,审查评分表分为5个部分,其中否决条款5项。
评分条款总分为300分,各部分内容和分值为:1.人员资质70分2.场地80分3.法规及质量管理文件40分4.生产能力40分5.检验能力70分(四)合格标准:“否决条款”一项不合格,即为本次审查不合格;“否决条款”全部合格且各部分的得分率均达到80%以上为合格;“否决条款”全部合格且各部分的得分率均达到60%以上,但其中一部分或几部分的得分率不足80%的,要求企业整改并对整改情况进行复查,复查仍不合格的,即为本次审查不合格;“否决条款”全部合格但有一部分或几部分的得分率不足60%的,即为本次审查不合格。
二、评分方法(一)按审查评分表中审查方法评分。
扣分时,最多至本项分数扣完为止。
(二)按评分通则评分。
评分不宜量化的条款,按评分通则打分。
实得分等于每项规定满分乘以得分系数。
得分系数及含义:全面达到规定要求;执行较好,但仍需改进;基本达到要求,部分执行较好;基本达到要求;已执行,但尚有一定差距;未开展工作。
(三)缺项(条)的处理:缺项(条)指由于产品管理类别而出现的合理缺项(条)。
缺项(条)不记分,计算得分率时,从该项(条)标准总分中减去缺项(条)应得分。
计算公式为:得分率=实得分/(该部分总和-缺项分)×100%(四)现场审查记录中的“合计”应包括总实得分及总得分率。
总实得分为各部分实得分和,总得分率=总实得分/总分三、审查结论现场审查后,应及时填写现场审查记录。
医疗器械供应商及采购商资质审查制度
医疗器械供应商及采购商资质审查制度为了更好地加强对医疗器械的采购管理及销售管理和对医疗器械供应商、采购商的资质审核,特制定本制度。
1、医疗器械供应商的审核1.1、在医疗器械的招标、谈判的采购过程中需认真审查供应商的资质和信誉,审核时不仅要检查证件的合法性,还要注意证件的有效性,要求供货商在资质证明的复印件上加盖供方印章。
需要审核的主要证件有:1.1.1、营业执照1.1.2、医疗器械经营企业许可证1.1.3、医疗器械生产企业许可证1.1.4、医疗器械注册证及附件(医疗器械注册登记表)1.1.5、中国国家强制性产品认证证书1.1.6、消毒剂和消毒器械卫生许可批件1.1.7、委托销售授权书1.2、平时要加强与供应商的沟通和了解,不定期的对供应商的资质和信誉进行评价。
发现供应商有资质、财务、供货和产品等问题时要及时向上级领导汇报,及时采取必要的措施,避免使我司的工作受到不利的影响或损失。
1.3、购进医疗器械前必须对供方的资质进行审核,审核合格后方可采购。
资质不合格的供应商不得列入合格供应商目录。
1.4、资质审核包括供方的供货资质,经营范围、相关产品的授权声明、注册证书、合格证明等符合有关规定的有效证明文件,相关证件内容必须齐全有效。
1.5、列入合格供应商目录的供方资质有效期为一年,下一年度招标时必须重新审核。
1.6、定期对供方进行评价,并根据评价结果,做出相应的处置。
1.7、评价的内容应包括供方的供货情况、临床的使用情况,供方的售后情况等。
1.8、评价不合格的应取消供方的合格供货商资格。
必要时做出相应的处罚。
2、采购商审核2.1、公司要依法将产品销售给具有合法资质的单位,不得向证照不齐全的单位和个人销售产品。
2.2、购销部开发的客户要收集客户资质证明,填写《客户资格审核表》,然后交由质管负责审核,经质量负责人批准方可销售。
购销部还要对其商业信誉、合同承付能力等进行调查、评价和验证。
2.3、对前来购产品的客户,开票员要先审查该单位是否进入公司“合法销售客户一览表”内,否则令其到购销部进行“销售客户审核程序‘进行审核,审核合格后,方可开票销售。
一次性使用医疗器械和器具的管理制度
供应商选择: 对供应商进
采购合同:与 供应商签订采 购合同,明确 采购物品的规 格、质量、数 量、价格、交 货时间等条款
采购物品验收: 对采购物品进 行验收,确保 符合质量标准
和采购要求
验收标准
检查产品外观、包装、标识 等是否符合相关标准和规定。
保管规定
存储环境要求: 温度、湿度、 清洁度等需符 合医疗器械的
特性要求。
存储方式:分 类、分批、分 区域存储,避 免混放和交叉
污染。
存储期限:根 据医疗器械的 有效期和存储 条件确定,定 期进行质量检
查。
出入库管理: 建立严格的出 入库登记制度, 确保医疗器械 的数量、规格、 批号等信息准
确无误。
THEME TEMPLATE
20XX/01/01
一次性使用医 疗器械和器具
的管理制度
单击此处添加副标题
汇报人:
目录
CONTENTS
一次性使用医疗器械和器具的定义与 分类
管理制度的制定与实施
采购与验收
存储与保管
使用与废弃处理
监督与检查
一次性使用医疗器械和器 具的定义与分类
章节副标题
定义
一次性使用医 疗器械和器具 是指仅供一次 性使用于人体 的医疗器械和
定期检查
存储与保管过程中,应定期对一次性使用医疗器械和器具进行检查,确保其完好无损。 检查内容包括外观、性能、有效期等方面,发现问题应及时处理。 定期检查应做好记录,以便追溯和核查。 定期检查应由专人负责,并确保检查过程的规范性和科学性。
使用与废弃处理
章节副标题
使用规定
一次性使用医疗器 械和器具必须经过 严格消毒,确保无 菌状态。
添加标题
