206食品化学实验指导
食品化学实验指导
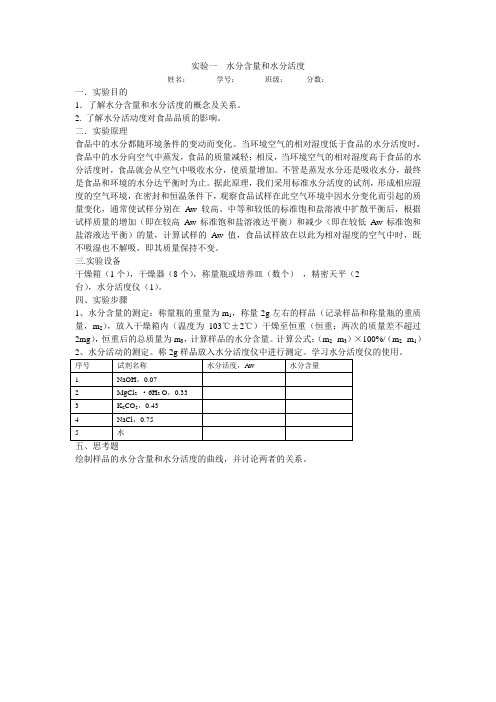
实验一水分含量和水分活度姓名:学号:班级:分数:一.实验目的1.了解水分含量和水分活度的概念及关系。
2. 了解水分活动度对食品品质的影响。
二.实验原理食品中的水分都随环境条件的变动而变化。
当环境空气的相对湿度低于食品的水分活度时,食品中的水分向空气中蒸发,食品的质量减轻;相反,当环境空气的相对湿度高于食品的水分活度时,食品就会从空气中吸收水分,使质量增加。
不管是蒸发水分还是吸收水分,最终是食品和环境的水分达平衡时为止。
据此原理,我们采用标准水分活度的试剂,形成相应湿度的空气环境,在密封和恒温条件下,观察食品试样在此空气环境中因水分变化而引起的质量变化,通常使试样分别在Aw较高、中等和较低的标准饱和盐溶液中扩散平衡后,根据试样质量的增加(即在较高Aw标准饱和盐溶液达平衡)和减少(即在较低Aw标准饱和盐溶液达平衡)的量,计算试样的Aw值,食品试样放在以此为相对湿度的空气中时,既不吸湿也不解吸,即其质量保持不变。
三.实验设备干燥箱(1个),干燥器(8个),称量瓶或培养皿(数个),精密天平(2台),水分活度仪(1)。
四、实验步骤1、水分含量的测定:称量瓶的重量为m1,称量2g左右的样品(记录样品和称量瓶的重质量,m2),放入干燥箱内(温度为103℃±2℃)干燥至恒重(恒重:两次的质量差不超过2mg),恒重后的总质量为m3,计算样品的水分含量。
计算公式:(m2- m3)×100%/(m2- m1)五、思考题绘制样品的水分含量和水分活度的曲线,并讨论两者的关系。
实验二、油脂氧化酸败一.实验目的1.了解油脂酸败的概念及机理。
2.研究影响脂肪酸败的因素。
二.实验原理由于化学结构的特点,不饱和脂肪酸和油脂容易氧化降解,这就是所谓的氧化酸败。
这是一类自由基链式反应,从脂肪酸链上脱除一个有反应性的烯丙基上的氢,随之产生一系列的化、重组、链的断裂和风味化合物的产生。
脂肪酸败是肉眼看不见的,胡萝卜素是一种高度不饱和的碳氢化合物,其结构与脂肪酸相似,当氧化发生时能从明亮的橙色变为无色。
食品化学实验指导书201006

食品化学实验指导王昕石晶吉林大学生物与农业工程学院食品科学与工程系2010年06月目录实验一、水分活度的测定——溶剂萃取法 (1)实验二、方便食品中淀粉α-化程度的测定(碘量法) (3)实验三、油脂酸价和过氧化值的测定 (5)实验四、二氧化硫(SO2)含量测定(碘液滴定法) (8)实验五粗纤维含量测定 (9)实验六蛋白质食品功能特性测定 (11)一、实验材料和试剂 (11)二、实验内容 (11)(一)蛋白质的水溶性 (11)(二)蛋白质的乳化性 (12)(三)、蛋白质的起泡性 (14)(四)、蛋白质热凝集性的测定 (15)(五)蛋白质的胶凝作用 (16)附:蜂蜜海绵蛋糕的制作 (17)实验九、α-淀粉酶活力的测定 (21)实验十、美拉德反应初始阶段的测定 (22)实验十一果胶的提取、测定和果酱的制备 (24)实验十二软饮料中可溶性固形物的测定(折光计法) (27)实验十三过氧化物酶的测定 (31)实验十四青菜叶中叶绿素含量的测定 (32)实验十五苹果中多酚氧化酶最适温度的测定 (34)实验十六凝固剂对豆腐凝胶的影响 (36)ii实验一、水分活度的测定——溶剂萃取法1.原理样品中的水可用不混溶的溶剂来萃取,萃取的水量与水相中的水分活性成正比。
2.试剂(1)卡尔费休试剂:甲液:在干燥的棕色玻璃瓶中加入100mL 无水甲醇、8.5g 无水乙酸钠(需预先在120℃干燥48h 以上),5.5g 碘化钾,摇匀溶解后再通入3.0~10.0g 干燥的二氧化硫。
乙液:称取37.65g 碘、27.8g 碘化钾及42.25g 无水乙酸钠,移入干燥棕色瓶中,加入500mL 无水甲醇,摇匀溶解后备用。
将上述甲、乙液混合,用聚乙烯薄膜套在瓶外,置于冰浴中静置一昼夜,放在干燥器中,升至室温后备用。
(2)卡尔费休试剂的标定:取干燥带塞的玻璃瓶称重,准确称入重蒸馏水30mg 左右,加入无水乙醇2mL ,在不断振摇下,用卡尔费体试剂滴定至终点。
食品化学综合实验指导 (仅供参考)

实验一糖水桔子罐头一、实验目的通过实验使学生熟识和掌握罐头制作的一般工艺流程及工艺参数,及其不同类别食品罐头的加工技术。
二、实验原理罐藏是把食品原料经过前处理后,装入能密封的容器内,添加糖液、盐液或水,通过排气、密封和杀菌,杀灭罐内有害微生物并防止二次污染,使产品得以长期保藏的一种加工技术。
三、材料及用具蜜桔、白砂糖、柠檬酸、盐酸、氢氧化钠、四旋玻璃瓶、不锈钢锅、镊子、天平、称、测糖仪、温度计四、工艺流程及制作方法(一)工艺流程原料选扦一选果分组一清洗—热烫剥皮—去络、分瓣—酸碱处理一漂洗一整理—分选一装罐一真空封罐,杀菌一冷却一擦罐、人库、贴标(二)制作方法1.原料选择选用肉质致密、色泽鲜艳美观、香味良好、糖分含显高、糖酸比适度、含橙皮苷低的果实。
果实呈扁圆形、原料无、果皮薄.桔大小一致、无损伤果,适于加丁的品种有温州蜜柑、本地早及红桔。
2.原料处理①去皮、分瓣桔子经剔选后在生产罐头前需进行清洗后剥皮、有热剥和冷剥。
热剥是把桔子放在90℃的热水中烫2-3min,烫至易剥皮但果心不热为准。
不热烫者为冷剥,一般这种方法多采用于出口厂家,剥皮稍费功夫,由于预热次数减少对营养、风味保存较好。
皮剥号后即进行分瓣,分瓣要求手轻,以免囊因受挤压而破裂,因此要特别注意,可用小刀帮助分瓣,办要干爽,桔络去净为宜。
另一方面办的大小在分瓣是应分开便于处理。
一般按大、中、小三级分,烂瓣另作处理。
②去囊衣:可分为全去囊衣及半去囊衣两种。
a、全去囊衣:将桔半先行浸酸处理,办与水之比为1:1.5(或2),用0.4%左右的盐酸溶液处理桔办,一般为30min左右,具体使用酸的浓度及桔办的囊衣厚薄,品种等来定浸泡的时间,水温要求在20℃以上随温度上升其作用加速,但要注意温度不易过高,20—25℃为宜,当浸泡到囊衣发软并呈疏松状,水呈乳浊状即可沥干桔瓣,放入流动清水中漂洗至不浑浊止,然后进行碱液处理,使用浓度为0.4%,水温在20-24℃浸泡2-5min,具体软囊衣厚薄而定。
食品化学实验指导

食品化学实验指导
食品化学实验指导
1,实验前准备:
(1)介绍调查对象:该实验对对不同品种的食品残留进行实验,采集需要检测的各项品种;
(2)有关仪器设备准备:微量天平、色谱仪、高效液相色谱-质谱联用仪、高效分离质谱仪、质谱仪等实验仪器,为食品残留测定提供有效的技术保证和谱图鉴定。
(3)采样准备:根据实验要求,根据国家有关技术文件,进行采样准备;
(4)样品献血:根据样品,从食品中以适当量取样,按国家质量标准准确比例称取;
(5)实验室环境:确保实验环境安全,明确实验区域的主要污染源,检查实验室的温度、湿度、气味进行校准;
2,实验步骤及操作:
(1)测定样品:采用高效液相色谱-质谱技术,将待测的食品样品按
指定的比例加入实验管中,加入酸性溶剂进行溶解后,使用色谱仪将样品
分离,然后取样加入测定管中,放入电解极板模拟现场植物生长状况,对
样品进行测定、计算;
(2)实验分析:根据实验数据,依据所测定的残留物质含量,计算精
确度、准确度、线性、检出限、重现性等指标;
(3)实验结果:与标准结果对比,结合相关理论,如果实验结果符合
要求,则实验结果为有效,否则实验结果无效,或再重复实验1次;
(4)实验报告:根据实验数据、测定原理和实验步骤,编写实验报告,把实验结果写入报告;
3,实验结果分析:
(1)结果评价:根据实验结果,对所测定的残留物质含量,定量和定
性评价;
(2)质量控制:及时修改实验程序,建立完善的实验质量控制体系,
保证实验数据的准确度,充分挖掘实验数据的丰富性。
食品化学实验指导

食品化学实验指导食品化学实验指导中国农业大学食品科学与营养工程学院2006年3月实验一淀粉α-化度的测定一、实验目的:了解α-淀粉酶的作用,观察淀粉制品α-化度的差别,理解生淀粉、老化淀粉和糊化淀粉的酶解速度差异,从而了解糊化淀粉对于食品加工和人体消化吸收的意义。
理解糖的还原性质和淀粉及酶解产物与碘的作用。
二、实验原理:淀粉食品在含充足水条件下加热到糊化温度以上发生糊化。
糊化后快速脱水可以固定在α-状态,缓慢降温则可能发生老化。
淀粉糊化度的高低可以用α-化度来表示,而α-化度高,则容易为淀粉酶所水解,因此α-化度也是衡量淀粉消化难易程度的一个指标。
用碘量法测定淀粉酶水解生成的葡萄糖的含量,可以反映出淀粉的α-化度。
淀粉与碘形成包合物从而呈现颜色,其颜色深浅与淀粉的糖链长度和分子状态有关。
碘量法测定中淀粉作为指示剂。
CHO COOH(CHOH)4 +I2 + 2NaOH (CHOH)4 + 2NaI + H2OCH2OH CH2OHI2(过量部分)+ 2NaOH NaIO + NaI + H2ONaIO +NaI +H2SO4Na2SO4 +I2+H2OI2 + 2Na2S2O32NaI + Na2S4O6三、实验材料与试剂1、材料:生玉米淀粉、速食绿豆粥、膨化食品、老化的粉丝、老化的米饭等。
2、试剂:a. 5mg/ml淀粉酶(活力单位3000~5000)溶液:临用前直接用水配制,过滤。
b. pH5.6柠檬酸缓冲液:A柠檬酸20.01g,水配制并定容1000ml;B柠檬酸三钠29.41g 水配制并定容1000ml,1:2体积混合即可);c. 0.05mol/L硫代硫酸钠溶液:称取13g Na2S2O3·5H2O,溶于1000ml水中,缓缓煮沸10min,冷却。
放置两周后过滤备用。
使用前用基准重铬酸钾标定。
d. 0.1mol/L碘-碘化钾标准溶液:称取碘13g和碘化钾35g,先将碘化钾溶解于少量蒸馏水中,在不断搅拌下加入碘,使其全部溶解后,移入1000mL棕色容量瓶中,定溶至刻度,摇匀,置避光处待用。
食品化学实验教案

食品化学实验教案引言食品化学实验是食品科学与工程专业学生的重要实践环节。
通过进行实验,学生能够进一步了解食品中的化学成分、性质和反应,培养他们的实验操作能力和科学研究思维,为日后的食品加工和质量控制奠定基础。
本教案将介绍一门食品化学实验课程的设计,具体包括实验目的、实验原理、实验步骤、实验结果分析以及安全注意事项等内容。
通过实验课程的开展,能够帮助学生更好地理解食品化学领域的知识并应用于实践。
一、实验目的本实验旨在通过对不同食品样品的化学分析和实验操作,使学生掌握以下知识和能力:1. 了解常见食品的主要化学成分及其性质;2. 学习使用常规的化学实验方法和仪器进行食品分析;3. 掌握食品分析数据的处理和结果分析能力;4. 培养实验室操作规范,保证安全意识。
二、实验原理1. 食品基本成分分析方法:包括水分、脂肪、蛋白质和碳水化合物等主要成分的测定方法,如称量法、真空干燥法、黄色反应法、高压液相色谱法等。
2. 食品酸碱度的测定:通过使用酸碱指示剂或酸碱滴定法,测定食品的酸碱度,了解食品在不同pH值下的性质和稳定性。
3. 食品添加剂检测:利用色谱仪或其他分析仪器,检测食品中的添加剂,如防腐剂、色素、甜味剂等。
并了解这些添加剂的安全性和使用限量。
4. 食品品质评价方法:通过感官评价和仪器分析,对食品的色、香、味等方面进行评估,了解食品的品质特点和影响因素。
三、实验步骤1. 实验前准备:准备实验所需的食品样品、试剂、仪器和设备等。
2. 实验一:食品水分测定a. 取适量食品样品;b. 称取食品样品质量并记录;c. 将食品样品放入干燥器中,使用真空干燥法测定水分含量;d. 计算食品样品的水分含量。
3. 实验二:食品酸碱度测定a. 取适量食品样品;b. 加入适量酸碱指示剂;c. 观察食品在酸碱溶液中的颜色变化;d. 使用酸碱滴定法测定食品样品的酸碱度。
4. 实验三:食品添加剂检测a. 取适量食品样品;b. 提取食品样品中的添加剂;c. 使用色谱仪检测添加剂的含量;d. 分析检测结果。
食品化学实验指导书
食品化学实验指导合肥工业大学生物与食品工程学院目录实验一美拉德反应初始阶段的测定实验二脂肪氧化、过氧化值及酸价的测定(滴定法)实验三蛋白质的功能性质(一)实验四蛋白质的功能性质(二)实验五绿色果蔬分离叶绿素及其含量测定实验一美拉德反应初始阶段的测定一、原理美拉德反应即蛋白质、氨基酸或胺与碳水化合物之间的相互作用。
美拉德反应开始,以无紫外吸收的无色溶液为特征。
随着反应不断进行,还原力逐渐增强,溶液变成黄色,在近紫外区吸收增大,同时还有少量糖脱水变成5-羟甲基糖醛(HMF),以及发生健断裂形成二羰基化合物和色素的初产物,最后生成类黑精色素。
本实验利用模拟实验:即葡萄糖与甘氨酸在一定pH缓冲液中加热反应,一定时间后测定HMF的含量和在波长为285nm处的紫外消光值。
HMF的测定方法是根据HMF与对-氨基甲苯和巴比妥酸在酸性条件下的呈色反应。
此反应常温下生成最大吸收波长的550nm的紫红色。
因不受糖的影响,所以可直接测定。
这种呈色物对光、氧气不稳定,操作时要注意。
二、实验仪器与试剂(一)实验仪器:分光光度计、水浴锅、试管等。
(二)实验试剂:1.巴比妥酸溶液:称取巴比妥酸500mg,加约70ml水,在水浴加热使其溶解,冷却后转移入100ml容量瓶中,定容。
2.对-氨基甲苯溶液:称取对-氨基甲苯10.0g,加50ml异丙醇在水浴上慢慢加热使之溶解,冷却后移入100ml容量瓶中,加冰醋酸10ml,然后用异丙醇定容。
溶液置于暗处保存24小时后使用。
保存4-5天后,如呈色度增加,应重新配制。
3.1mol/L葡萄糖溶液。
4.0.1mol/L甘氨酸溶液。
三、操作步骤(一)取5支试管,分别加入5 ml 1.0 mol/L葡萄糖溶液和0.1mol/L赖氨酸溶液,编号为A1、A2、A3、A4、A5。
A2、A4调pH 到9.0,A5加亚硫酸钠溶液。
5支试管置于90℃水浴锅内并记时,反应1h,取A1、A2、A5管,冷却后测定它们的258nm紫外吸收和HNF 值。
食品化学实验指导
食品化学实验指导目录实验一水分的测定(烘重量法)实验二食品水分活度的测定(直接测定法)实验三食品水分活度(a w)的测定(水分活度仪测定法)实验四粗灰分的测定(干式灰化法)实验五总酸的测定(滴定法)实验六还原糖的测定实验七淀粉含量的测定实验八淀粉含量的测定(碘量法)实验九美拉德反应初始阶段的测定实验十果胶的提取和果酱的制备实验十一淀粉糊化及酶法制备淀粉糖浆及其葡萄糖值的测定实验十二豆类淀粉和薯类淀粉的老化(粉丝的制备与质量感官评价)实验十三粗脂肪的测定(索氏抽提法)实验十四脂肪氧化、过氧化值及酸价的测定(滴定法)实验十五大豆中油脂和蛋白质的分离实验十六蛋白质的盐析和透析实验十七蛋白质的功能性质(一)实验十八蛋白质的功能性质(二)实验十九粗蛋白质的测定(微量凯氏定氮法)实验二十可溶性蛋白质的测定(考马斯亮蓝G-250法)实验二十一茚三酮法测定氨基酸总量实验二十二维生素C含量的测定(2,6-二氯酚靛酚法)实验二十三维生素C含量的测定(紫外快速测定法)实验二十四总抗坏血酸含量的测定(荧光法)实验二十五从番茄中提取番茄红素和β—胡萝卜素实验二十六β-胡萝卜素含量的测定(HPLC法)实验二十七类黄酮含量的测定(HPLC法)实验二十八绿色果蔬分离叶绿素及其含量测定实验二十九水果皮颜色和淀粉白度的测量(测色色差计的使用)实验三十食品感官质量评价实验一水分的测定(烘重量法)一、原理常用的果蔬新鲜原料含水量的测定, 是将称重后的果蔬置于烘箱中烘去水分, 其失重为水分重量。
在烘干过程中, 果蔬中的结合水, 在100℃以下不易烘干, 若在105℃以上, 样品中一些有机物质(如脂肪)是易氧化使干重增加, 而果蔬中的糖分, 在100℃上下则易分解, 也可使测定产生误差, 故烘干温度先为60-70℃, 至接近全干时再改用100-105℃干燥。
二、材料、仪器与试剂(一)材料: 苹果、梨、黄瓜、番茄等。
(二)仪器: 烘箱或真空干燥箱、分析天平、称量瓶、干燥器。
食品化学实验指导
食品化学实验指导实验一、果胶的提取和果冻的制备一、引言果胶广泛存在于水果和蔬菜中,如干橘皮约含10-15%,苹果(以湿品计)中含量为0.7-1.5%,在蔬菜中以南瓜含量最多,7-17%。
果胶的基本结构是以α-1,4甙键连接的聚半乳糖醛酸,其中部分羧基被甲酯化,其余的羧基与钾、钠、铵离子结合成盐。
在果蔬中,尤其是未成熟的水果和皮中,果胶多数以原果胶存在,原果胶以金属离子桥与多聚半乳糖醛酸中的游离羧基相结合。
原果胶不溶于水,故用酸水解生成可溶性的果胶,再进行脱色、沉淀、干燥即为商品果胶。
从柑橘皮中提取的果胶是高酯化度的果胶。
酯化度在70%以上。
在食品工业中常利用来制作果酱、果冻和糖果,在汁液类食品中作增稠剂、乳化剂。
二、实验材料和试剂柑橘皮、苹果皮等,市售果胶。
0.25%HCL,95%乙醇、蔗糖、柠檬酸。
天平、烘箱、抽滤机、电炉、玻璃器皿。
三、实验步骤1.果胶的提取(1)原料预处理:称取新鲜柑橘皮10g用清水洗净后,放入250毫升容量瓶中,加水120毫升,加热至90℃保持5-10分钟,使酶失去活力。
用水冲洗后切成3-5毫米的颗粒,用50℃左右的热水漂洗,直至水为无色、果皮无异味为止/每次漂洗必须把果皮用尼龙布挤干,在进行下一次的漂洗(2)酸水解萃取:将预处理过的果皮粒放入烧杯中,加约为0.1%的盐酸溶液60毫升,以浸没果皮为宜,pH调节至2.0-2.5之间,加热至90℃煮20分钟趁热用尼龙布或四层纱布过滤。
(3)脱色:在滤液中加入0.5—1%的活性炭于80℃加热10分钟进行脱色和除异味,趁热抽滤,如抽滤困难可加入2—4g硅藻土作为助滤剂。
如果柑橘皮漂洗干净萃取液为清澈透明则不用脱色。
(4)沉淀:待萃取液冷却后用稀氨水调节pH3-4。
在不断搅拌下加入95%乙醇溶液,加入乙醇的量约为原体积的1.3倍,使酒精浓度达到50%-65%。
(5)用尼龙布过滤、洗涤、再次过滤、60℃烘干、包装即为产品。
滤液可用蒸馏法收回乙醇。
食品化学实验指导-综合性实验-终版.jsp
“食品化学综合实验”实验指导实验一罗非鱼在冰藏中鲜度变化的检测一、实验目的运用在课堂上所学过的食品化学基础理论知识,查阅有关文献,结合实验室现有的条件,在教师的指导下,通过实验,达到以下目的:1、掌握鱼体在冰藏中鲜度变化的感官检测方法;2、掌握鱼体在冰藏中鲜度变化的化学检测方法,包括挥发性盐基氮、三甲胺及盐溶性蛋白的测定原理和方法。
二、实验内容2.1鱼新鲜度的感官鉴别冰鲜鱼类鲜度的感官鉴别指标如表1所示。
表1. 冰鲜鱼类鲜度的感官鉴别指标续表1.冰鲜鱼类鲜度的感官鉴别指标根据上表鱼体鲜度变化的指标,记录冰藏了一段时间的罗非鱼的鲜度变化,并与新鲜鱼对比。
2.2盐溶性蛋白的测定(一)实验原理鱼肉中的蛋白质按照是否溶于水以及高离子浓度的盐溶液可以分为两种:盐溶性蛋白和水溶性蛋白。
前者如肌球蛋白、肌动蛋白,而水溶性蛋白有肌浆蛋白等。
盐溶性蛋白和水溶性蛋白都溶解于高离子强度的盐溶液中,而水溶性蛋白同时又溶解于低离子强度的盐溶液中。
因此,高盐溶液中的蛋白质含量减去低盐溶液的蛋白质含量即为盐溶性蛋白质含量。
(二)实验原料与仪器1、实验原料及试剂1.1 新鲜罗非鱼及冰藏罗非鱼(约4天)1.2 高离子磷酸缓冲液(0.5M KCl-0.01M NaH2PO4-0.03M Na2HPO4)1.3 低离子磷酸缓冲液(0.025M NaH2PO4-0.025M Na2HPO4)1.4 15%三氯醋酸(TCA)1.5 1N NaOH1.6 双缩脲试剂:混合1.50gCuSO4.5H2O和6.00g酒石酸钾钠,加入500ml蒸馏水,置于烧杯中搅拌,搅拌时加入300ml10%NaOH,转移入1升的容量瓶,定容至1升,转移入塑料瓶保存。
2、实验仪器天平(1台)、100ml烧杯(8个)、研钵(2个)、高速离心机(共2台),离心管(50ml,每组8根),100ml容量瓶(2个)、25ml容量瓶(4个)、752紫外分光光度计(共2台),移液管(1ml、2ml、5ml各2根),100ml量筒(1个)、滤纸(2包/班)、漏斗(2个),10ml试管(10根)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
食品化学实验指导目录实验一水中总硬度的测定 (3)实验二食品中蔗糖的测定 (6)实验三食品中淀粉的测定 (9)第一法酶水解法 (9)第二法酸水解法 (10)实验四水产品中的组胺的检测 (13)实验五蛋白质含量测定(Folin-酚试剂法) (15)实验六蛋白质功能性质测定(一)(水溶性、乳化性、起泡性、胶凝作用) (19)实验七蛋白质功能性质测定(二)(酪蛋白的凝乳性、谷蛋白粘弹性、肌肉蛋白持水性) (21)实验八粗纤维素的测定 (24)实验九食物中不溶性膳食纤维的测定 (26)实验十固态食品比容的测定 (28)实验十一油脂水分及挥发物的测定(建议删除) (30)方法一电热烘箱法 (30)方法二电热板法 (30)方法三真空烘箱法 (31)实验十二皂化值和碘值的测定 (32)实验十三直链淀粉和支链淀粉的测定 (35)实验十四淀粉α-化度的测定 (37)实验十五豆类淀粉和薯类淀粉的老化、粉丝的制备与质量感官评价 (40)实验十六软饮料中可溶性固形物的测定 (42)实验十七羰胺反应速度的影响因素 (43)实验十八辣椒红色素的分离提取及测定 (45)实验十九维生素E在油脂中的抗氧化作用 (46)实验二十酶促褐变的影响因素 (48)实验二十一反相高效液相色谱法测定水果中维生素C的含量 (51)实验二十二蔬菜中叶绿素的分离及其含量的测定 (53)实验二十三化学滴定法测定还原糖 (56)实验二十四火焰原子吸收光谱法测定微量元素铜 (59)实验二十五单宁含量的测定 (62)实验二十五火腿肠中亚硝酸盐的测定---盐酸萘乙胺比色法 (64)实验二十六食品中反式脂肪酸的测定 (67)实验二十六食品中总酸度的测定(滴定法) (71)实验二十七壳聚糖的制备、特性鉴定及果蔬保鲜应用 (74)实验二十八食品中矿物质元素含量的测定-ICP-AES法 (76)实验二十九食品中苯并[a]芘含量的测定 (79)第—法荧光分光光度法 (79)第二法目测比色法 (82)实验三十多酚类物质总量的测定 (84)实验三十一茚三酮法测定氨基酸总量 (86)实验一水中总硬度的测定一、实验目的1、掌握EDTA标准溶液的配制和标定方法。
2、掌握配位滴定的基本原理、方法和计算。
3、掌握铬黑体T、钙指示剂的使用条件和终点变化。
二、实验原理测定自来水的硬度,一般采用络合滴定法,用EDTA标准溶液滴定水中的Ca2+、Mg2+、总量然后换算为相应的硬度单位。
用EDTA滴定Ca2+、Mg2+总量时,一般是在pH=10的氨性缓冲溶液进行,用EBT(铬黑体)作指示剂。
化学计量点前,Ca2+、Mg2+和EBT生成紫红色络合物,当用EDTA溶液滴定至化学计量点时,游离出指示剂,溶液呈现纯蓝色。
由于EBT与Mg2+显色灵敏度高,与Ca2+显色灵敏度低,所以当水样中Mg2+含量较低时,用EBT作指示剂往往得不到敏锐的终点。
这时可在EDTA标准溶液中加入适量的Mg2+(标定前加入Mg2+对终点没有影响)或者在缓冲溶液中加入一定量Mg2+—EDTA盐,利用置换滴定法的原理来提高终点变色的敏锐性,也可采用酸性铬蓝K-萘酚绿B混合指示剂,此时终点颜色由紫红色变为蓝绿色。
滴定时,Fe3+、Al3+等干扰离子,用三乙醇胺掩蔽;Cu2+,Pb2+,Zn2+等重金属离子则可用KCN、Na2S或硫基乙酸等掩蔽。
三、仪器与试剂1、EDTA标准溶液(0.01mo/L):称取2 g乙二胺四乙酸二钠盐(Na2H2Y.2H2O)于250 mL 烧杯中,用水溶解稀释至500mL。
如溶液需保存,最好将溶液储存在聚乙烯塑料瓶中。
2、氨性缓冲溶液(pH=10):称取20g NH4Cl固体溶解于水中,加100ml 浓氨水,用水稀释至1L。
3、铬黑体(EBT)溶液(5g.L-1):称取0.5 g铬黑体,加入25mL 三乙醇胺、75 mL乙醇4、Na2S 溶液(20g/L)5、三乙醇氨溶液(1+4)6、盐酸(1+1)7、氨水(1+2)8、甲基红:1g/L 60%的乙醇溶液9、镁溶液:1gMgSO4.7H2O 溶解于水中,稀释至200mL10、CaCO3基准试剂:120℃干燥2h。
11、金属锌(99.99%):取适量锌片或锌粒置于小烧杯中,用0.1mol/L HCl 清洗1min,以除去表面的氧化物,再用自来水和蒸馏水洗净,将水沥干,放入干燥箱中100℃烘干(不要过分烘烤)冷却。
四、实验步骤(一)EDTA的标定。
标定EDTA的基准物较多,常用纯CaCO3,也可用纯金属锌标定,其方法如下:1、金属锌为基准物质:准确称取0.17-0.20g 金属锌置于100mL烧杯中,用1+1 HCl,5mL立即盖上干净的表面皿,待反应完全后,用水吹洗表面皿及烧杯壁,将溶液转入250mL容量瓶中,用水稀释至刻度,摇匀。
用移液管平行移取25.00mL Zn2+的标准溶液三份分别于250mL锥形瓶中,加甲基红1滴,滴加(1+2)的氨水至溶液呈现为黄色,再加蒸馏水25mL,氨性缓冲溶液10mL,摇匀,加EBT指示剂2-3滴,摇匀,用EDTA溶液滴至溶液有紫红色变为纯蓝色即为终点。
计算EDTA溶液的准确浓度。
2、CaCO3为基准物质;准确称取CaCO3 0.2g-0.25g 于烧杯中,先用少量的水润湿,盖上干净的表面皿,滴加1+1 HCl 10mL,加热溶解。
溶解后用少量水洗表面皿及烧杯壁,冷却后,将溶液定量转移250mL容量瓶中,用水稀释至刻度,摇匀。
用移液管平行移取25.00mL标准溶液三份分别加入250mL锥形瓶中,加1滴甲基红指示剂,用(1+2)氨水溶液调至溶液由红色变为淡黄色,加20mL水及5mLMg2+溶液,再加入pH=10 的氨性缓冲溶液由红色变为纯蓝色即为终点,计算EDTA溶液的准确浓度。
(二)自来水样的分析。
打开水龙头,先放数分钟,用已洗净的试剂瓶承接水样500-1000mL,盖好瓶塞备用。
移取适量的水样(用什么量器?)(一般为50-100mL,视水的硬度而定),加入三乙醇胺3 mL ,氨性缓冲溶液5 mL,EBT指示剂2-3滴,立即用EDTA 标准溶液滴至溶液由红色变为纯蓝色即为终点。
平行三份,计算水的总硬度,以CaCO3表示。
五、结果计算本实验以CaCO3的质量浓度(mg/L)表示水的硬度。
我国生活饮用水规定,总硬度以CaCO3计,不得超过450 mg/L。
计算公式:水的硬度=C×v/水样体积×100.09(mg/L)式中:C为EDTA的浓度,V为EDTA的体积,100.09为CaCO3的质量。
六、注意事项1、自来水样较纯、杂质少,可省去水样酸化、煮沸,加Na2S掩蔽剂等步骤。
2、如果EBT指示剂在水样中变色缓慢,则可能是由于Mg2+含量低,这时应在滴定前加入少量Mg2+溶液,开始滴定时滴定速度宜稍快,接近终点滴定速度宜慢,每加1滴EDTA溶液后,都要充分摇匀。
七、思考题1.滴定时为什么要加入NH3·H2O-NH4Cl缓冲溶液?2.在配位滴定中,指示剂应具备什么条件?实验二食品中蔗糖的测定一、实验目的1、明确与掌握各类食品中蔗糖含量的原理及测定方法。
2、掌握用酸水解法测定蔗糖的方法。
二、实验原理脱脂后的样品,用水或乙醇提取,提取液经澄清处理除去蛋白质等杂质后,用稀盐酸进行水解,使蔗糖转化为还原糖,再按还原糖测定方法分别测定水解前后样液中还原糖的含量,两者之差即为由蔗糖水解产生的还原糖量,再乘以换算系数0.95即为蔗糖含量。
三、仪器与试剂1、仪器(1)滴定管(2)25mL古式坩埚或G4垂融坩埚(3)真空泵(4)水浴锅2、试剂除特殊说明外,实验用水为蒸馏水,试剂为分析纯。
(1) 6 mol/L盐酸:量取50mL盐酸加水稀释至100 mL。
(2)甲基红指示剂:称取10mg甲基红,用100mL乙醇溶解。
(3)5 mol/L氢氧化钠溶液:称取20g氢氧化钠加水溶解并稀释至100mL。
(4)碱性酒石酸铜甲液:称取34.639g 硫酸铜(CuSO4·5H2O),加适量水溶解,加0.5mL硫酸,再加水稀释至500mL,用精制石棉过滤。
(5)碱性酒石酸铜乙液:称取173g酒石酸钾钠与50g氢氧化钠,加适量水溶解,并稀释至500mL,用精制石棉过滤,贮存于橡胶塞玻璃瓶中。
(6)精制石棉:取石棉先用3mol/L盐酸浸泡2~3天,用水洗净,再加2.5mol/L 氢氧化钠溶液浸泡2~3天,倾去溶液,再用热碱性酒石酸铜已液浸泡数小时,用水洗净。
再以3 mol/L盐酸浸泡数小时,以水洗至不呈酸性。
然后加水振摇,使成微细的浆状软纤维,用水浸泡并贮存于玻璃瓶中,即可用做填充古式坩埚用。
(7)0.1000mol/L高锰酸钾标准溶液。
(8)1mol/L氢氧化钠溶液:称取4g 氢氧化钠,加水溶解并稀释至100mL。
(9)硫酸铁溶液:称取50g硫酸铁,加入200mL水溶解后,慢慢加入100mL 硫酸,冷却后加水稀释至1L。
(10)3mol/L盐酸:量取30mL盐酸,加水稀释至120mL。
四、实验步骤(一)样品处理:(1)乳类、乳制品及含蛋白质的食品:称取约0.5~2 g固体样品(吸取2~10 mL液体样品),置于250 mL容量瓶中,加50 mL水,摇匀。
加入10 mL 碱性酒石酸铜甲液及4 mL1mol/L氢氧化钠溶液,加水至刻度,混匀。
静置30min,用干燥滤纸过滤,弃去初滤液,滤液备用。
(2)酒精性饮料:吸取100 mL样品,置于蒸发皿中,用1 mol/L氢氧化钠溶液中和至中性,在水浴上蒸发至原体积1/4后,移入250 mL容量瓶中。
加50 mL水,混匀。
按以上步骤加10mL碱性酒石酸铜甲液。
(3)含多量淀粉的食品:称取2~10 g样品,置于250 mL容量瓶中,加200 mL水,在45℃水浴中加热1 h,并时时振摇。
(注意:此步骤是使还原糖溶于水中,切忌温度过高,因为淀粉在高温条件下可糊化、水解,影响检测结果。
)冷却后加水至刻度,混匀,静置。
吸取200 ml上清液于另一250 ml容量瓶中,加10ml碱性酒石酸铜甲液。
(4)汽水等含有二氧化碳的饮料:吸取100 mL样品置于蒸发皿中,在水浴上除去二氧化碳后,移入250 mL容量瓶中,并用水洗涤蒸发皿,洗液并入容量瓶中,再加水至刻度,混匀后,备用。
(二)样品水解吸取2份50mL样品处理液,置于100mL锥形瓶中,一份加入5 mL 6 mol/L盐酸,在68~70℃中水解15 min(注意温度和时间,如果温度过高或时间过长,一些大分子糖也可被水解)。
冷却后加2滴甲基红指示剂(注意:如果样品液颜色较深,可以用广泛pH试纸或外指示剂,如溴麝香草酚蓝),用5mol/L氢氧化钠溶液中和至中性,转至容量瓶中,加水定容至100mL,混匀。
