强弱氧化剂 还原剂
常见氧化剂还原剂和催化剂的应用
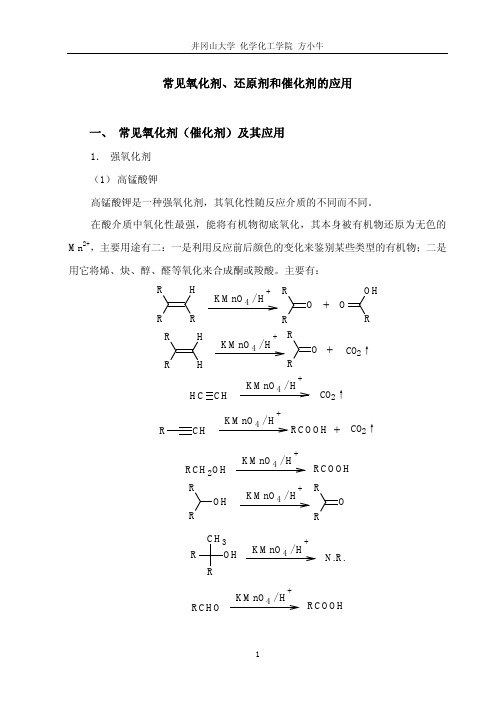
常见氧化剂、还原剂和催化剂的应用一、 常见氧化剂(催化剂)及其应用1. 强氧化剂 (1) 高锰酸钾高锰酸钾是一种强氧化剂,其氧化性随反应介质的不同而不同。
在酸介质中氧化性最强,能将有机物彻底氧化,其本身被有机物还原为无色的Mn 2+,主要用途有二:一是利用反应前后颜色的变化来鉴别某些类型的有机物;二是用它将烯、炔、醇、醛等氧化来合成酮或羧酸。
主要有:R H KMnO 4 / H+OROR OH+ R RHH KMnO 4 / H++O RRCO 2↑KMnO 4 / H+C H CH CO 2↑KMnO 4 / H++CHRCO 2↑RCOOHKMnO 4 / H+RCOOHRCH 2OHOH RRKMnO 4 / H+O RROHRR CH 3KMnO 4 / H+N.R.KMnO 4 / H+RCOOH RCHOKMnO 4 / H +N.R.RCOR' KMnO 4 / H+CO 2↑COOH COOH高锰酸钾在中性或碱性介质中的氧化性稍弱,在控制条件下可以将 π 键氧化而不断裂 σ 键,主要用于从烯烃制备邻二醇(反应的立体化学特征是顺式加成)。
四氧化锇的作用与此类似。
OO MnO(2) 重铬酸钾K 2Cr 2O 7 / H 2SO 4溶液的氧化性能与KMnO 4 / H +相似,用途也相似。
除用以氧化醇、醛等含氧衍生物外,主要用于将芳环氧化成醌。
如:O OCrO 3-H 2SO 4CrO 3-H 2SO 4OOK 2Cr 2O 7 / H 2SO 4RCH 2OHRCHO 边氧化边蒸馏(3) 稀硝酸稀硝酸具有强氧化性,它可以将芳环的侧链氧化和将醇氧化,如:Ar-CH 3Ar-COOH 稀HNO 3稀HNO 3OHO△HO 2C-(CH 2)4-CO 2H2. 温和氧化剂 (1) 二氧化锰MnO 2-H 2SO 4是一种中强氧化剂,可将甲苯氧化成苯甲醛:C 6H 5-CH 3C 6H 5-CHOMnO 2-H 2SO 4活性MnO 2则是一种温和的氧化剂,能将烯丙式醇氧化成醛而不影响C=C 双键:CH 3CH 3CH 3CHOMnO 2石油醚(2) 三氧化铬-吡啶络合物三氧化铬-吡啶络合物(CrO 3-C 5H 5N )又称为Sarett 试剂,是一种温和的氧化剂,能将醇(尤其是烯丙式的)氧化成为醛,而不影响其它基团。
氧化剂、还原剂强弱的比较

物质氧化性、还原性强弱的比较,实质上是物质得失电子难易程度的比较。
即物质越易夺得电子,则其氧化性越强,越难夺得电子则其氧化性越弱;反之,物质越易失去电子,则其还原性越强,越难失去电子,则其还原性越弱。
一、利用化合价,比较物质氧化性、还原性强弱由同种元素形成的不同价态物质的氧化性和还原性的强弱规律是:元素的最高价态只具有氧化性,元素的最低价态只具有还原性,元素的中间价态既有氧化性又有还原性。
例1.对铁元素组成的物质而言:氧化性:Fe<二价铁盐<三价铁盐还原性:Fe>二价铁盐>三价铁盐二、利用元素活泼性的不同,比较物质氧化性、还原性的强弱1.对金属而言,金属越活泼(金属性越强),其单质的还原性越强,其金属阳离子的氧化性越弱。
例2.对金属活动性顺序表而言:K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au活泼性(金属性)————→减弱其单质还原性:K>Ca>Na>Mg>Al>…Hg>Ag>Pt>Au其离子氧化性:K+<Ca2+<Na+<Mg2+<Al3+<…<Hg2+<Ag+<Pt2+<Au+例3.对同主族的金属元素,从上到下活泼性依次增强。
如对ⅡA族金属元素:Be Mg Ca Sr Ba活泼性(金属性)————→增强其单质还原性:Be<Mg<Ca<Sr<Ba其阳离子氧化性:Be2+>Mg2+>Ca2+>Sr2+>Ba2+例4.对同周期金属而言,从左到右其金属活泼性(金属性)依次减弱。
如对第3周期金属而言:Na Mg Al活泼性(金属性)————→减弱其单质还原性:Na>Mg>Al其阳离子氧化性:Na+<Mg2+<Al3+2.对非金属而言,其非金属越活泼(非金属性越强),其非金属单质的氧化性越强,其阴离子的还原性越弱。
例5.对一般的非金属活动性顺序而言:F Cl Br I S活泼性(非金属性)————→减弱其单质氧化性:F2>Cl2>Br2>I2>S其阴离子还原性:F-<Cl-<Br-<I-<S2-例6.对同主族的非金属而言,从上到下非金属的活泼性依次减弱。
氧化还原性强弱顺序

淡黄色:S、Na2O2、TNT、PCl5、AgBr、浓HNO3(混有NO2)、浓HCl(混有Fe3+)、硝基苯(溶有NO2)灰黄色:Mg3N2棕黄色:FeCL3溶液、碘水(深黄--褐)棕色:固体FeCl3、固体CuCl2、NO2(红棕)、Fe2O3(红棕)常见微溶物:Ag2SO4、CaSO4、Ca(OH)2、MgCO3Ag+ 与Cl-、Br-、I-、SO42-Ca2+ 与CO32-、SO32-Ba2+ 与CO32-、SO32-、SO42-H+存在,其中不能大量含有OH-、弱酸根离子(如CO32-、SO32-、S2-、F-、ClO-、CH3COO-、C6H5O-、PO43-、AlO2-、SiO32-等)以及弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-等)OH-存在,其中不能大量含有H+、弱碱的阳离子(如NH4+、Mg2+、Ag+、Al3+、Zn2+、Cu2+、Fe2+、Fe3+ 等)以及弱酸的酸式根离子。
Fe3+与S2-、SO32-、HSO3-、I-、HS-、CO32-、HCO3-、AlO2-SO32-(H+)与S2-MnO4-(H+)、Cr2O72-、ClO-与Cl-、I-、S2-、Fe2+、HS-、SO32-、HSO3-NO3-(H+)与Fe2+、S2-、HS-、SO32-、HSO3-、Br-、I-Al3+与CO32-、HCO3-、S2-、HS-、AlO2-NH4+与AlO2-还原;K、Ca、Na、Mg、Al,Zn、Fe、Sn、Pb、(H),Cu、Fe3+、Hg、Ag、Pt、Au氧化: F2>O2>Cl2>Br2>Fe3+>I2>SO2>S还原: Fe-<OH-<Cl-<Br-<Fe2+<I-<SO32-<S2-氧化: KMnO4>MnO2>O2常见物质的氧化性还原性强弱顺序一、顺序的由来及依据学过氧化还原反应的强弱律之后,我们可以根据下列反应①2FeCl2+Cl2=2FeCl3②2FeCl3+2HI=I2+2FeCl2+2HCl ③I2+K2S=S+2KI判断氧化剂的氧化性由强到弱的顺序为Cl2>Fe3+>I2>S同样可以得出还原性由弱到强的顺序为 Cl-<Fe2+<I-<S2-推而广之,我们可以根据大量的氧化还原反应得出常见物质的氧化性还原性顺序。
常见的氧化剂和还原剂

常见的氧化剂和还原剂在化学反应中,氧化剂和还原剂是两种常见的重要概念。
氧化剂可以接受电子,使得其他物质失去电子而被氧化,还原剂则相反,它们可以提供电子,使得其他物质接受电子而被还原。
在本文中,我们将介绍一些常见的氧化剂和还原剂。
氧化剂氧气氧气是最常见的氧化剂之一,它可以参与许多氧化反应。
例如,在可燃物燃烧时,氧气就是典型的氧化剂。
氧气也可以氧化一些金属和非金属物质,使它们失去电子。
由于氧气极易与其它物质反应,加热或提高压力可以促进其反应活性。
高锰酸钾高锰酸钾(KMnO4)是一种强氧化剂,可以参与许多氧化反应,常用于工业和化学实验室中。
它可以氧化有机物和无机物,包括金属离子和离子化合物。
在有机化学中,高锰酸钾也被用于氧化剂。
双氧水双氧水(H2O2)是一种弱氧化剂,在化学反应中被广泛使用。
它可以将一些有机物转化为更易于处理的化合物,并且常用于消毒和漂白。
双氧水也可以用作氧化铁和氧化锰的原料,以及化学合成过程中的还原剂。
还原剂金属在化学反应中,金属是最常见的还原剂之一,由于其外层电子结构的特殊性质,金属具有提供电子的能力。
铁和钢铁是在建筑和机械工程中常用的金属还原剂。
氢气氢气(H2)是一种常用的还原剂,主要是因为它极易与氧气反应,从而释放出大量的能量。
在一些化学反应中,两种反应要素之一是氧化剂和还原剂。
在某些情况下,氢气可以被用作还原剂,提供电子给其他物质。
亚硫酸盐亚硫酸盐是一类含有亚硫酸根离子(SO32-)的离子化合物。
它们可以提供电子给其他物质,从而发挥还原剂的作用。
关于亚硫酸盐作为还原剂的应用,最常见的例子是在染料、药物和食品加工工业中,其中亚硫酸盐可以被用作脱色剂和防腐剂。
氧化剂和还原剂在化学反应中起着重要作用。
常见的氧化剂包括氧气、高锰酸钾和双氧水。
而在还原剂方面,金属、氢气和亚硫酸盐是其中最常见的几种。
这些物质的化学特性使得它们可以用于许多不同类型的反应,并为化学工业和实验室提供了广泛的应用。
判断氧化剂和还原剂的强弱

判断氧化剂和还原剂的强弱标准电极电势数值越小,其还原型的还原性越强,而氧化型的氧化性越弱.例如Zn2+ + 2e-Zn φθ=-0.7628VCu2+ + 2e-Cu φθ=-0.337V锌的电极电势比铜的电极电势小得多,表明金属锌是较强的还原剂,而锌离子能在溶液中较稳定地存在,是弱氧化剂.相反,Cu2+是比Zn2+更强的氧化剂,而金属铜是比金属锌更弱的还原剂.例如:已知:根据电极电势越高,其氧化型氧化能力越强,反之其还原型还原能力越弱的原理,有:氧化能力:MnO4->Cl2>Fe2+>Zn2+还原能力:Zn>Fe>Cl->Mn2+判断氧化还原反应的方向氧化还原反应自发进行的方向为:强氧化型1 + 强还原型2 = 弱还原型1 + 弱氧化型2在标准状态下,标准电极电势较大的电对的氧化型能氧化标准电极电势数值较小的电对的还原型.因此,在标准电极电势表中,氧化还原反应发生的方向,是右上方的还原型与左下方的氧化型作用.可以通俗地总结成:“对角线方向相互反应”.我们还可以用标准电极电势定量地判断氧化还原方向.其具体步骤可总结如下:(1)首先根据氧化数的变化确定反应中的氧化剂和还原剂.(2)分别查出氧化剂电对的标准电极电势和还原剂电对的标准电极电势.(3)以反应物中还原剂的电对作负极,反应物中氧化剂的电对作正极,求出电池标准状态的电动势:ΔEø=Φø(+)-Φø(-)若ΔEø>0,则反应自发正向(向右)进行;若ΔEø<0,则反应逆向(向左)进行.例如:判断Zn+Cu2+=Zn2++Cu反应是否向右进行?在上述反应中,Zn作还原剂,Cu2+作氧化剂,则电对Zn/Zn2+作负极,电对Cu2+/Cu 作正极.查表得:(-)Zn2+ + 2e-=Zn Φø=0.7628 V(+)Cu2+ + 2e-=Cu Φø=0.337 V则电池电动势:ΔEø=Φø(+)-Φø(-)=0.337-(-0.7628)=1.10V >0∴反应向右进行.判断氧化还原反应进行的程度从热力学的学习中大家已经了解到自发进行的反应自由能变化为负值,而在本章我们又看到氧化还原反应自发进行的方向是电池电动势大于零的方向.将这两种判断结合在一起考虑,就可知体系的自由能在恒温恒压下减少的值等于体系作最大有用功的能力(非膨胀功),即ΔG=-WR.在电池中如果非膨胀功只有电功一种,那么自由能和电池电动势之间就有下列关系:电功=电量×电动势=Q·E=nFE∴Δr G =-nFE (9-1)Δr G是自由能变化(kJ),n是在反应中电子的转移数,F是法拉第常数96.487kJ·V-1·mol-1,E是电动势(V).当反应物和产物是在标准状态时,电池电动势为Eø,则Δr Gø=-nFEø(9-2) 已经介绍过标准自由能变化和平衡常数的关系:Δr Gø=-RTlnK(9-3) 用以10为底的对数来表示,得:Δr Gø=-2.303RTlgK将(9-2)与上面的方程合并得:Δr Gø=-nFEø=-2.303RTlgKnFEø=2.303RTlgK求298.15K时,2.303RT/F的数值:T=298.15K R=8.314J·K-1·mol-1F=96.487kJ·V-1·mol-1所以298.15K时平衡常数和Eø的关系式为:(9-4) 式中,n表示总反应得失电子总数,Eø表示标准态下的电池电动势.根据(9-4)式,已知标准状态下正负极的电极电势,即可求出该电池反应的平衡常数K.从(9-4)式可以看出,正,负极标准电势差值越大,平衡常数也就越大,反应进行得越彻底.因此,可以直接用Eø的大小来估计反应进行的程度.按一般标准,平衡常数K=105,反应向右进行的程度就算相当完全了.综上所述,标准电极电势不仅可以用来比较氧化还原剂的强弱,而且可以判断氧化还原反应进行的方向和程度,它使氧化还原反应的研究定量化了.因此,标准电极电势是氧化还原反应很好的定量标度.但是,也应该注意标准电极电势并不是万能的,它的应用是有条件的,能解决的问题是有限制的.应用标准电极电势时应该注意的问题(l)Φø与反应速度无关.Φø从热力学的角度衡量反应进行的可能性和进行的程度.是电极处于平衡状态时表现出的特征值,它与平衡到达的快慢,反应速度的大小无关.当我们用Φø来解释实验现象时,特别要注意这一点.例如,从标准电极电势看,钠的活泼性应小于锂,但Li,Na与水反应时,钠与水反应更为剧烈.为什么会出现这样的现象?我们发现实验结果不仅取决于反应的可能性,趋势和程度,还和实现反应的速度快慢有关.而Φø值的大小只能说明反应的可能性,趋势和程度的高低.由于氧化还原反应进行的速度常常比中和反应和沉淀反应慢,所以,对于氧化还原反应,反应速度常常是不可忽视的问题.(2)Φø的应用是有条件的.Φø的数据是在标准状态下水溶液中测出的,对非水溶液,高温,固相反应是不适用的.例如,欲判断C+O2CO2反应能否进行,Φø则无能为力了.(3)Φø与电极反应中物质的计量系数无关.因为Φø是电极的强度性质,取决于物质的本性,而和物质的多少无关.所以电极反应中各物质的系数无论乘以什麽系数,其标准电极电势的数值仍然不变.例如: Ag+ + e-Ag φθ=0.7996V2Ag+ + 2e-2Ag φθ=0.7996V。
氧化还原性强弱顺序

常见物质得氧化性还原性强弱顺序一、顺序得由来及依据学过氧化还原反应得强弱律之后,我们可以根据下列反应 ①2FeCl 2+Cl 2=2FeCl 3 ②2FeCl 3+2HI =I 2+2FeCl 2+2HCl③I 2+K 2S =S+2KI判断氧化剂得氧化性由强到弱得顺序为 Cl 2>Fe 3+>I 2>S 同样可以得出还原性由弱到强得顺序为Cl -<Fe 2+<I -<S 2-推而广之,我们可以根据大量得氧化还原反应得出常见物质得氧化性还原性顺序。
再者,从理论上由物质得标准电极电势也可得到同样得结论。
二、常见氧化剂(还原剂)得氧化性(还原性)由强到弱顺序关于SO 2、SO 32-还原性得说明:由于在溶液中SO 2、SO 32-得氧化产物就是稀硫酸而不就是浓硫酸,再者,由反应I 2+SO 2+2H 2O ===2HI +H 2SO 4可得,还原性I -<SO 2,所以SO 2、SO 32-得还原性比I -强,但比S 2-弱。
三、助记口诀:氟锰氯硝浓硫酸,溴铁铜碘硫氢铅。
往后离子氧化性,前氧后低表来翻。
理解要点:(1)注意各微粒中元素得价态(2)由氧化性顺序可得还原性顺序,氧化剂得氧化性越强,其对应得还原产物还原性越弱。
(3)强氧化剂可氧化弱氧化剂得还原产物生成弱氧化剂,此之谓“前氧后低”即前面得物质可氧化后面物质得低价态。
四、应用举例1、推测物质可能发生得氧化还原反应(见下表)2、推测能否反应及产物如①Fe3+与I-可反应但不能与Cl-,Br-反应;②浓H2SO4能干燥HCl但不能干燥HBr、HI、H2S;③ Fe与Cl2,Br2能生成FeCl3,FeBr3但与I2,S只能生成FeI2,FeS;④能把Fe氧化成Fe3+得有Cl2,HNO3,浓H2SO4,Br2但I2,S都只能把Fe氧化成+2价。
⑤HNO3能氧化HBr,HI,H2S但不能氧化HCl3、推测反应顺序①如少量Cl2通入到FeBr2,FeI2中得离子方程式就不同;②把Fe投入到Fe2(SO4)3+H2SO4+CuSO4混合液中时相继发生得反应顺序。
氧化剂还原剂强弱比较及其规律

2NaI + Cl2 = 2NaCl + I2
Na2S + I2 = 2NaI + S
A. Cl2 > I2 >S C. I2 >Cl2 > S
B. Cl2 >S >I2 D. S >I2 >Cl2
分析:
-2 0
0
-1
H2S + Cl2 = S + 2HCl
氧化剂 氧化产物
-1 0
-1 0
2NaI + Cl2 பைடு நூலகம் 2NaCl + I2
得电子总数=失去电子总数=电子转移总数 (2)化合价升降守恒
化合价升高总数=化合价降低总数
2、价态规律 高价氧,低价还,中间价,两边转 ⑴元素处于最高价,只有氧化性;
⑵元素处于最低价,只有还原性;
⑶元素处于中间价态,既有氧化性又有还原性。 常见的变价元素有:Cl、Mn、S、N、Fe等
【练习】 1、下列微粒中,只有氧化性的是 (5) (6) ;
N2O3 + H2O
②NH3 + N歧O 化反应HNO2 + H2O
③N2O4 +H2O
HNO3 + HNO2
其中你认为一定不可能实现的是:(B)
A. ① B. ② C. ③ D. ①②③
【练习】1、在黑火药的爆炸反应
2KNO3 + S + 3C = K2S + N2↑+3CO2↑中,化合 价升高的元素是 C ,得电子的原子是 N、S, 被还原的元素是 N、,S 发生氧化反应的物质 是 C。 氧化剂是:KNO3 和S;还原剂是: C 。
化性(或还原性)越弱;反之,则反应越易 进行,氧化性(或还原性)越强。
强氧化剂和强还原剂

强氧化剂和强还原剂
嘿,大伙们!今天咱来聊聊强氧化剂和强还原剂。
这强氧化剂和强还原剂啊,就像一对欢喜冤家。
强氧化剂呢,特别厉害,能把别的东西氧化得服服帖帖。
强还原剂呢,也不示弱,能把被氧化的东西给还原回来。
我记得有一次上化学课,老师给我们做实验。
老师拿出一瓶高锰酸钾,说这就是强氧化剂。
哇,那颜色可深了,紫得发黑。
老师又拿出一些铁粉,说这是还原剂。
然后老师把高锰酸钾和铁粉放在一起,哇,那场面可热闹了。
高锰酸钾开始冒泡,铁粉也开始变黑。
老师说,这就是强氧化剂和强还原剂在起反应呢。
强氧化剂和强还原剂在生活中也有很多用处呢。
比如说,漂白粉就是一种强氧化剂。
它能把衣服上的污渍氧化掉,让衣服变得白白净净。
还有消毒水,也是强氧化剂。
它能杀死细菌和病毒,让我们的生活更健康。
强还原剂也很有用哦。
比如说,在电池里就有强还原剂。
它能把化学能变成电能,让我们的手机、电脑能工作。
还有在炼铁的时候,也需要强还原剂。
它能把铁矿石里的铁还原
出来,变成我们能用的铁。
不过呢,强氧化剂和强还原剂也很危险哦。
如果不小心碰到了,可能会烧伤皮肤。
所以啊,我们在使用的时候一定要小心。
总之啊,强氧化剂和强还原剂虽然很厉害,但我们也要正确使用它们。
这样才能让它们为我们的生活服务,而不是给我们带来麻烦。
嘿嘿。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
强氧化剂:
1活泼的金属单质,如X2(卤素)、O2、O3、S等
2高价金属阳离子,如Cu²+,Fe3+等或H+
3高价过较高价含氧化合物,如MnO2、KMnO4、K2Cr2O7、HNO3、H2SO4(浓)、KClO3、HClO等
4过氧化物,如Na2O2、H2O2等
弱氧化剂:
氧化铜氢氧化铜银氨溶液(有机里会用到)水
强还原剂:
活泼或较活泼的的金属,如K,Na,Mg,Al,Zn,Fe等
2低价金属阳离子,如Fe2+,Sn2+等
3非金属阳离子,如Cl-,B-,I-,S2-等
4某些非金属单质,如H2,C,Si
锂钠钾氢气(这个一般)金属氢化物草酸金属钠族、碱土族金属、铁等常见非贵金属、氢气、硫、磷
弱还原剂:
一些金属一氧化碳碳硫
氧化剂
活泼非金属单质:X2、O2、S 高价金属离子:Fe3+、Sn4+
不活泼金属离子:Cu2+、Ag+ 其它:[Ag(NH3)2]+、新制Cu(OH)2
含氧化合物:NO2、N2O5、MnO2、Na2O2、H2O2 、HClO、
HNO3、浓H2SO4、NaClO、Ca(ClO)2、KClO3、
KMnO4、王水
还原剂活泼金属单质:Na、Mg、Al、Zn、Fe
某些非金属单质:C、H2、S 低价金属离子:Fe2+、Sn2+
非金属的阴离子及其化合物:
S2-、H2S、I -、HI、NH3、Cl-、HCl、Br-、HBr 低价含氧化合物:
CO、SO2、H2SO3、Na2SO3、Na2S2O3、NaNO2、
H2C2O4、含-CHO的有机物:醛、甲酸、甲酸盐、甲酸某酯、葡萄糖、麦芽糖等
既可作氧化剂又可作还原剂的有:S、SO32-、HSO3-、H2SO3、SO2、NO2-、Fe2+等,及含-CHO的有机物
蓝色固体:胆矾(蓝矾、五水硫酸铜CuSO4•5H2O)
绿色固体:碱式碳酸铜(铜绿)
黑色固体:碳粉、氧化铜、二氧化锰、四氧化三铁
白色固体:无水硫酸铜(CuSO4)、氯酸钾、氯化钾、氧化镁、氯化钠、碳酸钙、碳酸钠、硫酸锌
紫黑色:高锰酸钾
浅绿色溶液:硫酸亚铁(FeSO4)
气体H2、O2、CO2、HCl 、HBr、HI、Cl2、Br2、O3、SO2、NO、NO2、NH3、N2、CO、CH4、C2H4、C2H2中
可以从颜色来识别的有哪些?
Cl2、Br2、NO2、O3
NO遇空气变红棕色
哪些气体有特殊气味?
NH3、SO2、NO2、Br2、Cl2、HCl、HBr、HI、O3
哪些气体易溶于水?
NH3、HCl、HBr、HI、SO2 (NO2)
能在空气中形成白雾的气体有哪些?
HCl、HBr、HI(HNO3)
利用燃烧来鉴别的气体有哪些?燃烧现象有什么不同?
H2、CO、CH4、C2H2、C2H4
火焰颜色亮度烟干冷的小烧杯罩在火焰上看是否有水出现倒过来,注入澄清石灰水看是否会变浑浊
溶于水显酸性的气体有哪些?碱性的呢?
CO2、HCl、HBr、HI、Cl2、SO2、NO2;NH3
利用通入溶液中产生沉淀的方法检验的气体有哪些?
CO2 SO2 HCl HBr HI
具有强氧化性的气体有哪些?有什么共同的实验现象?怎样区别它们?
Cl2、Br2、NO2、O3 能使湿润的KI淀粉试纸变蓝
Br2与NO2的区别:1通入水中2通入AgNO3溶液3加压
能使溴水褪色的气体有哪些?
SO2、NH3、C2H2、C2H4
能使澄清石灰水变浑浊的气体有哪些?你能用多少种方法鉴别它们?
SO2、CO2
1气味2品红3溴水(氯水)4 KMnO4溶液5FeCl3溶液
具有漂白作用的气体有哪些?漂白原理有什么不同?
Cl2、O3、SO2 前两种漂白是由于强氧化性,后者是与有机色素结合,可逆,只能漂白某些色素
能使CuO变红的气体有哪些?
H2、CO、NH3等
什么气体遇蘸了浓氨水的玻棒产生白烟?
HCl、HBr、HI、Cl2(HNO3)
易液化的气体有哪些?Cl2、NH3、SO2。
