2021年新高考化学最新模拟好题汇编(含详解):化学能与热能
2021新高考化学模拟试题后附答案(3套)

2021年新高考化学模拟试题1.中华文化瑰宝记载着历史的兴衰与成败,具有重要的历史价值与科学研究价值。
下列关于文物的说法正确的是( )A.新疆和田玉被称为“美玉”,和田玉是在一定条件下发生化学反应而形成的B.中医药学是我国文化瑰宝,中药的提取分离、浓缩、干燥过程发生了化学变化C.陶瓷文物配补时需要用到的石膏粉、环氧树脂、滑石粉等均属于无机化合物D.《千里江山图》采用了石绿中的头绿和四绿,其均为孔雀石,主要成分为碳酸铜 2.用化学用语表示2222322Na O 2CO 2Na CO O ++中的相关微粒,其中错误的是( )A.中子数为10的氧原子:188OB.22Na O 中含有非极性键和离子键C.若用188O 标记二氧化碳中的氧原子,则产物中均含有188OD.2CO 的结构式:O = C = O3.下列应用不涉及氧化还原反应的是( )A.22Na O 用作呼吸面具的供氧剂B.工业上电解熔融状态的23Al O 制备AlC.工业上利用合成氨实现人工固氮D.实验室用4NH Cl 和()2Ca OH 制备3NH4.设A N 表示阿伏加德罗常数的值。
反应222422H O N H N H O ++→(未配平)可为火箭发射提供动力,下列说法错误的是( )A.标准状况下,17 g 22H O 溶液中含有氧原子的数目为A NB.3.2 g 24N H 中含有共用电子对的数目为0.5A NC.生成1 mol 2N 时转移电子的数目为4A ND.0.1 mol 2H O 中含有质子的数目为A N5.肼()22H NNH 是一种高能燃料,有关化学反应的能量变化如图所示。
已知断裂1 mol 化学键所需的能量(kJ):N N ≡为942、O=O 为500、N —N 为154,则断裂1 mol N —H 键所需的能量(kJ)是( )A.194B.391C.516D.6586.药物普加巴林可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:下列有关叙述正确的是( )A.该反应为加成反应FeCl溶液区别乙酰水杨酸和对乙酰氨基酚B.可用3NaHCO溶液反应C.乙酰水杨酸和对乙酰氨基酚均能与3D.普加巴林与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠7.利用下列装置进行实验,能达到实验目的的是( )H B.用乙比较碳元素与硫元素的非金属性强弱A.用甲制备并收集纯净的2C.用丙提取溴水中的溴单质D.用丁蒸发2MgCl 溶液制备2MgCl8.海藻中含丰富的、以离子形式存在的碘元素。
2021届高三化学二轮复习化学能与热能(含答案)

D.Zr+CH4→CH—Zr···H3ΔH=+39.54kJ•mol-1
二、原理综合题
16.研究氨的合成和分解对工业生产和防治污染有重要意义,回答下列问题:
(1)化学键键能数据如下:
化学键
H—H
N≡N
N—H
436
946
391
氨分解反应 的活化能 ,由此计算合成氨反应 的活化能 _______ 。
15.金属插入CH4的C—H键形成高氧化态过渡金属化合物的反应频繁出现在光分解作用、金属有机化学等领域,如图是CH4与Zr形成过渡金属化合物的过程。下列说法不正确的是()
A.整个反应快慢,由CH2—Zr···H2→状态2反应决定
B.Zr+CH4→CH3—Zr···H活化能为213.67kJ•mol-1
A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
C.5NH4NO3 2HNO3+4N2↑+9H2O反应中,生成28gN2,转移的电子数目为3.75NA
D.反应N2(g)+3H2(g)⇌2NH3(g)△H=-92kJ/mol放出热量9.2kJ时,转移电子小于0.6NA
D.步骤①2Fe3+(aq) + 2I-(aq) = I2(aq) + 2Fe2+(aq) ΔH1;步骤②2Fe2+(aq) + (aq) = 2Fe3++ 2 (aq) ΔH2,则ΔH1> ΔH2
12.如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列说法不正确的是
新高考2021届高考化学小题必练9化学能与热能(含答案)

高考化学小题必练考查化学反应过程中化学键的断裂和形成过程中的能量变化,吸热反应和放热反应的判断,能量的转化和利用,热化学方程式的意义,热化学方程式的书写及正误判断;利用盖斯定律书写热化学方程式和进行反应热计算。
1.【2020年江苏卷】反应42SiCl (g)+2H (g)Si(s)+4HCl(g)高温可用于纯硅的制备。
下列有关该反应的说法正确的是()A .该反应ΔH >0、ΔS <0B .该反应的平衡常数()()4242c (HCl)K c SiCl c H =⨯ C .高温下反应每生成1mol Si 需消耗2×22.4L H 2D .用E 表示键能,该反应ΔH=4E(Si —Cl)+2E(H —H)-4E(H —Cl)【答案】B【解析】SiCl 4、H 2、HCl 为气体,且反应前气体系数之和小于反应后气体系数之和,因此该反应为熵增,即ΔS >0,故A 错误;B .根据化学平衡常数的定义,该反应的平衡常数K=4242c (HCl)c(SiCl )c (H )⋅,故B 正确;C.题中说的是高温,不是标准状况下,因此不能直接用22.4L ·mol −1计算,故C 错误;D .ΔH=反应物键能总和-生成物键能总和,即ΔH=4E(Si —Cl)+2E(H —H)-4E(H —Cl)-2E(Si —Si),故D 错误;答案为B 。
【点睛】熵代表的是体系的混乱度,混乱度越大,熵越大。
2.【2020年天津卷】理论研究表明,在101kPa 和298K 下,HCN(g)HNC(g)异构化反应过程的能量变化如图所示。
下列说法错误的是( ) (新高考)小题必练9:化学能与热能A.HCN比HNC稳定B.该异构化反应的ΔH=+59.3kJ·mol−1C.正反应的活化能大于逆反应的活化能D.使用催化剂,可以改变反应的反应热【答案】D【解析】A.根据图中信息得到HCN能量比HNC能量低,再根据能量越低越稳定,因此HCN比HNC稳定,故A正确;B.根据焓变等于生成物总能量减去反应物总能量,因此该异构化反应的11-+⋅∆=⋅,故B正确;C.根据图中信息得出该=59.3kJ mol59.3kJ molH--反应是吸热反应,因此正反应的活化能大于逆反应的活化能,故C正确;D.使用催化剂,不能改变反应的反应热,只改变反应路径,反应热只与反应物和生成物的总能量有关,故D 错误。
2021年各地高考化学真题分类汇编:化学能与热能
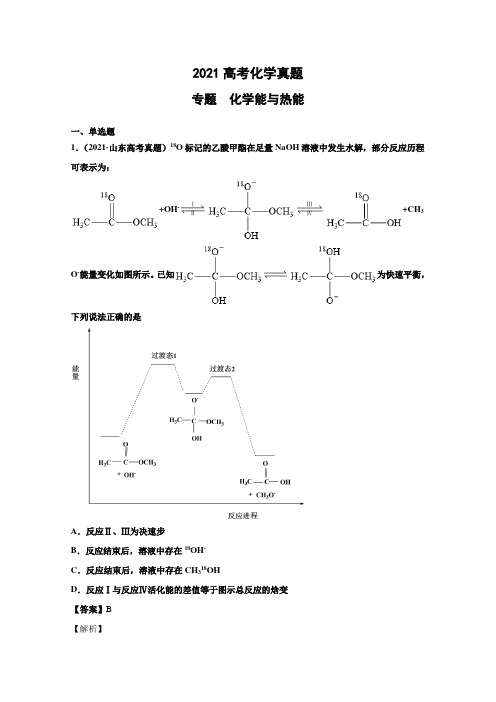
2021高考化学真题专题化学能与热能一、单选题1.(2021·山东高考真题)18O标记的乙酸甲酯在足量NaOH溶液中发生水解,部分反应历程可表示为:+OH-ⅠⅡⅢⅣ+CH3O-能量变化如图所示。
已知为快速平衡,下列说法正确的是A.反应Ⅱ、Ⅲ为决速步B.反应结束后,溶液中存在18OH-C.反应结束后,溶液中存在CH318OHD.反应Ⅰ与反应Ⅳ活化能的差值等于图示总反应的焓变【答案】B【解析】A .一般来说,反应的活化能越高,反应速率越慢,由图可知,反应I 和反应IV 的活化能较高,因此反应的决速步为反应I 、IV ,故A 错误;B .反应I 为加成反应,而与为快速平衡,反应II 的成键和断键方式为或,后者能生成18OH -,因此反应结束后,溶液中存在18OH -,故B 正确;C .反应III 的成键和断键方式为或,因此反应结束后溶液中不会存在CH 318H ,故C 错误;D .该总反应对应反应物的总能量高于生成物总能量,总反应为放热反应,因此和CH 3O -的总能量与和OH -的总能量之差等于图示总反应的焓变,故D 错误;综上所述,正确的是B 项,故答案为B 。
2.(2021·浙江)相同温度和压强下,关于反应的ΔH ,下列判断正确的是A .12ΔH >0,ΔH >0B .312ΔH =ΔH +ΔHC .3212>ΔH ,ΔH ΔH >ΔHD .423=ΔH H +ΔΔH【答案】C 【解析】A .环己烯、1,3-环己二烯分别与氢气发生的加成反应均为放热反应,因此,21H 0,H 0∆∆<< ,A 不正确;B .苯分子中没有碳碳双键,其中的碳碳键是介于单键和双键之间的特殊的共价键,因此,其与氢气完全加成的反应热不等于环己烯、1,3-环己二烯分别与氢气发生的加成反应的反应热之和,即312H H H ∆≠∆+∆,B 不正确;C .环己烯、1,3-环己二烯分别与氢气发生的加成反应均为放反应,21H 0,H 0∆∆<<,由于1mol 1,3-环己二烯与氢气完全加成后消耗的氢气是等量环己烯的2倍,故其放出的热量更多,其12H H ∆>∆;苯与氢气发生加成反应生成1,3-环己二烯的反应为吸热反应(4ΔH >0),根据盖斯定律可知,苯与氢气完全加成的反应热342H =H +H ∆∆∆,因此32H H ∆>∆,C 正确;D .根据盖斯定律可知,苯与氢气完全加成的反应热342H =H +H ∆∆∆,因此342H -H H ∆∆=∆,D 不正确。
2021届高考化学一轮复习化学能与热能专题测试卷【含答案】

2021届高考化学一轮复习化学能与热能专题测试卷一、单选题1.下列设备工作时,将化学能转化为热能的是A.A B.B C.C D.D2.已知有平衡关系:①2SO2(g) + O2(g) = 2SO3(g) ΔH1= a kJ/mol②3O2(g) = 2O3(g) ΔH2= b kJ/mol则可推测反应:SO2(g) + O3(g) = SO3(g) + O2(g) 的ΔH3= ( ) kJ/molA.a+b B.a-b C.0.5b-0.5a D.0.5a-0.5b3.已知相同条件下,下列反应的焓变和平衡常数分别表示为①2H2O(g)=O2(g)+2H2(g)ΔH1 K1=x②Cl2(g)+H2(g)=2HCl(g)ΔH2 K2=y③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)ΔH3 K3=x则下列关系正确的是()A.ΔH3=ΔH1+2ΔH2z=xy2B.ΔH3=ΔH1+ΔH2z=x+yC.ΔH3=ΔH1+2ΔH2z=x﹣y2D.ΔH3=ΔH1+ΔH2z=x y4.美国亚利桑那州大学和阿贡国家实验室的科学家最近设计出生产氢气的人造树叶,原理为2H2O(g)太阳能2H2(g)+O2(g)。
有关该反应的说法错误的是A.氢能是理想的绿色能源B.该反应最终是将太阳能转化为电能C.该反应为充分利用太阳能开辟了广阔前景D.没有人造树叶和太阳能的作用,该反应在常温下不能自发进行5.下列过程中△H大于零的是( )A.碳的燃烧B.葡萄糖在人体内氧化分解C.Ba(OH)2·8H2O与NH4Cl反应D.锌粒与稀H2SO4反应制取H26.已知:CO(g)+2H 2(g)CH3OH(g) △H,反应过程中生成1mol CH3OH(g)的能量变化如下图所示。
曲线△、△分别表示无或有催化剂两种情况。
下列判断正确的是A.加入催化剂,△H变小B.△H=+91 kJ/molC.生成1molCH3OH(l)时,△H值增大D.反应物的总能量大于生成物的总能量7.已知反应X Y M N+=+为吸热反应,下列对该反应的说法正确的是()A.X的能量一定低于M的能量,Y的能量一定低于N的能量B .因为该反应为吸热反应,故需要加热反应才能进行C .破坏反应物中的化学键所吸收的能量大于形成生成物中化学键所放出的能量D .反应物X 和Y 的总能量大于生成物M 和N 的总能量8.下列说法正确的是A .1mol 碳在常温常压下燃烧所放出的热量为碳的燃烧热B .1molH 2完全燃烧生成1mol 气态水所放出的热量称为氢气的燃烧热C .化石燃料主要包括石油、煤和天然气,它们蕴藏无限,可以再生D .太阳能是新能源、可再生能源9.下列反应中生成物总能量高于反应物总能量的是( )A .碳酸钙受热分解B .乙醇燃烧C .铝粉与氧化铁粉末反应D .氧化钙溶于水 10.下列有关热化学方程式的叙述正确的是A .在稀溶液中:()()()2H aq OH aq H O l H 57.3kJ /mol +-+==- ,若将含240.6molH SO 的稀硫酸与含1mol NaOH 的稀溶液混合,放出的热量等于57.3kJB .已知正丁烷()g →异丁烷()g H 0<,则正丁烷比异丁烷稳定C .()()()12222H g O g 2H O l H 571.6kJ?mol -+==-,则2H 的燃烧热为1571.6kJ?mol -D .已知()()()2212C s 2O g 2CO g H +=,()()()222C s O g 2CO g H +=,则12H H >11.已知下列热化学方程式:2Zn(s)+O 2(g)=2ZnO(s) △H 1=−702.2kJ/mol Hg(l)+12O 2(g)=HgO(s) △H 2=−90.7kJ/mol 由此可知Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H 3,其中△H 3的值是A.−260.4kJ/mol B.−254.6kJ/mol C.−438.9kJ/mol D.−441.8kJ/mol12.已知H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol,则反应HCl(g)=12H2(g)+12Cl2(g)的△H为()A.+184.6kJ/mol B.-92.3kJ/mol C.-369.2kJ/mol D.+92.3kJ/mol13.一个化学反应无论是一步完成还是分几步完成,反应热都是一样的。
2021版高考化学考点分类汇编(近3年真题+模拟)专题五 化学能与热能 (2)(1)

专题五化学能与热能高考试题考点一化学反映中能量转变的概念及计算1.(2021年北京理综,6,6分)以下设备工作时,将化学能转化为热能的是( )A B C D硅太阳能电池锂离子电池太阳能集热器燃气灶解析:硅太阳能电池是将光能转化为电能,A错误;锂离子电池是化学电池,将化学能转化为电能,B错误;太阳能集热器将光能转化为热能,C错误;燃气灶工作时将化学能转化为热能,D正确。
答案:D2.(2021年大纲全国理综,9,6分)反映A+B C(ΔH<0)分两步进行:①A+B X(ΔH>0),②X C(ΔH<0)。
以下示用意中,能正确表示总反映进程中能量转变的是( )解析:该反映第①步ΔH>0,为吸热反映,那么说明A+B总能量小于X,第②步ΔH<0,为放热反映,那么说明X能量大于C。
那么正确的图像应为D。
答案:D3.(2021年江苏化学,4,2分)某反映的反映进程中能量转变如下图(图中E1表示正反映的活化能,E2表示逆反映的活化能)。
以下有关表达正确的选项是( )A.该反映为放热反映B.催化剂能改变该反映的焓变C.催化剂能降低该反映的活化能D.逆反映的活化能大于正反映的活化能解析:该反映的反映物总能量低于生成物总能量,为吸热反映,A错误;有催化剂和无催化剂时,ΔH相同,说明催化剂不能改变该反映的焓变,B错误;无催化剂时,该反映的活化能为E1,有催化剂时,活化能E2小于E1,说明催化剂能降低该反映的活化能,C正确;逆反映的活化能为E2,正反映的活化能为E1,E2<E1,D错误。
答案:C4.(2020年上海化学,3,2分)据报导,科学家开发出了利用太阳能分解水的新型催化剂。
以下有关水分解进程的能量转变示用意正确的选项是( )解析:水的分解为一吸热反映,即产物能量应高于反映物能量。
另外,催化剂可降低反映所需的活化能。
答案:B5.(2020年江苏化学,10,2分)以下图示与对应的表达相符的是( )A.图1表示某吸热反映别离在有、无催化剂的情形下反映进程中的能量转变B.图2表示0 mol·L-1 NaOH溶液滴定mL 0 mol·L-1 CH3COOH溶液所取得的滴定曲线C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的不饱和溶液D.图4表示某可逆反映生成物的量随反映时刻转变的曲线,由图知t时反映物转化率最大解析:图1表示的为放热反映,A项错误;图2中, 0 mol·L-1CH3COOH溶液的pH应大于1小于2,图中标注等于1,B项错误;图3中,80 ℃时KNO3饱和溶液中溶解的m(KNO3)>a g,C 项正确;图4中,t时反映未达平稳,那么现在反映物转化率尚未达到最大,D项错误。
高一化学《化学能与热能习题》(含解析)

化学能与热能1 .天然气燃烧过程中的能量转化方式为2 .下列关于化学反应的说法中不正确的是()A.化学反应过程中一定有热量释放出来B.化学反应的特征是有新物质生成C.化学反应的过程实际上是一个旧键断裂、新键形成的过程D.在一确定的化学反应关系中,反应物的总能量与生成物的总能量一定不相等B.①③6.已知反应A 2+B 2===2AB,破坏1 mol A 2中的化学键吸收的能量为 Q i kJ,破 坏1 mol B 2中的化学键吸收的能量为 Q 2 kJ,形成1 mol AB 中的化学键放出的能量为Q 3 kJ,则下列说法中正确的是 ( )A.若A 2和B 2的总能量大于生成的AB 的总能量,则反应吸热A.化学能转化为热能B. 化学能转化为电能C.热能转化为化学能D. 化学能转化为机械能3. 卜列变化过程中,需要吸收能量的是()A. H+H —> H 2B, H + Cl —>HCl C. Cl 2-> Cl + ClD. H2+O2->H2O 4. 卜列说法中正确的是(A.任何化学反应都伴随着能量的变化B. H 2O (g )—>H 2O (l )该过程放出大量的热,所以该过程是化学变化C.化学反应中能量的变化都表现为热量的变化D.对于如图所示的过程,是吸收能量的过程5.某学生用如图所示的装置进行化学反应 X + 2Y-2Z 能量交化情况的研究。
当往试管中滴加试剂Y 时,看到试管中甲处液面下降,乙处液面上升。
关于该反应的下列叙述正确的是()①该反应为放热反应②反应物的总能量比生成物的总能量高An p L % ■ ③该反应过程可以看成是“贮存”于 X 、Y 内部的能量转化为热量而释放出来B.若A2和B2的总能量小于生成的AB的总能量,则反应放热C.若该反应为放热反应,则 Q l + Q2<Q3D.若该反应为吸热反应,则Q I +Q2>2Q37.已知2SO2+O2===2SC3为放热反应,对该反应的下列说法正确的是 ( )A.O2的能量一定高于SO2的能量B.SO2和O2的总能量一定高于SO3的总能量C.SO2的能量一定高于SO3的能量D.因该反应为放热反应,故不必加热就可发生8.白磷、红磷是磷的两种同素异形体。
2021届高考化学一轮复习优选:化学能与热能

2021高考化学(一轮)优选:化学能与热能含答案专题:化学能与热能一、选择题1、已知:H2(g)+F2(g)===2HF(g)ΔH=-270 kJ·mol-1,下列说法正确的是() A.氟化氢气体分解生成氢气和氟气的反应是放热反应B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJC.在相同条件下,1 mol H2与1 mol F2的能量总和小于2 mol HF气体的能量D.该反应中的能量变化可用下图来表示2、已知:①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l)ΔH1;②C(s)+O2(g)===CO2(g)ΔH2;③2H2(g)+O2(g)===2H2O(l)ΔH3;④2CO2(g)+4H2(g)===CH3COOH(l)+2H2O(l)ΔH4;⑤2C(s)+2H2(g)+O2(g)===CH3COOH(l)ΔH5。
下列关于上述反应的焓变的判断正确的是()A.ΔH1>0,ΔH2<0B.ΔH5=2ΔH2+ΔH3-ΔH1C.ΔH3>0,ΔH5<0D.ΔH4=ΔH1-2ΔH33、载人空间站中为循环利用人体呼出的CO2并提供氧气,我国科学家设计了一种装置(如图所示),实现“太阳能→电能→化学能”转化,总反应为2CO2===2CO +O2。
下列有关说法不正确的是()A.该装置属于电解池B.X极发生氧化反应,Y极发生还原反应C.人体呼出的水蒸气参与Y极反应:CO2+H2O+2e-===CO+2OH-D.X极每产生标准状况下22.4 L气体,有2 mol的OH-从Y极移向X极4、已知25 ℃、101 kPa时,乙烯和乙炔(C2H2)燃烧的热化学方程式分别为C2H4(g)+3O2(g)===2CO2(g)+2H2O(l)ΔH=-1411 kJ·mol-1,2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH=-2600 kJ·mol-1,又知燃烧时火焰的温度乙炔高于乙烯。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学能与热能
一、选择题(本题包括10小题,每题6分,共60分)
1.(2020山西阳泉高三期末改编)中国学者在水煤气变换[CO(g)+H 2O(g)CO 2(g)+H 2(g) ΔH ]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的,反应过程示意图如下:
下列说法正确的是( )
A.过程Ⅰ和过程Ⅲ均为放热过程
B.图示过程中的H 2O 均参与了反应过程
C.过程Ⅲ生成了具有极性共价键的H 2、CO 2
D.使用催化剂降低了水煤气变换反应的ΔH
2.(2020河北沧州高三质量检测)已知反应X(g)+3Y(g)
2Z(g) ΔH ,该反应的能量变化如下图
所示。
下列说法正确的是( )
A .ΔH =E 2-E 1
B.更换高效催化剂,E 3不变
C.恒压下充入一定量的氦气,n (Z)会减少
D.压缩容器,c (X)减小
3.(双选)(2020山东实验中学高三诊断改编)下列依据热化学方程式得出的结论正确的是( )
A.已知:正丁烷(g)异丁烷(g) ΔH <0,则异丁烷比正丁烷稳定
B.已知:C 2H 4(g)+3O 2(g)2CO 2(g)+2H 2O(g) ΔH =-1 478.8 kJ·mol -1,则C 2H 4的燃烧热ΔH =-1 478.8 kJ·mol -1
C.已知:H +(aq)+OH -(aq)H 2O(l) ΔH =-57.3 kJ·mol -1,但稀Ba(OH)2(aq)和稀H 2SO 4(aq)完全反应生成1 mol H 2O(l)时,放出的热量大于57.3 kJ
D.已知:S(g)+O 2(g)SO 2(g) ΔH 1;S(s)+O 2(g)SO 2(g) ΔH 2,则ΔH 1>ΔH 2
4.(双选)(2020福建漳州一模改编)下列关于化学反应与能量的说法正确的是( )
A.已知正丁烷的燃烧热ΔH =-2 878 kJ·mol -1,则表示正丁烷燃烧热的热化学方程式为
2CH 3CH 2CH 2CH 3(g)+13O 2(g)8CO 2(g)+10H 2O(l) ΔH =-2 878 kJ·mol -1
B.已知在一定条件下,2 mol SO 2与1 mol O 2充分反应后,释放出98 kJ 的热量,则其热化学方程式为2SO 2(g)+O 2(g)2SO 3(g) ΔH =-98 kJ·mol -1
C.已知稀盐酸与稀NaOH 溶液反应的中和热ΔH =-57.3 kJ·mol -1,则表示稀硫酸与稀NaOH 溶液反应的热化学方程式为12H 2SO 4(aq)+NaOH(aq)
12Na 2SO 4(aq)+H 2O(l) ΔH =-57.3 kJ·mol -1 D.已知CuSO 4(s)+5H 2O(l)
CuSO 4·5H 2O(s),该反应为熵减小的反应
5.(2020浙江教育绿色评价联盟高三适应性考试)碘单质与氢气在一定条件下反应的热化学方程式如下:
①I2(g)+H2(g)2HI(g)ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)2HI(g)ΔH=+26.48 kJ·mol-1
下列说法正确的是()
A.该条件下,1 mol H2(g)和1 mol I2(g)充分反应,放出热量9.48 kJ
B.该条件下,碘升华的能量变化为I2(s)I2(g)
ΔH=+35.96 kJ·mol-1
C.相同条件下,Cl2(g)+H2(g)2HCl(g)的ΔH>-9.48 kJ·mol-1
D.反应①是放热反应,所以反应①的活化能大于反应②的活化能
6.(双选)(2020河北廊坊高中联合体联考改编)工业合成氨反应在催化剂表面的反应历程及能量变化如图所示,下列说法正确的是()
A.增大压强,①→②之间的能量差值不变
B.合成氨的正、逆反应的焓变相同
C.合成氨的过程是吸热反应
D.若使用催化剂,生成等量的NH3需要的时间更短
7.(双选)(2020山东威海质检)2SO2(g)+O2(g)2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。
下列有关叙述不正确的是()
A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数
B.500 ℃、101 kPa下,将1 mol SO2(g)和0.5 mol O2(g)置于密闭容器中充分反应生成SO3(g)放热a kJ,则该反应的热化学方程式为2SO2(g)+O2(g)2SO3(g)
ΔH=-2a kJ· mol-1
C.该反应中,反应物的总键能大于生成物的总键能
D.ΔH=E1-E2,使用催化剂可改变活化能,但不改变反应热
8.(2020河南驻马店高三期末)1 mol常见金属M和卤素反应的焓变ΔH(单位:kJ·mol-1)示意图如图,反应物和生成物均为常温时的稳定状态。
下列选项中不正确的是()
A.MBr2与Cl2反应的ΔH<0
B.化合物的热稳定性顺序:MI2>MBr2>MCl2>MF2
C.MBr2(s)+F2(g)MF2(s)+Br2(l)ΔH=-600 kJ·mol-1
D.由MCl2(s)制得M的反应是吸热反应
9.(2020辽宁辽阳高三期末)甲烷与氧气反应过程中的能量变化如图所示。
下列有关说法中正确的是()
A.1 mol CH4(g)的能量大于1 mol CO2(g)和2 mol H2O(g)的能量总和
B.反应CH4(g)+2O2(g)CO2(g)+2H2O(l)ΔH=-800 kJ·mol-1
C.若破坏1 mol O2(g)中的化学键需吸收热量493 kJ,则破坏1 mol C—H键需吸收热量415 kJ
D.在反应CH4(g)+2O2(g)CO2(g)+2H2O(g)中放出热量400 kJ,则有1 mol O—H键生成
10.(2020四川阆中中学高三质检)已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热(ΔH)分别是-285.8 kJ·mol-1、-1 411.0 kJ·mol-1和-1 366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成1 mol C2H5OH(l)的ΔH为()
A.-44.2 kJ·mol-1
B.+44.2 kJ·mol-1
C.-330 kJ·mol-1
D.+330 kJ·mol-1
二、非选择题(本题包括3小题,共40分)
11.(2020河北沧州调研节选)(12分)甲醛(HCHO)俗称蚁醛,是一种重要的有机原料。
利用甲醇(CH3OH)可制备甲醛:
脱氢法:CH3OH(g)HCHO(g)+H2(g)ΔH1=+92.09 kJ·mol-1
O2(g)HCHO(g)+H2O(g)
氧化法:CH3OH(g)+1
2
ΔH2
(1)已知:2H2(g)+O2(g)2H2O(g)ΔH3=-483.64 kJ·mol-1,则ΔH2=。
(2)与脱氢法相比,氧化法在热力学上趋势较大,其原因
为。
(3)下图为甲醇制备甲醛反应的lg K(K为平衡常数)随温度(T)的变化曲线。
曲线(填“a”或“b”)对应脱氢法,判断依据为。
12.(2020山东济南调研节选)(14分)CH4超干重整CO2技术可得到富含CO的化工原料。
回答下列问题。
CH4超干重整CO2的催化转化如图所示:。
