大豆子叶愈伤组织诱导
(2021年整理)第三章-愈伤组织诱导

(完整)第三章-愈伤组织诱导编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)第三章-愈伤组织诱导)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)第三章-愈伤组织诱导的全部内容。
第三章愈伤组织的诱导与培养第一节愈伤组织的诱导与继代培养愈伤组织(callus): 在培养基上,由外植体经脱分化和细胞分裂形成的一团无序生长的薄壁细胞。
大部分外植体细胞须经脱分化形成愈伤,才能再分化成完整植株,只有茎尖等少数细胞只恢复为分生状态但不分裂,直接再分化。
愈伤组织的诱导与分化是植物组培的基本环节。
一、愈伤组织的诱导及其形态特征1、愈伤组织的诱导1)起动期/诱导期(initiation/induction stage, Induction of growth)外植体细胞在外源激素作用下,经脱分化而恢复分裂状态,开始形成愈伤。
细胞外观无明显变化,代谢旺盛,合成加强,为分裂做准备.持续十几小时~几天。
2)分裂期(divition stage/phase):外植体切口边缘膨大,外层细胞迅速分裂,体积变小,具分生细胞的特征,细胞数速增。
3)形成期(formation stage/Differentiation phase):外植体表层细胞分裂减缓,内部细胞开始分裂,大量细胞形成瘤状/泡状或片状结构。
若不及时继代,将分化出拟分生组织瘤状物和维管组织,又称分化期。
2. 愈伤组织的形态特征质地:松脆易碎的颗粒状;紧密坚实的结块状;水渍或浆糊状。
颜色:白色或淡黄色;淡绿色或绿色;黄色至褐色。
一般,淡黄或淡绿/绿色松脆(近圆形)或致密的颗粒状愈伤再生能力较强,白色/灰白色或黄褐色、浆糊状或紧实(香蕉形)的愈伤再生能力差。
植物组织培养实验报告

摘要:以大豆子叶为外植体,在MS 培养基上附加不同浓度、不同种类的植物激素,以研究不同激素组合和不同浓度对大豆子叶愈伤诱导率的影响,并练习无菌操作。
实验结果显示第 2 组即 MS+6-BA〔2.0mg/L)+NAA(1.0mg/L)和第 3 组即 MS+KT〔0.5mg/L)+2,4-D(1.0mg/L) 培养基中愈伤组织诱导率较高,为较佳的愈伤组织诱导组合。
关键词:大豆;植物组织培养;无菌操作;愈伤组织1.1 实验材料:大豆子叶1.2 实验试剂与仪器〔1〕试剂: 75%酒精、MS 干粉、蔗糖、琼脂、植物生长调节剂〔NAA、2,4-D、KT、6-BA〕、无菌水、升汞、 NaOH 溶液〔2〕仪器:超菌净工作台、圆纸片、培养皿、封口膜、称量纸、千分之一天平、不锈钢杯子、移液枪、试管、高压灭菌锅、注射器、酒精灯、镊子、手术刀、搁置架、烧杯、电炉。
1.3 实验方法培养基的配制与灭菌1.3.1.1 配制培养基的准备阶段〔1〕准备 80 个培养试管及封口膜, 2 个小培养皿、 1 个大培养皿,用洗衣粉、自来水洗净,再用蒸馏水把每一个培养试管、润洗一下。
带晾干后将试管编号 1-80;〔2〕在称量纸上用百分之一天平分别称取 1.5g 琼脂 4 份, 7.5g 蔗糖 4 份,在烧杯里用千分之一天平上称取 1.185g MS 干粉 4 份〔烧杯不要清洗〕;〔3〕剪小圆纸片 40,均分在两个小培养皿小能从中自由取出为宜;剪大圆纸片10,均分在两个大培养皿中。
然后分别用报纸包好。
〔4〕把接种工具手术刀、镊子、剪刀等用报纸包好。
1.3.1.2 配制培养基〔1〕在装有 MS 干粉的烧杯中按下表参加植物生长调节剂实验所用的所有激素浓度均为 0.5mg/mL编号培养基配置激素的加样量(ml)6-BA N A A K T2,4-D1 23 4 MS+6-BA〔1.0mg/L)+NAA(0.5mg/L)MS+6-BA〔2.0mg/L)+NAA(1.0mg/L)MS+KT〔0.5mg/L)+2,4-D(1.0mg/L)MS+KT〔1.0mg/L)+2,4-D(2.0mg/L)0.51.00.250.50.250.50.51.0〔2〕用量筒量取250ml 〔稍多〕蒸馏水,取一个不锈钢杯子参加150ml 蒸馏水和称量好的琼脂,在电炉子加热沸腾 2min,再参加混合好的 MS 培养基 1 号和蔗糖,混合沸腾 2min,用剩余的蒸馏水定容至 250ml;〔3〕当温度降到 60℃摆布时,将溶液 pH 调至 5.8,普通加 4 滴 NaOH 溶液即可;〔4〕取编号 1-20 的培养试管,用大量注射器以每瓶 12.5ml 摆布培养基分装在培养试管中,用封口膜封口, 4 支一捆捆扎好。
大豆愈伤组织诱导及再分化的影响因素探索

化,因此不同植物 对 光 照 强 度 也 有 不 同 要 求。 大 豆 在
体细胞胚胎发生诱 导 过 程 中 对 光 照 的 要 求 不 太 严 格,
可以是黑暗,也可 以 采 用 12~24h 光 照,光 照 强 度 的
[ ]
变化范围也较宽,在 50~6000l
另外,取材季节、外植体的大小与灭菌效果及存活率存
基中的生长素和细胞 分 裂 素 的 相 对 浓 度 有 关,当 生 长
在一定关联,在合适时间如生长旺季取样,试验材料的
素/细胞分裂素比值 高 时,促 进 根 的 分 化;比 值 低 时 则
消毒效果、成活率、诱导率及增殖率往往比在生长末期
促进芽的分化;而当 两 者 平 衡 时 则 会 一 直 处 于 愈 伤 组
分以及激素种类配比 选 取 不 同,大 豆 愈 伤 组 织 的 诱 导
导分化的成功率高,有 的 部 位 极 难 脱 分 化 或 再 分 化 率
以及再生也会相应呈现不同的效果。培养条件对大豆
组织培养的作用也 不 容 忽 视。 因 此,深 入 探 索 大 豆 组
很低。雷 海 英 等 [3]以 晋 豆 19 号 为 材 料,选 取 子 叶 节、
因
刘思言等 [9]以吉农 28、吉农 27、吉农 17 三个基因型大
2.
1 培养基的影响
2.
1.
1 培养基营养组分的影响
豆子叶节作为外植体进行植株再生的研究,结果表明,
培养基 是 外 植 体 赖 以 生 存 的 基 质。 培 养 基 的 种
类、营养组分以及培 养 基 的 状 态 等 也 关 系 着 组 织 培 养
关键。
导效果依次递减,说 明 胚 轴 是 比 较 适 合 的 外 植 体。 再
第三章 植物愈伤组织的诱导、继代及分化

⑶先芽后根:愈伤组织中产生多个分生细胞形成分生中心, 从中仅分化出芽,一般情况下待芽长到一定大小时,切下 移入生根培养基中,在其基部即可分化出根。
有些植物在分化芽的培养基上同时在芽器官基部分化出根, 形成完整的植株。大多数植物均属这类正常的分化途径, 这类苗移栽较易成活。
⑷先根后芽:有些植物外植体脱分化后在愈伤组织上先分 化出根,而后在靠近愈伤组织的根部上再分化出芽,有的 将根切下放入分化培养基,再于根上分化出芽器官,甚至 在根端也能分化出芽。
从单个细胞或外植体上脱分化形成典型的愈 伤组织,大致经历三个时期:
起动期:又称为诱导期,
是愈伤组织形成的起点。 外植体已分化的活细胞 在 外源激素的作用下,
通过脱分化起动而进入 分裂状态,并开始形成 愈伤组织。
起动期
分裂期
分裂期:外植体切口边缘开
始膨大,外层细胞通过一分 为二的方式进行分裂,从而 形成一团具有分生组织状态 细胞的过程。
二、从愈伤组织建立悬浮培养体系
多数悬浮培养物(suspension cultures)是将生长快、质地 疏松的愈伤 小块转移到与愈伤诱导含同样成分的液体培养 基里进行振荡培养而获得。
接种时必须有足够多的细胞块,以保证有较合适的细胞密 度。振荡速度一 般为 30-150rpm。
第一次继代时,应去掉开始时接入的大块细胞团——过滤。
第三节 愈伤组织分化与植株再生
体细胞胚胎发生:指从体细胞进行的类胚结构的生产。 体细胞胚是一个二极结构,不物理地附着于原组织,每一 个体细胞胚称为胚状体,它可以同 合子胚一样发育成植株。 器官发生:指从愈伤组织形成芽及根的过程,芽是一个单 极性结构,物理地同母体组织联结着。
细胞分化
无论是在离体还是在活体条件下,植物细胞分化 研究的重点是维管组织的分化,特别是木质部成 分的分化。
植物愈伤组织诱导实验

实验一植物愈伤组织诱导实验一、实验目的1、掌握植物愈伤组织诱导、继代、器官分化的原理。
2、培养基的配制,灭菌等基本实验操作技术。
二、实验原理植物组织培养是将植物的器官组织以至单个细胞,应用无菌操作方法,使其在人工条件下,能够分裂、增殖、分化发育成一完整植株的过程。
植物的组织在人工培养条件下,原来已经分化停止生长的细胞,可以重新分裂,形成没有组织结构的细胞团,即愈伤组织,这一过程称为“脱分化作用”。
而已经“脱分化”的愈伤组织,在一定条件下,又能重新分化形成输导系统以及根和芽等组织和器官,这一过程称为“再分化作用”。
植物激素在“再分化”过程中起着重要作用,生长素和细胞分裂素的比例,决定了根和芽的分化。
超净工作台原理:本工作台是一种水平单向流型局部空气净化设备室内空气→预过滤器(初滤) →小型离心风机压入静压箱→高效空气过滤器(精滤) →出风面吹出洁净气流(具有一定的、均匀的断面风速)→不断排除工作区原来的空气→形成高洁净的工作环境三、仪器试剂培养皿及培养架、光照培养箱、超净工作台、高压灭菌锅、解剖刀、弯头镊子、剪子、100ml烧杯、培养皿(或不锈钢浅盘)、封口膜、棉线、橡皮筋、次氯酸钠(或HgCl2)、MS 培养基全部试剂、植物激素及生长调节物质、无水乙醇、工业酒精、胡萝卜四、实验步骤(1)用70~75%的酒精棉擦拭双手和操作台面,进行常规的无菌操作准备。
(2)将植物体用自来水冲洗后,用酒精棉擦拭欲取材部位表面, 或于70%酒精中浸沾数秒钟。
(3)将材料放入已灭菌的100ml烧杯(或试剂瓶)中,加入10%的次氯酸钠溶液,浸泡5分钟。
(4)弃次氯酸钠浸泡液,再加入10%的次氯酸钠溶液,浸泡10分钟。
(5)弃次氯酸钠浸泡液,用无菌水浸泡漂洗3~4次,每次1~2分钟,用无菌镊子搅动。
(6)将已灭菌的植物材料置于灼烧后冷却的金属盘中,按无菌操作要求剥去外皮,用解剖刀切成5mm厚的薄片,弃去两头的两片,取中间部分的薄片,用镊子将其接种在愈伤组织诱导培养基上,注意圆片的切口朝向培养基,每瓶4~6片,均匀分散,以绿豆为材料时,将绿豆纵切或横切,去皮后分别接种。
激素对大豆悬浮细胞系愈伤组织诱导的影响

( NAA) 6B 和 - A合用 诱 导 出的大 豆愈 伤组 织 也呈现 出
质地 坚硬 的特 点 , 研 究 结 果 表 明 高 浓 度 的 6B 单 其 -A 用或 与 NAA等 配合使 用 时 , 可诱 导 出愈 伤 组 织 , 虽 但
轴 愈伤组 织诱 导 的影 响 , 选 确 定 了适 于 大豆 悬 浮 细 筛 胞 培养所 要求 的愈伤 组 培 激 素 条 件 , 成功 建 立 了大 并
豆 悬浮 细胞 培养 体系 .
1 材 料 与 方 法
1 1 材 料 .
京豆 1 大 豆种 子 由黑龙 江省 哈尔 滨市大 豆研究 号
素 受 体 结 合 而 发 挥 雌 激 素 样 作 用 , 称 为 植 物 雌 激 被 素C 2, I ] 它们在 缓解 妇女 更年 期综 合 症 , 效 预 防与 激 - 有 素相 关 的癌症 发生 等方 面显 著而 独特 的 生物 学活性 更 引起 了 国 内外 学 者 的关 注[ .然 而 , 3 ] 由于 大 田植 株 生 长周期 长且 受 自然环 境 条 件 的影 响 较 大 , 掌 握 大 要 豆异 黄 酮成分代 谢途 径 的调控 机 理及 通过 异黄 酮代 谢 工程 提高植 物 雌激 素含 量 的研 究 , 必 须 建立 可 迅 速 就 增殖 的细胞 悬 浮培养 体系 .
选择 粒 大 、 满 、 饱 无霉 病斑 的种 子 , 水清洗 后 , 用 于 7 %的酒 精浸 泡 3 , 菌水 冲洗 , 0 0s 无 再浸 泡于有 效氯为 1 的 Na 1 C 0溶液 中 , 断振 荡 , 种子 的表 面充 分接 不 使 触溶 液 , Ori 用无 菌水 冲洗 4 5次 , 种 于 1 2 2 n后 a ~ 接 / MS培养 基 上 , 养 室 ( 5 中 暗培 养 , 种 子 萌 发 培 2 ̄ C) 待
11.3愈伤组织的诱导、形成及分化04

注意:
**愈伤组织遗传上的不稳定性因基因型、外植体、培养基成 分和培养时间而异。 **同基因型的同一种外植体在不同培养基上会产生不同的变 异。 **组织培养中涉及到的遗传变异主要是细胞核组成的改变, 变异是不可逆的,这种遗传上的改变可以是染色体畸变,细 胞核破碎,或者是由于细胞内复制引起的多倍性以及分子水 平上的改变等形式。 **培养基成分,特别是外源激素的成分与变异的产生密切有 关。
周继代一次。
** 继代时应注意愈伤组织分割。
Typical callus growth curve. X indicates time for subculture
拟分生组织
**愈伤组织在分裂期会出现导管细胞,筛管细胞,分泌细胞, 毛状体细胞及木栓细胞等,并出现由小而密集的分裂细胞构 成的细胞团,称为拟分生组织。 **这些区域化的细胞团往往在以后分化中称为形成芽原基及 根原基的中心,愈伤组织也经常呈颗粒状的外形,这些颗粒 中含有韧皮部、木质部和形成层组织,这种具有类似微管组 织的愈伤组织颗粒也具有分化形成不定芽和不定根的能力。
在愈伤组织诱导、增殖和形态建成过程中,对其调控幅 度最大的是植物生长调节物质,主要调节生长调节物质的 种类、浓度和比例,其中生长素和细胞激动素的浓度和配 比对大多数植物材料愈伤组织的诱导、增殖和形态建成的 调控起重要作用。对绝大多数植物材料而言,2,4-D 是诱 导愈伤组织和细胞悬浮培养的最有效物质,常用浓度为 0.2~2mg/L,为促进细胞和组织的生长还要加入0.5~ 2mg/L的细胞激动素(KT)。
callus type
胚性愈伤组织 embryogenic callus
成熟胚 mature embryo
幼穗 immatur e spike
大豆(Glycinemax)遗传转化实验技术原理
大豆(Glycinemax)遗传转化实验技术原理
展开全文
大豆(Glycine max)是一年生草本豆科植物,起源于东亚。
它的种子和豆荚都可食用,是人类重要的油和蛋白质来源。
另外,大豆还是研究植物各种生理功能如固氮和互利共生等的模式植物。
因此,大豆被认为是世界上非常有价值的作物之一。
大豆的遗传转化可以通过基因枪或农杆菌介导来实现。
对于基因枪方法,常用芽分生组织和/或胚性悬浮细胞为外植体,通常由氦驱动的生物分子装置(例如Bio-Rad PDS1000/He)进行轰击。
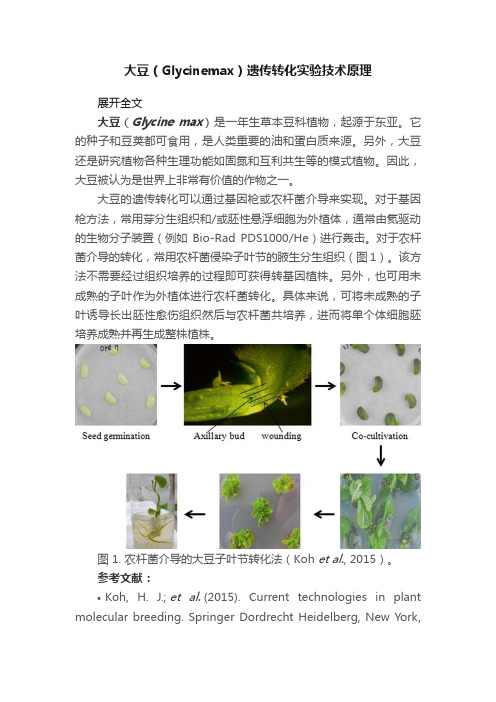
对于农杆菌介导的转化,常用农杆菌侵染子叶节的腋生分生组织(图1)。
该方法不需要经过组织培养的过程即可获得转基因植株。
另外,也可用未成熟的子叶作为外植体进行农杆菌转化。
具体来说,可将未成熟的子叶诱导长出胚性愈伤组织然后与农杆菌共培养,进而将单个体细胞胚培养成熟并再生成整株植株。
图 1. 农杆菌介导的大豆子叶节转化法(Koh et al., 2015)。
参考文献:
•Koh, H. J.; et al. (2015). Current technologies in plant molecular breeding. Springer Dordrecht Heidelberg, New York,
London.。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大豆子叶愈伤组织诱导
XXX
(省略)
摘要:大豆组织培养过程中的培养基的配制、温度、光照、激素配比及浓度等因素都会对愈伤组织的诱导率产生影响,本试验以大豆子叶为材料,接种到不同培养的试管中培养2周。
发现MS+6-BA 1.0 mol·L-1+NAA 0.5 mol·L-1 加蔗糖30 g·L-1,琼脂粉6 g·L-1,肌醇100 mg·L-1,调PH=5.8 的培养基愈伤组织诱导量最多,效果最好。
关键字:大豆子叶;培养基;激素;愈伤组织
前言大豆(Glycine max L.) 在全世界范围内广泛种植,既是重要的粮食作物,又具有较高的经济价值,富含蛋白质和植物油和多种生理有益成分,在食用、药用、饲用等方面均发挥着巨大的作用,是世界上最重要的农作物之一[1,2]。
中国大豆年需求量达4 000 万吨左右,但年产量还不到2 000 万吨,短缺部分依赖进口。
由于一些大豆种子具有坚厚且不透水气的种皮,阻碍了种子萌发,从而导致种子出现发芽率低,发芽期长,发芽不整齐等现象,给大豆生长发育方面带来了一定的影响。
近年来,为了解决这一问题,众多学者将大豆种子萌发的研究重点集中在种子活力,物理因素和化学因素的处理方法上。
大豆体组织培养技术对加速良种繁育、优良种质资源保存、有益突变体筛选及大豆遗传操作、幼胚早期离体培养克服种间或远缘杂交的不可亲性以及克服一些常规育种难以解决的困难有着特殊的作用[3]。
大豆的细胞组织培养研究始于20世纪60年代,但是与其他农作物相比各种外植体的组织培养、成功率、再生植株方面都十分困难。
直到进入80 年代中后期,大豆的组织培养工作才有了突破性的进展。
1 材料与方法
1.1 材料由XX大学植物生理系实验室提供的新鲜健壮的大豆子叶、75%乙醇、
0.1%升汞、组培镊子和刀片、无菌水。
1.2 处理将大豆子叶用用酒精清洗,重复进行4次。
然后用升汞浸泡大豆子叶8 min,然后用蒸馏水清洗4次。
然后用消过毒的镊子和刀片将一片大豆子叶切成小
长方形,然后转入不同培养基的指形试管中,每种培养基设置7×7支试管。
将指形试管置于无菌培养室中。
表1 培养基成分
编号培养基配制
1 MS+6-BA 1.0 mol·L-1+NAA 0.5 mol·L-1
2 MS+6-BA 2.0 mol·L-1+NAA 1.0 mol·L-1
3 MS+2,4-D 1,0 mol·L-1+KT 0.5 mol·L-1
以上培养基均加蔗糖30g·L-1,琼脂粉6g·L-1,肌醇100mg·L-1,调PH=5.8。
2 结果
取出指形试管观察,愈伤组织的污染数、愈伤组织数、生长量和颜色记录在表2中。
表2 植物生长对大豆子叶愈伤组织诱导情况统计
培养基接种数
(个)
污染数
(个)
污染
率(%)
愈伤组织数
(个)
愈伤诱导
率(%)
愈伤生长量愈伤颜色
1 54 3 5.65 4
2 77.78 +++,致密深绿偶见黄色
2 4
3 1 2.33 42 97.67 ++,致密黄绿色
3 47 5 10.6
4 41 87.23 +,疏松黄绿色
表中+++表示量多,++次之,+量最少。
3 分析与讨论
由于本班试验分为三个小组,对于MS+2,4-D 2,0 mol·L-1+KT 1.0 mol·L-1的试验未能进行,试验结论可能增大随机误差。
造成结果不准确。
经过对比笔者发现1、2组的愈伤组织的量多于3组,这可能跟培养基中的成分不同有关。
6-BA和NAA激素的组合对愈伤组织诱导比2,4-D和KT的组合的效果好。
其中1的愈伤组织量多于2说明一定浓度范围内浓度高有利于愈伤组织的诱导。
这与鲍顺淑[2]等的研究结果一致,培养基成分尤其是激素添加对大豆组培苗的生
根和生长有显著性影响。
何恩铭[4]等通过对6个大豆品种用不同培养基进行组织
培养发现MS + 2 ,4-D 2. 0 mg·L-1 + 6-BA 0.5 mol·L-1+ 蔗糖3% + 琼脂0.8%培养基对于大豆子叶和大豆下胚轴可高频率诱导出愈伤组织。
在植物组织培养过程中,温度、湿度、光照强度、CO2浓度等组培物理微环境对组培苗的生长发育有较大的影响改善大豆组培微环境是一项解决大豆组培再生问题的有效措施。
与常规的组织培养相比,无糖培养具有使组培苗生长健壮、生根快、干物质含量高等优。
常规组织培养条件下组培苗受到高湿、低CO2浓度、气体交换不足、光照不足等环境因素的影响,导致苗的生长能力弱甚至不正常生长,组培苗生理状况及品质较差,生根率低,根系活力低,适应能力差,成苗成本过高。
无糖培养通过提高CO2浓度,进行自然通风等措施,改善了大豆组培苗的生长环境,促进组培苗的生长发育,提高组培苗根系活力[3]。
最后向在试验中给予耐心指导和帮助的刘凡老师和倪苏老师表示感谢!
参考文献:
[1] 高会,自强.子萌发影响因素研究进展[J].大豆科学,2011, 30(1): 153-157.
[2] 鲍顺淑, 贺冬仙.可控环境下培养基成分对大豆组培苗生根的影响[J]. 中国农学通
报,2006,22(11): 60-64.
[3] 刘水丽,杨其长. 无糖培养条件下三种大豆组培苗生长差异研究[J]. 大豆科学,2007,26(2): 163-166.
[4] 何恩铭,齐香君,陈秀清,等. 大豆愈伤组织的诱导与离体培养[J]. 陕西科技大学学
报,2005,23(5): 29-31.。
