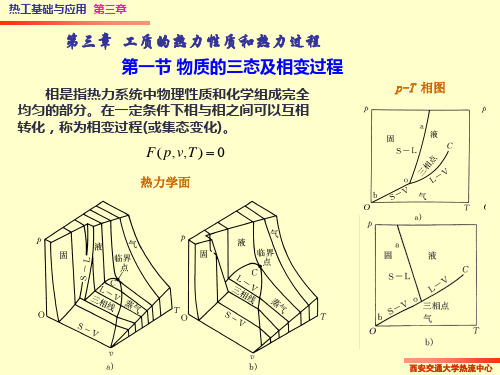
热工基础 第三章.理想气体的性质与热力过程
理想气体
∆h = ∫ c p dT
T1
T2
平均比热容 平均比热容( 平均比热容(表) 定值比热容 热力性质表
∆u = cV ∆u = cV
t2
t1
⋅ (t 2 − t 1 ) ⋅ t 2 − cV
t1
∆h = c p
∆h = c p
t2 t1
⋅ (t 2 − t1 )
⋅ t2 − c p
t1 0° C
t2
0° C
热力学能 焓和熵
T p ∆s = c p ln 2 − Rg ln 2 T1 p1
∆h = c p ∆T = c p ∆t
ct =
t2
1
c 02°C ⋅t2 −c 01°C ⋅t1
t t
t2 −t1
定值比热容表
单原子气体
cV (C ,m) V
c p (Cp,m)
3 3 Rg ( R ) 2 2
双原子气体
0° C
⋅ t1
t2 0° C
⋅ t1
∆u = cV ∆T = cV ∆t
∆u = u 2 (T2 ) − u1 (T1 )
∆h = c p ∆T = c p ∆t
∆h = h2 (T2 ) − h1 (T1 )
西安交通大学热流中心
热工基础与应用 第三章
2、 理想气体的熵
ds =
δqre
T
=
du + pdv cV dT + pdv dT dv p / T = Rg / v = ds = cV + Rg → T T T v
混合气体 组成气体
1、分压力定律 : 分压力 :各组元在混合物温度
下单独占据混合物所占体积时 所产生的压力。
《热工基础》第五讲_114805516

dv 0 v const.
5
6
1
3-6 四种典型热力工程分析
初、终态参数的关系
3-6 四种典型热力工程分析
能量转换
v const . v v, pv Rg T 2 1
u cV (T2 T1 ) h c p (T2 T1 ) sv cV ln
p-v图和T-s图
3-6 四种典型热力工程分析
定压过程
过程方程
dp 0 p const .
dsv cV
9
dT T
dT ds
V
T cV
10
3-6 四种典型热力工程分析
初、终态参数的关系
p const . pv Rg T p2 p1 , v2 T2 v1 T1
p-v图定压线下方, T-s图定压线右下方, wt>0
39
40
例题(常见题型1)
1、试将满足以下要求的理想气体多变 过程在p-v图和T-s图上表示出来: (1)工质又膨胀、又吸热、又降温 (2)工质又受压缩、又升温、又吸热 (3)工质又受压缩、又降温、又降压
3-6 四种典型热力工程分析
能量转换
dp 0
wt vdp 0
p1 p2
u cV (T2 T1 ) h c p (T2 T1 ) T p T v s p c p ln 2 Rg ln 2 c p ln 2 c p ln 2 T1 p1 T1 v1
30
5
3-6 多变过程
多变比热容 多变指数
3-6 多变过程
cn nk cV n 1
n cn c p c n cv
热工基础(2.2.7)--理想气体的热力性质和热力过程

习 题1 试写出仅适用于理想气体的闭口系的能量方程。
2 把CO2压送到体积为0.6m3的储气罐内。
压送前储气罐上的压力表读数为4kPa,温度为20℃;压送终了时压力表读数为30kPa,温度为50℃。
试求压送到罐内的C02的质量。
设大气压力p b=0.lMPa。
3 体积为0.03m3的某刚性储气瓶内盛有700kPa、20℃的氮气。
瓶上装有一排气阀,压力达到880kPa时阀门开启,压力降到850kPa时关闭。
若由于外界加热的原因造成阀门开启,问:(1)阀开启时瓶内气体温度为多少?(2)因加热,阀门开闭一次期间瓶内气体失去多少?设瓶内氮气温度在排气过程中保持不变。
4 氧气瓶的容积V=0.36m3,瓶中氧气的表压力p gl=1.4MPa,温度t1=30℃。
问瓶中盛有多少氧气?若气焊时用去一半氧气,温度降为t2=20℃,试问此时氧气瓶的表压力为多少?(当地大气压力p b=0. 098MPa)5 某锅炉每小时燃煤需要的空气量折合成标准状况时为66000m3/h。
鼓风机实际送入的热空气温度为250℃,表压力为20.0kPa,当大气压p b=0.lMPa时,求实际送风量(m3/h)。
6 某理想气体等熵指数k=1.4,定压比热容c p=1.042kJ/(kg.K),求该气体的摩尔质量M。
7 在容积为0.3m3的封闭容器内装有氧气,其压力为300kPa,温度为15℃,问应加人多少热量可使氧气温度上升到800℃?(1) 按定值比热容计算;(2) 按平均比热容(表)计算。
8 摩尔质量为0.03kg/mol的某理想气体,在定容下由275℃加热到845 ℃,若比热力学能变化为400kJ/kg,问焓变化了多少?9 将1kg氮气由t1=30℃定压加热到t2 =415℃,分别用定值比热容,平均比热容(表)计算其热力学能和焓的变化。
10 3kg的CO2、由p1=800kPa、t l=900℃,膨胀到p2 =120kPa,t2 =600℃,试利用定值比热求其热力学能、焓和熵的变化。
热工基础第三章2
ds =
δ qR
T
绝热
ds = 0
说明: 说明
s
adiabatic isentropic (1) 不能说绝热过程就是等熵过程 不能说绝热过程就是等熵过程, 绝热过程就是等熵过程 可逆绝热过程才是等熵过程 必须是可逆绝热过程才是等熵过程。 必须是可逆绝热过程才是等熵过程。 Reversible adiabatic (2) 不仅 s = 0 , ds = 0 s 处处相等
对象 1) 参数 ( p, T, v, u, h, s ) 变化 2) 能量转换关系, q , w, wt 能量转换关系 方法 1) 抽象分类
p v T
s
n
基本过程 2) 可逆过程 (不可逆再修正 不可逆再修正) 不可逆再修正
研究热力学过程的依据
1) 热一律 稳流 2) 理想气体
δ q = du + δ w = dh + δ wt
理想气体 s 的过程方程
ds = 0
理想气体
γ=
cp cv
dp dv ds = cv + cp =0 p v dp dv +γ =0 p v
当 γ = const
γ
ln p + γ ln v = Const
绝热指数 κ 三个条件: 三个条件 (1)理想气体 (2)可逆过程 (3) γ = const 理想气体 可逆过程
dT dv dT dp dv dp ds = cv + Rg = cp Rg = cp + cv T v T p v p
适用于理想气体任何过程 1、若定比热 、
cv , cp = const
T2 v2 s = cv ln + Rg ln T1 v1 T2 p2 v2 p2 = cp ln Rg ln = cp ln + cv ln T1 p1 v1 p1
《热工与流体力学基础》课件3第三章 理想气体的热力性质和热力过程

2018/8/1
第二节 理想气体的比热容及热量计算
一、比热容的定义和单位
——物体温度变化1K(或1℃)所需要吸收或放
出的热量称为该物体的热容。
• 根据不同的物量,存在三种比热容:
质量热容 : 1kg物质的热容 , 符号为c ,单位为J/(kg· K)或kJ/(kg· K); 摩尔热容: lmol物质的热容, 符号为Cm,单位为J/(mol· K)或kJ/(mol· K); 体积热容: 标准状态下1m3物质的热容,符号为c,单位为J/(m3· K)或 kJ/(m3· K)。
2018/8/1
学习要求
• 理解理想气体的含义,熟练掌握并正确应用理想气体的状态方程。
•
理解比热容的物理意义以及影响比热容的主要因素;理解真实比热
容、定值比热容和平均比热容的含义,能正确使用定值比热容和平 均比热容计算过程热量。
•
•
掌握理想气体热力学能和焓变化量的计算。
掌握理想气体基本热力过程的过程方程式和基本状态参数变化的关 系式,能正确计算理想气体基本热力过程的热量和功量。
2018/8/1
二、 理想气体状态方程
当理想气体处于任一平衡状态时,三个基本状态参 数之间满足:
称为理想气体状态方程 又称克拉贝龙方程式
pv RgT
Rg 气体常数,单位为J/(kg·K),其数值取决
于气体的种类,与气体状态无关。
2018/8/1
理想气体状态方程
对于质量为mkg 的理想气体,有
pV mRg T
SI制中,物质的量以mol (摩尔)为单位,因此, 还 有其它形式的理想气体状态方程式。
物质的量:n ,单位: mol(摩尔)。
热工基础-3-(1)-第三章 理想气体

∆T
若比热容取定值或平均值,有: ∆ h = c p ∆ T
∆h = c p
T2 T1
∆T
3. 理想气体熵变化量的计算:
δ q du + pdv cv dT p ds = = = + dv T T T T cv dT p v cv dT dv = + dv = + Rg T T v T v
同理:
δ q dh − vdp c p dT v ds = = = − dp T T T T c p dT p v c p dT dp = − dp = − Rg T T p T p
Rg ,eq = ∑ wi Rg ,i
i
作业:P103-104
3-10 3-15
思考题: P102
10
五. 理想气体的基本热力过程 热力过程被关注的对象:
1) 参数 ( p, T, v, u, h, s ) 变化 2) 能量转换关系, q , w, wt 。
思路:
1) 抽象分类:
p
v T
s
n
基本过程 2) 简化为可逆过程 (不可逆再修正)
R = 8.314 J/(mol ⋅ K)
R 是一个与气体的种类
无关,与气体的状态也 无关的常数,称为通用 (摩尔)气体常数。
R = M ⋅ Rg
例题3.1: 已知体积为0.03m3的钢瓶内装有氧气,初 始压力p1=7×105Pa,温度t1=20℃。因泄漏,后 压力降至p2=4.9×105Pa ,温度未变。问漏去多少 氧气? 解:取钢瓶的容积为系统(控制容积),泄漏过 程看成是一个缓慢的过程。初终态均已知。假定 瓶内氧气为理想气体。根据状态方程:
V
0 m
= 22 . 414 m
第三章理想气体的性质与热力过程讲义
2. 通用气体常数 R (也叫摩尔气体常数)
气体常数之所以随气体种类不同而不同,是因为在同 温、同压下,不同气体的比容是不同的。如果单位物 量不用质量而用摩尔,则由阿伏伽德罗定律可知,在 同温、同压下不同气体的摩尔体积是相同的,因此得
到通用气体常数 R 表示的状态方程式:
1mol方程 pVm RT 或 pV nRT n mol方程
14
(3)cp与cv关系
气体在定压下受热时,由于温度升高的同时, 还要克服外力膨胀做功,而在定容过程中,并 不膨胀对外做功,故同样升高1K,定压时比定 容下受热需要更多的热量,也就意味着定压比 热比定容比热大。
对理想气体,两者关系为:
迈耶公式
cp cv Rg
C p,m CV ,m R
K为比热容比 (绝热指数)
6
二、理想气体 状态方程
1、理想气体的状态方程式
理想气体在任一平衡状态时p、v、T之间关系的函数关 系即理想气体状态方程式,或称克拉贝龙(Clapeyron)
方程。
pv RgT 或 pV mRgT
•式中:Rg为气体常数(单位J/kg·K),与气体所
处的状态无关,随气体的种类不同而异。 •应用时注意单位:p的单位pa;v的单位m3/kg;T 的单位K。
第三章 理想气体的性质
1
本章基本要求
1.掌握理想气体的概念及理想气体状态方程的各种 表达形式,并能熟练运用;
2.理解理想气体比热容的概念及影响因素,掌握理 想气体比热容的分类;能够熟练利用平均比热容 表或定值比热容进行热量的计算;
3.掌握理想气体的热力学能及焓的特点,能够进行 理想气体的热力学能、焓及熵变化量的计算;
4
哪些气体可当作理想气体
中国石油大学热工基础典型问题第三章 理想气体的性质与热力过程
工程热力学与传热学第三章 理想气体的性质与热力过程 典型问题分析一. 基本概念分析1 c p ,c v ,c p -c v ,c p /c v 与物质的种类是否有关,与状态是否有关。
2 分析此式各步的适用条件:3将满足下列要求的理想气体多变过程表示在p-v 图和T-s 图上。
(1) 工质又膨胀,又升温,又吸热的过程。
(2) 工质又膨胀,又降温,又放热的过程。
4 试分析多变指数在 1<n<k 范围内的膨胀过程特点。
二. 计算题分析理想气体状态方程式的应用 1某蒸汽锅炉燃煤需要的标准状况下,空气量为 q V =66000m 3/h ,若鼓风炉送入的热空气温度为t 1=250°C ,表压力 p g1=20.0kPa 。
当时当地的大气压力 p b =101.325kPa 。
求实际的送风量为多少?理想气体的比热容 2在燃气轮机动力装置的回热器中,将空气从150ºC 定压加热到350ºC ,试按下列比热容值计算对每公斤空气所加入的热量。
01 按真实比热容计算;02 按平均比热容表计算(附表2,3); 03 按定值比热容计算;04 按空气的热力性质表计算(附表4); 3已知某理想气体的比定容热容c v =a+bt , 其中a ,b 为常数,试导出其热力学能,焓和熵变的计算式。
理想气体的热力过程 4一容积为 0.15m 3 的储气罐,内装氧气,其初始压力 p 1=0.55MPa ,温度 t 1=38ºC 。
若对氧气加热,其温度,压力都升高。
储气罐上装有压力控制阀,当压力超过 0.7MPa 时,阀门便自动打开,dTm c dHpV U d pV d dU pdV dU WdU Q P ==+=+=+=+=)()(δδ典 型 问 题放走部分氧气,即储气罐中维持的最大压力为 0.7MPa 。
问当罐中氧气温度为 285ºC 时,对罐中氧气共加入了多少热量?设氧气的比热容为定值。
中国石油大学热工基础典型问题第三章 理想气体的性质与热力过程
工程热力学与传热学第三章 理想气体的性质与热力过程 典型问题分析一. 基本概念分析1 c p ,c v ,c p -c v ,c p /c v 与物质的种类是否有关,与状态是否有关。
2 分析此式各步的适用条件:3将满足下列要求的理想气体多变过程表示在p-v 图和T-s 图上。
(1) 工质又膨胀,又升温,又吸热的过程。
(2) 工质又膨胀,又降温,又放热的过程。
4 试分析多变指数在 1<n<k 范围内的膨胀过程特点。
二. 计算题分析理想气体状态方程式的应用 1某蒸汽锅炉燃煤需要的标准状况下,空气量为 q V =66000m 3/h ,若鼓风炉送入的热空气温度为t 1=250°C ,表压力 p g1=20.0kPa 。
当时当地的大气压力 p b =101.325kPa 。
求实际的送风量为多少?理想气体的比热容 2在燃气轮机动力装置的回热器中,将空气从150ºC 定压加热到350ºC ,试按下列比热容值计算对每公斤空气所加入的热量。
01 按真实比热容计算;02 按平均比热容表计算(附表2,3); 03 按定值比热容计算;04 按空气的热力性质表计算(附表4); 3已知某理想气体的比定容热容c v =a+bt , 其中a ,b 为常数,试导出其热力学能,焓和熵变的计算式。
理想气体的热力过程 4一容积为 0.15m 3 的储气罐,内装氧气,其初始压力 p 1=0.55MPa ,温度 t 1=38ºC 。
若对氧气加热,其温度,压力都升高。
储气罐上装有压力控制阀,当压力超过 0.7MPa 时,阀门便自动打开,dTm c dHpV U d pV d dU pdV dU WdU Q P ==+=+=+=+=)()(δδ典 型 问 题放走部分氧气,即储气罐中维持的最大压力为 0.7MPa 。
问当罐中氧气温度为 285ºC 时,对罐中氧气共加入了多少热量?设氧气的比热容为定值。
工程热力学 第三章理想气体的性质与过程PPT课件
2020/10/30
14
§3-3 理想气体的u、h、s和热容
一、理想气体的u
1843年焦耳实验,对于理想气体
AB 真空
p v T 不变
qduw du0
绝热自由膨胀
2020/10/30
15
理想气体的内能u
理气绝热自由膨胀 p v T 不变 du0
u f (T, p)
du(Tu)pdT(up)Tdp
1kmol物质的质量单位用kg/kmol。
2020/10/30
4
摩尔容积Vm
阿伏伽德罗假说: 相同 p 和 T 下各理想气体的
摩尔容积Vm相同
在标准状况下 (p0 1.01325105Pa
T0 273.15K) Vm0 22.41m 43kmol
Vm常用来表示数量
2020/10/30
5
Rm与R的区别
d p0 必(然 p u)T0,u与 p无关
u f (T,v)
du(T u)vdT(uv)Tdv
d v 0 必 然 ( u v )T 0 ,u 与 v 无 关
uf(T) 理想气体u只与T有关
2020/10/30
16
理想气体内能的物理解释
u f (T) 内能=内动能+内位能
T
T, v
理想气体无分子间作用力,内能只 决定于内动能
18
理想气体的焓
hupvuR T
h f (T) 理想气体h只与T有关
实际气体
h h ( T h)pd T ( p h )T d p c p d T ( p h )T d p
理想气体
dh cpdT
理想气体,任何过程
2020/10/30
19
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
i 1 i 1
29
k
i 1 k
i 1 k
3-4 理想气体的热力过程
1.热力过程的研究目的与方法
(1)目的: 了解外部条件对热能与机械 能之间相互转换的影响,以便合理地安排 热力过程,提高热能和机械能转换效率。
V V1 V2 Vk Vi
i 1
k
25
3. 理想混合气体的成分 成分:各组元在混合气体中所占的数量份额。 (1) 成分的分类 1)质量分数 :某组元的质量与混合气体总质量
的比值称为该组元的质量分数。
k k mi wi , m mi wi 1 m i 1 i 1 2)摩尔分数 : 某组元物质的量与混合气体总物
22
3-3
理想混合气体
1. 理想混合气体的定义 由相互不发生化学反应的理想气体组成混合 气体,其中每一组元的性质如同它们单独存在一 样,因此整个混合气体也具有理想气体的性质。 混合气体的性质取决于各组元的性质与份额。 2. 理想混合气体的基本定律 (1)分压力与道尔顿定律 分压力: 某组元i单独占有混合气体体积V并处于 混合气体温度T 时的压力称为该组元的 分压力。用 pi 表示。
10
由比定容热容定义式可得
qV u cV dT T V
(4)比定压热容
cp
q p dT
据热力学第一定律,对微元可逆过程,
q dh vdp
11
焓也是状态参数, h h(T ,
p)
h h dh dT dp T p p T 对定压过程,dp 0 ,由上两式可得 h q p dT T p
pv RgT
20
dT dv ds cV Rg T v dT dp ds c p Rg T p
比热容为定值时 ,分别将上两式积分,可得
T2 v2 s cV ln Rg ln T1 v1 T2 p2 s c p ln Rg ln T1 p1 代入 pv RgT和迈耶公式cp cV=Rg ,得
(2)任务:确定过程中工质状态参数的 变化规律,分析过程中的能量转换关系。 (3)依据:热力学第一定律表达式、理 想气体状态方程式及可逆过程的特征关系 式。
30
(4)分析方法: 采用抽象、概括的方法,将实际过程近 似为具有简单规律的典型可逆过程,如可逆 定容、定压、定温、绝热过程等。
(5)分析内容与步骤:
21
p2 v2 s cV ln c p ln p1 v1
结论: (1)理想气体比熵的变化完全取决于初态和终 态,与过程所经历的路径无关。这就是说,理 想气体的比熵是一个状态参数。 (2)虽然以上各式是根据理想气体可逆过程的 热力学第一定律表达式导出,但适用于计算理 想气体在任何过程中的熵的变化。
第三章 理想气体的性质与热 力过程
理想气体是一种经过科学抽象的假想气 体,在自然界中并不存在。但是,在工程上 的许多情况下,气体工质的性质接近于理想 气体。因此,研究理想气体的性质具有重要 的工程实用价值。本章重点讨论理想气体的 性质、状态参数与热力过程的特点及计算方 法。
1
3-1 理想气体状态方程式
19
2) 理想气体的熵 根据熵的定义式及热力学第一定律表达式, 可得
q du pdv du p ds dv Τ T T T q dh vdp dh v ds dp T T T T
对于理想气体,
du cV dT , dh c pdT ,
代入上面两式,可得
18
3. 理想气体的热力学能,焓和熵
(1)理想气体的热力学能与焓
理想气体的热力学能与焓都是温度的单值函数。
du 由式 cV dT
可得
du cV dT
u cvdT
1 2
dh cp dT dh c pdT
h c pdT
1
2
理想气体在任一过程中的热力学能与焓的变化 和可以分别由以上两式计算,也可查表求得。
3
2. 理想气体状态方程式
pv RgT
又称克拉贝龙方程式 。Rg为气体常数,单位为 J/(kg· K),其数值取决于气体的种类,与气体状 态无关。 对于质量为m 的理想气体,
pV mRgT
物质的多少还以物质的量(摩尔数)来衡量。 物质的量:n ,单位: mol(摩尔)。
4
摩尔质量: M ,1 mol物质的质量,kg/mol。
对于理想气体,根据焓的定义,
h u pv u RgT
13
可见,理想气体的焓 h 也是温度的单值函数。
dh h 由式 c p 可得 c p dT dT T p
理想气体的cp与cV之间的关系:
q p
dh d(u pv ) du d( RgT ) cp dT dT dT dT
1. 理想气体与实际气体 热机的工质通常采用气态物质:气体或蒸气。 气体:远离液态,不易液化。 蒸气:离液态较近,容易液化。 理想气体是一种经过科学抽象的假想气 体,它具有以下3个特征:
2
(1)理想气体分子的体积忽略不计;
(2)理想气体分子之间无作用力;
(3)理想气体分子之间以及分子与容器壁的 碰撞都是弹性碰撞。 理想气体在自然界并不存在,但常温下, 压力不超过 5 MPa的O2、N2、H2、CO等实 际气体及其混合物都可以近似为理想气体。 另外,大气或燃气中少量的分压力很低的水 蒸气也可作为理想气体处理。
= cV + Rg 即
cp cV Rg
迈耶公式
上式两边乘以摩尔质量M,得
摩尔定压热容
摩尔定容热容
14
Cp,m – CV,m = R
比热容比:
得
cp cV
,联立式
cp cV Rg
cp
1
Rg
1 cV Rg 1
(2)真实比热容与平均比热容
理想气体的 u 和 h 是温度的单值函数,所 以理想气体的 cV 和 cp 也是温度的单值函数。
23
道尔顿定律: 混合气体的总压力等于各组元分压 力之和(仅适用于理想气体)。
p p1 p2 pK pi
i 1 k
24
(2)分体积与分体积定律 分体积: 混合气体中第 i 种组元处于与混合 气体压力和温度时所单独占据的体积称 为该组元的分体积,用 Vi 表示。 分体积定律: 理想混合气体的总体积等于各 组元的分体积之和,即
质的量的比值。
ni xi , n
n ni
i 1
k
x
i 1
k
i
1
26
3)体积分数 :某组元分体积与混合气体总体积 的比值称为该组元的体积分数。
Vi i , V Vi V i 1
k
i 1
k
i
1
(2)各成分间的关系 pVi ni RT 组元i : 混合气体: pV nRT
Vi ni V n
i xi
混合气体的成分表示法实际上只有两种:质量分 数wi和摩尔分数xi ,二者之间的关系为 mi ni M i xi nM i xi M i wi k k k m ni M i xi nM i xi M i
i 1 i 1 i 1
27
wi m M i ni mi M i wi M i k xi k k n mi M i wi m M i wi M i
物体热容量的大小与物体的种类及其数量 有关,此外还与过程有关,因为热量是过程量。 如果物体初、终态相同而经历的过程不同,则 吸入或放出的热量就不同。 8
根据物质的数量和经历的过程不同,热容 又分为 (1)比热容(质量热容) : 单位质量物质的热容,c ,J/(kg· K)。 q q c dT dt (2)摩尔热容 1 mol物质的热容,Cm,J/(mol·K)。
R
k wi 1 M i 1 M i
xM
i 1 i
k
i
M xi M i
i 1
k
5.理想混合气体的比热容 比热容: mc mi ci
i 1 k
c p wi c p ,i
k
cV wi cV ,i
k
i 1
i 1 k
摩尔热容:
Cp,m Mcp xi M i c p ,i xi C p ,m,i
i 1 i 1 i 1
4.理想混合气体的平均摩尔质量和平均气体常数 (1)理想混合气体的平均摩尔质量
k m 1 ni M i M n i 1 n k k ni M i xi M i i 1 i 1 n
28
(2)理想混合气体的平均气体常数
k R wi Rg R M j 1 M i
真实比热容:
cp a0 a1T a2T a3T 2 3 cV a0 a1T a2T a3T
2 3
15
平均比热容:
q12 cdt c t t2 t1
t2 t2
1
t1
ct
t2
称为工质在 t1 ~ t2温度范围内的平均比热 1 容 t2 q 1 t
pVm MRgT
令
Vm M v
R MRg
,则得
pVm RT
R 称为摩尔气体常数。 根据阿佛伽德罗定律,同温、同压下任何 气体的摩尔体积Vm都相等,所以任何气体的摩 尔气体常数R都等于常数,并且与气体所处的 具体状态无关。
R=8.314
J/(mol· K)
6
气体常数Rg 与摩尔气体常数的关系:
