氯化钾溶解温度时间曲线
常用化合物在不同温度下的溶解度
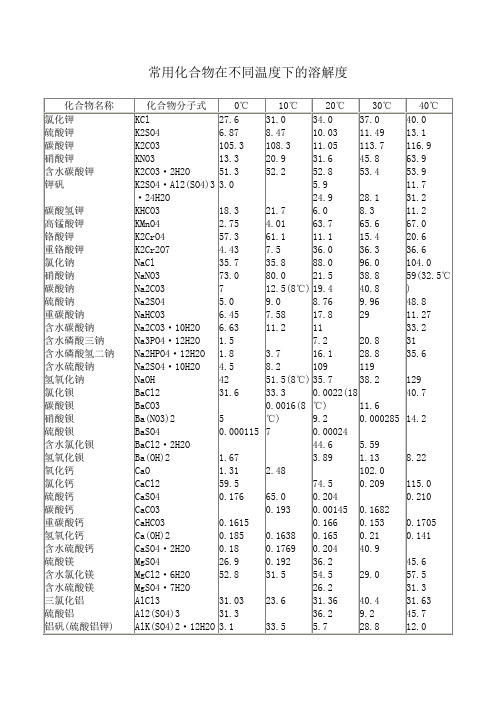
K2CrO4
25.9 31.2 36.2 41.1 45.2 50.5
K2Cr2O7
37.0 37.3 37.8 38.4 39.0 39.8
NaCl
114.0 124.0 135.0 148.0 162.0 180.0
NaNO3
45.4
Na2CO3
46.7 45.3 44.1 43.7 42.9 42.5
FeCl2
34.4
FeCl3
73.1
FeSO4
315.1
FeCl2·4H2O
48.6
FeCl3·6H2O
42.2
FeSO4·7H2O
75.9
CuSO4
32.3
CuSO4·5H2O
33.3
NH4Cl
25.1
NH4NO3
50.4
(NHห้องสมุดไป่ตู้)2SO4
NH4HCO3
(NH4)2HPO4
(NH3)2SO4·Al2
KNO3
85.5 110.0 138.0 169.0 202.0 246.0
K2CO3·2H2O
54.8 55.9 57.1 58.3 59.6 60.9
K2SO4·Al2(SO4)3
24.75
71.0 109.0
·24H2O
34.2 37.5
KHCO3
14.4 18.0
KMnO4
69.0 72.8
(SO4)3·24H2O
0.86 136.8 0.205
0.1750 0.116
55.0 61.0 35.5 31.73 59.2 26.1
37.1 78.3
57.0 43.9
35.5 40.0 28.1 55.2 421.0 88.0
初三化学氯化钙,氢氧化钾溶解度曲线解题技巧

初三化学氯化钙,氢氧化钾溶解度曲线解题技巧技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游弋上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5个字,就低不就高)1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶)技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。
技巧引入:例:已知:40℃时氯化钾的溶解度为40g,其含义为。
(1)在40℃时,向100g水中加入20gKCl,搅拌至完全溶解,形成溶液A,此时,溶液A中KCl的质量分数为,溶液为(填“饱和”或“不饱和”)。
(2)在40℃时氯化钾的饱和溶液B的质量分数为。
(3)在40℃时,向100g水中加入50g氯化钾,充分搅拌形成溶液C。
此时溶液C中氯化钾的质量分数为。
其溶液为(填“饱和”或“不饱和”)。
(4)在40℃时,向100g水中加入100g氯化钾,充分搅拌后形成溶液D,此时溶液D中氯化钾的质量分数为,溶液为(填“饱和”或“不饱和”)。
(5)在溶解度曲线中绘制表示四各溶液A,B,C,D规律:(1)点A,B,C,D与曲线的位置关系(线上,线上方,线下方)来判断溶液的状态。
(2)线上面的点C,D与线上的点B表示的溶液在该温度下的质量分数相等。
(线上面的点C,D表示的溶液的质量分数可以用B点来代替)。
2021年中考化学专题复习:溶解度曲线
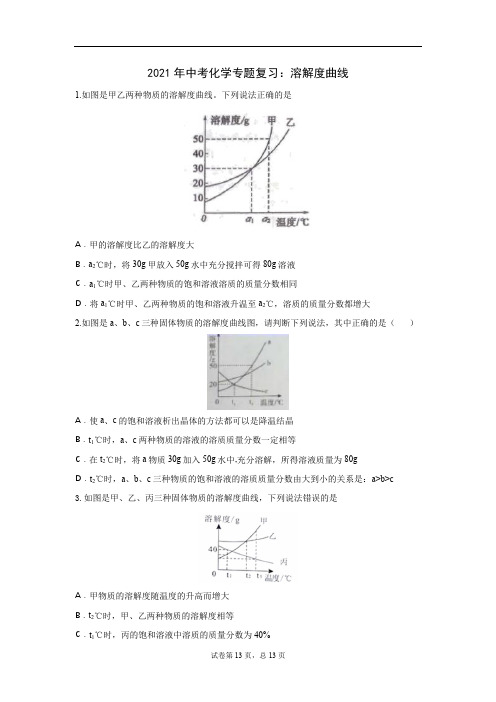
2021年中考化学专题复习:溶解度曲线1.如图是甲乙两种物质的溶解度曲线。
下列说法正确的是A.甲的溶解度比乙的溶解度大B.a2℃时,将30g甲放入50g水中充分搅拌可得80g溶液C.a1℃时甲、乙两种物质的饱和溶液溶质的质量分数相同D.将a1℃时甲、乙两种物质的饱和溶液升温至a2℃,溶质的质量分数都增大2.如图是a、b、c三种固体物质的溶解度曲线图,请判断下列说法,其中正确的是()A.使a、c的饱和溶液析出晶体的方法都可以是降温结晶B.t1℃时,a、c两种物质的溶液的溶质质量分数一定相等C.在t2℃时,将a物质30g加入50g水中,充分溶解,所得溶液质量为80gD.t2℃时,a、b、c三种物质的饱和溶液的溶质质量分数由大到小的关系是:a>b>c3.如图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是A.甲物质的溶解度随温度的升高而增大B.t2℃时,甲、乙两种物质的溶解度相等C.t1℃时,丙的饱和溶液中溶质的质量分数为40%D.当甲中混有少量丙时,可采用降温结晶的方法提纯4.如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是()A.a的溶解度大于b的溶解度B.P点表示t1℃时a、c两物质溶解度相等C.将t1℃饱和的c溶液升温到t2℃,得到的是不饱和溶液D.将t2℃,a、b、c三种物质的饱和溶液降温到t1℃时,所得溶液中溶质质最分数由大到小的顺序为:b>a=c5.甲、乙两种固体的溶解度曲线如右图所示,下列说法正确的是A.甲的溶解度大于乙的溶解度B. t1°C时,甲乙饱和溶液中溶质的质量分数相等C. t2°C时,60g 甲的饱和溶液稀释到20%需加水10gD.将t1°C时相等质量的甲、乙的饱和溶液升温到t2°C,溶液中溶质的质量甲大于乙6.A、B、C三种固体物质的溶解度曲线如图所示,下列说法正确的是()A.阴影区域中,A、C均处于不饱和状态B.除去B固体中含有的少量A杂质,可采用配成热饱和溶液,降温结晶、过滤、洗涤、干燥的方法提纯BC.将A和B的饱和溶液从t2℃降到t1℃时,析出晶体的质量关系为A>BD.t1℃时,将50g固体A加入到200g水中,所得溶液溶质的质量分数约为16.7% 7.甲、乙两种物质溶解度曲线如图所示。
专题36溶解度及溶解度曲线-5年(2018-2022)中考1年模拟化学分项汇编(原卷版)

分类十二溶液及溶解度曲线专题36 溶解度及溶解度曲线1.(2022·四川绵阳·中考真题)食盐加碘可有效补充人体碘元素,所加物质一般为KIO3。
NaCl和KIO3的溶解度如下表:根据表中数据判断,下列说法错误的是A.对比数据变化趋势可知,温度对KIO3溶解度的影响程度更大B.在30℃时,NaCl饱和溶液的溶质质量分数大于KIO3饱和溶液C.该表转化为溶解度曲线图后,在10℃~100℃范围内不出现交点D.将等质量40℃的两种物质的饱和溶液降温至20℃,NaCl析出晶体质量更大2.(2022·江苏镇江·中考真题)如图为Na2CO3和NH4HCO3的溶解度曲线。
下列说法正确的是A.T3℃时,将30gNa2CO3固体加到50g水中,所得溶液的溶质质量分数为37.5%B.将Na2CO3饱和溶液从T2℃升温到T4℃,溶质质量分数变大C.将100gNH4HCO3饱和溶液从T4℃降温到T1℃,析出20gNH4HCO3晶体D.将等质量的两物质饱和溶液从T1℃升温到T4℃,为使溶液恰好饱和,加入两固体质量相等3.(2022·内蒙古鄂尔多斯·中考真题)固体物质a、b、c的溶解度曲线如图所示。
下列相关说法正确的是A.t1℃时,将接近饱和的c溶液通过降温变为饱和溶液B.要从b物质的饱和溶液中得到b物质的晶体,一般采用冷却结晶法C.分别将a和c的饱和溶液从t1℃升温至t2℃,溶质质量分数的变化是a增大、c减小D.t2℃时,将30g a加入到50g水中充分溶解,可得75g a的饱和溶液4.(2022·四川巴中·中考真题)如图为KNO3、NaCl两种物质的溶解度曲线,下列说法正确的是A.a1℃时,向100g水中加入20gKNO3,充分溶解后所得溶液是饱和溶液B.KNO3和NaCl的溶解度相等C.当KNO3中含有少量NaCl时,可以用蒸发结晶的方法提纯KNO3D.将a2℃时等质量的NaCl与KNO3的饱和溶液降温到a1℃,所得溶液中溶质质量NaCl大于KNO35.(2022·江苏常州·中考真题)下表是两种硫酸盐在不同温度时的溶解度:下列说法正确的是A.随温度升高,物质的溶解度只可能不断增大或不断减小B.在080℃间的任何温度下,硫酸钠和硫酸铈的溶解度均不相等C.某温度下,向等质量水中分别加入等质量硫酸钠和硫酸铈,充分溶解后,前者的溶质质量分数可能大于、等于或小于后者D.将100g30℃时的饱和硫酸铈溶液加热到40℃(加热过程中水的蒸发忽略不计),从溶液中可析出4g硫酸铈晶体6.(2022·甘肃·永昌县教学研究室中考真题)如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。
KCl的溶解焓

序号 02学号 14091700344 物理化学设计性实验(论文)题目:氯化钾溶解焓的测定作者秦华系别化工系年级 2009级指导教师张建策完成时间 2011年11月6日摘 要: 物质溶解在溶剂中存在着两个过程,一是晶格破坏的吸热过程;二是离子溶剂化,即离子的水合作用,为放热过程。
溶解焓是这两个过程热效应的总和。
积分溶解焓是指在一定温度、压力下,将1mol 溶质溶于一定量溶剂中形成一定浓度的溶液时,所吸收或放出的热量。
微分溶解焓是指在温度、压力及溶液组成不变的条件下,向溶液中加入溶质后的热效应。
本次实验采用了量热法测定氯化钾的溶解焓。
关键词:溶解焓;积分溶解焓;微分溶解焓;量热法;氯化钾的溶解焓1 前言积分溶解焓可以由实验测定,在绝热容器中测定积分溶解焓的方法一般有两种:一是先用标准物质测出热量计的热容,然后测定待测物质溶解过程的温度变化,从而求出待测物质的积分溶解焓;二是测定溶解过程中温度的降低,然后由电热法使该体系恢复到起始温度,根据所耗电能计算热效应。
2 实验部分2.1实验目的1、学会用量热法测定KCl 的积分溶解焓2、掌握计温、量热的基本原理和测量方法2.2 实验原理溶解过程的温度变化用数字式贝克曼温度计测定,量热法测定积分溶解焓,通常是在具有良好绝热层的热量计中进行。
在恒压条件下,由于热量计是绝热系统,溶解过程中所吸收或放出的热全部由系统温度变化反映出来。
把杜瓦瓶做成的量热计看成绝热体系,在杜瓦瓶中加一定量的水,搅拌,用数显热电偶或热电阻温度计相隔一定时间测定温度。
用一定的功率加热一段时间,测定水上升的温度ΔTe ,从而算出热容量C 。
另取相同量的水,准确加入一定量的氯化钾,完全熔解,测定降低的温度ΔTs 。
应用雷诺校正图解外推法,分别求得升温和降温时的ΔTe 和ΔTs,根据下式计算量热计的热容量C :e T Pt C ∆=/再根据下式计算KCl 的积分溶解热:W M T C H s m /∆=∆其中W 和M 分别是KCl 的质量和摩尔质量。
如图为NaCl、KNO3的溶解度曲线(水的密度约为1gcm3).

80.(2012•连云港)如图为NaCl、KNO的溶解度曲线(水的密度约为1g/cm3).3(1)20℃时,KNO的溶解度是 g,以下实验中:310mL水x y zx、y、z中为饱和溶液的是.(2)若使NaCl溶液由不饱和变为饱和溶液,一般采用的方法是.固体中混有的少量NaCl,提纯的步骤是:加水溶解、、,(3)除去KNO3然后过滤、洗涤、干燥.(1) 31.6 y (2) 蒸发溶剂至饱和或加氯化钠固体至不再溶解 (3) 蒸发浓缩降温结晶81.(2012.宜宾市)(8分)根据图1、图2中三种固体物质的溶解度曲线回答问题。
(1)分析图1,P点处A、B两种物质的溶解度关系是A B(填“>”、“<”或“=”);取一定质量的A的饱和溶液,将溶液温度从t℃降低到10℃,溶液中溶质的质量分数 (填“增大”、“减小”或“不变”)。
(2)分析图2,要使C的饱和溶液变成不饱和溶液,可采用的方法是:①;②。
(3)10℃时,A、B、C的饱和溶液中溶质的质量分数由大到小的顺序是。
(1)=;减少(2)降低温度或加溶剂水(3)B>A>C82.(2012.昆明市) (4)请根据下列图示回答问题:①甲图中R物质在室温(20℃)时的饱和状态为D点,40℃时的饱和状态为A点,现将甲图中的R溶液从A状态变到B状态,请设计并简述两个简单的实验操作途径: a.、 b.;c.A状态由两种不同途径变到B状态时,溶液的溶质质量分数是否相等 (填“是”或“否”)。
②乙图是表示M、N两种物质饱和溶液的溶质质量分数随温度变化的曲线。
现分别向50g M、80g N固体中各加入150g水,并加热至完全溶解,同时各蒸发掉50g水,冷却至t℃,下列分析正确的是 (填序号,多选、少选、错选均不给分)。
a.只有N析出晶体; b.M、N两种溶液的溶质质量分数相等;c.只有M析出晶体: d.M、N均有晶体析出:e.M、N两种物质的溶解度相同。
①a.可先将R溶液从A状态稀释到C状态,再将温度升高到60℃;b.可先将A状态的R溶液温度降低到20℃,过滤后再将滤液温度升高到60℃: C.是②a e83.(2012.江西省)(6分)右图是三种固体物质的溶解度曲线。
初三化学期末易错点:溶解度曲线讲解

期末冲刺易错点:溶解度曲线一、教师期末备考建议溶解度曲线这个知识点是考试中的热点,经常以选择题、填空题或者信息阅读题的形式出现,分值一般是2~6分,而考查的内容主要是对于溶解度曲线的应用。
溶解度曲线的信息量非常大,想要熟练掌握溶解度曲线的应用,就必须先熟练掌握溶解度的概念,了解溶解度曲线的意义。
此外,溶解度曲线的应用主要是在以下的几个方面:(1)查找某种物质某一温度下的溶解度(2)比较不同固体物质在同一温度下的溶解度的大小(3)确定温度对于溶解度的影响状况(4)根据溶解度曲线确定如何配制饱和溶液(5)确定混合物的分离、提纯的方法。
所以在复习的时候可以重点从这几个方面着手,勤加练习,加深理解,熟练掌握。
二、期末易错知识点1.溶解度曲线的意义溶解度曲线表示的是某一物质溶解度随温度变化的情况。
曲线上的点代表在该物质在某温度下的溶解度,其溶液必然是饱和溶液,曲线下方的点代表不饱和溶液,而在曲线上方的点,则代表有未溶解固体的饱和溶液。
当有多条曲线时,出现交叉点,则表示这些溶质在同一温度下具有相同的溶解度。
2.溶解度坐标内点的移动基本原则:温度升高向右平移,温度下降向左平移,浓度上升向上平移,浓度下降向下平移。
如坐标图中初始溶液在a点,从T2降温至T1,a点向左平移至a’点,a’点与T1温度时溶解度曲线纵坐标差可衡量溶液中析出固体的质量。
溶液初始在a点,在温度T2恒温蒸发溶剂,a点向上平移至a”点,a”点与T2温度时溶解度曲线纵坐标差可衡量溶液中析出固体的质量。
3.物质的提纯溶解度随温度变化剧烈上升的物质称为“陡升型物质”,溶解度随着温度变化缓慢上升的物质称为“缓升型物质”。
若要提纯陡升型物质(如KNO3中混有NaCl)常采用加热浓缩降温结晶而后过滤的方式提纯。
若要提纯缓升型物质(如NaCl中混有KNO3)常采用加热浓缩恒温蒸发溶剂结晶而后过滤的方式提纯。
三、期末易错典型例题例1.(2017南京溧水月考)如图是a、b、c三种物质的溶解度曲线.由如图所示判断下列说法中不正确的是()A.c的溶解度随温度的升高而减少℃时,a的溶解度等于b的溶解度B.在t℃降温至t1℃时变为不饱和溶液C.a的饱和溶液从tD.t1℃时,a的饱和溶液60g中含有溶剂50g例2.(2017南京清水亭学校月考)如图是A、B、C三种物质的溶解度曲线。
3溶解热测定实验报告

华 南 师 范 大 学 实 验 报 告学生姓名 学 号 专 业 化学(师范) 年级、班级 课程名称 物理化学实验实验项目 溶解热的测定实验类型 :□验证□设计□综合 实验时间 年 月 日 实验指导老师 左晓希 实验评分【实验目的】①设计简单量热装置测定某物质在水中的积分溶解焓。
②复习和掌握常用的量热技术与温度测定与校正方法。
③由作图法求出该物质在水中的摩尔稀释焓、微分溶解焓、微分稀释焓。
【实验原理】溶解热,即为一定量的物质溶解于一定量的溶剂中所产生的热效应。
溶解热除了与溶剂量及溶质质量有关外,还与体系所处的温度及压力有关。
溶解热分为积分溶解热和微分溶解热。
积分溶解热即在等温等压条件下,1mol 溶质溶解在一定量的溶剂中形成某指定浓度的溶液时焓变。
也即为此溶解过程的热效应。
它是溶液组成的函数,若形成溶液的浓度趋近于零,积分溶解热也趋近于一定值,称为无限稀释积分溶解热。
积分溶解热是溶解时所产生的热量的总和,可由实验直接测定。
微分溶解热是等温等压下,在大量给定浓度的溶液里加入1mol 溶质时所产生的热效应,它可表示为A pn T B sol n H 、)/(∂∆∂。
因溶液的量很大,所以尽管加入1mol 溶质,浓度仍可视为不变。
微分热难以直接测量。
但可通过实验,用间接的方法求得。
溶解热的测量可通过绝热测温式量热计进行,它是在绝热恒压且不做非体积功的条件下,通过测定量热系统的温度变化,而推算出该系统在等温等压下的热效应。
本实验采用标准物质法进行量热计能当量的标定。
利用1molKCl 溶于200mol 水中的积分溶解热数据进行量热汁的标定。
当上述溶解过程在恒压绝热式量热计中进行时,可设计如下途径:在上述途径中,△H 1为KCl(s)、H 2O(l)及量热计从T 1等压变温至T 2过程的焓变,△H 2则为在T 2温度下,物质的量为n 1 mol 的KCl(s)溶于n 2 mol H 2O(l)中,形成终态溶液的焓变。
