GMP认证全套文件资料026-片剂崩解时限检查标准操作规程
验操作规程:崩解时限检查法

1.主题内容:建立有崩解时限检查法操作方法。
2.适用范围:本规程适用于检查药物在生产过程中的崩解时限检查法的操作。
3.引用标准:《中国药典2010版二部》
4.责任:化验员、QC主管。
5. 用途:化验室
6.内容:本法系用于检查口服固体制剂在规定条件下的崩解情况。
崩解系指口服固体制剂在规定条件下全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网。
如有少量不能通过筛网,但已软化或软质上漂且无荧心者,可做符合规定论。
凡规定检查溶出度、释放度、融变时限或分散均匀性的制剂,不再进行崩解时限检查
6.1片剂
仪器装置:采用升降式崩解仪,主要疾结构为—能升降的金属支架与下端镶有筛网的吊蓝,并附有挡板。
崩解时限检查标准操作规程

崩解时限检查标准操作规程
1 编制依据:《中华人民共和国药典》2005年版(一部、二部)
2 定义:崩解系指固体制剂在检查时限内全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应通过筛网。
3 检验操作方法
3.1 仪器及用具
崩解仪
3.2检查法
3.2.1 将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37℃±1℃的水,调节水位高度使吊篮上升时筛网在水面下25mm处。
3.2.2 除另有规定外, 取供试品6片(粒), 分别置上述吊篮的玻璃管中, 加档板, 启动崩解仪进行检查
3.2.3 结果判定
3.2.3.1 片剂:各片在30分钟内全部崩解判为符合规定,如有1片不能完全崩解,应另取6片复试,均应符合规定。
3.2.3.2 胶囊剂:硬胶囊剂30分钟内全部崩解并通过筛网(囊壳碎片除外),判为符合规定。
如有1粒不能完全崩解,应另取6粒按上述方法复试,均应符合规定。
崩解时限检查法的操作流程

崩解时限检查法的操作流程The process of conducting a failure time limit inspection can be a complex and critical task. 崩解时限检查法的操作流程可能是一个复杂而关键的任务。
It requires strict attention to detail and a thorough understanding of the inspection process. 需要严格的细节关注和对检查过程的彻底了解。
The first step in the process is to gather all necessary documentation and information related to the equipment being inspected. 流程的第一步是收集与被检查设备相关的所有必要文件和信息。
This includes equipment manuals, maintenance records, and any previous inspection reports. 这包括设备手册、维护记录以及任何以前的检查报告。
Having access to this information is crucial for ensuring a comprehensive and accurate inspection. 能够获取这些信息对于确保全面和准确的检查至关重要。
Once all necessary documentation has been gathered, the next step is to conduct a visual inspection of the equipment. 一旦收集了所有必要的文件,下一步就是对设备进行视觉检查。
This involves visually inspecting all components of the equipment for signs of wear, damage, or deterioration. 这涉及对设备的所有组件进行视觉检查,以寻找磨损、损坏或恶化迹象。
025-片剂硬度检查标准操作规程 片剂崩解时限检查标准操作规程 胶囊崩解时限检查标准操作规程

目的: 制订片剂压片过程中片剂硬度检查标准操作规程。
适用范围: 压片过程中片子硬度的检查。
责任: 压片操作工、车间质管员执行本规程,质管部负责监督检查本规程的执行。
程序:
1.仪器:片剂硬度测定仪。
2.方法
必须按规定的时间、次数进行测定。
2.1取样:每次测定至少取6.5g片。
2.2测定:根据所使用仪器的说明书进行测定并按所规定的位置放置,至少分别测定
6.5g片。
3.结果:
3.1在控制限度内:如果测得的结果在控制限度内,压片可继续进行,但若测定结果恰好在限度内或有接近限度的趋势,则须立即告知操作工对机器设备进行适当的调整。
调整后,另取样品再进行试验。
3.2 超出控制限度:一旦测得的结果超出控制限度,则须重新取样称重,以证实结果。
如果第二次测定的结果与上次一致时,应立即通知操作工对过程进行适当的调整。
对压片机调整后,取一新样品,再次测定,一旦再次测定结果在控制范围内,则通知操作工必须更换另一收集容器收集药片。
在调整前,最后一次测定结果合格与调整后重新得到合格品之间压出的药片必须与该批合格的药片分开放置,并在容器上贴上“待处理”标签,直到作出有关的决定为止。
如工艺过程调整后仍超过控制限度,则必须立即报告质管员及质管部。
查阅并记录片剂崩解时限检查方法及标准

【主题】查阅并记录片剂崩解时限检查方法及标准一、引言在制药行业中,片剂的崩解时间是一个重要的质量指标,它直接影响着药物的有效性和安全性。
对片剂的崩解时间进行检查是非常必要的。
本文将从深度和广度方面对片剂崩解时间的检查方法及标准进行全面评估,并撰写一篇有价值的文章,以便读者能更深入地理解这一主题。
二、片剂崩解时间检查方法1. 表面法表面法是一种常用的片剂崩解时间检查方法,它通过观察片剂在模拟胃肠道中的崩解情况来判断片剂的崩解时间。
具体操作步骤为将片剂放入模拟胃肠道中,然后记录片剂开始崩解的时间点,直到完全崩解为止。
这种方法简单易行,能够直观地反映片剂的崩解情况。
2. 离体法离体法是另一种常用的片剂崩解时间检查方法,它通过使用离体器官或模拟体液来模拟人体消化道环境,观察片剂在其中的崩解情况。
离体法对片剂崩解时间的检查更加接近真实人体情况,因此具有一定的参考意义。
3. 化学分析法除了直接观察片剂的崩解情况外,化学分析法也是常用的片剂崩解时间检查方法之一。
通过测定片剂中药物成分的溶出速度和量来间接反映片剂的崩解时间。
这种方法能够更加客观地评估片剂的崩解情况,但操作过程较为复杂。
三、片剂崩解时间标准根据《药典》的规定,片剂的崩解时间应当符合相应的标准,一般来说,常用的标准包括15分钟、30分钟和60分钟。
不同类型的药物可能有不同的崩解时间标准,需要根据具体情况进行调整。
四、个人观点和理解对于片剂崩解时间的检查,我认为应该在综合考虑了表面法、离体法和化学分析法的优缺点之后,选择最适合具体情况的检查方法。
标准的制定也应该结合实际情况进行调整,以确保能够更好地评估片剂的崩解情况。
五、总结和回顾通过本文的全面评估,我们对片剂崩解时间的检查方法及标准有了更深入的了解。
在实际的生产和质量控制中,我们应该根据具体情况选择合适的检查方法和标准,并不断优化和完善这一过程。
在本文中,我们深入探讨了片剂崩解时间的检查方法及标准,并共享了个人观点和理解。
崩解时限检查法
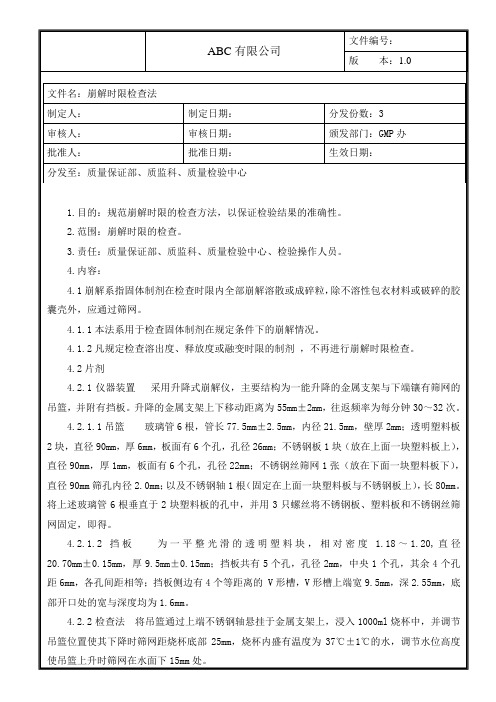
4.3.1硬胶囊剂或软胶囊剂 ,除另有规定外,取供试品6粒,按上述装置与方法(漂浮在液面的胶囊剂可加挡板)检查。硬胶囊剂应在30分钟内、软胶囊剂应在1小内全部崩解并通过筛网(囊壳碎片除外)。软胶囊剂可改在人工胃液中进行检查。如有1粒不能完全崩解,应另取6粒按上述方法复试,均应符合规定。
4.3.2肠溶胶囊剂,除另有规定外,取供试品6粒,按上述装置与方法(漂浮在液面的胶囊剂 可加挡板)检查。先在盐酸溶液(9→1000)中检查2小时,每粒的囊壳均不得有裂缝或崩解现象;继将吊篮取出,用少量水洗涤后,每管各加挡板一块,再按上述方法在磷酸盐缓冲液(PH6.8)中进行检查,1小内应全部崩解并通过筛网(囊壳碎片除外)。如有1粒不能完全崩解,应另取6粒复试,均应符合规定。
文件名:崩解时限检查法
制定人:
制定日期:
分发份数:3
审核人:
审核日期:
颁发部门:GMP办
批准人:
批准日期:
生效日期:
分发至:质量保证部、质监科、质量检验中心
1.目的:规范崩解时限的检查方法,以保证检验结果的准确性。
2.范围:崩解时限的检查。
3.责任:质量保证部、质监科、质量检验中心、检验操作人员。
4.内容:
4.2.2检查法 将吊篮通过上端不锈钢轴悬挂于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37℃±1℃的水,调节水位高度使吊篮上升时筛网在水面下15mm处。
4.2.2.1除另有规定外,取供试品6片,分别置上述吊篮的玻璃管中,启动崩解仪进行检查,药材原粉片各片均应在30分钟内全部崩解;浸膏(半浸膏)片、糖衣片各片均应在1小时内全部崩解。如有1片不能完全崩解,应另取6片复试,均应符合规定。
GMP认证全套文件资料63-崩解时限检查法标准操作规程
崩解时限检查法标准操作规程目的:制订崩解时限检查法标准操作规程。
适用范围:崩解时限检查。
责任:检验室检验人员按本规程操作,检验室主任监督本规程的实施。
程序:1. 简述1.1 本法(中国药典2000年版二部附录X A)适用于片剂(包括普通片、薄膜衣片、糖衣片、肠溶衣片及泡腾片)、胶囊剂(包括硬胶囊剂、软胶囊剂及肠溶胶囊剂),以及丸剂的溶散时限检查。
凡规定检查溶出度、释放度或融变时限的制剂,不再进行崩解时限检查。
1.2 片剂口服后,需经崩散、溶解,才能为机体吸收而达到治疗目的;胶囊剂的崩解是药物溶出及被人体吸收的前提,而囊壳常因所用囊材的质量,久贮或与药物接触等原因,影响溶胀或崩解;丸剂中不含有崩解剂,故在水中不是崩解而是逐渐溶散,且基质的种类与丸剂的溶解性能有密切关系,为控制产品质量,保证疗效,药典规定本检查项目。
1.3 本检查法中所称“崩解”,系指固体制剂于规定条件下在检查时限内全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应通过筛网。
2.仪器与用具2.1 崩解仪(见中国药典2000年版二部附录X A的仪器装置)2.2 滴丸剂专用吊篮按2.1项下所述仪器装置,但不锈钢丝筛网的筛孔内径改为0.425mm.2.3 烧杯1000ml2.4 温度计分度值1℃3. 试药与试液3.1 人工胃液(供软胶囊剂和以明胶为基质的滴丸剂检查用)取稀盐酸16.4ml,加水约800ml与胃蛋白酶10g,摇匀后,加水稀释成1000ml,即得。
临用前制备。
3.2 人工肠液(供肠溶胶囊剂检查用)取磷酸二氢钾6.8g,加水500ml使溶液解,用0.4%氢氧化钠溶液调节PH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释成1000ml,即得。
临用前制备。
4. 操作方法4.1 将吊篮通过上端的不锈钢轴悬挂于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37±1℃的水(或规定的溶液),调节液面高度使吊篮上升时筛网在液面下15mm处。
崩解时限检查操作规程
制药GMP管理文件一、引用标准:中华人民共和国药典(2005年版)一部。
二、目的:本标准规定了崩解时限检查法标准操作规程。
三、适用范围:适用于崩解时限的检查。
四、责任者:质检人员。
五、正文:1、简述:本法用于检查内服固体制剂在规定条件下的崩解情况。
崩解系指内服固体制剂在规定条件下全部崩解溶散或成碎粒,除不溶性包衣材料或破碎的胶囊壳外,应全部通过筛网。
如有少量不能通过筛网,但以软化或轻质上漂且无硬心者,可作符合规定论。
凡规定检查溶出度、释放度或融变时限的制剂,不再进行崩解时限的检查。
2、仪器与用具:升降式崩解仪。
3、操作方法:将吊兰通过上端的不锈钢轴悬挂于金属支架上,侵入1000ml烧瓶中,并调节吊兰位置使其下降时筛网距烧杯底部25mm,烧杯内盛有温度为37℃±1℃的水,调节水位高度使吊兰上升时筛网在水面下15mm处。
除另有规定外,取供试品6片,分别置上述吊兰的玻璃管中,启动崩解仪进行检查,各片均应在15分钟内全部崩解,如有一片不能全部崩解,应另取6片复试,均应符合规定。
薄膜衣片,按上述装置与方法检查,并可改在盐酸溶液中进行检查,应在30分钟内全部崩解。
如有一片不能全部崩解,应另取6片复试,均应符合规定。
肠溶衣片,按上述装置与方法,先在盐酸溶液中检查2小时,每片均不得有裂缝、崩解或软化现象,继将吊兰取出,用少量水洗涤后,每管加入挡板1块,按上述方法在磷酸盐缓冲液中进行检查,1小时内应全部崩解,如有一片不能全部崩解,应另取6片复试,均应符合规定。
泡腾片,取1片,置250ml烧杯中,烧杯中盛有200ml水,水温为15-25℃,有许多气泡放出,当片剂或碎片周围的气体停止逸出时,片剂应溶解或分散在水中,无聚集的颗粒剩留。
除另有规定外,同法检查6片,各片均应在5分钟内崩解,如有一片不能全部崩解,应另取6片复试,均应符合规定。
查阅并记录片剂崩解时限检查方法及标准
查阅并记录片剂崩解时限检查方法及标准查阅并记录片剂崩解时限检查方法及标准1. 引言片剂崩解时限检查是药品质量控制中不可或缺的一环。
正确而准确地评估片剂崩解时限可以为药品生产企业提供重要的质量保证。
在本文中,我们将深入探讨片剂崩解时限检查的方法和标准,以帮助读者更好地理解这一重要的质量控制指标。
2. 片剂崩解时限的定义和意义片剂崩解时限是指在一定的试验条件下,药物通过崩解释放活性成分所需的时间。
正确评估片剂崩解时限可以验证药物是否按照设计要求释放活性成分。
片剂崩解时限还可以衡量药物的生物利用度和治疗效果。
3. 片剂崩解时限检查方法(1)理论基础片剂崩解时限检查方法主要基于药典规定,其中包括中国药典、美国药典等。
这些药典为片剂崩解时限提供了详细的试验条件和评估指标。
(2)试验条件片剂崩解时限检查通常需要在模拟生理条件下进行。
常见的试验条件包括温度、溶液pH值、搅拌速度等。
这些条件的选择应基于药物的特性和适应对象。
(3)试验设备常用的片剂崩解时限检查设备包括崩解度仪、电子天平、恒温槽等。
这些设备可以提供稳定和准确的试验条件。
(4)试验步骤片剂崩解时限检查的试验步骤包括样品准备、试验条件设定、试验操作、数据记录等。
通过严格按照试验步骤进行操作,可以准确评估片剂崩解时限。
4. 片剂崩解时限的评估标准(1)国家标准不同国家和地区对于片剂崩解时限的评估标准可能存在差异。
中国药典对于常见药物的崩解时限给出了具体的评估标准,生产企业应根据国家标准进行评估。
(2)药企自主标准一些大型药企可能根据自身需求和技术水平制定了更为严格的片剂崩解时限评估标准。
这些标准可以更好地满足企业的质量控制需求。
5. 个人观点和理解片剂崩解时限是药品质量控制过程中非常重要的一项指标。
通过准确评估片剂崩解时限,可以保证药物的质量和疗效。
片剂崩解时限还可以为药企提供重要的质量控制数据和生产指导。
在实际操作中,我认为需灵活运用片剂崩解时限检查方法和标准。
崩解检测流程与标准
一、简述:1.崩解系指口服固体制剂在规定条件下全部崩解容散或成碎粒,除不溶性包衣材料或破碎的胶囊壳除外,应全部通过筛网。
如有少量不能通过筛网,但已软化或轻质上漂且无硬心者可作符合规定。
2.本法适用于片剂(普通、薄膜衣、糖衣、泡腾片)胶囊剂(硬、软、肠溶)以及丸剂的容散时限检查。
凡规定溶出度、释放度或溶变时间或分散均匀性的制剂,不在进行崩解时限测定。
二、仪器与用具:崩解仪、专用吊篮、1000ml烧杯三、操作方法:1.将吊篮通过上方的不锈钢轴悬挂于金属支架上,浸入1000ml烧杯中,并调节吊篮位置使其下降时筛网距烧杯底部25mm,烧杯内盛有37±1℃水(或规定的溶液),调节液面高度使吊篮上升时筛网在液面下15mm处。
除另有规定外,取片剂六片分别置于上述吊篮的玻璃管中,每管各加一片,立即启动崩解仪进行检测。
2.按上述装置与方法进行检测普通片:各片均应在15min内全部崩解。
如有一片崩解不完全应取六片重复上述操作。
薄膜衣片:可改在盐酸溶液(9→1000)中检查,各片均应在30min内全部崩解,如有一片崩解不完全应取六片重复上述操作。
四、结果与判定:1.供试品六片,每片均能在规定的时限内全部崩解、判定为符合标准。
2.初试结果,到固定时限后如有一片不能完全崩解,另取六片复试,各片在规定时限内均能完全崩解,仍判定为符合标准。
3.初试结果中有两片及以上不能完全崩解的,或在复试中有一片及以上不能完全崩解的判定为不符合标准。
五,注意事项:1.在测试过程中烧杯内的水温(或介质温度)应保持在37±1℃。
2.没测试一次后应当清洗吊篮的玻璃管及内壁筛网、档板等,并重新更换水或者规定的介质溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
操作标准----生产管理
文件名称片剂崩解时限检查标准编码SOP-SJ-026-00
页数2-1 实施日期
制订人审核人批准人
制订日期审核日期批准日期
制订部门质管部分发部门生产部、生产车间、车间质管员、检验室
目的: 制订片剂在压片过程中(或成品)片剂崩解时限检查标准操作规程。
适用范围: 压片过程中或片剂成品崩解时限的测定。
责任: 压片操作工、车间质管员、检验室检验员执行本规程,质管部负责监督本规程的执行。
程序:
1.仪器:ZB-IB崩解仪。
2.方法:按中国药典规定的方法依法测定(中国药典2000年版二部附录X A)。
2.1 取样:从压片机出口或每锅包衣片中至少取6片。
2.2 测定:使用药典所指定的崩解介质,从样品中取6片,分别防入崩解仪的6个管
子中,按下列时间表检查崩解情况。
允许的最大崩解时间在下述规定时间检查药片
≤2分钟连续观察
3分钟 1,2,3分钟
5分钟 1,3,5分钟
8分钟 4,6,8分钟
10分钟 5,8,10分钟
15分钟 5,10,15分钟
20分钟 10,15,20分钟
25分钟 15,20,25分钟
30分钟 15,25,30分钟
60分钟 30,45,60分钟记录每一组药片的崩解时间。
出现不合格结果时,要停机检查原因。
3.结果:
3.1 在控制限度内:如果测得的结果在控制限度内,压片可继续进行,但若测定结果
恰好在限度内或有接近限度的趋势,则须立即告知操作工对机器设备进行适当的
操作标准----生产管理
文件名称
片剂崩解时限检查标准
操作规程编码SOP-SJ-026-00 页数2-2
调整。
调整后,另取样品再进行试验。
3.2 超出控制限度:一旦测得的结果超出控制限度,则须重新取样测定,以证实结果。
如果第二次测定的结果与上次一致时,应立即通知操作工对过程进行适当的调整。
对压片机调整后,取一新样品,再次测定,一旦再次测定结果在控制范围内,则通
知操作工必须更换另一收集容器收集药片。
在调整前,最后一次测定结果合格与调
整后重新得到合格品之间压出的药片必须与该批合格的药片分开放置,并在容器上
贴上“待处理”标签,直到作出有关的决定为止。
如工艺过程调整后崩解时限仍超
过控制限度,则必须立即报告质管员及质管部。
