产品质量信息反馈及处理记录表
品质部质量改善跟进汇总表
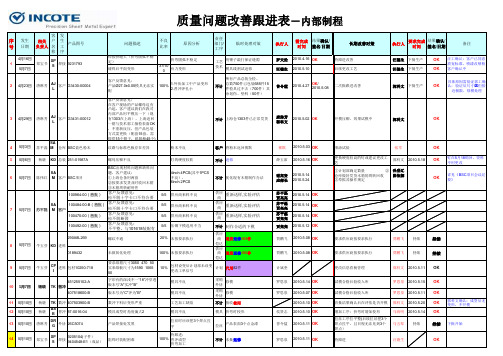
子件1302704A-03-01与子件 130270413-03-01组装后2个 面不平 ①.13(-0.05/-0.1)实测12.8 (min)12.93(max) ②.Ø10(+0.015/0)通规止 ③.Ø3(+0.06/0)同轴度不 良
图标333.86实测为197.5
100%
1302704A-03-01 2个辅 助定位去除和角度偏大
质量问题改善跟进表―内部制程
客发
序 号
发生 日期
相关 户 负责人 名
生 工
产品图号
称序
1 4月16日 郑宝书 XP 焊接 9231793
5月7日
S
2
4月23日
唐琳芳
AJ L
客户
G3430-00004
3
4月29日 唐琳芳 AJ 客户 G3431-00012 L
SA 4 5月3日 苏平磊 M 仓库 BSC蓝色粉末
2010.5.28
OK
罗思泉 2010.5.30 OK
2 5月18日 杨晓 TK 普冲 200495503-A
漏冲小凸包
300P CS
漏工序
普冲 返工
李强 2010.5.18 OK
按标准制作
马谈 2010.25 OK
3 5月18日 杨晓 TK 钳铆 407507100-C
压死边处腐蚀
压死边后氧化,氧化液残 留
郭科文
2010.5.13
1.各工序规范摆放
2.质量判定原则: a工序上报责任追溯前工序+可追 溯的工序; b品质发现:责任界定入当前工
各工序负 责人 QE
序+可追溯工序
持续
普冲落料完转序前通知项目主管 确认是否去毛刺并在流程卡上说 明
客户投诉处理记录

客户投诉处理记录日期:xxxx年xx月xx日受理人:XXX公司客服部门投诉人信息:姓名:XXX联系方式:XXX-XXXX-XXXX投诉内容:投诉人XXX先生就XXX产品质量问题向我公司进行投诉,提出以下问题:1. 产品损坏:他购买的产品在运输过程中受到了损坏。
2. 售后服务:在提出问题后,他与售后服务部门的沟通效果不理想。
3. 服务态度:售后服务人员的态度冷漠,未提供有效解决方案。
处理过程:我公司高度重视客户投诉事宜,迅速启动投诉处理程序,具体处理过程如下:1. 确认投诉案件:我们向投诉人XXX先生确认投诉内容,并核实其投诉事项的准确性。
2. 接纳投诉并致歉:我们向投诉人表达了我们对造成他的不便和困扰的诚挚歉意,并承诺将尽快解决问题。
3. 调查及处理:我们成立了一个由专业人员组成的调查小组,对投诉内容进行了详细调查。
我们与运输部门核实了运输过程中可能导致产品损坏的情况,并及时与相关部门进行沟通。
同时,我们也与售后服务部门沟通了投诉人提到的与售后服务人员的沟通问题,并进行了内部培训,以提升服务水平。
4. 解决方案:经过调查和协商,我们为投诉人找到了一种解决方案。
对于投诉人购买的损坏产品,我们将提供替换或退款的选择,并承担运输费用。
对于售后服务沟通问题,我们将增加售后服务人员的培训,并改善服务流程,以确保更好的沟通效果和解决方案。
5. 反馈处理结果:我们向投诉人XXX先生反馈了处理结果,并再次向其道歉。
我们承诺在今后的业务中不断提升产品质量和服务水平,确保类似问题不再发生。
结论:通过我们的努力和处理,投诉人XXX先生对我们的处理结果表示满意。
感谢他对我们工作的理解和支持。
我们将持续关注产品质量和客户服务,不断改进和提升,以更好地满足客户的需求和期望。
客户投诉处理记录完毕。
医疗器械经营企业记录表格(质量记录表格)
医疗器械质量信息反馈单编号: 反馈部门:
首营企业审批表
审核表应附资料:
1.医疗器械经营许可证或医疗器械生产许可证(复印件加盖红章)。
2.营业执照、税务登记证、组织机构代码证(复印件加盖红章)。
3.授权委托书原件。
首营品种审批表
编号:
注: 附医疗器械生产/经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。
医疗器械购进记录
医疗器械退货记录表
医疗器械入库验收单
医疗器械拒收单
医疗器械养护、检查表
医疗器械养护处理记录
医疗器械质量复检通知单
医疗器械质量查询函
近效期医疗器械预警表
医疗器械客户资格审核表
医疗器械销售记录表
医疗器械产品出库复核记录
医疗器械售后服务记录
质量问题追踪表
医疗器械产品质量查询、投诉记录表
医疗器械用户访问处理意见表
质量事故报告单
质量事故确认处理记录表
可疑医疗器械不良事件报告表
医疗器械销售退回申请单
医疗器械退回验收记录
医疗器械退回记录
医疗器械召回事件报告表补救无害化处理销毁
医疗器械召回计划实施情况报告
报告单位: (盖章)负责人: (签字)报告人: (签字)报告日期: 不合格品医疗器械确认表
不合格医疗器械报损审核表
不合格医疗器械产品处理记录表
不合格医疗器械销毁记录表
医疗器械培训计划表
年度培训记录表
年度体检汇总表档案
医疗器械员工健康档案表
医疗器械设施设备一览表
质量管理制度执行情况自查考试记录。
产品质量投诉、信息反馈处理管理制度
有限公司管理标准类文件目的:规范产品质量投诉、信息反馈的管理,确保用药安全,提高产品质量。
适用范围:本公司产品质量投诉、信息反馈的处理。
责任人:质量授权人、质量部经理、物控部经理、销售部经理、QAQC内容:1.本公司负责销售的部门或其他部门职工收到口头或书面有关本公司药品质量问题的信息,须立即将信函、实物、用户反映内容报告质量部人员。
2.质量部填写“产品质量投诉、信息反馈处理单",签署处理意见(一般派员走访、去电了解情况)。
报质量授权人及总经理批准。
3.走访人员应向用户了解药品质量情况,索取致使不良反应等药品实物、相关材料,所有调查情况均须记录在案。
4.质量部QA人员对取回的样品及相关资料进行检查确认。
5.非本公司产品或因用户保存不当等原因引起的质量问题或因用户误解,质量部QA人员应以书面形式向用户解释。
6.属于内在质量问题通知QC主任,对该批留样进行检验,并检查产品贮存情况;对被投诉的产品从生产产品的原辅料、内包装材料,生产设备、环境监测、工艺用水、批生产记录、偏差处理等全过程进行调查,如对关联批号产品也应开展调查,对留样样品进行检验;确认为产品质量缺陷的属药品召回范畴按药品召回管理制度执行。
7.个别产品缺陷:派员或去电、去函向用户致歉,必要时适当补偿(一般补赠药品或赔款)08.对产品质量肯定的信息也应收集。
9.质量部负责收集用户投诉、产品质量信息反馈资料及处理措施,造册存档。
10.对用户投诉严重不良反应,应按《不良反应监察报告管理制度》执行。
11.附“产品质量投诉处理单”,“用户访问意见处理单”,“产品质信息反馈处理单”。
R(M-QA-1012-01-01产品质量投诉处理单海南新中正制药有限公司用户访问意见处理单产品质量信息反馈处理单产品瑕疵责任和产品缺陷责任的差别1、性质不同。
瑕疵是违约责任,缺陷是侵权责任。
2、归责原则不同。
只要销售的产品有瑕疵的存在,销售者就应承担瑕疵担保责任;生产者的缺陷责任适用严格责任原则,销售者的缺陷责任适用过错责任原则或过错推定原则。
质检部记录表格
质检部相关记录表格
质量记录清单
文件更改申请
质量策划实施情况检查表
内校记录表
编号:ZG-7.6-04 序号:
编号::ZC-8.1.2-02 序号:
审核组组长:组员年月日第页共页
1审核目的:
2审核依据:GB/T19001-2000idtISO9001:2000
本公司质量手册第一版及质量管理体系其他文件
3审核覆盖产品:
审核时间:年月日至年月日
首次会议时间:月日时分
首次会议时间:月日时分
5现场审核期间请被审核方有关人员参加下列活动:
首、末次会议:最高管理者或其代表及与审核有关的管理要员参加。
审核活动:按审核日程安排,被审核方有关人员在本岗位。
6审核安排:
内审检查表
编号::ZC-8.1.2-03 共页第页
不符项报告
内部质量管理体系审核报告(可另附纸叙述)
进货验证记录表
半成品检验记录
成品检验记录
不合格品报告
客户投诉处理单
编号::ZC-8.3-01 序号:
纠正和预防措施处理单
编号::ZC-8.3-02 序号:
改进、纠正和预防措施实施情况一览表
编号::ZC-8.3-03 序号:
信息联络处理单
编号::ZC-8.3-01 序号:
关键控制点监控计划实施状况检查表
编号:SC-6.2-06 执行部门: 序号:
编制: 日期: 批准: 日期:
持续改进计划
合格供方评定表:
供方能力调查表
编号:GY-7.4-0.3 序号:。
质量信息传递反馈表

质量信息传递反馈表
编号:MLH-ZD-005 【5-1(18】
信息名称:总局关于39批次药品不合格的通告(2017年第193号)
信息来源:国家食品药品监督管理局
收集时间:2017年12月04日
收 集 人:***
信息等级:B类
信息主体:经中国食品药品检定研究院等11家药品检验机构检验,标示为吉林省力胜制药有限公司等19家企业生产的39批次药品不合格。现将相关情况通告如下:
一、不合格产品的标示生产企业、药品品名和生产批号为:
吉林省力胜制药有限公司生产的批号为20160902、20160903、20161002、20161102的安胃片,甘肃佛仁制药科技有限公司生产的批号为150902、151101、160301、170201的安胃片,山西云鹏制药有限公司生产的批号为D150501、D150502、D160201、D160602的安胃片,山西汾河制药有限公司生产的批号为170202的吡拉西坦片,山东仁和堂药业有限公司生产的批号为160601的吡拉西坦片,大同市云岗制药有限公司生产的批号为161214的硫酸庆大霉素颗粒,丹东宏业制药有限公司生产的批号为20160404、20160702的硫酸庆大霉素碳酸铋胶囊,上海全宇生物科技确山制药有限公司生产的批号为1605051的硫酸庆大霉素碳酸铋胶囊,太极集团重庆桐君阁药厂有限公司生产的批号为17030008的龙胆泻肝片,山东齐都药业有限公司生产的批号为1C16120305的羟乙基淀粉130/0.4氯化钠注射液,山东华鲁制药有限公司生产的批号为D17021802、D17012504、D17021601、D16102201、D17012402的羟乙基淀粉130/0.4氯化钠注射液,焦作联盟医用材料股份有限公司生产的批号为20160501的曲安奈德新霉素贴膏,上海金不换兰考制药有限公司生产的批号为20160506的曲克芦丁片,六安华源制药有限公司生产的批号为161120022-A的替硝唑氯化钠注射液,天津儿童药业有限公司生产的批号为20160502的头孢克洛颗粒,焦作市银河药业有限公司生产的批号为20160310、20160405、20160407、20160409、20160506的头孢拉定颗粒,广西邦琪药业集团有限公司生产的批号为160327、160525的头孢拉定颗粒,辽宁丹生生物制药有限公司生产的批号为20160801的胰酶肠溶片,陕西中医学院制药厂生产的批号为160701、17A01的银翘解毒合剂。不合格项目包括含量测定、脆碎度、装量差异、溶出度、微生物限度、可见异物、效价测定、性状等(详见附件)。
质量记录表格汇总86张

文件发放清单受控文件清单部门:第页共页制表:审批:日期:文件管理登记表部门:第页共页制表:审批:日期:文件领用申请单文件更改申请单文件销毁/留用申请单销毁文件登记表文档目录文件夹/袋名称:编号:编制:日期:文件借阅登记表有效文件登记表类别:体系文件编制:批准:有效期:质量记录清单部门:第页共页编制:审批:日期:管理评审计划管理评审通知管理评审记录管理评审会议签到表管理评审报告管理评审纠正/预防/改进措施记录单年度公司培训计划编制部门:负责人:编制日期:审批:第页共页个人培训记录培训考核记录表特殊工作人员资格审查记录表人力资源需求计划表员工培训考核有效性评价设施设备需求表设施设备报废申请表办公用品领用单设施设备记录设备管理台帐质量计划实施情况检查表产品要求确认表质量反馈信息处理单更改通知单_____________项目/产品开发建议书编制:审核:批准:新冶高科技集团蓄热电器与节能材料分公司年月日________________可行性分析报告编制:审核:批准:新冶高科技集团蓄热电器与节能材料分公司年月日________________设计任务书编制:审核:批准:新冶高科技集团蓄热电器与节能材料分公司年月日________________设计评审报告编制:审核:批准:新冶高科技集团蓄热电器与节能材料分公司年月日________________设计确认报告编制:审核:批准:新冶高科技集团蓄热电器与节能材料分公司年月日________________设计验证报告编制:审核:批准:新冶高科技集团蓄热电器与节能材料分公司年月日供方质量保证能力调查表请如实填写或选择下列各项,谢谢合作。
供方产品调查表供方质量保证能力评价报告供方质量保证能力评价报告合格供方名单拟制:审核:批准:日期:合格供方复审报告说明:表中评价方式共有a b c d四种,内容如下a 供方能力和质量体系的现场评价;b产品样品评价;c对比类似产品的历史情况;d对比其它使用者的使用经验。
产品质量问题反馈及处理流程

1. 目的:为了统一和规范产品质量问题反馈渠道及处理方式,保证产品质量问题得到闭环处理。
2.范围:适用于来自客顾客的产品质量问题投诉以及生产过程反馈的产品质量问题的处理。
3. 质量问题处理组织机构3.1质量领导小组成员:陈再明、蔡晓华、张慧敏、于长萍3.2质量问题处理小组成员:林金云、王荣伟、陈于荣、林琪、陈亚、杨树云、韩红艳、罗永初4.职责:4.1质量领导小组职责4.1.1负责质量方案和执行计划的监督考核;4.1.2负责因客观原因造成解决方案和执行计划不能实施情况的协调及发生责任纠纷的仲裁;4.1.3负责A类问题解决方案的评审和批准;4.1.4负责组织A类质量问题改进后产品的最终确认(包括产品及过程确认)。
4.1.5负责制定(QC小组奖励标准和验收标准及QC成果评价)4.2商务部职责:4.2.1负责顾客处产品质量问题信息的收集、反馈和责任及缺陷形式确认,4.2.2负责与顾客联系对改进后产品在主机厂的试装并跟踪改进后产品的试装情况,及时将准确的试装时间和试装要求反馈给大豪公司品保部、项目部和生产部,(更改后的条款)4.2.3负责改进产品送样计划和产品切换的储备计划的的编制。
4.3品保部职责:4.3.1对外部的质量问题品保部依据商务部确立的责任和缺陷形式,负责组织责任部门(研发/项目/商务)对A 的质量问题进行调查分析在48小时内制定顾客问题解决方案(纠正),负责立项的统计(记录在质量/生产例会清单上)并考核项目的完成情况,在质量/生产例会上公示考核结果;4.3.2负责B1类问题的失效原因分析和提出解决方案及执行计划并组织实施和跟踪验证;4.3.3对B1类质量问题(如顾客有要求时)负责制定纠正措施或8D报告,并负责改进样品的确认、样品提交及顾客试装结果的跟踪,提交跟踪验证验证结果报告,4.3.4品保部参与A类质量问题改进产品样品的确认及工装/模具/检具的验证,4.3.5负责组织A类质量问题更改后产品PPAP文件的提交,4.3.6品保部负责涉及到程序、制度和记录的更改。
