免疫组化实验结果的判定和分析
免疫组化操作方法、原理、步骤以及常见问题处理大总结

免疫组化操作方法、原理、步骤以及常见问题处理大总结免疫组化操作方法、原理、步骤以及常见问题处理大总结1、方法操作不难,最大的难处是出现异常结果时如何解决?这就需要掌握免疫组化实验原理,每一步知道为什么这样做,这样你才敢大胆地改革先前的不对的方法步骤。
如抗体孵育条件主要是抗体浓度、温度、时间,这三者一般是相互成反比的(相对),其中浓度是最重要的先决条件,温度决定反应的速度、时间决定反应的量。
就拿温度来说,可以有4 度、室温、37度,我推荐4度最佳,反应最温和,背景较浅;而37度反应速度较快,时间较短;室温我不太提倡,除非你每次都把环境温度控制在一定的范围,否则,尽量选择前两者。
2、免疫组化最大的优势是定位和定性。
相比于其他蛋白检测方法,免疫组化具有定性灵敏度高、定位较直接准确,是定位检测分析首选方法。
尤其对于有些因子的转位研究十分有用。
3、免疫组化结果定量分析的前提是高质量的染色切片。
免疫组化结果也能定量分析,但必须是背景染色浅而特异性染色较深的情况下,分析最为准确,这种原则可能也是我们日常审稿时判定研究结果的必备条件。
4、免疫组化实验一定要设置阳性对照和阴性对照。
阳性对照一般是用肯定表达这种抗原的切片来做;阴性对照一般是用PBS或非一抗替代一抗来进行反应,其余步骤均一致。
前者是排除方法和实验系统有无问题;后者是排除有无一抗外的非特异性染色。
5、免疫组化的应用广泛,是当前实验研究的最重要方法之一。
如今发SCI论文时,明显感觉仅靠量化的数据来发文章很难,加一些形态学数据或图片,老外十分欢迎,可能是怕你学术造假吧。
当然也不能做假阳性或假阴性结果。
6、免疫组化技术掌握与否的鉴定标准是同一切片或不同切片中不同抗原均从摸索浓度或条件而做出优良的染色切片。
我在平时带教中就发现许多研究生把我已经摸索很成熟的反应条件、浓度、方法步骤,重复运用于同一性质的切片和同一种抗体,做出来后就觉得自己已经掌握了免疫组化方法,更换一种抗体后,居然连二抗的种属来源都拿错了。
hp判读免疫组化标准__概述说明以及解释

hp判读免疫组化标准概述说明以及解释1. 引言1.1 概述免疫组化标准是一种常见的生物医学技术,用于检测和评估组织样本中特定蛋白质的表达情况。
其中,hp判读免疫组化标准是一种基于免疫组化技术的分析方法,用于评估hp(high power)图像中蛋白质表达量及其相关性。
随着免疫组化技术在临床医学和生物医学研究中的广泛应用,hp判读免疫组化标准成为了对组织标本进行准确定量分析的重要手段之一。
通过hp判读,可以快速而准确地获取蛋白质表达信息,并据此为临床诊断和治疗决策提供依据。
1.2 研究背景在人类健康和疾病治疗上,蛋白质表达水平的变化往往与许多重要的生物过程以及肿瘤发展等密切相关。
因此,对于蛋白质表达量的准确测定和分析是非常关键的。
然而,在传统方法下观察和量化蛋白质表达往往存在一些局限性,如操作复杂、结果主观性较高等。
相比之下,hp判读免疫组化标准能够通过数字图像分析技术对hp图像进行定量评估,并提供客观、准确的结果。
1.3 目的本文的目的在于全面介绍和解释hp判读免疫组化标准的概念、原理和应用。
具体而言,我们将首先介绍hp判读方法的简要内容以及其在实际应用中的重要意义。
然后,我们会深入解析免疫组织化学基础知识,并描述标准标本处理流程。
此外,我们还将详细解释hp判读免疫组化标准评估过程中使用的参数及其含义,并对标星形象出现原因进行分析。
最后,通过实际应用案例分析,我们将展示hp判读在临床病例诊断和癌症筛查等方面的应用前景,并探讨其在生物医学研究领域中的可行性与潜力。
通过本文深入探讨hp判读免疫组化标准的相关内容,希望能为医学领域中对该技术感兴趣的研究人员和临床医生提供有益的参考和指导。
同时,也期望能为该技术的进一步发展提供思路和启示。
2. hp判读免疫组化标准概述2.1 hp判读方法简介hp判读是一种基于免疫组化技术的分析方法,用于评估特定标本中蛋白质的表达水平。
通过对组织或细胞中的特定抗原进行染色和观察,可以得出关于该抗原丰度和分布情况的信息。
免疫组化结果判读

免疫组化相关资料
• https:///PathIQ/ Home.do • /web/hist opathology_help.htm • /neq asicc.shtml
CD20
细胞质阳性
GFAP
Mammaglobin
PSMA
细胞质/细胞膜
CD8
CD30
CD21
细胞核/细胞质
p16
S-100
PGP9.5
细胞外基质
CollegenII
其他
HP Villin EBV
例1:患者女性,43岁,左颈部肿物2个月
CD30和CD15表达
CD30
CD15
CD30
CD15
058313
高分子CK(34β E12)
-
058314
AMACR/p504s(13H4)
+
免疫组化染色结果分析:
设置的各种对照实验染色正常,送检组织中见有多数的肿瘤性腺上皮细胞(细胞核大 且有明显核仁)细胞质中AMACP/p504s强阳性,肿瘤性腺体周围未见P63和高分子CK 表达,组织中残留的正常腺体周围见有明显的P63和高分子CK表达但腺上皮细胞未见 AMACP/p504s表达。免疫组化染色结果提示符合前列腺癌的特征。 病理医师 何深震
表2
病理免疫组化报告单样本 XX病理科免疫组化报告单 患者姓名 王大山 性别 男 年龄 75 申请免疫组化日期 2005/12/7 申请医生 许如云 蜡块编号 0512117.12 免疫组化实验日期 2005/12/8 组织名称 前列腺 HE初步诊断 前列腺癌待排除 免疫组化检测方法 MaxVision法 显色剂 DAB
免疫组化结果判断标准

免疫组化结果判断标准免疫组化(Immunohistochemistry,IHC)是一种通过使用特定的抗体来检测组织样本中特定蛋白质的方法。
通过对免疫组化结果进行判断和分析,可以为临床医生提供重要的诊断和预后信息。
在免疫组化结果的判断中,常见的标准有阳性标记、定量分析、判定阴性、强度评分等。
免疫组化结果按照阳性标记分为阴性和阳性。
阳性结果表示目标蛋白质的表达存在,而阴性结果表示目标蛋白质的表达不存在。
在判断免疫组化结果时,需要注意结果的可靠性和准确性。
一般来说,阳性结果需要出现明显的染色反应,在组织样本中产生特定的颜色变化,而阴性结果则需要获得几乎无染色反应的结果。
除了阳性标记外,还可以通过定量分析来判断免疫组化结果。
定量分析可以通过使用计算机软件或图像分析系统,对免疫组化结果图像中的染色强度和染色面积进行计算和量化。
通过定量分析,可以量化目标蛋白质的表达水平,并与其他样本进行比较和分析,从而得出更加客观和可靠的结果。
在免疫组化结果的判断中,还有一种常见的标准是判定阴性。
判定阴性是指使用阴性对照和负对照来确定免疫组化染色的结果是否是阴性。
阴性对照是指在免疫组化实验中使用无目标蛋白质的组织样本或细胞,负对照是指在免疫组化实验中使用无抗体的组织样本或细胞。
通过对阴性对照和负对照的染色结果进行比较和分析,可以确定是否存在非特异性染色或假阳性结果。
除了以上几种标准外,免疫组化结果的判断还可以通过强度评分进行。
强度评分是根据染色的强烈程度对结果进行判断和评分的方法。
一般来说,免疫组化结果的强度可以分为负(0)、弱(1+)、中(2+)和强(3+)四个等级。
这种评分方法可以为临床医生提供蛋白质表达的定量信息,并帮助他们作出更加准确和可靠的诊断和预后判断。
总之,免疫组化结果的判断标准包括阳性标记、定量分析、判定阴性和强度评分等。
通过合理地应用这些标准,可以为临床医生提供重要的蛋白质表达信息,从而指导临床诊断和治疗决策。
免疫组化结果判定标准

免疫组化结果判定标准免疫组化(Immunohistochemistry,IHC)是一种利用抗体与抗原特异性结合的原理,通过显色反应来检测组织中特定蛋白的方法。
在临床病理诊断中,免疫组化技术被广泛应用于肿瘤诊断、分子靶向治疗策略制定以及预后评估等方面。
而对于免疫组化结果的判定标准,是保证免疫组化结果准确性和可重复性的关键。
一、阳性判定标准。
1. 强阳性,细胞膜、细胞核或细胞质呈现明显的棕色沉积,且在显微镜下呈现出浓烈的阳性信号。
2. 中度阳性,细胞膜、细胞核或细胞质呈现较浅的棕色沉积,且在显微镜下呈现出中等强度的阳性信号。
3. 弱阳性,细胞膜、细胞核或细胞质呈现微弱的棕色沉积,且在显微镜下呈现出轻微的阳性信号。
二、阴性判定标准。
1. 完全阴性,组织中无任何棕色沉积,仅呈现蓝色或无色。
2. 部分阴性,部分细胞呈现棕色沉积,但大部分细胞呈现蓝色或无色。
三、判定标准的影响因素。
1. 抗体质量,抗体的纯度、稀释度、保存条件等因素会直接影响免疫组化结果的准确性。
2. 组织取材及处理,组织取材的新鲜度、固定方法、切片厚度等都会对免疫组化结果产生影响。
3. 染色条件,染色的时间、温度、染色试剂的配制等都是影响免疫组化结果的关键因素。
四、结果判定的标准化。
为了保证免疫组化结果的一致性和可比性,临床病理实验室需要建立完善的质控体系,确保免疫组化结果的准确性和可靠性。
同时,临床病理医师需要接受系统的免疫组化技术培训,熟悉不同抗体的特异性和染色条件,以保证结果的准确判定。
总之,免疫组化结果的判定标准是保证免疫组化技术在临床病理诊断中准确应用的重要保障。
只有严格按照标准操作,才能保证免疫组化结果的准确性和可靠性,为临床诊断和治疗提供有力支持。
免疫组化实验报告
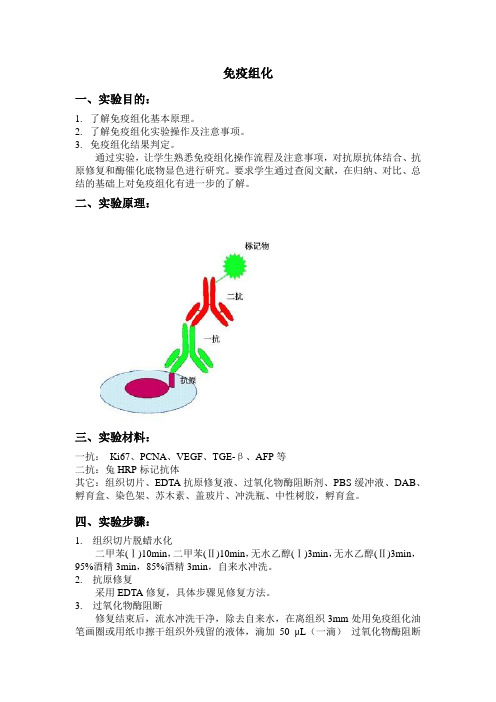
免疫组化一、实验目的:1.了解免疫组化基本原理。
2.了解免疫组化实验操作及注意事项。
3.免疫组化结果判定。
通过实验,让学生熟悉免疫组化操作流程及注意事项,对抗原抗体结合、抗原修复和酶催化底物显色进行研究。
要求学生通过查阅文献,在归纳、对比、总结的基础上对免疫组化有进一步的了解。
二、实验原理:三、实验材料:一抗:Ki67、PCNA、VEGF、TGE-β、AFP等二抗:兔HRP标记抗体其它:组织切片、EDTA抗原修复液、过氧化物酶阻断剂、PBS缓冲液、DAB、孵育盒、染色架、苏木素、盖玻片、冲洗瓶、中性树胶,孵育盒。
四、实验步骤:1.组织切片脱蜡水化二甲苯(Ⅰ)10min,二甲苯(Ⅱ)10min,无水乙醇(Ⅰ)3min,无水乙醇(Ⅱ)3min,95%酒精3min,85%酒精3min,自来水冲洗。
2.抗原修复采用EDTA修复,具体步骤见修复方法。
3.过氧化物酶阻断修复结束后,流水冲洗干净,除去自来水,在离组织3mm处用免疫组化油笔画圈或用纸巾擦干组织外残留的液体,滴加50 μL(一滴)过氧化物酶阻断剂,室温孵育10min,PBS冲洗3×3min。
4.孵一抗甩去PBS,纸巾擦干组织3mm外的残留液体,每张切片加50 μL(一滴)相应一抗,37℃孵育60min或4℃过夜,PBS冲洗3×3min。
5.孵二抗甩去PBS,纸巾擦干组织3mm外的残留液体,每张切片加50 μL(一滴)二抗试剂,37℃下孵育30分钟,PBS冲洗3×3min。
6.DAB显色甩去PBS液,纸巾擦干组织3mm外的残留液体,每张切片加50 μL(一滴)新鲜配制的DAB,显色5min,自来水冲洗。
7.苏木素复染每张切片滴加50 μL(一滴)苏木素,10-15s后自来水冲洗,或浸泡于PBS 中10-15s再自来水冲洗。
8.封片梯度酒精脱水干燥(85%酒精2min,95%酒精2min,无水乙醇2min,无水乙醇2min,二甲苯1min),或直接烘箱烘干,中性树胶封固。
免疫组化检测标准处理

免疫组化检测标准处理# 免疫组化检测标准处理## 一、前言嘿,朋友们!咱们今天来说说免疫组化检测这个事儿。
你看啊,在医学研究和疾病诊断领域呢,免疫组化检测就像是一个超级侦探。
它能帮助医生和研究人员发现细胞里面那些小小的变化,比如说哪里出现了癌细胞,或者某种特定的蛋白质是怎么分布的。
这个检测这么重要,要是没有个标准来规范它,那就像一群人在黑暗里摸索,乱了套了。
所以呢,咱们今天就来好好讲讲免疫组化检测的标准处理,让大家心里都有个底儿。
## 二、适用范围(一)病理诊断在医院里,病理科的医生经常会用到免疫组化检测。
比如说,有个患者的肿瘤组织看起来很复杂,医生很难判断它到底是良性的还是恶性的。
这时候,免疫组化检测就上场了。
这个标准就适用于这种情况,它能确保检测结果准确可靠。
就像给医生的诊断配上了一副高清眼镜,能让医生清楚地看到肿瘤细胞的“真面目”。
(二)疾病研究在科研人员研究疾病的时候,也离不开免疫组化检测。
例如研究某种新型疾病,想要了解病毒对人体细胞的影响,免疫组化检测可以显示出病毒感染后细胞内蛋白质的变化情况。
这个标准适用于从样本采集到最终结果分析的整个研究流程,就像一个路线图,让科研人员不会在研究的过程中“迷路”。
(三)药物研发制药公司在研发新药的时候,也需要用到免疫组化检测来看看药物对细胞内特定靶点的作用。
这个标准能保证不同实验室、不同研究人员做出来的结果具有可比性。
就好比大家都按照同一个菜谱做菜,做出来的菜味道才能有个比较。
## 三、术语定义(一)抗原咱们可以把抗原想象成是身体里的一个小标签。
它是一种能够刺激机体产生免疫反应的物质,就像一个小信号,让免疫系统知道有外来的东西或者身体里不正常的东西存在了。
在免疫组化检测里,抗原就是我们要找的那个“小目标”,检测就是看这个“小目标”在细胞里的什么地方,有多少。
(二)抗体抗体呢,就是身体的免疫系统为了对付抗原产生的一种特殊蛋白质。
你可以把它当成是专门针对抗原这个“小目标”的小卫士。
免疫组化实验结果的判定和分析

免疫组化实验结果的判定和分析免疫组化实验是一种广泛应用于生物医学研究领域的分析方法,它用于检测和定量分析细胞或组织中特定分子的表达水平。
该实验主要通过特异性抗体与目标分子结合并产生可视化信号来实现。
在进行免疫组化实验的结果判定和分析时,需要考虑多个因素,如抗体的选择、染色的强度和分布等。
首先,在实验结果的判定和分析时,抗体的选择是非常重要的因素之一、选择合适的抗体可以确保实验结果的准确性和可靠性。
抗体需要具有高度的特异性,能够与目标分子结合形成稳定的抗原-抗体复合物。
此外,抗体还需要具有良好的亲和力和灵敏度,以便能够捕获并检测到目标分子的最低表达水平。
其次,实验结果的判定和分析需要考虑染色的强度和分布。
免疫组化实验中常用的染色方法有荧光染色和酶标染色等。
染色的强度可以反映目标分子在细胞或组织中的表达水平,而染色的分布则可以提示目标分子的亚细胞定位或组织定位。
通过评估染色的强度和分布,可以对目标分子的表达及其在生物学过程中的作用进行初步分析。
另外,实验结果的判定和分析还需要结合负对照和阳性对照组的结果。
负对照组通常是将待测样本中的目标分子结合位点堵塞或与非特异性抗体结合,以排除非特异性染色的可能性。
而阳性对照组则是使用已知表达目标分子的样本进行染色,以验证实验方法的可靠性。
通过与负对照和阳性对照组的比较,可以进一步确定实验结果的准确性和特异性。
此外,实验结果的判定和分析还可以应用定量分析方法。
免疫组化实验通常使用染色强度的定量参数,如光密度或荧光信号强度来评估目标分子的表达水平。
这可以通过计算图像中目标区域的颜色强度来实现。
定量分析可以帮助研究者确定目标分子在不同条件下的变化趋势,并进一步研究其与疾病发生和发展的关联。
最后,实验结果的判定和分析应该结合其他相关的实验数据和研究背景进行综合分析。
免疫组化实验的结果往往只能提供目标分子在组织或细胞中的表达水平,而无法直接确定其功能和作用机制。
因此,需要将实验结果与其他实验手段和研究结果相结合,以获得更全面的分析结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
免疫组化实验结果的判定和分析
免疫组化实验结果的判定和分析
就实验结果而言,免疫组化技术服务主要涉及抗体实验结果的描述与分析、图片的确定与选取、相关数据的提供,上述工作是免疫组化工作的重点内容。
只有严格的实验设计、标准的实验操作、专业化的结果分析才能满足客户的要求,更好地为客户提供最优质的服务。
免疫组化结果的判定原则:
⒈必须同时设对照染色。
没有对照染色的免疫组化染色结果是不可信的。
⒉抗原表达必须在特定部位。
如LCA应定位在细胞膜上;CK应定位在细胞浆内;PCNA及p53蛋白应定位在细胞核内;EMA应定位在细胞膜上等等。
不在抗原所在部位的阳性着色,一概不能视为阳性。
⒊阴性结果不能视为抗原不表达。
由于检测方法灵敏度有高低之分,有时可因染色方法灵敏度不够,而导致阴性反应,判断时应注意。
⒋尽量避开出血、坏死及切片刀痕和界面边缘细胞的阳性表达,特别是酶免疫标记。
因为这类阳性着色多系内源干扰,或系人为因素所致。
⒌对免疫组化标记结果的意义不能绝对化,应结合临床资料、X线等影像学及实验结果综合分析。
对照染色设计:
(一)对照染色的目的
设对照的目的是为了排除假阴性和假阳性。
假阴性的原因主要有三种:
①组织处理不当,抗原丢失过多或被遮蔽;
②抗体失活、效价过低或稀释度不合适(主要指一抗,即特异性抗体);
③染色步骤遗漏及差错,或显色剂的选择、缓冲液pH和离子强度不当等。
假阳性均系由多种因素造成的非特异着色所致,原因主要有:
①自发荧光或内源酶等干扰;
②抗体试剂不纯(特别是一抗);
③操作失误,如污染、切片干枯或显色剂操作不当等;
④Fc受体的干扰,等等。
(二)对照的种类及其选用目的
对照染色大致可分为四类:
即阳性组织对照、阴性组织和阴性试剂对照及自身对照。
⒈阳性组织对照
指用已证实含有靶抗原的同源及不同源组织切片或细胞涂片与待检实验切片同时作同样处理和免疫染色的组织对照。
正确的结果应呈现阳性,目的是为了证实所用免疫组化染色流程的有效性,排除假阴性的可能。
⒉阴性组织对照
指用已证实不含靶抗原的同步处理和免疫标记染色的组织对照。
正确的结果应为阴性,目的是除外假阳性。
⒊阴性试剂对照
是指用于证实在免疫组化染色中所用试剂,尤其是特异性抗体试剂的有效性和可靠性而所设立的同步免疫染色对照,包括有:
空白对照、替代对照、吸收试验和抑制试验等。
目的在于除外假阳性和证实所用免疫组化试剂及其技术方法的有效性和待检实验切片免疫标记阳性结果的可靠性。
⑴空白对照
指以缓冲液(PBS、TBS等)取代第一抗体(主要的,必要时还可做第二抗体及桥联抗体的空白取代),其他各步不变的试剂对照染色,结果应为阴性。
⑵取代对照
指以所用方法第一抗体同源动物的正常血清,或与本实验无关的抗体(靶生物缺如的)取代第一抗体,其他步骤不变的试剂对照染色,结果应为阴性。
⑶吸收试验
是指用事先经过量抗原吸收的第一抗体上清液取代第一抗体,其他步骤不变的免疫染色试剂对照。
结果应是阴性或阳性着色明显减弱(吸收不全时)。
⑷抑制试验
是指用标记抗体和未标记抗体(可以是一抗,也可以是二抗或桥抗体)两者的混合物作试剂,其他步骤不变的免疫组化染色试剂对照,结果其阳性着色应成比例的减弱(等量或1:9)。
此试剂对照多用于直接法。
这类阴性试剂对照的选用原则是:
①空白对照不能省,其他对照在预实验中应多做,尤其是应用新抗体试剂;
②对照必需与实验片同步进行染色;
③对照的结果应附合要求。
⒋自身对照
是指在同一标记切片上的自身组织成分的阴性背景对照。
即与靶抗原阳性反应细胞或成分相邻的阴性背景结构的显色,结果应为阴性或着色较浅,需与阳性着色成分呈鲜明对比。
目的在于排除内源性干扰产生的假阳性和因抗原弥散移位造成的错误结果。
非特异性染色:
非特异染色是指免疫组化染色过程中产生的非靶抗原的呈色结果,属假阳性,又称背景着色,能严重干扰免疫组化染色结果的正确判断,应竭力避免或减轻。
其原因涉及免疫组化染色流程的各个环节,可来自:
①内源性干扰(自发荧光、内源酶、内源性生物素等);
②试剂污染(质量差,交叉反应,Fc受体干扰等);
③组织处理不当(组织固定不及时或固定不良所导致的抗原弥散移位、洗涤不充分所导致的游离试剂残留等)。
纠正的方法视原因而异,可在预实验基础上,采用有针对性的纠正对策,即对症下药。
阳性标记的形态特征和判断:
免疫组化标记具有一定形态特点,若能熟练掌握则有助于对免疫组化标记结果的正确判断。
特点包括定性、定位和定量三方面。
免疫显色强度和阳性细胞密度是定性定量指标,实际工作中常采用强度和密度结合的方法综合计量,与抗原含量有关;阳性细胞的着色形态及组织分布特点主要是定位指标,与功能有关。
一、阳性标记免疫特征
分"弱(+)、中(++)、强(+++)"三级。
免疫荧光法(FITC为例)则表现为浅绿色荧光、明显绿色荧光和亮绿色耀眼荧光;
免疫酶标记(HRP- DAB/H
2O
2)则表现为淡黄色细颗粒、棕黄色颗粒和褐黄色粗颗粒,后者耀眼易见。
一般图片照像,原则上多取强阳性区域。
二、阳性标记细胞学特征(以HRP-DAB/H
2O
2为例)
可分为①胞膜型;②胞核型;③胞质(浆)型;④微绒毛型和⑤复合型(胞膜-胞质兼有,胞核-胞质兼有,或微绒毛-胞质兼有)等五种阳性细胞类型。
这与抗原所在部位相关联,但应注意排除因组织固定不好引起的抗原弥散假象,尤其是复合型图像。
三、"阳性标记组织学特征(以HRP-DAB/H
2O
2为例)
免疫组化染色阳性细胞在组织中的分布排列形式可以有如下7种:
①局灶型;②弥漫型;③片块型;④网状型;⑤腺管型;⑥腔缘型和⑦菊团型等。
这主要取决抗原抗体复合物在细胞内的分布和阳性细胞在组织内的群体分布特点。
四、阳性标记强度特征
依照细胞阳性着色程度(抗原含量),可分为:
弱阳性(+)┅1分;
中等阳性(++)┅2分;
强阳性(+++)┅3分。
依照阳性细胞数量,可分为:
弱阳性(+,指阳性细胞总数在25%以下);
中等阳性(++,指阳性细胞总数在25%—49%);
强阳性(+++,指阳性细胞总数在50%以上)。
目前多采用积分综合计量。
计算公式为:(+)%x1 +(++)%x2+(+++)%x3;总数值< 1."0者为(+),
1."0-
1."5者为(++),>
1."5者为(+++)。
至少随机观察5-10个HPF。
