空气中NOx 的测定
环境空气 氮氧化物(一氧化氮和二氧化氮)的测定 盐酸萘乙二胺分光光度法(HJ 479—2009 )

目次前言 (iv)1 适用范围 (1)2 术语和定义 (1)3 方法原理 (1)4 试剂和材料 (1)5 仪器和设备 (2)6 干扰及消除 (2)7 样品 (3)8 分析步骤 (4)9 结果表示 (4)10 精密度和准确度 (5)附录A(规范性附录)吸收瓶的检查与采样效率的测定 (6)附录B(资料性附录) Saltzman实验系数的测定 (7)环境空气氮氧化物(一氧化氮和二氧化氮)的测定盐酸萘乙二胺分光光度法1 适用范围本标准规定了测定环境空气中氮氧化物的分光光度法。
本标准适用于环境空气中氮氧化物、二氧化氮、一氧化氮的测定。
本标准的方法检出限为0.12 µg/10 ml吸收液。
当吸收液总体积为10 ml,采样体积为24 L时,空气中氮氧化物的检出限为0.005 mg/m3。
当吸收液总体积为50 ml,采样体积288 L时,空气中氮氧化物的检出限为0.003 mg/m3。
当吸收液总体积为10 ml,采样体积为12~24 L时,环境空气中氮氧化物的测定范围为0.020~2.5 mg/m3。
2 术语和定义2.1 氮氧化物 nitrogen oxides指空气中以一氧化氮和二氧化氮形式存在的氮的氧化物(以NO2计)。
2.2 Saltzman实验系数 Saltzman-factor用渗透法制备的二氧化氮校准用混合气体,在采气过程中被吸收液吸收生成的偶氮染料相当于亚硝酸根的量与通过采样系统的二氧化氮总量的比值(测定方法见附录B)。
2.3 氧化系数 oxidation coefficient空气中的一氧化氮通过酸性高锰酸钾溶液氧化管后,被氧化为二氧化氮且被吸收液吸收生成偶氮染料的量与通过采样系统的一氧化氮的总量之比。
3 方法原理空气中的二氧化氮被串联的第一支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
空气中的一氧化氮不与吸收液反应,通过氧化管时被酸性高锰酸钾溶液氧化为二氧化氮,被串联的第二支吸收瓶中的吸收液吸收并反应生成粉红色偶氮染料。
空气中氮氧化物的测定

空气中氮氧化物(NOx)的测定(盐酸萘乙二胺分光光度法)摘要:本文采用盐酸萘乙二胺分光光度法测定室内空气中氮氧化物(NOx),根据配置标准溶液用分光光度计测定其吸光度,绘制标准曲线,分析空气中氮氧化物的含量结果。
关键词:氮氧化物分光光度法含量综述大气中氮氧化物主要包括一氧化氮和二氧化氮,其中绝大部分来自于化石燃料的燃烧过程,包括汽车及一切内燃机所排放的尾气,也有一部分来自与生产和使用硝酸的化工厂、钢铁厂、金属冶炼厂等排放的废气中。
动物实验证明,氮氧化物对呼吸道和呼吸器官有刺激作用,是导致目前支气管哮喘等呼吸道疾病不断增加的原因之一,二氧化氮与二氧化硫和浮游颗粒物共存时,其对人体的影响不仅比单独二氧化氮对人体的影响严重的多,而且也大于各自污染物之和。
对人体的实际影响是各污染物之间的协同作用。
因此大气氮氧化物的监测分析是环境保护部门日常工作的重要项目之一。
采用化学发光法测定空气中氮氧化物较以往的盐酸禁乙二胺分光光度法具有灵敏度高、反应速度快、选择性好等特点 ,现已被很多国家和世界卫生组织全球监测系统作为监测氮氧化物的标准方法 ,也已引起我国环保部门的注意和重视 ,相信不久将来 ,此方法也会成为我国环境空气监测氮氧化物的首推方法。
1、实验目的(1)熟悉、掌握小流量大气采样器的工作原理和使用方法;(2)熟悉、掌握分光光度计的工作原理及使用方法。
(3)掌握大气监测工作中监测布点、采样、分析等环节的工作内容及方法。
2、实验原理,测定氮大气中的氮氧化物(NOx)主要是一氧化氮(NO)和二氧化氮(NO2))氧化管将一氧化氮成二氧化氮。
二氧化氧化物浓度时,先用三氧化铬(CrO3),与对氨基苯磺酸起重氧化反应,再与盐氮被吸收在溶液中形成亚硝酸(HNO2酸萘乙二胺偶合,生成玫瑰红色偶氮染料。
于波长540~545之间测定显色溶液的吸光度,根据吸光度的数值换算出氮氧化物的浓度,测定结果以二氧化氮表示。
本法检出限为0.05μg/5mL,当采样体积为6L时,最低检出浓度为0.01μg /m3。
实验四大气中氮氧化物的测定

实验四大气中氮氧化物的测定本实验旨在通过分别采用盐酸铁法和紫外分光光度法对大气中氮氧化物进行测定。
一、实验原理大气中的氮氧化物主要包括一氧化氮(NO)、二氧化氮(NO2)、氮氧化物(NOx),其中NO和NO2又称为NOx的主要组成部分。
NOx的排放来源主要是机动车尾气、工业排放和燃煤发电等。
大气中的NOx经过光化学反应可以形成臭氧(O3)、光化学烟雾和酸雨等污染物,对环境和人体健康产生极大危害。
盐酸铁法是一种常用的测定NOx的方法。
NO与Fe2+在酸性环境下反应生成Fe3+和NO2,再用亚硝酸钠还原反应生产NO,通过测量反应体系中亚硝酸钠使用量确定NOx浓度。
NO + Fe2+ +2H+ → Fe3+ + NO2 + H2ONO2 + H2O + NO + 2H+ → 2NO2 + 2H2ONO2 + 2Fe2+ + 2H+ → 2Fe3+ + NO + H2O2NO + 2Fe2+ + 4H+ → 2Fe3+ + 2NO2 + H2ONO + NO2 → NOx紫外分光光度法是通过检测NO和NO2在紫外光区的吸收强度来测定NOx浓度的。
在氮氧化物的易水解性中NO在比较缓慢的速率下可以水解生成NO2,NO2的浓度在光照下会使NO的水解速率加快,导致NO逐渐被NO2替代。
根据此特性,在不同波长下测量NO和NO2的吸光度,可以用线性方程计算出它们的浓度。
二、实验步骤1、盐酸铁法方法(1)将空气样品抽入吸附管中,使用手摇气泵抽气5分钟。
(2)去掉吸附管两头的止口,在吸附管两侧放置刻度瓶,使用气泵用10ml/min的速率,将10ml 0.2mol/L HCl的溶液通过吸附管冲洗。
(3)再打开吸附管两侧的止口,在一个瓶内收集冲洗溶液。
该瓶内即为样品。
(4)取10mL样品定容到50mL瓶中,加入2ml浓盐酸和5ml5%亚硝酸钠溶液,静置10min,调至pH=1。
(5)加入50ml 离子交换水,置于紫外分光光度计上,将吸收室波长设定于543 nm 处,用离子交换水作为对照样品,读取样品和对照样品的吸光度。
大气中氮氧化物的测定

大气中氮氧化物的测定一、目的和要求(1) 把握大气采样器及汲取液采集大气样品的操作技术。
(2) 学会用盐酸蔡乙二胺分光光度法测定大气中氮氧化物的办法。
二、原理大气中的氮氧化物主要包括一氧化氮、一氧化二氮.金氧化二氮、二氧化氮等,无色无味的一氧化氮和刺激性的二氧化氮均是大气中的重要污染物,通常用NOx表示。
在测定氮氧化物时,先用三氧化铬将一氧化氮氧化成二氧化氮,然后测定二氧化氮的浓度。
二氧化氮被汲取液汲取后,生成亚硝酸和硝酸。
其中,亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸蔡乙二胺偶合,生成玫瑰红偶氮染料,按照色彩深浅,用分光光度法比色测定。
通过称量法校准的二氧化氮渗透管配制低浓度标准气体测得NO2(气)→NO2-(液)的转换系数为0.76,所以在计算结果时要除以转换系数0.76。
大气中二氧化硫浓度为氮氧化物浓度的10倍时,对氮氧化物的测定无干扰;30倍时,使色彩有少许减轻,但在城市环境大气中,这种状况较少。
臭氧浓度为氮氧化物浓度的5倍时,对氮氧化物的测定略有干扰,在采样3h后,使试液展现微红色,对测定影响较大。
过氧乙酞硝酸醋(PAN),对氮氧化物的测定产生正干扰,般环境空气中PAN浓度较低,不会导致显著的误差。
三、仪器与试剂(1) l0mL多孔玻板汲取管。
(2)双球玻璃管。
(3) 空气采样器。
流量范围0-1L/min。
(4)分光光度计。
(5) 重蒸蒸馏水。
所用试剂均用不含亚硝酸根的童然熟馏水配制,即所配汲取液的吸光度不超过0.005。
(6) 汲取原液。
称取5. 0g对氨基苯磺酸,通过玻璃小偏斗挺直加入1000mL容量瓶中,加入50mL冰醋酸和900mL水的混合溶液,盖塞振摇使其溶解,待对氨基苯磺酸彻低溶解后,加入0. 050g盐酸蔡乙二胺[N-(1-naphthyl)-ethylenediamine dihydrochloride〕溶解后,用水稀释至标线。
此为汲取原液,储于棕色瓶中,在冰箱中可保存2个月。
空气中氮氧化物(NOx)的测定

空气中氮氧化物(NOx)的测定(盐酸萘乙二胺分光光度法)1、实验目的(一)熟悉、掌握小流量大气采样器的工作原理和使用方法;(二)熟悉、掌握分光光度分析方法和分析仪器的使用;(三)掌握大气监测工作中监测布点、采样、分析等环节的工作内容及方法。
2、实验原理大气中的氮氧化物(NOx)主要是一氧化氮(NO)和二氧化氮(NO2),测定氮氧化物浓度时,先用三氧化铬(CrO3)氧化管将一氧化氮成二氧化氮。
二氧化氮被吸收在溶液中形成亚硝酸(HNO2),与对氨基苯磺酸起重氧化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料。
于波长540~545之间测定显色溶液的吸光度,根据吸光度的数值换算出氮氧化物的浓度,测定结果以二氧化氮表示。
本法检出限为0.05μg/5mL,当采样体积为6L时,最低检出浓度为0.01μg /m3。
3、实验仪器和试剂(一)实验用仪器除一般通用化学分析仪器外,还应具备:多孔玻板吸收管、空气采样器(KC—6型)、双球玻璃氧化管(内装涂有三氧化铬催化剂的石英砂)、分光光度计(7220型)、KC—6D型大气采样器(二)实验用试剂所有试剂均用不含硝酸盐的重蒸蒸馏水配制。
检验方法是要求用该蒸馏水配制的吸收液的吸光度不超过0.005(540~545nm,10mm比色皿,水为参比)。
1. 显色液:称取5.0克对氨基苯磺酸,置于200毫升烧杯中,将50毫升冰醋酸与900毫升水的混合液分数次加入烧杯中,搅拌使其溶解,并迅速转入1000毫升棕色容量瓶中,待对氨基苯磺酸溶解后,加入0.03克盐酸萘乙二胺,用水稀释至标线,摇匀,贮于棕色瓶中。
此为显色液,25℃以下暗处可保存一月。
采样时,按四份显色液与一份水的比例混合成采样用的吸收液。
2. 三氯化铬—砂子氧化管:将河砂洗净,晒干,筛取20~40目的部分,用(1+2)的盐酸浸泡一夜后用水洗至中性后烘干。
将三氧化铬及砂子按(1+20)的重量混合,加少量水调匀,放在红处灯下或烘箱里于105℃烘干,烘干过程中应搅拌数次。
大气中氮氧化物的测定实验报告

一、实验目的1. 掌握大气中氮氧化物(NOx)的测定方法。
2. 了解实验原理和实验操作步骤。
3. 学会使用分光光度计进行定量分析。
二、实验原理大气中的氮氧化物主要是一氧化氮(NO)和二氧化氮(NO2)。
测定大气中的氮氧化物浓度,通常采用盐酸萘乙二胺分光光度法。
该方法的原理是:先将NO氧化成NO2,然后NO2与吸收液中的对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料。
通过比色定量,计算空气中的氮氧化物浓度。
三、实验仪器与试剂1. 仪器:多孔玻板吸收管、双球玻璃管(内装三氧化铬-砂子)、空气采样器、分光光度计、容量瓶、移液管、烧杯、玻璃棒等。
2. 试剂:三氧化铬-砂子、冰乙酸、对氨基苯磺酸、盐酸萘乙二胺、亚硝酸钠标准溶液、蒸馏水等。
四、实验步骤1. 准备工作:称取5.0g对氨基苯磺酸,置于容量瓶中,加入50mL冰乙酸和900mL水的混合溶液,盖塞振摇使其完全溶解。
继之加入0.050g盐酸萘乙二胺,溶解后,用水稀释至标线,此为吸收原液,贮于棕色瓶中,在冰箱内可保存两个月。
2. 采样:将制备好的吸收原液与等体积的水混合,配成采样用吸收液。
用空气采样器以每分钟300毫升的速度采集空气样品,采样时间根据实验要求确定。
3. 氧化:将采样后的样品放入装有双球玻璃管(内装三氧化铬-砂子)的容器中,将空气样品中的NO氧化成NO2。
4. 显色:将氧化后的样品溶液倒入比色皿中,用分光光度计在波长540nm处测定吸光度。
5. 标准曲线绘制:用亚硝酸钠标准溶液配制一系列不同浓度的标准溶液,按照与样品溶液相同的步骤进行显色,绘制标准曲线。
6. 计算结果:根据样品溶液的吸光度,从标准曲线上查得对应的NO2浓度。
根据NO2与NO的转换系数0.76,计算空气样品中的氮氧化物浓度。
五、实验结果与分析1. 实验结果:通过实验,测定出空气样品中的氮氧化物浓度为X mg/m³。
2. 分析:本次实验采用盐酸萘乙二胺分光光度法测定大气中氮氧化物浓度,实验结果与理论值基本相符,说明实验方法可靠。
大气中NOX的测定
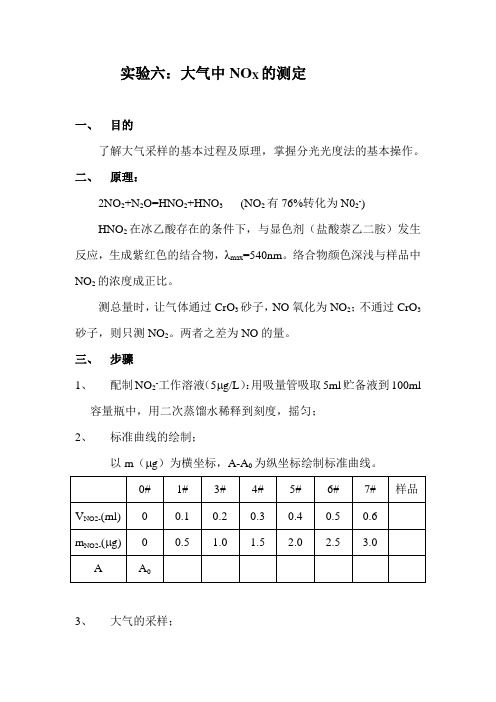
实验六:大气中NO X的测定一、目的了解大气采样的基本过程及原理,掌握分光光度法的基本操作。
二、原理:2NO2+N2O=HNO2+HNO3(NO2有76%转化为N02-)HNO2在冰乙酸存在的条件下,与显色剂(盐酸萘乙二胺)发生反应,生成紫红色的结合物,λmax=540nm。
络合物颜色深浅与样品中NO2的浓度成正比。
测总量时,让气体通过CrO3砂子,NO氧化为NO2;不通过CrO3砂子,则只测NO2。
两者之差为NO的量。
三、步骤1、配制NO2-工作溶液(5μg/L):用吸量管吸取5ml贮备液到100ml容量瓶中,用二次蒸馏水稀释到刻度,摇匀;2、标准曲线的绘制;以m(μg)为横坐标,A-A0为纵坐标绘制标准曲线。
3、大气的采样;通气到吸收液变红(吸收液:4ml 吸收原液 +1ml 水)。
记录: Q= L/min ; 采样的时间t= min ;实验室温度T= ℃; 大气压力P= kpa 。
4、测定:λmax =540nm ; b=1cm ; #0做参比液。
四、 原始数据五、 数据的处理1、根据112212P V P V T T =,求得标准状态下的体积V n 。
2.以A-A 0、m 为基本的参数,作回归方程:A=a+bm ,求出A a m b -=(μg ),NOx mC 0.76Vn= (mg/m 3) 或者以A~m 作图,求得m x ,再求出 xNOx m C 0.76Vn =(mg/m 3)。
六、 注意的事项1、 采样时注意管子的连接,不要将管靠近明火。
2、 将采集的气体集换成标准状态下的体集。
3、 配标准曲线时,切记将水倒出。
4、 不能污染药剂,吸管不能插错瓶子。
大气中NOx的测定

⼤⽓中NOx的测定学院不同⼯作场所⼤⽓中氮氧化物测定实验设计学院:学院专业:班姓名:学号:指导教师:实验不同⼯作场所⼤⽓中氮氧化物的测定⼀、实验⽬的1.了解⼤⽓中监测采样器的结构和使⽤操作;2.掌握⽤⽐⾊法测定⼤⽓中氮氧化物的原理和⽅法;3.学会溶液吸收富集采样⽅法对⼤⽓中分⼦污染物的采集。
⼆、原理⼤⽓中的氮氧化物主要是⼀氧化氮和⼆氧化氮。
在测定氮氧化物浓度时,应先⽤三氧化铬将⼀氧化氮氧化成⼆氧化氮。
⼆氧化氮被吸收液吸收后,⽣成亚硝酸和硝酸,其中,亚硝酸与对氨基苯磺酸发⽣重氮化反应,再与盐酸萘⼄⼆胺偶合,⽣成玫瑰红⾊偶氮染料,据其颜⾊深浅,⽤分光光度法定量。
因为NO 2(⽓)转变为NO 2-(液)的转换系数为0.76,故在计算结果时应除以0.76。
三、仪器1.多孔玻板吸收管2.分光光度计3.空⽓采样器:流量范围 0—1L/min4.双球玻璃管(内装三氧化铬-砂⼦)四、试剂:所有试剂均⽤不含亚硝酸根的重蒸馏⽔配制。
其检验⽅法是:所配制的吸收液对540nm光的吸光度不超过0.005。
1.吸收液:称取5.0g对氨基苯磺酸,置于1000mL容量瓶中,加⼊50mL冰⼄酸和900mL⽔的混合溶液,盖塞振摇使其完全溶解,继之加⼊0.050g盐酸萘⼄⼆胺,溶解后,⽤⽔稀释⾄标线,此为吸收原液,贮于棕⾊瓶中,在冰箱内可保存两个⽉。
保存时应密封瓶⼝,防⽌空⽓与吸收液接触。
采样时,按4份吸收原液与1份⽔的⽐例混合配成采样⽤吸收液。
2.三氧化铬-砂⼦氧化管:筛取20—40⽬海砂(或河砂),⽤(1+2)的盐酸溶液浸泡⼀夜,⽤⽔洗⾄中性,烘⼲。
将三氧化铬与砂⼦按重量⽐(1+20)混合,加少量⽔调匀,放在红外灯下或烘箱内于105℃烘⼲,烘⼲过程中应搅拌⼏次。
制备好的三氧化铬-砂⼦应是松散的,若粘在⼀起,说明三氧化铬⽐例太⼤,可适当增加⼀些砂⼦,重新制备。
称取约8g三氧化铬-砂⼦装⼊双球玻璃管内,两端⽤少量脱脂棉塞好,⽤乳胶管或塑料管制的⼩帽将氧化管两端密封,备⽤。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
)论文题目:校园空气中NO x 的测定姓名:院系专业:班级:09学号:指导老师:完成时间:目录目录 (I)摘要.................................................................................................................. I II Abstract ................................................................................................................ I II 一前言. (1)1.1 研究背景 (1)1.1.1 NO x的主要来源 (1)1.1.2 NO x的主要危害及其防治措施 (1)1.2 NO x的研究进展 (2)1.2.1化学发光法 (2)1.2.2库伦原电池法 (2)1.2.3盐酸萘乙二胺分光光度法 (2)1.3实验原理 (3)1.4选题依据 (3)二实验部分 (4)2.1实验仪器 (4)2.2实验药品和试剂 (4)2.3实验步骤 (5)2.3.1标准曲线的绘制 (5)2.3.2 样品的测定 (6)2.4数据处理 (6)三结果与讨论 (7)3.1标准曲线的绘制 (7)3.2采样及样品溶液的测定 (8)3.2.1 NO2一周的含量变化 (8)3.2.2 NO x一周的含量变化 (8)3.2.3 NO2含量的日平均浓度 (9)3.2.4 NO x含量的日平均浓度 (9)3.2.5实验数据分析 (10)3.3加标回收实验 (10)四结论 (11)参考文献 (12)致谢 (13)摘要[目的]探索用盐酸萘乙二胺分光光度法测定校园空气中氮氧化物的含量。
[方法]NO2被吸收液吸收后,生成硝酸和亚硝酸。
其中亚硝酸与对氨基苯磺酸发生重氮化反应,再与盐酸萘乙二胺偶合,生成玫瑰红偶氮染料,根据颜色深浅,用分光光度法于540nm处比色测定。
[结果]:当采样体积为10L时,NO2最低检出限(GB8969-88),NO2和NO x的含量都接近国家一级标准。
关键词:盐酸萘乙二胺;分光光度法;氮氧化物Abstract[Objective] In order to explore the use of hydrochloric acid naphthalene ethylenediamine spectrophotometry campus the content of nitrogen in the air. [Methods] : After NO2being absorbed by absorbing liquid, producing nitrate and nitrite. Nitrite and amino benzene sulfonic acid on diazotization reaction, again with hydrtion recovery rate was 94.10%, the lowest detection limit of NO x is 0.0717 mg/m3, standard addition recovery rate was 90.38%. . [Conclusion] This method conforms to the national standard (GB8969-88), the content of NO2and NO x are close to the national standard.Key words:Hydrochloric acid naphthalene ethylenediamine; Spectrophotometric method; Nitrogen oxides一前言1.1 研究背景1.1.1 NO x的主要来源氮的氧化物主要有:NO、NO2、N2O3、N2O4、N2O5、N2O等,大气中的氮氧化物(NO x)主要包括一氧化氮和二氧化氮,NO是无色、无臭气体,微溶于水,在大气中易被氧化成NO2;NO2是红棕色有特殊刺激性臭味的气体,易溶于化工厂、钢铁厂、金属冶炼厂等排放的废气,其中以工业窖炉、氮肥生产和汽车排放的NO x 量最多。
城市大气中2∕3的NO x 来自汽车尾气等的排放,交通干线空气中NO x 的浓度与汽车流量有密切关系,而汽车流量往往随时间而变化,因此,交通干线中NO x的浓度也随时间而变化。
1.1.2 NO x的主要危害及其防治措施NO x 对呼吸道和呼吸器官有刺激作用[14],是导致支气管哮喘等呼吸道疾病不断增加的原因之一。
当NO x与碳氢化物共存于空气中时,经阳光紫外线照射,发生光化学反应,产生一种光化学烟雾,它是一种有毒性的二次污染物。
NO2比NO x的毒性高4倍,可引起肺损害,甚至造成肺水肿。
慢性中毒可致气管、肺病变。
吸入NO,可引起变性血红蛋白的形成并对中枢神经系统产生影响。
NO x对动物的影响浓度大致为1.0毫克/立方米,对患者的影响浓度大致为0.2毫克/立方米。
国家国家环境质量标准规定,居住区的平均浓度低于0.10毫克/立方米,年平均浓度低于0.05毫克/立方米。
二氧化氮、二氧化硫、悬浮颗粒物共存时,对人体健康的危害不仅比单独NO x 严重得多,而且大于各污染物的影响之和,即产生协同效应。
大气中的NO x能与有机物发生光化学反应,产生光化学烟雾。
NO x能转化成硝酸和硝酸盐,通过降水对水和土壤环境等造成危害。
在全国范围内,削减氮氧化物的措施主要有[13]:第一,实施多指标综合管理。
就我国目前氮氧化物的污染状况而言,应该尽早强企业监督,督促其严格执行排放标准。
通过环境信息披露制度,在政府、企业与公众之间形成相辅相成的良性互动,达到更好的污染防治效果。
第四,推行经济激励。
在我国氮氧化物的防控工作中引入市场化的经济政策,使命令控制方式和市场化机制互相补充。
在实施氮氧化物排放总量控制时,配套实施相应的减排激励政策,鼓励多减排、早减排、尽快实施氮氧化物排污收税和排污削减量交易等措施。
第五,植物有过滤各种有毒有害大气污染物和净化空气的功能,树林尤为显著,所以绿化造林也是防治大气污染的比较经济有效的措施。
1.2 NO x的研究进展氮氧化物对环境危害日益严重[20],因此,建立准确有效的氮氧化物的测定方法具有重要的意义和应用价值。
目前,有关氮氧化物含量的检测方法已经很多[2],有化学发光法、库伦原电池法、荧光猝灭法、传感器法、高锰酸钾氧化法、离子色谱法[4]、中和滴定法[19]、分光光度法等。
1.2.1化学发光法化学发光是基于化学反应所提供足够的能量[18],使其中一种产物的分子的电子被激发成3000nm的宽带辅助光,一个NO分子只能生成一个NO2分子。
因此,化学发光强度和光电倍增管道输出电流大小与样品气中的NO浓度成正比关系。
因为只有NO才能和O3反应,若要分析NO2,必须在样品进入反应室之前,先转化为NO。
用二氧化氮标准气体标定仪器的刻度,即得知相当于二氧化氮量的氧化氮(NO x)的浓度。
仪器接记录器。
化学发光反应的发光强度和反应物的浓度在几个数量级的范围内成良好的线性关系。
1.2.2库伦原电池法氮氧化物分析仪是根据库仑原电池法原理制作的。
阴极铂网为原电池正极,阳极活性炭为原电池负极,电解液为pH=7的0.1mol/L 磷酸盐缓冲溶液中含0.3mol/L 碘化钾溶液。
在两个电极间有一个很小的电位差。
当被测空气经过选择性还原为碘离子,接通电路就产生微弱的电流,同时活性炭电极也有电化氧化作用。
若原电池中电流效率为100%,则电流大小与NO2浓度成正比,并可用法拉第电解定律计算。
由于NO2在水中化学反应较复杂,而氧化氮的转化率只有70%。
1.2.3盐酸萘乙二胺分光光度法空气中的NO x,经氧化管后,以NO2的形式在采样吸收过程中生成的亚硝酸,再与对氨基苯磺酰胺进行重氮化反应,然后与N-(1- 萘基)- 乙二胺盐酸盐作用生成玫瑰红色的偶氮染料[11]。
并于波长540nm 下测定吸光度,并根据相应的标准曲线定量。
利用称量法校准的NO2渗透管配置的标准气体,测得气态NO2并不完全转化为亚硝酸根离子,因此在计算结果时,要除以转换系数,其值与大气中NO2浓度有关。
不同的浓度范围,取不同值。
1.3实验原理用冰乙酸、对氨基苯磺酸和盐酸萘乙二胺配成吸收液采样[16],大气中的NO2被吸收转变成亚硝酸和硝酸,在冰乙酸存在条件下,亚硝酸与对胺基苯磺酸发生重氮化反应,然后再与盐酸萘乙二胺偶合,生成玫瑰红色偶氮染料,其颜色深浅与气样中NO2浓度成正比,因此,可用分光光度法进行测定[3]。
吸收及显色反应如下:2NO2+H2O=HNO2+HNO3量。
用吸收液吸收大气中的NO2,并不是100%的生成亚硝酸,还有一部分生成硝酸。
用标准SO2气体实验测知,NO2(气)→NO-2(液)的转换系数为0.76,因此在计算结果时需除以该系数。
1.4选题依据化学发光法分析NO x是一种最好的直接方法,对于多种污染物共存的大气,通过化学发光反应和发光波长的选择,不经过分离便能有效地进行各种污染物的测定。
采用库仑原电池法可以测得NO x的小时平均浓度和日平均浓度。
这种方法仪器的维护量较大,连续运行能力较差,使其应用受到限制。
盐酸萘乙二胺分光光度法[1]具有分析简便、显色稳定、准确度和灵敏度较高等优点,并且费用低,操作简单,测定快速应用比较广泛。
该方法采样和显色同时进行,收液用量大,,适于24h连续采样,测定大气中NO x的日平均浓度,其检出限为0.25μg/25mL;当24h采气量为288L时,最低检出浓度(以NO2计)为0.002mg/m3。
二实验部分2.1实验仪器表2-1 实验中的主要仪器仪器型号生产厂家大气采样器,(流量范围0~1L/min)DQ-1B型江苏江分店分析仪器有限公司多孔玻筛板吸收管10mL 江苏江分店分析仪器有限公司分光光度计电子天平723pcFA2104N江苏江分店分析仪器有限公司上海民桥精密科学仪器有限公司具塞比色管(10个)烧杯容量瓶棕色容量瓶10mL50mL 250mL1000mL 1000mL 250mL单球干燥管2.2实验药品和试剂1. 药品冰乙酸;盐酸萘乙二胺;对氨基苯磺酸;亚硝酸钠;CrO32. 试剂(1)对氨基苯磺酸-盐酸萘乙二胺吸收原液[5]:称取 5.0 g对氨基苯磺酸于烧杯中,将50 mL冰醋酸与900 mL水混合,分数次加入烧杯中,搅拌使之溶解,并迅速转入1000 mL容量瓶中,待对氨基苯磺酸溶解完全后,加入0.050 g盐酸萘乙二胺,溶解后,用水稀释至刻度。
