原子簇化合物
金属原子簇化合物

§4-5 钯 铂原子簇 -
指导老师: 学 生:
金属原子簇化合物的定义: 1 、金属原子簇化合物的定义:
1966年F.A.Cotton提出,原子簇是“含有直接而 明显键合的两个或以上的金属原子的化合物”。 美国化学文摘CA的索引中提出, “原子簇化合 物是含有三个或三个以上互相键合或极大部分互相键 合的金属原子的配位化合物”。 1982年我国徐光宪提出,“原子簇为若干有限 原子(三个或三个以上)直接键合组成多面体或缺顶 多面体骨架为特征的分子或原子”。(包括了硼烷及 杂硼烷)
5、钯、铂原子簇 由于钯铂原子簇在仿声系统、新型 材料、均相催化剂等方面具有潜在的应 用前景,因此,近二十年来一直是原子 簇化合物领域的研究热点之一。人们合 成了一系列蔟核结构,如下图,并对其 光学,电化学以及催化性质进行了研究。
钯、铂原子簇核结构
Pd(dppm)3(CO)2+为例介绍其 性质
关于核数超过十的多核钯蔟的研究室 目前的另一个热点。最近,具有纳米尺度 的[Pd30(CO)26(PEt3)10],[Pd54(CO)40(PEt3)14]等 多核钯原子簇已见报道。值得关注的是在 这些研究中发现多核蔟结构表现出类似主客复合物的结构。如[Pd69(CO)3(PEt3)18]蔟 核中具有由33个Pd原子构成的线形分子上。 多核的异钯铂原子簇同样引起人们的研究 兴趣。关于PdTI蔟以及PdNi蔟的合成与结 构的研究已有人涉足。预计今后这方面的 研究会更加活跃。
4、分类: 、分类:
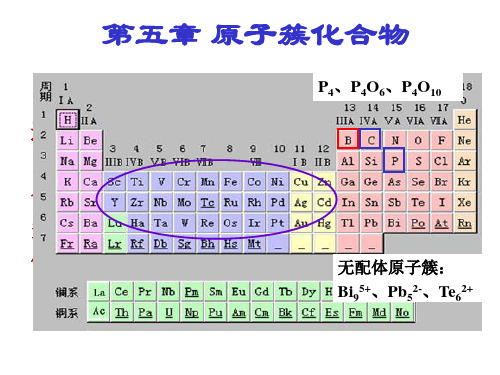
含有金属-金属键的化合物通称为金属原子簇 合物 . 它们可分为 3 类: ⅰ). 多核的金属羰基化合物 Mn2(CO)10, Fe3(CO)12, Fe2(CO)9; ⅱ). 低氧化态的卤化物和氧化物 [Re3Cl12]3-, [Re2Cl8]2-; ⅲ). 无配体金属原子簇, Bi4+(AlCl4), Bi53+ (AlCl4)3, K4Sn94-, NaPb4( 在液氨中).
中级无机化学[第五章原子簇化合物] 山东大学期末考试知识点复习
![中级无机化学[第五章原子簇化合物] 山东大学期末考试知识点复习](https://img.taocdn.com/s3/m/9ac8ff1210a6f524ccbf8528.png)
山东大学化学院《中级无机化学》期末复习知识点总结
4.Wade 规则 K.Wade 提出骨架成键电子对数 b 与硼烷及其衍生物几何结构之间存在以下 关系:
n 为多面体的实际顶点数。 对于通式为[(CH)a(BH)pHq]d-的硼烷或硼烷阴离子,骨架成键电子对数为 式中:a 为 C 原子数;p 为 B 原子数;q 为除去 p 个 B—H 键、a 个 C—H 键中 的 H 原子外的 H 原子数;d 为所带电荷数。若顶点为 P 和 S 原子,电子数分别记 为 3 和 4。
山东大学化学院《中级无机化学》期末复习知识点总结
和 H2,但 B10H14,B10H102-,B12H122-在动力学上非常稳定。所有挥发性硼烷都有毒。 (4)化学键类型
3.金属原子簇 金属原子簇:指金属原子通过金属一金属键直接键合形成多面体骨架的化合 物,其主要特征为含有金属一金属键。金属原子簇中重要配体有羰基、亚硝酰、 卤离子、羧酸,过渡后 p 区主族金属元素主要形成无配体簇。 (1)影响金属-金属键的主要因素 金属原子的 d 电子特性:原子化焓大的金 属易形成金属-金属键,因此重过渡金属比轻过渡金属更容易形成金属-金属键。 氧化态:低氧化态的金属易形成金属-金属键。 配体的性质:具有π电子接受性质、能有效降低金属原子 d 电子密度的配体 有助于形成金属一金属键。过渡元素均可形成金属羰基簇,只有前几族过渡元素 可形成低价卤化物簇和 S,Se,Te 化物簇。桥联配体有利于金属一金属键的形成。 (2)羰基的红外伸缩振动频率与配位方式的经验关系
山东大学化学院《中级无机化学》期末复习知识点总结
第五章 原子簇化合物
1.原子簇 原子簇:指原子间互相成键形成的笼状或多面体结构化合物,包括非金属原 子簇和金属原子簇。原子簇多面体大多数由三角面构成,多面体可以不完整。 2.硼原子簇 硼原子簇:指硼烷及其衍生物。硼烷(即硼氢化合物)中,B 原子至少与两个 同类原子键合。衍生物主要为 C,P,S 等非金属原子以及金属原子取代硼原子形 成的化合物。 (1)命名 称作某某硼烷。例如,B5H9:戊硼烷(9);B12H122-:闭式十二硼烷阴 离子(2-)。 硼原子数:10 以下以“甲"、“乙”等十个干支数表示,10 以上用“十一” 等表示。 氢原子数:在词干后括号内用阿拉伯数字表示,若只有一种结构则可不标。 结构类型:用“巢式一”等前缀表示。 硼烷阴离子的电荷:在词干后括号内用阿拉伯数字表示,不注氢原子数。 (2)制备 二元硼烷:由 NaBH4 制备 B2H6,用 B2H6 的热分解制备较高级硼烷,或通过硼 烷阴离子与三卤化硼或氯化氢反应制备较高级硼烷。 硼烷阴离子:通过 B2H6 或其他含 BH3 基团的硼烷与较低级的硼烷阴离子反应, 或由较低级硼烷阴离子的热解,制取较高级的硼烷阴离子。 (3)物理化学性质 大多数硼烷是液体或固体,少数为气体。富氢硼烷 BnHn+6 的稳定性不如贫氢硼烷 BnHn+4,硼烷阴离子最定。大多数硼烷与氧气猛烈反应(通 常爆炸),中性硼烷只有 B10H14 在空气中稳定。几乎所有硼烷都水解生成 B(OH)3
原子簇化合物的概念

原子簇化合物的概念
原子簇化合物是一种含有超过50个原子的化合物,它们是杂原子
团体的特殊类型,具有特定的物理和化学性质。
原子簇化合物的结构相当于一个由多个原子组成的小分子,称为原子簇,它们之间有某种类型的氢键相互连接。
原子簇化合物是近年来发现的一类新型化合物,它们拥有独特的物理和化学性质,可以用于各种催化剂和材料等应用。
原子簇化合物可以分为有机和无机两类。
无机原子簇化合物是由金属原子或碳氢基团组成的,它们的尺寸和形状比较特别。
有机原子簇化合物则是由碳原子和以碳为中心的空间结构组成的,其化学性质与传统有机物十分相似。
尽管不同的原子簇化合物具有独特的特性,但他们都焊接在一起,具有稳定的结构,但这种稳定性容易受到外部影响而发生变化。
原子簇化合物具有非常重要的潜力,它们可以应用于能源材料、药物分子和生物传感器等方面。
它们具有比结构更灵活的动力学性质,并具有良好的热稳定性。
原子簇化合物也可以与有机物实现氧化催化作用,从而改善反应效率。
厦门大学中级无机化学第5章 原子簇化合物-1-20140507

高核簇举例
[Pt9(CO)18]2- = [Pt3(CO)3(μ2−CO)3]3
:Pt
高核簇举例
[Ga12R10]2R = C13H9
高核簇举例
Au55(PPh3)12Cl6
内层 中层 外层
1 + 12 + 42 = 55
Au原子由中心向外分3层 密堆积排列为球形
高核簇举例
[Al77R20]2R = N(SiMe3)2
M–M四重键的其他例子
CH3 C O OO CH3 C O
X O
CH3 C O H 2O O C CH3 OO CH3 C O OH2
四棱柱形
CH3 C O OO CH3 C O X
Mo
O C CH3 O O C
Mo
O
Re
O C CH3 O C CH3
Re
O
CH3
[Mo2 (RCO2)4] ([Mo2Cl8]4-)
Cr
O O C CH3
Cr
O
[Re2(RCO2)4X2]
[Cr2(CH3CO2)4(H2O)2]
四棱柱形 Cr2(O2CR)4的无限链状结构
K4[Mo2(SO4)4]·2H2O中[Mo2(SO4)4]4-的结构
四棱柱形
Pauling提出:
一组d5sp3杂化轨道
可用哪些化学手段 改变四棱柱M2L8双核簇的键级?
[Ta6X12]2+ √ 例:VIII、IB
原子化焓较大的过渡金属易成簇
M(–M–M–)(s) → M(g) ΔH
对应 M–M 键强度
2. 形成条件
② 配体 纯给电子配体与d 电子较少的过渡金属成簇 (如X-、S2-、含氧酸根) π 酸配体与几乎所有过渡金属成簇 (如CO、NO)
第五章 原子族化合物

• 3、硼氢化反应
• CH3CH=CH2 +B2H6 →(CH3CH2CH2 )3B
四、硼烷的衍生物
• 1、硼烷阴离子 • (1)最简单的硼烷阴离子是BH4-,它具有四面体结构,其 主要应用是作为还原剂及H-离子的来源。它的衍生物有 [BH3CN]-, [BH(OCH3)3]-. • (2) BnHn2-(n=6-12):B10H102- B12H122- B7H72- B8H82- B9H92-其结 构具有多面体笼形结构,如B12H122-是由20个相等三角面构成 的规则二十面体,所有氢原子都是通过端梢B-H键与硼原子 结合。易发生亲电取代反应。 • 2、碳硼烷 • CH与BH-为等电子体,碳硼烷可看作CH代替BnHn2-离子中的BH -。即B H 2- →B n n n-2C2Hn • 分类:A、闭式-中性的二碳代碳硼烷,即闭式- BnC2Hn+2 (n=3-10,电子数为:2n+2); B、巢式-二碳代碳硼烷 阴离子,即巢式- BnC2Hn+3-(n=3-10,电子数为:2n+ 4); C、闭式-一碳代碳硼烷阴离子,即闭式- BnCHn+1- (n=4-11,电子数为:2n+2);
B4 H10 H 2
二、硼烷的结构和化学键 • 1、乙硼烷B2H6结构的成键要素
• 若与乙烷相似形成BH3BH3,有7 个共价单键,需14个 电子,但分子中只有12个电子。 • 在乙硼烷分子中B:2S22P1,采用SP3杂化,(1)每 个硼原子使用两个SP3杂化轨道和两个电子与氢原子形 成两个σ 键(2c-2e),两个硼原子形成了两个BH2基团, 且位于同一平面内.
•
原子簇

《高等无机化学》课程论文文献综述综述题目原子簇化合物在功能材料方面的应用作者所在系别理学院应用化学作者所在专业物理化学作者姓名作者学号导师姓名导师职称教授完成时间2012 年 4 月工业大学材料化学教研室制说明1.文献综述各项内容要实事求是,文字表达要明确、严谨,语言通顺,外来语要同时用原文和中文表达。
第一次出现缩写词,须注出全称。
2.学生撰写文献综述,阅读的主要参考文献应在10篇以上。
本课程的相关教材也可列为参考资料,但必须注明参考的具体页码。
3.文献综述的撰写格式按撰写规范的要求,字数在2000字左右。
原子簇化合物在功能材料方面的应用1.引言原子簇化合物是极小的原子聚合物,是以三个或三个以上的金属或非金属形成的多面体为核心,再与外围电子、离子或者基团配位键合后构成的化合物[1]。
是介于原子、分子与固体粒子之间的团粒分子。
原子簇化合物被称为“物质第五态”。
原子簇化合物的物理性质与一般状态的气体、液体、固体等物质差别较大。
原子簇可分为两大类,一类是主族原子簇化合物,核心原子为主族元素如碳、硼,外围原子多为氢、卤族元素和烷基等。
另一类是过渡金属簇合物,配体是π接受体(CO、NO……)或π给予体(Cl、OR、S……)。
若原子簇的核心不连接任何外围原子或基团,则可称为团簇。
2.原子簇化合物的历史1966年Frank Albert Cotton首次提出clusters的概念,卢嘉锡将其译为“原子簇”,并将cluster compound译为“原子簇化合物”。
1982年,我国学者徐光宪建议原子簇化合物定义为:“以三个或三个以上的有限原子直接键合组成多面体或缺顶多面体骨架为特征的分子或离子”。
原子簇化合物的应用领域涉及广泛,比如络合催化、生化模拟、超导材料、燃料加氢脱硫、表面抗氧化腐蚀等。
3.原子簇化合物用于催化原子簇化合物由于其组成构型确定、组分均匀等特征,能节省贵金属材料及在制备上好的重现性,为人们在直接应用这类化合物作为催化剂方面产生了浓厚的兴趣。
第5章 原子簇化合物
在这些异构体中, 若有两个碳原子, 则离得越远异构体越稳定。 加热不稳定的异构体往往发生异构重排。
2. CH基团上的H的弱酸性反应
2. 金属硼烷和金属碳硼烷 金属硼烷通常指硼烷骨架中的B原子被金属原子取代所得
的衍生物,即含有金属—硼键的化合物.
金属碳硼烷是由金属原子、硼原子以及碳原子组成骨架
多面体的原子簇化合物。
H2B H H H H BH2 +2L→2LBH3 (对称裂解)
H2B
BH2 +2L→[L2BH2]+[BH4]-(不对称裂解) 对称裂解生成BH3基团,不对称裂 解生成BH2+
裂解机理:
第一步 H2B H
BH2+L → H2B H L
H
BH3
第二步有两种不同的进攻位置: H2 B L H BH3 +L → 2LBH3 (对称裂解) 体积较大的Lewis碱有利于对称裂解 H 如C5H5N、(CH3)3N、(C2H5)O +L →[L2BH2]+[BH4]-(不对称裂解) BH3 体积较小的Lewis碱有利于不对称裂解 如NH3、OH-、CH3NH2
K[B6H11] + HCl
-110℃
(2) 硼烷阴离子的合成
1. BH缩聚法。用乙硼烷或其他含BH3基团的低级硼烷与硼 烷阴离子缩合, 如 BH4- + B2H6 B3H8- + H2
2. 低级硼烷阴离子盐的热解法。以B3H8-盐的热解为例:
△ [(CH3)4N][B3H8] [(CH3)3NBH3]+[(CH3)4N]2[B10H10] +[CH3)4N]2[B12H12] △ CsB3H8 Cs2B9H9 + Cs2B10H10 +Cs2B12H12
硼烷的定域处理
Lipscomb提出: 3c-2e(三中心两电子键) (定域)
金属原子簇化合物

金属原子簇化合物金属原子簇化合物是由金属原子通过化学反应形成的簇状结构的化合物。
这些簇化合物具有特殊的性质和应用潜力,引起了科学家们的广泛关注和研究。
金属原子簇化合物的形成是通过金属原子之间的相互作用而实现的。
金属原子倾向于通过电子的共享或转移来形成金属键。
在形成簇化合物时,金属原子通过适当的化学反应被组合在一起,形成具有特定结构和组成的簇体。
这些簇体通常由几个到数百个金属原子组成,形成不同的形状和尺寸。
金属原子簇化合物的研究主要集中在以下几个方面:1. 结构和组成:研究金属原子簇化合物的结构和组成是了解其性质和行为的基础。
通过使用X射线衍射、质谱、光谱等技术,科学家们可以确定簇体的原子排列和组成,从而揭示其微观结构。
2. 物理性质:金属原子簇化合物具有与宏观金属不同的物理性质。
由于其尺寸较小,金属原子簇化合物可以显示出量子效应,如量子尺寸效应、表面效应等。
此外,金属原子簇化合物的电子结构和磁性也具有独特的特点。
3. 化学性质:金属原子簇化合物的化学性质也是研究的重点之一。
金属原子簇化合物可以与其他分子或原子发生反应,形成新的化合物。
这些反应可以产生一系列新的化学性质和应用,如催化、氧化还原反应等。
4. 应用潜力:金属原子簇化合物具有广泛的应用潜力。
由于其特殊的结构和性质,金属原子簇化合物可以应用于催化剂、传感器、电子器件等领域。
例如,纳米金属簇化合物可以用作高效催化剂,具有广泛的应用前景。
金属原子簇化合物是一类具有特殊结构和性质的化合物。
通过研究金属原子簇化合物的结构、物理性质、化学性质和应用潜力,科学家们可以更好地理解和利用这些簇化合物的特点。
随着技术的不断进步,金属原子簇化合物的研究将为我们提供更多的新材料和应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第三章配位化学1.配合物配合物:由提供孤对电子或多个不定域电子的一定数目的离子或分子(配体)和接受孤对电子或多个不定域电子的原子或离子(统称中心原子)按一定组成和空间构型所形成的化合物。
其中,与中心原子直接相连的原子称为配位原子,与同一中心原子连接的配位原子数目称为配位数;由中心金属离子和配体构成的络合型体称为内界,通常用“[]”标出。
配合物的命名:配体名称在先,中心原子名称在后。
阴离子名称在先,阳离子名称在后,两者间用“化”或“酸”相连。
不同配体名称的顺序与化学式的书写顺序相同,相互间以圆点隔开,最后一种配体名称之后加“合”字。
配体个数在配体名称前用中文数字表示。
中心原子的氧化态在元素名称之后用括号内的罗马数字表示。
2.配合物的异构立体异构:包括几何异构和旋光异构。
配合物内界中两种或两种以上配体在空间的排布方式不同所产生的异构现象称为几何异构。
若由配体在空间的排布方式不同所产生的异构体之间互为对映体,则这种异构现象称为旋光异构。
电离异构:配合物在溶液中电离时,由于内界和外界配体发生交换而生成不同配离子的异构现象称为电离异构。
键合异构:含有多种配位原子的单齿配体用不同的配位原子参与配位而产生的异构现象称为键合异构。
配位异构:在配阴离子与配阳离子形成的配合物盐中,配阴离子与配阳离子中配体与中心离子出现不同组合的现象称为配位异构。
3.配合物的常用制备方法加成反应:路易斯酸碱之间直接反应,得到酸碱加合型配合物。
加成后配位数增大。
取代反应:用一种适当的配体(通常是位于光谱化学序列右边的配体)取代配合物中的某些配体(通常是位于光谱化学序列左边的配体)。
取代后配位数通常不变。
氧化还原反应:伴随有中心金属氧化态变化的制备反应,在许多情况下同时伴随有配体的取代反应。
热解反应:在升高温度时,配合物中易挥发的配体失去,外界阴离子占据失去配体的配位位臵,相当于固相取代反应。
4.配合物的化学键理论(1)晶体场理论理论要点:(a)中心金属离子具有电子结构,配体视为无电子结构的阴离子或偶极子,二者之间存在的静电吸引作用产生配位键。
(b)中心金属离子的电子与配体电子之间存在排斥作用。
由于配体在中心离子周围的分布具有方向性,配体的静电场作用使中心离子的d轨道发生能级分裂。
分裂的方式与分裂的程度取决于配位场的类型及配体、中心离子的性质。
(c)中心离子的电子在配位场能级中的占据结果,使配合物获得一个晶体场稳定化能(CFSE)。
晶体场理论可以定性解释配合物的吸收光谱、稳定性、磁性、结构畸变等,但无法解释金属与配体间的轨道重叠作用,不能很好地解释光谱化学序列。
(2)配位场理论理论要点:配体的存在使中心金属离子与配体之间存在的化学键作用既包括静电作用也包括共价作用(既有σ成键作用也有π成键作用)。
金属离子的d电子局限在金属原子核附近运动,不进入配体范围,但是配位场负电荷的影响使中心金属离子的d轨道能级分裂。
在配位场中,分裂能既决定于静电作用,又决定于共价作用(其中首先包括σ成键作用,其次包括π成键作用)。
配位场理论是对晶体场理论的修正,通常用修正拉卡(Racah)参数B的方法在模型中加入晶体场理论所忽略的共价作用的影响,因而比晶体场理论更接近实际。
(3)分子轨道理论理论要点:中心金属离子与配体之间形成分子轨道,电子在整个分子轨道中运动。
由于成键轨道、反键轨道的能量不同,能级发生分裂。
分子轨道理论可以解释配合物的磁学性质、热力学性质、结构性质,并且能够很好地解释光谱化学序列。
5.配合物的电子吸收光谱过渡金属配合物的电子吸收光谱包括:d—d跃迁光谱(又称配位场光谱)、金属与配体之间的电荷迁移光谱、配体内部光谱。
其中,d—d跃迁是宇称禁阻跃迁。
过渡金属配合物的电子吸收光谱具有带状光谱、可见区弱吸收但紫外区强吸收的特征。
可见区的d—d跃迁弱吸收是造成许多过渡金属配合物具有多彩颜色的重要原因,可见区的强电荷迁移跃迁吸收是部分配合物具有颜色的原因。
d—d跃迁光谱可运用配位场理论进行讨论,常用的光谱项图为Orgel图和Tanabe—Sugano 图。
6.配合物的反应动力学和反应机理动力学上,根据配体交换的速率,配合物可分为活性配合物(配体交换很快)和惰性配合物(配体交换很慢)。
配合物的取代反应包括亲核取代反应(SN反应)和亲电取代反应(SE反应)。
从反应机理上看,亲核取代反应主要包括解离机理(SN1反应)、缔合机理(SN2反应)以及介于这两种机理之间的交换机理。
根据价键理论和晶体场理论等理论可以对配合物的反应动力学和反应机理进行定性或半定量的讨论。
第四章有机金属化合物1.有机金属化合物有机金属化合物指含有至少1个M—C键的化合物,也称为金属有机化合物。
广义地,有机金属化合物包括某些含有M—B,M—P,M—Si键的化合物。
有机金属化合物因其独特的化学键、结构而具有独特的谱学性质、催化性质等。
有机金属化合物的重要用途之一是用作均相催化剂,典型实例包括Wilkinson催化剂用于催化烯烃加氢反应、[RhI2(CO)2]-用于催化Monsanto乙酸合成反应、Ziegler-Natta催化剂用于催化烯烃聚合。
2.重要的有机金属化合物(1)金属羰基化合物金属羰基化合物指含有一氧化碳(CO)配体的有机金属化合物,拥有众多衍生物。
通常,CO以C端孤对电子与金属原子生成σ键,以π*轨道与金属原子生成反馈兀键,因此CO称为π酸配体。
金属羰基化合物中的金属中心通常具有低氧化态,甚至负氧化态。
CO的等电子体CN-,NO,N2等小分子(离子)具有与CO相似的成键特点。
(2)烯烃配合物和炔烃配合物烯烃(炔烃)配合物为含有烯烃(炔烃)配体的金属配合物。
烯烃(炔烃)以π电子和π*轨道分别与金属原子生成σ键+反馈π键,因而称为π配体。
这类化合物的典型代表为蔡斯盐{K[PtCl3(C2H4)]〃H2O}。
(3)夹心结构配合物夹心结构配合物指含有离域π键的环状配体与金属离子形成的配合物,因形状而得名。
环状配体具有π配体的成键特点。
这类化合物的典型代表为二茂铁。
(4)简单烷基化合物主族元素(在此包括第12族)多数可以生成简单烷基化合物,其M—C 键具有较强的极性,因此较多化合物对极性试剂高度活泼。
典型化合物包括有机锂、格氏试剂、二甲基汞、四苯基硼酸根、烷基铝、烷基硅、四乙基铅、烷基锡等。
3.有效原子序数规则(EAN规则)EAN规则指出,稳定的有机金属化合物应该具有的电子特点是,金属原子的电子总数加上所有配体提供的电子数等于同周期稀有气体的原子序数。
对于过渡金属元素,每个金属原子的价电子数加上配体提供的电子数等于18的化合物是稳定的,因此该规则又称为“18电子规则”。
过渡元素广义上包括价电子构型为(n-1)d1~9ns1~2。
的d区元素和价电子构型为(n-1)d10ns1~2的ds区元素。
通常将第4,第5和第6周期的过渡元素分别称为第一、第二和第三系列过渡元素。
第一系列过渡元素又常称为轻过渡元素,第二、第三系列过渡元素又常称为重过渡元素。
d轨道的特性:d轨道比s,p轨道数目多,因此成键可能性增多;(n-1)d轨道的能量与ns,np比较接近,可参与成键;根据空间的角度分布,d轨道可分为两类:dx2-y2和dz2轨道波函数的极大值在坐标轴上,dxz,dxy,dyz轨道波函数的极大值在坐标轴间45°分角线上;d轨道与价层不同主量子数的轨道之间能级交错现象普遍。
过渡元素电子构型的重要特征是价层具有未充满的d轨道,因而表现出离子多有色、多变价、易形成配合物的特征。
2.过渡元素的性质(1)原子化焓过渡元素的原子化焓比碱土金属和锌族的大很多,而重过渡元素的原子化焓又普遍比轻过渡元素的大很多。
同一系列过渡元素,原子化焓从左到右先是逐渐增大,于第5,第6族达到最大值,然后逐渐减小。
金属与原子化焓有关的性质,如硬度、熔点表现出相应的变化规律。
原子化焓高的金属硬度大、熔点高。
(2)电离能同一系列过渡元素的同级电离能从左到右总体上逐渐增大,但在破坏半满和全满构型以及生成半满和全满构型处分别出现增大和减小的折点;同族元素的同级电离能比较接近;同一元素,I1,I2比较接近,I3比I2高很多;第一系列过渡元素的I2比第二系列过渡元素的大很多。
(3)氧化态第一系列过渡元素两端元素的氧化态变化少、氧化态低,中间氧化态变化多、氧化态高。
+1,0和-1,-3低氧化态常见于羰基、亚硝酰基等兀酸配体配合物、含有机共轭π键的配合物和有机金属原子簇化合物中。
+2,+3中等氧化态常见于离子型化合物、简单水合离子、简单离子配体配合物中。
第7族之前的第一系列过渡元素均可达到最高(族价)氧化态,此后的元素则通常不能。
重过渡元素的最高氧化态比轻过渡元素稳定。
处于最高氧化态的过渡金属化合物通常是含氧化合物(氧化物或含氧酸根离子)或氟化物,含氧化合物更为普遍。
3.第一系列过渡元素的化学性质除Cu外,在1 mol〃L-1H+的水溶液中,金属可自发转化为M2+。
从左向右金属转化为M2+变难。
各元素最稳定氧化态是+2或+3。
第一系列过渡元素的重要物种如下:4.第二、三系列过渡元素的性质第二、三系列过渡元素的特点:基态电子构型特例多;有几对同族元素原子半径、离子半径非常接近;第三级电离能较低;高氧化态稳定,低氧化态不稳定;通常具有很大的原子化焓;一般只形成低自旋配合物;自旋一轨道偶合显著;比第一系列过渡元素更易形成原子簇。
(1)第4~7族过渡元素的性质第4~7族过渡元素都是高熔点、高硬度、性质相当稳定的金属,其中W是目前已知的熔点最高的金属。
同族元素的单质及化合物性质很相似,但从左到右相似性减弱。
配合物不如第一系列过渡元素和铂系元素普遍,常见配合物主要有卤素配合物和羰基配合物。
形成各样多酸是Mo,W的重要特点之一。
可形成烷基、芳基化合物。
Nb,Ta,Mo,W,Tc,Re易形成原子簇。
(2)铂系元素(第8~10族重过渡元素)的性质铂系元素的性质彼此相似,并与铁族元素差异大。
单质:高熔点稀有金属,彼此间易形成合金;不活泼,能以游离态存在于自然界;大部分化合物受热易生成金属。
化合物:主要为配合物,简单水合阳离子不常见。
易形成有机金属化合物,易形成兀酸配体(CO,NO,CN-,PR3)配合物,易形成原子簇。
重要化合物包括:(3)第11~12族重过渡元素的性质均为柔软金属(除Hg为液态)。
Ag,Cd活泼;Au,Hg不活泼。
Ag,Au易形成原子簇。
1.镧系元素与稀土元素镧系元素:57~71号共15种元素,即镧(La)、铈(Ce)、镨(Pr)、钕(Nd)、钷(Pm)、钐(Sm)、铕(Eu)、钆(Gd)、铽(Tb)、镝(Dy)、钬(Ho)、铒(Er)、铥(Tm)、镱(Yb)、镥(Lu),常用Ln 表示。
