浙教版八年级下册同步练习_3.3 化学方程式(3)科学试卷
浙教版八年级科学下册同步练习附答案第三章第三节 化学方程式
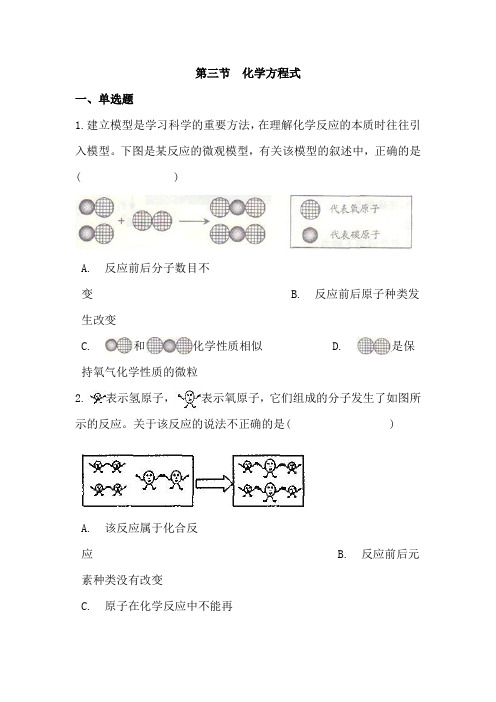
第三节化学方程式一、单选题1.建立模型是学习科学的重要方法,在理解化学反应的本质时往往引入模型。
下图是某反应的微观模型,有关该模型的叙述中,正确的是( )A. 反应前后分子数目不变 B. 反应前后原子种类发生改变C. 和化学性质相似D. 是保持氧气化学性质的微粒2.表示氢原子,表示氧原子,它们组成的分子发生了如图所示的反应。
关于该反应的说法不正确的是( )A. 该反应属于化合反应 B. 反应前后元素种类没有改变C. 原子在化学反应中不能再分 D. 反应前后分子的种类没有改变3.a和b为两份质量相等的固体,已知a为氯酸钾,b为混有少量二氧化锰的氯酸钾。
当分别同时加热a和b至完全反应时,能正确表示生成氧气的质量随反应时间而变化的图象是()A. B. C. D.4.哈尔滨市正在施工的地铁工程要用铝土矿(主要成分是氧化铝,假设杂质不含铝元素)来炼制铝合金.若要炼制含铝95%的铝合金108t,假设在炼制过程中损失5%铝元素,则理论上需要含杂质40%的铝土矿的质量是()A. 340tB. 204tC. 108tD. 120t5. 把一定质量的甲、乙、丙、丁四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下表。
下列说法不正确的是()物质甲乙丙丁反应前的质量4.0 2.0 3.0 2.0(g)反应后的质量1.2 X2.4 5.4(g)A. X=2.0,乙可能是催化剂 B. 甲和丙是反应物C. 参加反应的甲、丙质量比是1:2 D. 丁一定是化合物6. 已知:2KClO32KCl+3O2↑,如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是()A. 固体中氧元素的质量B. 生成O2的质量C. 固体中MnO2的质量D. 固体中钾元素的质量7. 在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表.已知甲的相对分子质量为丁的2倍.则下列说法不正确的是()甲的质量乙的质量丙的质量丁的质量/g /g /g /g反应64 10 1 16前t时刻32 a反应0 54 b 0后A. 乙和丙为生成物B. a等于32C. b等于37 D. 该反应方程式中甲与丁的化学计量数之比为1:28. 质量守恒定律是帮助我们认识化学反应实质的重要理论.某物质R与水和氧气反应的化学方程式为:2R+2H2O+7O2═2FeSO4+2H2SO4则R 的化学式应为()A. FeSB. Fe2S3C. FeOD. FeS29.在反应2A+3B===2C+4D中,若 A、B、C、D的质量比为8∶12∶11∶9,则A、B、C、D的相对分子质量之比为()A. 8∶12∶11∶9 B. 16∶36∶22∶36 C. 16∶16∶22∶9 D. 2∶3∶2∶410.下列化合物在氧气中燃烧,生成CO2和H2O的质量比为22∶9的是()A. CH4B. C6H12O6C. C2H5OHD. C2H611. 如图为某化学反应的微观模拟图,“○”和“●”分别表示两种不同的原子,下列说法正确的是()A. 该反应的基本反应类型为置换反应B. 反应前后原子的种类和数目保持不变C. 由大量微观甲“”聚集成的物质是单质D. 参加反应的甲、乙两种反应物的分子个数比为1:112.下列制备氧气的反应中,用等质量的反应物能获得氧气最多的是()A. 2H2O22H2O+O2↑ B.2KClO3 2KCl+3O2↑C. 2H2O2H2↑+O2↑ D. 2KMnO4△ K2MnO4+MnO2+O2↑13.乙醇在一定量的氧气中燃烧,测得反应前后各物质的质量如表所示。
浙教版八年级下册科学3.3化学方程式同步测试

3.3化学方程式同步测试一、选择题1.100克溶质质量分数为20%的氢氧化钠溶液和100克溶质质量分数为20%的稀盐酸混合,下列物质中,能跟该混合溶液发生反应的是()A. 氢氧化钾B. 氯化铁C. 一氧化碳D. 氯化钡2.宇宙飞船可用铝粉与高氯酸铵(NH4ClO4)的固体混合物作燃料,点燃时,铝粉被氧化放热引发高氯酸铵分解,化学方程式为:2NH4ClO4=4N2↑+4H2O+Cl2↑+2O2↑。
下列对此反应的叙述错误的是()A. 该反应属于分解反应B. 该反应能产生大量高温气体,推动飞船飞行C. 该反应过程中存在能量形式上的变化D. 在反应中铝粉是起催化作3.对于化学反应X+K2CO3=2Y+CaCO3↓的分析错误的是( )A. 该反应属于复分解反应B. X只能是熟石灰C. Y中一定含有钾元素D. X中阴离子化合价是﹣1价4.甲、乙、丙三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列不符合要求的甲、乙、丙依次为()A. O2、 CuO、 H20B. Na2CO3、 Na2SO4、NaOHC. FeSO4、 FeCl2、 FeD. CaCO3、 CaCl2、 CO25.下列化学方程式中符合题意且书写正确的是()。
A. 锌粒溶于稀硫酸: Zn 十H2SO4 = Zn SO4十H2B. 鸡蛋壳放入稀盐酸中产生气泡: CaCO3 + 2HCl = CaCl + H2O+ C02↑C. 精制石油时,用氢氧化钠中和过量稀硫酸: NaOH + H2SO4 =Na2 SO4 + H2OD. 用石灰乳刷墙,墙壁变得又白又硬: CO2 + Ca ( OH )2 = CaCO3↓+H2O6.用“W”型玻璃管进行微型实验,如图所示。
下列说法不正确的是()A. a处红棕色粉末变为黑色B. a处的反应为CO+Fe2O3=2Fe+CO2C. b处澄清石灰水变浑浊证明有CO2生成D. 可利用点燃的方法进行尾气处理7.如图是某化学反应的微观模型,下列对图示模型理解正确的是( )A. 该反应属于复分解反应B. 该化学反应可以表示为:2AC+B2=C2+2ABC. 反应物和生成物中共含有八种D. 参加反应的两种物质的个数比是1:18.芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的。
(部编版)2020八年级科学下册3.3化学方程式3同步练习新版浙教版91

3.3 化学方程式(3)1.八年级(二)班同学计算30克炭完全燃烧可以得到多少克二氧化碳时,出现了以下几种算式,其中正确的是 (B )A. 1230克=x 44B. 1244=30克xC. 12x =30克44D. 12x =4430克2.化学反应A +2B===C +D 中,5.6克A 和7.3克B 恰好完全反应,生成12.7克C ,现在要得到0.4克D ,所需A 的质量为(B )A. 5.6克B. 11.2克C. 14.6克D. 29.2克3.某同学在研究质量守恒定律的实验过程中,记录了如下数据(已知Fe +S=====△FeS):(1)第二次实验是否符合质量守恒定律?符合,原因是参加反应的硫粉和铁粉的质量之和等于生成的硫化亚铁的质量。
(2)通过实验说明,参加反应的各物质之间存在着比例关系,从上表可知,参加反应的铁和硫的质量比是7∶4。
(3)若该同学要进行第四次实验,如果要将48克硫粉完全反应,则需要铁粉多少克?能生成硫化亚铁多少克? 【解】 设需要铁粉的质量为x ,生成硫化亚铁的质量为y 。
Fe +S=====△FeS 56 32 88x 48克 y56x =3248克, x =84克; 3248克=88y, y =132克。
即需要铁粉84克,能生成硫化亚铁132克。
【解析】 (1)质量守恒定律适用于化学变化,其中所涉及的反应物的质量是指参加反应的那部分质量,未参加反应的那部分质量不计入反应物的总质量内,而第二次反应中硫粉过量,真正参加反应的硫粉只有16克,而非32克。
(2)第一次和第三次中铁粉与硫粉恰好完全反应,两者的质量比为7∶4。
4.科学中常常出现“1+1≠2”的有趣现象,但也有例外。
下列符合“1+1=2”的事实的是(C ) A. 1升水与1升酒精混合后的体积等于2升B. 1克木炭在1克氧气中充分燃烧后生成2克二氧化碳C. 1克硫粉在1克氧气中充分燃烧后生成2克二氧化硫D. 1克氯酸钾与1克二氧化锰混合,充分加热后所得固体质量为2克5.钛(Ti)是广泛应用于航空、航海等领域的一种重要金属。
浙教版科学八年级下册第三章第3节化学方程式同步练习D卷

浙教版科学八年级下册第三章第3节化学方程式同步练习D卷姓名:________ 班级:________ 成绩:________一、单选题 (共15题;共30分)1. (2分)下列化学方程式中,正确的是()A . C+O2 CO2B . Mg+O2 MgO2C . 4Fe+3O2 2Fe2O3D . 4P+5O2 2P2O52. (2分)下列指定反应的化学方程式正确的是()A . 铁和硝酸银反应:F e+AgNO3═Fe NO3+AgB . 铜绿和稀盐酸反应:Cu2(OH)2CO3+4HCl═2CuCl2+3H2O+CO2↑C . 铁丝在氧气中燃烧:4Fe+3O2═2Fe2O3D . 呼吸面具中过氧化钠吸收二氧化碳反应生成纯碱和氧气:2Na2O2+CO2═2Na2CO3+O2↑3. (2分)从陶瓷、玻璃、水泥到电子芯片,硅元素的用途非常广泛。
工业制取高纯硅的部分反应原理的微观示意图如下,有关说法错误的是()A . 该反应属于置换反应B . X的化学式是HClC . 反应后硅元素的化合价升高D . 图甲所示物质中硅、氯元素的质量比是14:714. (2分)从化学反应3Fe+2O2═Fe3O4中,可以得到下列信息,其中叙述错误的是()A . 反应物是铁和氧气,生成物是四氧化三铁B . 3份质量的铁和2份质量的氧气完全反应生成1份质量的四氧化三铁C . 168份质量的铁和64份质量的氧气完全反应生成232份质量的四氧化三铁D . 反应中铁原子与氧分子的微粒个数之比为3:25. (2分)下列化学方程式书写正确的是()A . 铁和硝酸银溶液发生反应:Fe+2AgNO3═Fe(NO3)2+2AgB . 实验室制取二氧化碳:2HCl+CaCO5═CaCl2+H2O+CO2C . 碳在氧气中充分燃烧:C+O2 2COD . 稀硫酸除铁锈:Fe2O3+2H2SO4═2FeSO4+2H2O6. (2分)从2H2+O22H2O中获取的信息错误的是()A . 在反应前后,元素的种类没有变化B . 在常温下氢气与氧气混合就可以发生反应C . 4g氢气与32g氧气完全反应,可以生成36g水D . 在反应前后,氢原子和氧原子的数目都没有改变7. (2分)下列叙述、对应的化学方程式、所属基本反应类型都正确的是()A . 石笋、石柱形成的原因:Ca(HCO3)2=CaCO3↓+CO2↑+H2O分解反应B . 医疗上用小苏打治疗胃酸过多症Na2CO3+2HCl=2NaCl+H2O+CO2↑复分解反应C . 用熟石灰中和硫酸厂废水Ca(OH)2+H2SO4=CaSO4+2H2O中和反应D . 用铁丝测定空气中氧气的含量3Fe+2O2 Fe3O4 化合反应8. (2分)充分煅烧20t含碳酸钙80%的石灰石,可制得含杂质的生石灰的质量为()A . 8.96tB . 11.2tC . 10tD . 12.96t9. (2分)今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl﹣、CO32﹣、SO42﹣.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测正确的是()A . 一定不存在Ba2+ , NH4+可能存在B . CO32﹣一定存在,SO42-可能存在C . Ba2+可能存在,SO42﹣一定不存在D . NH4+一定存在,CO32﹣一定存在10. (2分)下列图象能正确反映对应变化关系的是()A . 向一定量的二氧化锰中加入过氧化氢溶液B . 加热一定量的高锰酸钾固体C . 向两份完全相同的稀盐酸中分别加入锌粉、镁粉D . 将水通电电解一段时间11. (2分)下列化学方程式书写正确的是()A . 4Fe+3O2 2Fe2O3B . C+O2 CO2↑C . 2Al+O2 2AlOD . 2Mg+O2 2MgO12. (2分)下列叙述、对应的化学方程式、所属基本反应类型都正确的是()A . 用磁铁矿炼铁的反应:Fe2O3+3CO 3CO2+2Fe 置换反应B . 实验室用高锰酸钾制氧气:2KMnO4 K2MnO2+MnO2+O2↑分解反应C . 拉瓦锡测定空气中氧气的含量:4P+5O2 2P2O5 化合反应D . 探究铜和银的活动性:Cu+2AgNO3═2Ag+Cu(NO3)2 置换反应13. (2分)在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下,测得反应前后各物质的质量分数如图所示,下列说法正确的是()A . 乙一定是化合物B . 该反应是分解反应C . 丁一定是该反应的催化剂D . 甲的质量一定等于生成乙、丙的质量之和14. (2分)下列化学方程式书写正确的是()A . 2Fe+6HCl═2 Fe Cl 3+3H2↑B . CaCO3+2HCl═CaCl2+H2O+CO2↑C . Cu+Ag(NO3)2═NO3)2+AgD . Mg+O2 MgO215. (2分)(2013.宁波)汽车尾气是大气污染主要来源之一。
2020春浙教版八年级科学下册同步测试:3.3化学方程式

第3节化学方程式第1课时质量守恒定律[学生用书B32]1.在某一化学反应前后,下列各项中一定不变的是(C)①原子数目②分子数目③物质的总质量④物质的种类⑤元素的种类A.④B.②④C.①③⑤D.①②③④⑤2.[2019·衢州]1784年,科学家卡文迪什演示了“人工空气”的燃烧,发现燃烧产物只有水。
据此判断“人工空气”是(A)A.氢气B.氮气C.二氧化碳D.氧气【解析】“人工空气”燃烧,助燃气体应为氧气,化学反应前后没有新的元素生成,反应产物为水,则反应物“人工空气”中一定含有氢元素。
3.下列事实能用质量守恒定律解释的是(A)A.一定量的铜丝在空气中灼烧后,质量变大B.10g NaCl溶解在90g水中,形成100g NaCl溶液C.化学反应中常伴随能量变化,有的放热,有的吸热D.100mL酒精与100mL水混合后,溶液体积小于200mL4.下列关于质量守恒定律的认识,不正确的是(A)A.质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关B.通过化学变化,只能改变物质的种类,不能改变物质的总质量C.质量守恒定律为定量揭示化学变化的规律提供了理论依据D.随着科技的发展,精密仪器为我们定量研究化学变化创造了条件5.红磷燃烧测定空气中氧气含量的实验中,能正确反映容器内有关量随时间变化的图像是(D)6.现有a g A物质与b g B物质,充分反应后,生成C物质,则生成C的质量为(D)A.等于(a+b)g B.小于(a+b)gC.大于(a+b)g D.不大于(a+b)g7.[2019·丽水模拟]“丹砂烧之成水银”中的“丹砂”指的是硫化汞。
该反应的微观示意图如下,有关说法正确的是(B)图3-3-1A.“”代表非金属单质汞B.此反应遵循质量守恒定律C.反应前后原子的种类发生改变D.反应前后各元素的化合价都不变8.某实验过程如下:取a g锡粉置于密闭容器中,称得容器和固体的总质量为b g,煅烧使锡粉与O2充分反应;冷却后打开容器时发现有空气冲入,待容器内气体组成恢复到反应前,称得容器和固体的总质量为c g;取出所有固体,称得固体为d g,则c等于(D)A.d+b+a B.d-b-aC.d-b+a D.d+b-a9.同学们进行探究实验“设计实验证明甲烷中含有氢元素和碳元素”。
专题3.3化学方程式-2020年浙教版八年级下科学同步学习(试卷和答案)解析版

第 1 页,共 9 页专题3.3化学方程式-2020年浙教版八年级下科学同步学习(试卷和答案)解析版一、选择题1. 在化学反应A+B=C+D 中,已知20克A 与9克B 恰好完全反应,生成7克C 。
当反应有11克D 生成时,参加反应的A 的质量为( )A .5克B .l0克C .l5克D .20克【答案】B2. 我国科研人员成功研制出一种纳米纤维催化剂可将二氧化碳转化成液体燃料甲醇,其微观示意图如图。
下列说法正确的是( )A .甲的相对分子质量为B .一个丙分子中含有4个氢原子C .参加反应的甲与乙的质量比为3:1D .氢元素的化合价在反应前后没有发生改变【答案】B【解析】【考点】模型与符号【解析】【分析】A 、根据相对分子质量为化学式中各原子相对原子质量之和分析;B 、根据丙的分子构成分析;C 、根据甲和乙参加反应的相对质量分析;D 、根据氢气和水中氢元素化合价分析。
【解答】A 、 甲为氢气,相对分子质量为2,错误;B 、 一个丙分子中含有4个氢原子 ,正确;C 、 参加反应的甲与乙分子个数比为3:1,则质量比为6:44=3:22,错误;D 、氢元素反应前为0价,反应后为+1价,发生了变化,错误;故答案为:B3. 一定质量的木炭与过量氧气在密闭容器内加热使其充分反应。
图中能正确反映容器内有关的量随时间变化关系的图像是( )【答案】D【解析】由于氧气过量,反应后碳已没有剩余,而氧气则有剩余,反应前后容器内的总质量不变。
4.) A B .化学反应中,原子发生重新组合C .化学反应前后,原子种类、数目保持不变。
八年级科学下册3.3化学方程式3同步练习新版浙教版36

3.3 化学方程式(3)A 组1.八年级(二)班同学计算30克炭完全燃烧可以得到多少克二氧化碳时,出现了以下几种算式,其中正确的是 (B )A. 1230克=x 44B. 1244=30克xC. 12x =30克44D. 12x =4430克2.在化学反应2A +3B===2C +D 中,已知8克物质A(相对分子质量为32)与12克B 完全反应,则物质B 的相对分子质量为(B )A. 16B. 32C. 48D. 643.在反应2CO +O 2=====点燃2CO 2中,各物质之间的质量比为7∶4∶11,各物质之间分子个数比为2∶1∶2,化学计量数之和为5。
4.某学习小组的同学用KClO 3和MnO 2的混合物加热制取O 2,收集到4.8克O 2后停止加热,称得剩余固体的质量为28.0克,继续加热至不再产生O 2,最终剩余固体质量为23.2克。
试计算(不考虑O 2的损耗):(1)两次生成O 2的总质量为9.6克。
(2)理论上可回收MnO 2的质量(写出计算过程)。
【解】 设生成氯化钾的质量为x 。
2KClO 3=====MnO 2△2KCl +3O 2↑ 149 96 x 9.6克 14996=x 9.6克,x =14.9克。
二氧化锰作催化剂,反应前后质量不变,则可回收到MnO 2的质量为23.2克-14.9克=8.3克。
5.某氯碱工厂排放的尾气里含有有毒的氯气(Cl 2),为防止其污染空气,工厂用20%的NaOH 溶液吸收氯气(反应的化学方程式为Cl 2+2NaOH===NaClO +NaCl +H 2O)。
计算:4吨溶质质量分数为20%的NaOH 溶液,理论上可吸收氯气的质量为多少?【解】 设理论上可吸收氯气的质量为x 。
Cl 2+2NaOH===NaCl +NaClO +H 2O 71 80x 4吨×20%71x =804吨×20%x =0.71吨答:理论上可吸收氯气的质量为0.71吨。
八年级科学下册3-3化学方程式3同步练习新版浙教版 (2)

3.3 化学方程式(3)A 组1.八年级(二)班同学计算30克炭完全燃烧可以得到多少克二氧化碳时,出现了以下几种算式,其中正确的是 (B )A. 1230克=x 44B. 1244=30克xC. 12x =30克44D. 12x =4430克2.在化学反应2A +3B===2C +D 中,已知8克物质A(相对分子质量为32)与12克B 完全反应,则物质B 的相对分子质量为(B )A. 16B. 32C. 48D. 643.在反应2CO +O 2=====点燃2CO 2中,各物质之间的质量比为7∶4∶11,各物质之间分子个数比为2∶1∶2,化学计量数之和为5。
4.某学习小组的同学用KClO 3和MnO 2的混合物加热制取O 2,收集到4.8克O 2后停止加热,称得剩余固体的质量为28.0克,继续加热至不再产生O 2,最终剩余固体质量为23.2克。
试计算(不考虑O 2的损耗):(1)两次生成O 2的总质量为9.6克。
(2)理论上可回收MnO 2的质量(写出计算过程)。
【解】 设生成氯化钾的质量为x 。
2KClO 3=====MnO 2△2KCl +3O 2↑ 149 96 x 9.6克 14996=x 9.6克,x =14.9克。
二氧化锰作催化剂,反应前后质量不变,则可回收到MnO 2的质量为23.2克-14.9克=8.3克。
5.某氯碱工厂排放的尾气里含有有毒的氯气(Cl 2),为防止其污染空气,工厂用20%的NaOH 溶液吸收氯气(反应的化学方程式为Cl 2+2NaOH===NaClO +NaCl +H 2O)。
计算:4吨溶质质量分数为20%的NaOH 溶液,理论上可吸收氯气的质量为多少?【解】 设理论上可吸收氯气的质量为x 。
Cl 2+2NaOH===NaCl +NaClO +H 2O 71 80x 4吨×20%71x =804吨×20%x =0.71吨答:理论上可吸收氯气的质量为0.71吨。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浙教版八年级下册同步练习_3.3 化学方程式(3)科学试卷
姓名:________ 班级:________ 成绩:________
一、选择题
1 . 将等容积、等质量(含瓶塞、导管、燃烧匙及瓶内少量的细砂)的两个集气瓶置于灵敏天平的左右两盘,并调至平衡,然后同时迅速放入点燃的等质量的白磷和木炭(如图所示)使两者充分燃烧后冷却至室温,打开止水夹后,此时的天平()
A.指针偏向右B.指针偏向左C.仍处于平衡状态D.指针先向左后向右偏
2 . 在密闭的容器中,某反应在点燃的条件下发生,涉及甲乙丙丁四种物质,他们的微观示意图和反应前后的质量如图所示,以下判断错误的是()
A.乙丙丁为氧化物
B.反应前密闭容器中的物质为混合物
C.反应后密闭容器中的物质质量为85克
D.x,y的质量关系为(50-x):(y-1)=8:3
3 . 雷雨天气时,氮气可逐步转化为硝酸盐,其关键反应为:该反应属于()
A.化合反应B.分解反应C.置换反应D.复分解反应
4 . 若将m克CO2经CO2→Na2CO3→CO2→CaCO3的一系列变化(假设无损耗),最多能得到CaCO3沉淀x克,若将m克CO2经CO2→CO→CO2→CaCO3的一系列变化(假设无损耗),最多能得到CaCO3沉淀y克,则x与y的关系是()
A.x=y B.2x=y C.x=2y D.不成比例关系
二、简答题
5 . 某混合溶液由硫酸和硫酸铜溶液组成。
某化学兴趣小组进行了如下实验:取124.5g该混合溶液于烧杯中,然后将150g NaOH溶液分六次加人其中,每次充分反应后称量所得溶液的质量,所测数据如下表所示。
第1次第2次第3次第4次第5次第6次
加入NAOH溶液的质量/g252525252525
反应后溶液的质量/g149.5174.5194.6209.8225250
每次产生沉淀的质量/g00 4.9n9.80
计算:
(1)写出表格中产生沉淀的化学方程式__________
(2)上述表格中产生沉淀的质量:n=_____。
(3)所加NaOH溶液中溶质的质量分数。
______
(4)第5次加入NaOH溶液充分反应后所得溶液中溶质的质量分数。
______
6 . 分子中仅含C、H两种元素的有机物叫烃,可用通式CxHy表示,且y≤2x+2。
汽油的主要成分是含碳原子5~11个的烃,柴油以含碳原子15~18个的烃为主,而压缩天然气的主要成分是甲烷,液化石油气主要是含3~4个碳原子的烃。
烃类在燃烧时,含碳量(质量分数)越高,就越易造成不完全燃烧,产生一氧化碳甚至冒黑烟!
(1)很多机动车在行驶中不仅噪音巨大,而且还排放大量黑烟。
若某机动车燃料为CxHy,写出不完全燃烧分别生成“黑烟”和一氧化碳的两个化学方程式_________、__________。
(2)资料显示,在非采暖期,北京大气中79%的烃、80%的一氧化碳和55%的氮氧化物主要来自汽车尾气,而在采暖期,上述三种污染物的比例却降低到74%、63%和37%。
在冬季采暖期,汽车尾气排放的三种污染物的比例下降的原因可能是____。
采暖期大气污染程度是有所减轻还是有所加重?________。
7 . 已知碳酸氢钠在270℃左右就能分解为碳酸钠、水和二氧化碳,2 NaHCO Na2CO3+CO2+H2O,而碳酸钠受热不分解。
工厂生产出的碳酸氢钠中可能会混有少量的碳酸钠,为了测定产品中碳酸氢钠的质量分数,具体的检验步骤如下
①取一只洁净的坩埚,称其质量为ag;再向其中加入样品:称得总质量为m1g
②加热该盛有样品的坩埚;
③将坩埚放到干燥器中充分冷却,称量坩埚和剩余固体的质量,称得坩埚和剩余固体的总质量为m2g。
④……
回答以下问题:
(1)请将步骤④补充完整_____
(2)如果将加热后的坩埚放在空气中冷却,会使碳酸氢钠的质量分数计算值_____(选填“偏大”、“不变”、“偏小”)。
(3)根据题意,用a、m1、m2的代数式表示样品中碳酸氢钠的质量分数为_____
8 . 某化学研究小组的同学对金属铁、铝、铜进行系列研究。
(1)合金的应用是人类社会文明发展的象征。
有下列三种合金:
①铁合金;②铝合金;③铜合金,
这三种合金被广泛应用的先后顺序按年代由远及近排列应是_______________(填序号)。
(2)该小组的同学还利用单质铜制取,其设计方案如图1:取一定量的放入盛有一定量稀硫酸的烧杯中,恰好完全反应。
向烧杯中逐滴加入10%的溶液,产生沉淀的质量与所滴入溶液质量的关系曲线如图2所示,当滴入10%的溶液120g时(即B点),试通过计算,求此时所得沉淀的质量_____(计算结果精确至0.1g)
9 . 某初中学生在帮助老师准备实验时,发现了一瓶失去标签的黑色粉末和一瓶标签破损(如图)的无色液体。
询问老师得知,该实验室的黑色粉末只有氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉五种可能。
为了鉴定这两种试剂,该同学将黑色粉末与无色液体混合,发现立即产生气泡。
请你根据上述信息,作出关于黑色粉末和无色液体可能成分的猜测:
参考答案
一、选择题
1、
2、
3、
4、
二、简答题
1、
2、
3、
4、
5、。
